Students can go through AP Board 9th Class Physical Science Notes 4th Lesson పరమాణువులు-అణువులు to understand and remember the concept easily.
AP Board 9th Class Physical Science Notes 4th Lesson పరమాణువులు-అణువులు
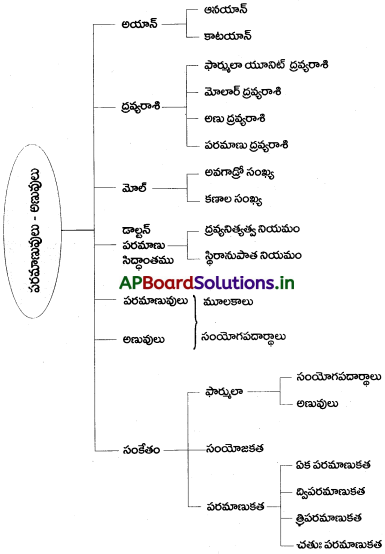
→ ఒక రసాయన చర్యలో ద్రవ్యరాశిని సృష్టించలేము, నాశనం చేయలేము. దీనినే ద్రవ్యనిత్యత్వ నియమం అంటారు. దీనిని ఆంటోనీ లెవోయిజర్ ప్రతిపాదించాడు.
→ స్థిరానుపాత నియమమును జోసెఫ్ ప్రొస్ట్ ప్రతిపాదించాడు. దీని ప్రకారం ఒక నిర్దిష్ట రసాయన సంయోగ పదార్ధములో ఒకే మూలకాలు స్థిరభార నిష్పత్తిలో ఉంటాయి.
→ డాల్టన్ పరమాణు సిద్ధాంతం ప్రకారం, “పదార్ధము పరమాణువులనే విభజింపవీలులేని కణాలచే నిర్మితమై ఉంటుంది.”
→ ఒకే రకపు పరమాణువులు కలిగియున్న పదార్థమును మూలకము అంటారు.
→ ఒకే రకమయిన మూలక పరమాణువులుగాని, వేర్వేరు మూలక పరమాణువులు గాని సంయోగం చెంది అణువులు ఏర్పడుతాయి.
→ సంకేతం మూలకాన్ని సూచిస్తుంది, సాంకేతికం (ఫార్ములా) అణువులు లేదా సంయోగ పదార్థాలను సూచిస్తుంది. ఈ సంకేతంలో ఒకటి లేదా రెండు ఇంగ్లీషు అక్షరాలు వుంటాయి.
→ ఒక మూలక అణువు ఏర్పడాలంటే ఎన్ని మూలక పరమాణువులు సంయోగం చెంది ఉంటాయో ఆ సంఖ్యను ‘పరమాణుకత’ అంటారు.
![]()
→ ఒక మూలక పరమాణువులు వేరొక మూలక పరమాణువులతో సంయోగం చెందే సామర్థ్యమును ఆ మూలక పరమాణువు యొక్క సంయోజకత అంటారు.
→ అయాన్లు ఒక ఆవేశపూరిత పరమాణువును గాని, ఫలిత ఆవేశం కలిగి ఉన్న పరమాణువుల గుంపుగా గాని ఉంటాయి.
→ ఋణావేశిత అయాను ఆనయాన్ అని, ధనావేశిత అయానన్ను కాటయాన్ అని పిలుస్తాం.
→ వివిధ మూలక పరమాణువుల ద్రవ్యరాశులను లెక్కించడానికి శాస్త్రవేత్తలు సాపేక్ష పరమాణు ద్రవ్యరాశిమానంను వాడారు.
→ ఒక మూలక పరమాణువు కార్బన్ – 12 ద్రవ్యరాశిలో 1/12 వ భాగం ద్రవ్యరాశి కంటె ఎన్ని రెట్లు ఎక్కువో తెలిపే సంఖ్యనే ఆ పరమాణువు యొక్క పరమాణు ద్రవ్యరాశి అంటాం.
→ సమ్మేళనాల సాంకేతికాలను రాయడానికి క్రిస్క్రాస్ పద్ధతిని వాడతారు.
→ ఒక పదార్థం యొక్క అణుద్రవ్యరాశి ఆ పదార్థపు అణువులోని అన్ని పరమాణువుల యొక్క పరమాణు ద్రవ్యరాశుల మొత్తానికి సమానం.
![]()
→ ఒక అణువు యొక్క ఫార్ములా యూనిట్ ద్రవ్యరాశి ఆ అణువు యొక్క ఫార్ములా యూనిలోని పరమాణువుల లేదా అయాన్ల మొత్తం ద్రవ్యరాశికి సమానం.
→ ఒక పదార్థ పరమాణు ద్రవ్యరాశి లేదా అణు ద్రవ్యరాశికి సమానమైన పదార్ధంలో ఎన్ని కణాలు (పరమాణువులు, అణువులు, అయాన్లు) ఉంటాయో తెలిపే సంఖ్యనే ‘మోల్’ అంటారు.
→ ఒక మోల్ పదార్థంలో ఉన్న కణాల సంఖ్యను అవగాడ్రో సంఖ్య అంటాం. దీని విలువ ఎల్లప్పుడూ 6.022 × 1023 కు సమానం.
→ ఒక మోల్ పదార్థం యొక్క ద్రవ్యరాశిని గ్రాముల్లో చెబితే దానిని మోలార్ ద్రవ్యరాశి అంటాం.
→ ద్రవ్యనిత్యత్వ నియమం : ఒక రసాయన చర్యలో ఏర్పడిన క్రియాజన్యాల మొత్తం ద్రవ్యరాశి ఆ చర్యలో పాల్గొన్న క్రియాజనకాల మొత్తం ద్రవ్యరాశికి సమానము.
(లేదా)
ఒక రసాయన చర్యలో ద్రవ్యరాశిని సృష్టించలేము, నాశనం చేయలేము.
→ స్థిరానుపాత నియమము : ఒక నిర్దిష్ట రసాయన సంయోగ పదార్థంలో ఒకే మూలకాలు స్థిరభార నిష్పత్తిలో ఉంటాయి.
→ మూలక పరమాణువు : ఏదైనా పదార్థము యొక్క అన్ని ధర్మాలను ప్రదర్శించే, రసాయన చర్యలో పాల్గొనే అతి సూక్ష్మ కణాన్ని ఆ పదార్థం యొక్క పరమాణువు అంటారు.
![]()
→ సంకేతవం : ఒక మూలకాన్ని సూచించడానికి వాడే చిన్న గుర్తునే సంకేతం అంటారు.
→ సాంకేతికం : ఒక సమ్మేళనాన్ని సూచించే సంక్షిప్త రూపాన్ని ఆ సమ్మేళనం యొక్క సాంకేతికం (Formula) అంటారు.
→ పరమాణు ద్రవ్యరాశి : ఏదైనా ఒక మూలక పరమాణువు కార్బన్ – 12 యొక్క ద్రవ్యరాశిలో \(\frac{1}{12}\) వ భాగం కంటె ఎన్ని రెట్లు ఎక్కువ ఉంటుందో దానిని ఆ మూలక పరమాణువు యొక్క పరమాణు ద్రవ్యరాశి అంటారు.
→ పరమాణు ద్రవ్యరాశి ప్రమాణం (amu) : కార్బన్ – 12 యొక్క ద్రవ్యరాశిలో సరిగా \(\frac{1}{12}\) వంతును ఒక పరమాణు ద్రవ్యరాశి ప్రమాణం (Atomic Mass Unit) గా నిర్వచిస్తారు.
→ ఏకీకృత ద్రవ్యరాశి (u) : పరమాణు ద్రవ్యరాశి ప్రమాణం (amu) స్థానంలో, పరమాణు ద్రవ్యరాశిని సూచించడానికి వాడే రాణి.
→ సంయోగపదార్థాలు (లేదా) మూలక సమ్మేళనాలు : వేర్వేరు మూలక పరమాణువుల కలయిక వలన ఏర్పడే అణువులను సంయోగ పదార్థాలు లేదా సమ్మేళనాలు అంటారు.
![]()
→ అయాన్లు (కాటయాన్ మరియు ఆనయాన్) : అయాన్లు ఒక ఆవేశ పూరిత పరమాణువుగా గాని, ఫలిత ఆవేశం ఉన్న పరమాణువుల గుంపుగా గాని ఉంటాయి.
→ కాటయాన్ : ఇది ధనావేశిత అయాన్.
→ ఆనయాన్ : ఇది ఋణావేశిత అయాన్.
→ పరమాణుకత : ఒక మూలక అణువు ఏర్పడాలంటే ఎన్ని మూలక పరమాణువులు సంయోగం చెంది ఉంటాయో ఆ సంఖ్యయే.
→ సంయోజకత : ఒక మూలక పరమాణువులు వేరొక మూలక పరమాణువులతో సంయోగం చెందే సామర్థ్యమును కలిగి ఉంటాయి. ఈ సంయోగ సామర్థ్యాన్ని ఆ మూలక పరమాణువు యొక్క సంయోజకత అంటారు.
ఉదా : క్లోరిన్ సంయోజకత – 1
కార్బన్ సంయోజకత – 4
→ అణు ద్రవ్యరాశి : ఒక పదార్థం యొక్క అణు ద్రవ్యరాశి. ఆ పదార్థపు అణువులోని అన్ని పరమాణువుల యొక్క పరమాణు ద్రవ్యరాశుల మొత్తానికి సమానము.
→ ఫార్ములా యూనిట్ ద్రవ్యరాశి : సమ్మేళనపు అణువు యొక్క అనుభావిక ఫార్ములాలోని ఘటక మూలక పరమాణువుల పరమాణు ద్రవ్యరాశుల మొత్తాన్ని ఫార్ములా ద్రవ్యరాశి అంటారు.
→ మోల్ : గ్రాములలో పరమాణు ద్రవ్యరాశి లేదా అణు ద్రవ్యరాశి ఉన్న పదార్థంలో ఎన్ని కణాలు (పరమాణువులు, అణువులు, అయానులు లేదా ఇతర కణాలు) ఉంటాయో ఆ సంఖ్యను మోల్’ అంటారు.
→ అవగాడ్రో సంఖ్య (N) : ఒక మోల్ ఏ పదార్థంలో అయినా ఉండే కణాల సంఖ్య ఎల్లప్పుడు స్థిరం. దీని విలువ 6.022 × 1023. దీనినే అవగాడ్రో సంఖ్య అంటారు.
![]()
→ మోలార్ ద్రవ్యరాశి : ఒక మోల్ పదార్థం యొక్క ద్రవ్యరాశిని గ్రాములలో చెబితే దానిని మోలార్ ద్రవ్యరాశి అంటారు.
→ అణువు : ఏదైనా మూలకము లేదా సంయోగ పదార్థములో స్వతంత్రంగా ఉండగలిగే పదార్థం యొక్క అన్ని ధర్మాలను ప్రదర్శించే అతి సూక్ష్మకణాన్ని ఆ పదార్థపు ‘అణువు’ అంటారు.
→ మూలక అణువు : ఒకే రకమైన మూలక పరమాణువులు గాని, వేర్వేరు మూలక పరమాణువులు గాని సంయోగం చెంది అణువులు ఏర్పడుతాయి.