These AP 10th Class Physical Science Important Questions 8th Lesson రసాయన బంధం will help students prepare well for the exams.
AP Board 10th Class Physical Science 8th Lesson Important Questions and Answers రసాయన బంధం
10th Class Physics 8th Lesson రసాయన బంధం 1 Mark Important Questions and Answers
ప్రశ్న 1.
“రసాయన బంధం” అనగానేమి?
జవాబు:
అణువులోని పరమాణువుల మధ్యగల ఆకర్షణ శక్తిని “రసాయన బంధం” అంటారు.
ప్రశ్న 2.
అయానిక బంధం గల రెండు సంయోగ పదార్థాల పేర్లు రాయండి.
జవాబు:
అయానిక బంధం గల సంయోగ పదార్థాలు
- Nacl
- MgCl2
ప్రశ్న 3.
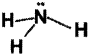
వేలన్సీ స్థాయి ఎలక్ట్రాన్ జంట వికర్షణ సిద్ధాంతం ఆధారంగా అమ్మోనియా అణువు నిర్మాణాన్ని గీయండి.
జవాబు:
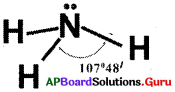
ప్రశ్న 4.
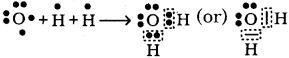
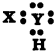
కింద ఇచ్చిన లూయిస్ చుక్కల నిర్మాణాలను గమనించి, HCl అణువు ఏర్పడే విధానాన్ని లూయిస్ చుక్కల నిర్మాణంతో చూపండి.
![]()
జవాబు:
![]()
ప్రశ్న 5.
A, B లు రెండు మూలకాలు, వాటి సంయోగ పదార్థం A,B అయిన A, B ల వేలన్సీలు ఏమై ఉండవచ్చునో తెల్పండి.
జవాబు:
‘A యొక్క వేలన్సీ -1 ; B యొక్క వేలన్సీ -2.
![]()
ప్రశ్న 6.
సాధారణంగా తక్కువ అయనీకరణ శక్మం, తక్కువ ఎలక్ట్రాన్ ఎఫినిటి మరియు ఎక్కువ పరమాణు పరిమాణం గల ఒక మూలక పరమాణువు ఏ రకమైన అయానను ఏర్పరచగలదో ఊహించి వ్రాయండి.
జవాబు:
కాటయాన్ (లేదా) ధనాత్మక అయానను ఏర్పరుస్తుంది.
ప్రశ్న 7.
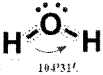
నీటి అణువులో బంధకోణం 109° 28′ కాకుండా 104°31′ గా ఎందుకు ఉంటుందో వివరించండి.
జవాబు:
నీటి అణువులోని ఆక్సిజన్ పరమాణువులో ఉండే “బంధంలో పాల్గొనని ఒంటరి ఎలక్ట్రాన్ జంటలు” ఆక్సిజన్, హైడ్రోజన్ల మధ్య, “బంధంలో పాల్గొన్న ఎలక్ట్రాన్ జంటల” మధ్య వికర్షణ వల్ల నీటి అణువులో బంధ కోణం 109° 28′ కాక 104°31′ గా ఉంటుంది.
ప్రశ్న 8.
“అష్టక నియమం” అంటే ఏమిటి?
జవాబు:
పరమాణువులు ఎలక్ట్రాన్లను కోల్పోవడం, స్వీకరించడం లేదా పంచుకోవడం ద్వారా వాటి వేలన్సీ కర్పరంలో ఎనిమిది ఎలక్ట్రాన్లను పొందటానికి ప్రయత్నిస్తాయి. దీనినే అష్టక నియమం అంటారు.
ప్రశ్న 9.
“అష్టక నియమం”ను ఎవరు ప్రవేశపెట్టారు?
జవాబు:
కొసెల్, లూయీలు అష్టక సిద్ధాంతమును కనిపెట్టారు.
ప్రశ్న 10.
s, s2- లకు లూయీ ఎలక్ట్రాన్ చుక్కల సంకేతాలు వ్రాయండి.
జవాబు:
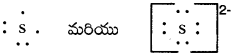
ప్రశ్న 11.
‘ఎలక్ట్రోవేలన్సీ’ మరియు ‘కోవేలన్సీ’ అనగానేమి?
జవాబు:
- ఎలక్ట్రాన్ల స్థానాంతర గమనం వల్ల ఏర్పడే వేలన్సీని “ఎలక్ట్రో వేలన్సీ” అని అంటారు.
- ఎలక్ట్రాన్లను సమిష్టిగా పంచుకోవడం వల్ల ఏర్పడే వేలన్సీని “కోవేలన్సీ” అని అంటారు.
ప్రశ్న 12.
‘అయానిక బంధం’ లేదా ‘ఎలక్ట్రోవేలంట్ బంధం’ అనగానేమి? ఉదాహరణలిమ్ము.
జవాబు:
ఎలక్ట్రాన్ల స్థానాంతర గమనం వల్ల ఏర్పడ్డ విరుద్ధ ఆవేశాలు గల అయాన్ల మధ్య గల స్థిర విద్యుదాకర్షణ బలాలను ‘అయానిక బంధం’ లేక ‘ఎలక్ట్రోవేలంట్ బంధం’ అంటారు.
ఉదా : NaCl, MgCl2, Na2O, AlCl3
ప్రశ్న 13.
లాటిస్ శక్తి అనగానేమి?
జవాబు:
అనంత దూరంలో ఉన్న విరుద్ధ ఆవేశాలు గల అయాన్లను దగ్గరకు చేర్చినపుడు ఒక మోల్ అయానిక స్ఫటికం ఏర్పడుతుంది. అప్పుడు విడుదలయ్యే శక్తిని లాటిస్ శక్తి అంటారు.
ప్రశ్న 14.
సమయోజనీయ బంధం అనగానేమి? ఉదాహరణలిమ్ము.
జవాబు:
ఎలక్ట్రాన్లను సమిష్టిగా పంచుకోవడం వల్ల ఏర్పడే బంధాన్ని సమయోజనీయ బంధం అంటారు. దీనిని ఎలక్ట్రాన్ జంట బంధం అని కూడా అంటారు.
ఉదా : F2, O2, N2, CH4, NH3, H2O
![]()
ప్రశ్న 15.
VSEPRT సిద్ధాంతం దేనిని వివరిస్తుంది?
జవాబు:
VSEPRT సిద్ధాంతం అణువుల ఆకృతులను మరియు బంధ కోణాలను వివరిస్తుంది.
ప్రశ్న 16.
VSEPRT ని విస్తరింపుము.
జవాబు:
వేలన్సీ షెల్ ఎలక్ట్రాన్ పెయిర్ రిపల్టన్ థియరీ (Valency Shell Electron Pair Repulsion Theory).
ప్రశ్న 17.
“బంధదైర్ఘ్యం” అనగానేమి?
జవాబు:
బంధింపబడి ఉన్న పరమాణువుల మధ్య గల సరాసరి అంతర్ కేంద్ర దూరాన్ని “బంధదైర్ఘ్యం” అంటారు.
ప్రశ్న 18.
“బంధశక్తి” అనగానేమి?
జవాబు:
ఒక మోల్ సమయోజనీయ బంధాన్ని దాని అనుఘటక పరమాణువులుగా విడగొట్టడానికి కావలసిన శక్తిని “బంధశక్తి” అంటారు.
ప్రశ్న 19.
‘ధృవాత్మక బంధం’ అనగానేమి?
జవాబు:
రెండు పరమాణువుల మధ్య ఎలక్ట్రానులు ఎప్పుడూ కూడా సమానంగా పంచుకోబడకపోవచ్చు. దీనినే ‘ధృవాత్మక బంధం’ అంటాం.
ప్రశ్న 20.
కర్పూరం కిరోసిన్లో కరుగుతుంది. కానీ నీటిలో కరగదు. ఎందువల్ల?
జవాబు:
సమయోజనీయ సమ్మేళనాలు అధృవ ద్రావణాలలో కరుగుతాయి. కాని ధృవ ద్రావణులలో కరగవు. కర్పూరం సమయోజనీయ సమ్మేళనం. కనుక ఇది అధృవ ద్రావణి అయిన కిరోసిన్లో కరుగుతుంది. కానీ ధృవ ద్రావణి అయిన నీటిలో కరగదు.
ప్రశ్న 21.
ఆల్కహాల్ లేదా ఈథర్ మొదలయిన కర్బన ద్రావణాలలో Lice కరుగుతుందా? ఎందుకు?
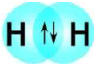
జవాబు:
Lice కోవలెంట్ స్వభావం గల పదార్థం. అందువల్ల అది అధృవ ద్రావణులైన ఆల్కహాల్, ఈథర్ లో కరుగుతుంది.
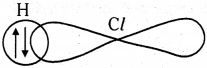
ప్రశ్న 22.
జడ వాయువుల సాధారణ ఎలక్ట్రాన్ విన్యాసం ఏది?
జవాబు:
ns² np6 (హీలియం తప్ప మిగిలిన జడవాయువులకు) మరియు He ఎలక్ట్రాన్ విన్యాసం 1s².
ప్రశ్న 23.
అయాన్ యొక్క సమన్వయ సంఖ్య అనగానేమి?
జవాబు:
ఒక నిర్దిష్ట ఆవేశం గల అయాన్ చుట్టూ ఎన్ని వ్యతిరేక ఆవేశం గల అయానులు అమరి ఉన్నాయో తెలిపే సంఖ్యను ఆ అయాన్ యొక్క సమన్వయ సంఖ్య (Coordination number) అంటారు.
ప్రశ్న 24.
‘ఋణ విద్యుదాత్మకత’ అనగానేమి?
జవాబు:
ఋణ విద్యుదాత్మకత : బంధంలో పాల్గొన్న ఎలక్ట్రాన్ జంటను తమ వైపుగా ఆకర్షించే స్వభావాన్ని ‘ఋణ విద్యుదాత్మకత’ అంటారు.
ప్రశ్న 25.
‘సంయోజనీయత’ అనగానేమి?
జవాబు:
ఒక మూలక పరమాణువు ఎన్ని సంయోజనీయ బంధాలను ఏర్పరచగలదో తెలిపే సంఖ్యనే ఆ మూలకం యొక్క “సంయోజనీయత” అంటారు.
ప్రశ్న 26.
‘బంధ దూరం’ లేదా ‘బంధదైర్ఘ్యం’ అనగానేమి?
జవాబు:
సంయోజనీయ బంధంతో కలుపబడిన రెండు పరమాణువుల కేంద్రకాల మధ్య సమతాస్థితి వద్ద గల దూరాన్నే ‘బంధదూరం’ లేదా ‘బంధదైర్ఘ్యం’ అంటారు.
ప్రశ్న 26.
బంధదూరం ప్రమాణాలు ఏమిటి?
జవాబు:
బంధదూరం ప్రమాణాలు నానోమీటర్ (nm) గానీ, ఆంగ్ స్ట్రామ్ (A°) యూనిట్ లో గానీ తెలియజేస్తారు.
ప్రశ్న 27.
నీటి అణువు ఆకృతి ఏమి?
జవాబు:
నీటి అణువు ‘V’ ఆకృతిని కలిగి ఉండును.
ప్రశ్న 28.
NH3, PCl3 మరియు PH3 అణువుల ఆకృతి ఏమి?
జవాబు:
NH3, PCl3 మరియు PH3 అణువుల ఆకృతి ‘పిరమిడల్ ఆకృతి’.
![]()
ప్రశ్న 29.
PCl5 ఆకృతి ఏమి?
జవాబు:
PCl5 అణువు, ట్రైగోనల్ బై-పిరమిడ్ ఆకృతిని కలిగి ఉండును.
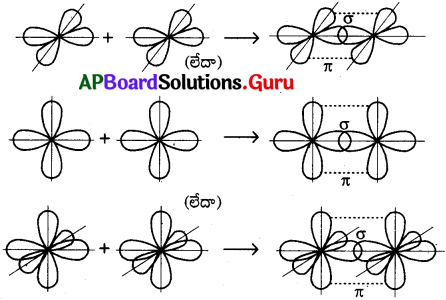
ప్రశ్న 30.
‘σ’ మరియు ‘π’ బంధములు ఎలా ఏర్పడును?
జవాబు:
ఆర్బిటాళ్ళ అంత్యాతిపాతం (End – on) వలన సిగ్మా (σ) బంధం మరియు ఆర్బిటాళ్ళ పార్శ్వ (partial) అతిపాతం వల్ల పై (π) బంధం ఏర్పడును.
ప్రశ్న 31.
ద్విబంధము ఏర్పరచే అణువులకు ఉదాహరణ ఇవ్వండి.
జవాబు:
O2
ప్రశ్న 32.
త్రికబంధం ఏర్పరచే అణువులకు ఉదాహరణ ఇవ్వండి.
జవాబు:
N2
ప్రశ్న 33.
సమయోజనీయ బంధం ఏ విధంగా ఏర్పడును?
జవాబు:
రెండు పరమాణువులు ఒకదానికొకటి దగ్గరగా వచ్చినప్పుడు అవి ఎలక్ట్రాన్లను పరస్పరం పంచుకోవడం వల్ల ఏర్పడే బంధమే “సమయోజనీయ బంధం”.
ఉదా : H2, O2, N2 అణువులు ఏర్పడుట.
ప్రశ్న 34.
సిగ్మా (σ) మరియు పై (π) బంధాలను పోల్చుము.
జవాబు:
| సిగ్మా (σ) బంధం | పై (π) బంధం |
| 1. ఇది పరమాణు ఆర్బిటాళ్ళ అంత అతిపాతం వల్ల వల్ల ఏర్పడును. | 1. ఇది పరమాణు ఆర్బిటాళ్ళ పార్శ్వ అతిపాతం ఏర్పడును. |
| 2. ఇది స్వతంత్రంగా ఏర్పడగలదు. | 2. ఇది స్వతంత్రంగా ఏర్పడలేదు. |
| 3. ఇది బలమైన బంధం. | 3. ఇది బలహీన బంధం. |
| 4. అణువులో ఒకే ఒక సిగ్మా (σ) బంధం ఉండును. | 4. రెండు పరమాణువుల మధ్య ఒకటి లేదా రెండు పై (π) బంధాలుంటాయి. |
ప్రశ్న 35.
కాటయాన్ ఎలా ఏర్పడును?
జవాబు:
ఒక పరమాణువు ఎలక్ట్రాన్ కోల్పోయినపుడు కాటయాన్ ఏర్పడుతుంది.
ప్రశ్న 36.
ఆనయాన్ ఎలా ఏర్పడుతుంది?
జవాబు:
ఒక పరమాణువు ఎలక్ట్రాన్ ను గ్రహించినపుడు ఆనయాన్ ఏర్పడుతుంది.
ప్రశ్న 37.
అయానిక బంధంలోనున్న బలాలు ఏవి?
జవాబు:
అయానిక బంధంలో స్థిర విద్యుత్ ఆకర్షణ బలాలు వున్నాయి.
ప్రశ్న 38.
ఎటువంటి సమ్మేళనాలు ధృవ ద్రావణిలలో కరుగుతాయి?
జవాబు:
అయానిక పదార్థాలు ధృవ ద్రావణిలలో ఎక్కువగా కరుగుతాయి.
ప్రశ్న 39.
అధిక ద్రవీభవన మరియు బాష్పీభవన స్థానాలు గల సమ్మేళనాలు ఏవి?
జవాబు:
అయానిక సమ్మేళనాలు అధిక ద్రవీభవన మరియు బాష్పీభవన స్థానాలు కలిగి ఉంటాయి.
ప్రశ్న 40.
ఒక అలోహం యొక్క వేలన్సీని ఎలా తెలుసుకుంటారు?
జవాబు:
ఒక అలోహ పరమాణువు, అణువుగా ఏర్పడటానికి పొందే ఎలక్ట్రానుల సంఖ్యను దాని వేలన్సీ అంటారు.
వేలన్సీ = (8 – ఆ అలోహపు గ్రూపు సంఖ్య)
ఉదా : క్లోరిన్ వేలన్సీ = (8 – 7) = 1
ప్రశ్న 41.
పరమాణువులు సంయోగం చెంది అణువుగా ఎందుకు మారతాయి?
జవాబు:
ఒక అణువు శక్తి, దానిలోనున్న పరమాణువుల మొత్తం శక్తికన్నా తక్కువగా ఉంటుంది. అందువల్ల అది సంయోగం చెంది స్థిరత్వాన్ని పొందుతుంది.
ప్రశ్న 42.
అయానిక పదార్థాలు మంచి విద్యుద్విశ్లేషకాలు ఎందుకు?
జవాబు:
అయానిక పదార్థాల జలద్రావణాలలో స్వేచ్ఛగా చలించే అయానులు ఉంటాయి. కావున ఇవి విద్యుద్విశ్లేషకాలు.
ప్రశ్న 43.
పరమాణువుల మధ్య అయానిక బంధం ఎప్పుడు ఏర్పడుతుంది?
జవాబు:
స్వల్ప అయనీకరణ శక్మము గల పరమాణువులు మరియు అత్యధిక ఋణ విద్యుదాత్మకత గల పరమాణువుల మధ్య అయానిక బంధం ఏర్పడును.
(లేదా)
రెండు మూలకాల ఋణ విద్యుదాత్మకతల మధ్య తేడా 1.9 గానీ అంతకన్నా ఎక్కువ గానీ ఉంటే ఆ మూలకం పరమాణువుల మధ్య అయానిక బంధం ఏర్పడుతుంది.
![]()
ప్రశ్న 44.
బంధకోణం అనగానేమి?
జవాబు:
మధ్య పరమాణువు, సమయోజనీయ బంధంలో పాల్గొనే మిగతా పరమాణువుల కేంద్రకాల గుండా వెళ్ళే ఊహా రేఖలు, మధ్య పరమాణువు కేంద్రం వద్ద చేయు కోణాన్ని ‘బంధకోణం’ అంటారు.
ప్రశ్న 45.
NaCl నీటిలో కరుగును కాని బెంజీన్లో కరుగదు. ఎందుకు?
జవాబు:
నీరు ధృవద్రావణి. NaClలో Na+ మరియు Cl– అయానులు ఉంటాయి. కావున ఇది అయానిక పదార్థం. అయానిక పదార్థాలు ధృవద్రావణిలలో కరుగుతాయి. కాని అధృవ ద్రావణులలో కరుగవు. కావున NaCl నీటిలో కరుగుతుంది కాని బెంజీన్లో కరుగదు.
ప్రశ్న 46.
సంకరీకరణము అనగానేమి?
జవాబు:
పరమాణువుల చివరి కక్ష్యలో ఉండి దాదాపు సమానశక్తి కలిగిన పరమాణు ఆర్బిటాళ్ళు పరస్పరం కలిసిపోయి, పునర్వ్యవస్థీకరించబడడం ద్వారా అదే సంఖ్యలో బంధశక్తి, ఆకారం వంటి ధర్మాలు ఒకే విధంగా ఉండే సర్వసమాన ఆర్బిటాళ్ళను ఏర్పరచే దృగ్విషయాన్ని సంకరీకరణము అంటారు.
ప్రశ్న 47.
H2O మరియు NH3 లలోని బంధకోణాలు ఎంత?
జవాబు:
H2O అణువులో బంధకోణం 104°.31′
NH3 అణువులో బంధకోణం 107°.48′
10th Class Physics 8th Lesson రసాయన బంధం 2 Marks Important Questions and Answers
ప్రశ్న 1.
కింద తెలిపిన పదార్థాలు ఏర్పడే క్రమాన్ని లూయీస్ నిర్మాణంలో సాంకేతాలతో చూపండి.
(i) కాల్షియం, క్లోరిన్ కలిసి కాల్షియం క్లోరైడ్ ఏర్పడడం.
(ii) ఆక్సిజన్ అణువు ఏర్పడడం.
జవాబు:
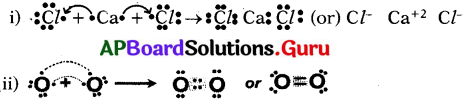
ప్రశ్న 2.
ఒక తటస్థ పరమాణువు, దాని ధన అయాన్లలో దేని పరిమాణం ఎక్కువ? ఎందుకు?
జవాబు:
- తటస్థ పరమాణువు కన్నా దాని ధన అయాన్ పరిమాణం తక్కువ ఉంటుంది.
- ఎలక్ట్రాన్లు కోల్పోయిన పరమాణువు కేంద్రక ఆవేశ ప్రభావం ఎక్కువగా ఉండి, చిట్ట చివరి కక్ష్యలోని ఎలక్ట్రాన్లను మరింత బలంగా ఆకర్షిస్తుంది.
- ఈ ఆకర్షణ కారణంగా అయాన్ పరిమాణం తగ్గిపోతుంది.
- కాబట్టి పరమాణువుకన్నా దాని ధన అయాన్ పరిమాణం తక్కువగా ఉంటుంది.
ప్రశ్న 3.
అష్టక నియమంను రాయండి. ఈ నియమం ప్రకారం మెగ్నీషియం (Z = 12) క్లోరితో చర్య జరిపేటప్పుడు ఎలా స్థిరత్వం పొందుతుందో తెల్పండి.
జవాబు:
అష్టక నియమం :
మూలకాలకు చెందిన పరమాణువులు తమ బాహ్య కక్షలో ఎనిమిది ఎలక్ట్రాన్లు మిగిలి ఉండేలా రసాయన మార్పు చెందడానికి ప్రయత్నిస్తాయి. దీనిని అష్టక నియమం అంటాం.
మెగ్నీషియం రెండు ఎలక్ట్రాన్లను కోల్పోయి చివరి కక్ష్యలో 8 ఎలక్ట్రాన్లు మిగుల్చుకొని నియాన్ విన్యాసాన్ని పొంది స్థిరత్వాన్ని పొందుతుంది.
ప్రశ్న 4.
ఆక్సిజన్ అణువు ఏర్పడే విధానాన్ని వేలన్సీ బంధ సిద్ధాంతం ప్రకారం పటం గీచి చూపండి.
జవాబు:
ప్రశ్న 5.
అయానిక బంధంను ఒక ఉదాహరణతో వివరించండి. ..
జవాబు:
- సోడియం (Na) పరమాణువు ఒక ఎలక్ట్రాన్ ను కోల్పోయి సోడియం ధన అయాన్ గా మారుతుంది. (Na+)
Na → Na+ + le– - క్లోరిన్ (Cl) పరమాణువు ఒక ఎలక్ట్రాన ను గ్రహించి క్లోరిన్ ఋణ అయాన్ గా మారుతుంది. (Cl– )
Cl + le– → Cl– - సోడియం ధన అయాన్, క్లోరిన్ ఋణ అయాన్ల మధ్య స్థిర విద్యుత్ ఆకర్షణ వలన అయానిక బంధం ఏర్పడి సోడియం క్లోరైడ్ (NACl) ఏర్పడుతుంది.
Na+ + Cl– → NaCl
ప్రశ్న 6.
VSEPRT సిద్ధాంతం అనగానేమి?
జవాబు:
మూడు, అంతకంటే ఎక్కువ పరమాణువుల కలయిక వలన ఏర్పడిన అణువులలో అన్ని పరమాణువులు ఒక కేంద్రక పరమాణువులతో సమయోజనీయ బంధంతో బంధింపబడి ఉన్నప్పుడు, వాని మధ్య బంధకోణాలు వివరించడానికి ఒక సిద్ధాంతాన్ని అభివృద్ధిపరచారు. దీనినే VSEPRT సిద్ధాంతం అంటారు.
ప్రశ్న 7.
సంకరీకరణం (Hybridization) అనగానేమి?
జవాబు:
పరమాణువుల చివరి కక్ష్యలో ఉండే దాదాపు సమానశక్తి కలిగిన పరమాణు ఆర్బిటాళ్ళు పరస్పరం కలిసిపోయి, పునర్వ్యవస్థీకరించబడటం ద్వారా అదే సంఖ్యలో బంధశక్తి, ఆకారం వంటి ధర్మాలు ఒకే విధంగా ఉండే సర్వసమాన ఆర్బిటాళ్ళను ఏర్పరచే దృగ్విషయాన్ని సంకరీకరణం అంటారు.
ప్రశ్న 8.
Cl– అయాను, Cl పరమాణువు కంటే స్థిరమైనది. ఎందువల్ల?
జవాబు:
ns²np6 ఎలక్ట్రాన్ విన్యాసం గల పరమాణువు లేదా అయాను స్థిరమైనది. Cl– కు స్థిర ఎలక్ట్రాను విన్యాసం కలదు.
Cl (Z = 17) ఎలక్ట్రాన్ విన్యాసం : 1s² 2s² 2p63s² 3p5
Cl– ఎలక్ట్రాన్ విన్యాసం : 1s² 2s² 2p6 3s² 3p6
అందువల్ల Cl కన్నా Cl– అయాను స్థిరమైనది.
ప్రశ్న 9.
‘లోహధర్మం ‘ లేదా ‘ధన విద్యుదాత్మకత’ అనగానేమి?
జవాబు:
లోహ మూలకాలు తమ బాహ్య కక్ష్య నుండి ఎలక్ట్రాన్లను కోల్పోయి, అష్టక విన్యాసం పొందటానికి ప్రయత్నిస్తాయి. ఈ విధమైన స్వభావాన్నే ‘లోహధర్మం’ లేదా ‘ధన విద్యుదాత్మకత’ అంటారు.
ప్రశ్న 10.
VSEPRT సిద్ధాంతం ప్రకారం, బంధ ఎలక్ట్రాన్ జంటల సంఖ్య, అణువు ఆకృతి గురించి వివరించండి.
జవాబు:
| బంధ ఎలక్ట్రాన్ జంటల సంఖ్య | అణువు ఆకృతి |
| 2 | రేఖీయం |
| 3 | సమతల త్రిభుజం |
| 4 | టెట్రా హైడ్రల్ |
| 5 | ట్రైగోనల్ బై పిరమిడల్ |
| 6 | ఆక్టా హైడ్రల్ |
| 7 | పెంటాగోనల్ బై పిరమిడల్ |
ప్రశ్న 11.
లూయిస్ చుక్కల నిర్మాణం అనగానేమి?
జవాబు:
పరమాణు కేంద్రకాన్ని లోపలి కక్ష్యలోని ఎలక్ట్రాన్లను ఆ మూలకం యొక్క గుర్తు ద్వారా మరియు పరమాణు బాహ్య కక్ష్యలోని ఎలక్ట్రాన్లను చుక్కలు (⋅) లేదా గుణకారపు గుర్తు (×)తో సూచిస్తారు. దీనినే లూయిస్ చుక్కల నిర్మాణం అంటాం.
ఉదా : Nax
దీనిలో Na అనేది సోడియం పరమాణు కేంద్రకం మరియు దాని పైనున్న గుణకారపు గుర్తు (×), సోడియం యొక్క వేలన్సీలోనున్న ఎలక్ట్రానుల సంఖ్యను తెలియజేస్తుంది.
ప్రశ్న 12.
అయనీకరణము అనగానేమి? ఒక ఉదాహరణనిమ్ము.
జవాబు:
- ఒక పరమాణువు నుండి ఎలక్ట్రాన్ (ల)ను తొలగించు ప్రక్రియను అయనీకరణము అందురు.
ఉదా : Na → Na+ + e– - ఒక అయానిక పదార్థం సరియైన ద్రావణిలో, దాని అంశీభూత అణువులుగా విడిపోయే ప్రక్రియను అయనీకరణము అంటారు.
ఉదా : NaCl(జ.ద్రా.) → Na+ + Cl–
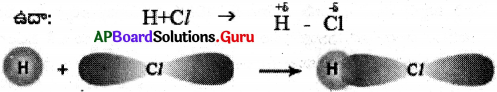
ప్రశ్న 13.
HCl అణువు ఎలా ఏర్పడుతుంది?
జవాబు:
H పరమాణువులో ఒంటరి ఎలక్ట్రాన్ ను కలిగి ఉన్న ‘1s’ ఆర్బిటాల్, క్లోరిన్ పరమాణువులో వ్యతిరేక స్పినను కలిగి ఉన్న ఒంటరి ఎలక్ట్రాన్ ను కలిగి ఉన్న ‘3p’ ఆర్బిటాల్ తో అతిపాతం చెంది HCl అణువును ఏర్పరుస్తాయి.
ప్రశ్న 14.
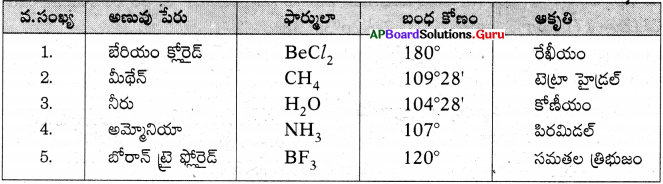
కొన్ని అణువులు వాటి బంధకోణాలు, ఆకృతులు పట్టిక రూపంలో రాయండి.
జవాబు:
10th Class Physics 8th Lesson రసాయన బంధం 4 Marks Important Questions and Answers
ప్రశ్న 1.
త్రిబంధం గురించి వివరించండి.
(లేదా)
వేలన్సీ బంధ సిద్ధాంతాన్ని ఎవరు ప్రతిపాదించారు ? ఈ సిద్ధాంత ఆధారంగా N, అణువు ఏర్పడు విధానం వివరించండి.
జవాబు:
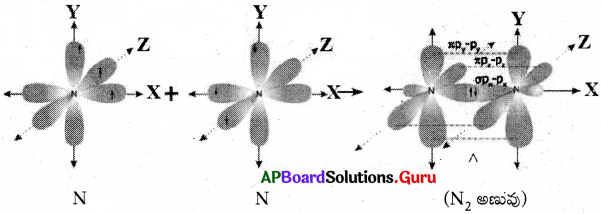
వేలన్సీ బంధ సిద్ధాంతాన్ని “లైనస్ పౌలింగ్” ప్రతిపాదించారు.
N2 అణువు ఏర్పడుట :
- 7N యొక్క ఎలక్ట్రాన్ విన్యాసం (z = 7) = 1s²2s² 2px¹2py¹ 2pz¹
- ఒక నైట్రోజన్ పరమాణువులోని ‘Px‘ ఆర్బిటాల్, వేరొక నైట్రోజన్ పరమాణువులోని ‘Px‘ ఆర్బిటాల్ తో అతిపాతం చెందటం ద్వారా సిగ్మా (σ) px – px బంధం ఏర్పడుతుంది.
- నైట్రోజన్ పరమాణువులో మిగిలిన py మరియు pz ఆర్బిటాళ్ళు వేరొక నైట్రోజన్ పరమాణువులోని py, pz ఆర్బిటాళ్ళతో పార్శ్వ అతిపాతం చెంది రెండు పై (π) (py – pz మరియు pz – pz) బంధాలను ఏర్పరుస్తాయి.
- ఈ విధంగా N2 అణువులోని రెండు నైట్రోజన్ పరమాణువుల మధ్య ఒకటి సిగ్మా(σ), రెండు పై (π) బంధాలు ఏర్పడుతాయి. మొత్తం 3 బంధాలు ఏర్పడుట వలన N2 అణువులో “త్రి బంధం” ఏర్పడుతుంది.
ప్రశ్న 2.
వేలన్సీ బంధ సిద్ధాంతం ద్వారా BF3 అణువు ఏర్పడు విధానాన్ని వివరించండి.
జవాబు:
- బోరాన్ పరమాణుసంఖ్య 5. ఎలక్ట్రాన్ విన్యాసం 1s² 2s² 2p¹.
- ఉత్తేజ స్థితిలో బోరాన్ ఎలక్ట్రాన్ విన్యాసం 1s² 2s¹ 2px¹ 2py¹.
- బోరాన్లోని 2s, 2px, 2py, ఆర్బిటాళ్ళు కలిసి మూడు sp² సంకర ఆర్బిటాళ్ళను ఏర్పరచును. ఇవి బంధంలో పాల్గొంటాయి.
- ఫ్లోరిన్ పరమాణు సంఖ్య 9. ఎలక్ట్రాన్ విన్యాసం 1s² 2s² 2p5.
- ఫ్లోరిన్ లోని 2pz ఆర్బిటాల్ లోని ఎలక్ట్రాన్ బంధంలో పాల్గొంటుంది.
- బోరాన్ లోని మూడు sp² సంకర ఆర్బిటాళ్ళతో మూడు ఫ్లోరిన్ పరమాణువులలోని 2p, ఆర్బిటాల్ లోని ఒంటరి ఎలక్ట్రాన్లు జతకూడి మూడు సిగ్మా బంధాలు ఏర్పరుస్తాయి. ఈ విధంగా మూడు (σsp²-p) బంధాలతో BF3 అణువు ఏర్పడుతుంది.
ప్రశ్న 3.
“నైట్రోజన్, హైడ్రోజన్ చర్యనొంది, అమ్మోనియా (NH3) అణువును ఏర్పరుస్తాయి. కార్బన్, హైడ్రోజన్ తో చర్యనొంది మీథేన్ (CH4) అణువును ఏర్పరచును.
పై వాటిలో ప్రతీ చర్యకి సంబంధించి
A) చర్యలో పాల్గొన్న ప్రతి పరమాణువు వేలెన్సీ ఎంత?
B) చర్యలో ఏర్పడిన సమ్మేళనాల యొక్క చుక్కల నిర్మాణం తెల్పండి.
జవాబు:
A) అమ్మోనియాలో : నైట్రోజన్ వేలెన్సీ 3, హైడ్రోజన్ వేలెన్సీ 1
మీథేన్ లో : కార్బన్ వేలెన్సీ 4, హైడ్రోజన్ వేలెన్సీ 1

ప్రశ్న 4.
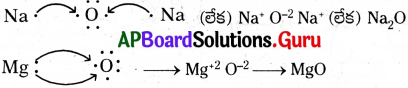
అ) సోడియం, ఆక్సిజన్ మరియు మెగ్నీషియంలకు ఎలక్ట్రాన్ బిందు నిర్మాణాలను చూపే పటాలను గీయండి.
జవాబు:
1) సోడియం పరమాణువులో ఒక వేలన్సీ ఎలక్ట్రాన్ ఉన్నది కావున సోడియం యొక్క ఎలక్ట్రాన్ బిందు నిర్మాణం Na x లేక Na⋅
2) ఆక్సిజన్ పరమాణువులో రెండు వేలన్సీ ఎలక్ట్రాన్లు ఉంటాయి కావున ఆక్సిజన్ యొక్క ఎలక్ట్రాన్ బిందు నిర్మాణం Oxx లేక O:
3) మెగ్నీషియం పరమాణువులో కూడా రెండు వేలన్సీ ఎలక్ట్రాన్లుంటాయి కావున మెగ్నీషియం యొక్క ఎలక్ట్రాన్ బిందు
నిర్మాణం Mgxx లేక Mg:
ఆ) Na2O మరియు MgO ల ఏర్పాటును గురించి పటం రూపంలో చూపండి.
జవాబు:
Na2O
ప్రశ్న 5.
నీటి యొక్క సాంకేతికం H2O గానే రాస్తాం. HO2 గా ఎందుకు రాయకూడదో తెల్పండి.
జవాబు:
- నీటి అణువులో ఆక్సిజన్ పరమాణువు తనకు దగ్గరి జడవాయువైన నియాన్ విన్యాసం పొందుటకు రెండు ఎలక్ట్రానులు అవసరము.
- హైడ్రోజన్ పరమాణువు తన దగ్గరి జడవాయువైన హీలియం విన్యాసం పొందుటకు ఒక ఎలక్ట్రాను అవసరం.
- ఈ విధంగా రెండు హైడ్రోజన్ (H) పరమాణువులతో, ఒక ఆక్సిజన్ (O) చర్య జరిపి రెండు ఏక సమయోజనీయ బంధాలను ఏర్పరచును. కనుక నీటి యొక్క రసాయన సాంకేతికం H2O గానే వ్రాస్తాము.
![]()
ప్రశ్న 6.
A మరియు B అనే పరమాణువుల ఎలక్ట్రాన్ విన్యాసాలు వరుసగా :
1s²2s²2p63s²3p¹; 1s²2s²2p4 అయితే
జవాబు:
పరమాణువు – A యొక్క ఎలక్ట్రాన్ విన్యాసము – 1s²2s²2p63s²3p¹
పరమాణువు – B యొక్క ఎలక్ట్రాన్ విన్యాసము – 1s²2s²2p4
అ) ఏ పరమాణువు ఋణ అయానును ఏర్పరుస్తుంది?
జవాబు:
‘A’ పరమాణువు ఎలక్ట్రాన్లను కోల్పోయే అవకాశం కలదు, ‘B’ పరమాణువు ‘2’ ఎలక్ట్రాన్లను స్వీకరించే అవకాశం కలదు. కనుక ‘B’ పరమాణువు ఋణ అయానును ఏర్పరుస్తుంది.
ఆ) ఏ పరమాణువు ధన అయానును ఏర్పరుస్తుంది?
జవాబు:
‘A’ పరమాణువు మూడు ఎలక్ట్రానులను కోల్పోవుట వలన ధన అయానుగా మారును.
ఇ) పరమాణువు A వేలెన్సీ ఎంత?
జవాబు:
పరమాణువు ‘A’ యొక్క వేలన్సీ – 3
ఈ) A మరియు B అనే పరమాణువులచే ఏర్పడే సంయోగపదార్థం యొక్క అణుఫార్ములా ఏమిటి?
జవాబు:
క్రిస్ క్రాస్ పద్ధతిన A మరియు B పరమాణువులచే ఏర్పడు సంయోగ పదార్థం యొక్క అణుఫార్ములా – A3B2
ఈ అణుఫార్ములా గల పదార్థం – Al3O2
ప్రశ్న 7.
అయానిక మరియు సమయోజనీయ బంధాల మధ్య భేదాలను రాయుము.
జవాబు:
| అయానిక బంధం | సమయోజనీయ బంధం |
| 1. ఒక పరమాణువు నుండి మరొక పరమాణువుకు ఎలక్ట్రాన్ల బదిలీ వల్ల అయానిక బంధం ఏర్పడును. | 1. పరమాణువుల మధ్య ఎలక్ట్రాన్ల పంపిణీ వల్ల సమయోజనీయ బంధం ఏర్పడును. |
| 2. స్థిరవిద్యుత్ ఆకర్షణ బలం ఉంటుంది. | 2. స్థిర విద్యుదాకర్షణ బలం ఉండదు. |
| 3. అయానిక బంధం వల్ల అయానిక పదార్థాలు ఏర్పడుతాయి. | 3. సమయోజనీయ బంధం వల్ల సమయోజనీయ పదార్థాలు ఏర్పడుతాయి. |
| 4. దిశా ధర్మం లేదు. | 4. దిశా ధర్మం పాటిస్తుంది. |
ప్రశ్న 8.
ద్విబంధం గురించి వివరించండి.
(లేదా)
వేలన్సీ బంధ సిద్ధాంతం ఆధారంగా O2 అణువు ఏర్పడు విధానం వివరించండి.
జవాబు:
ఆక్సిజన్ అణువు (O2) ఏర్పడుట :
- 80 యొక్క ఎలక్ట్రాన్ విన్యాసం (z = 8) = 1s²2s²2px²2py¹2pz¹
- ఆక్సిజన్ పరమాణువులో ‘py‘ ఆర్బిటాల్, మరొక ఆక్సిజన్ పరమాణువులోని ‘py‘ ఆర్బిటాల్ లో అతిపాతం చెందడం వలన py – py మధ్య సిగ్మా బంధం (σ) ఏర్పడుతుంది.
- ఒక ఆక్సిజన్ పరమాణువులో ఉండే pz ఆర్బిటాల్, వేరొక ఆక్సిజన్ పరమాణువులో ఉండే pz ఆర్బిటాల్లో పార్శ్వ అతిపాతం చెందడం వలన pz – pz మధ్య పై (π) బంధం ఏర్పడుతుంది.
- ఈ విధంగా O2 అణువులో ఒక సిగ్మా బంధం, ఒక పై బంధం ఏర్పడుతాయి. మొత్తం 2 బంధాలు ఏర్పడుట వలన O2అణువులో ద్విబంధం ఏర్పడును.
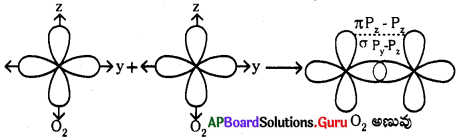
ప్రశ్న 9.
A మరియు B అనే పరమాణువుల ఎలక్ట్రాన్ విన్యాసాలు వరుసగా :
1s²2s²2p63s²3p¹ ; 1s²2s²2p4 అయితే
అ) ఏ పరమాణువు ఋణ అయానును ఏర్పరుస్తుంది?
ఆ) ఏ పరమాణువు ధన అయానును ఏర్పరుస్తుంది?
ఇ) పరమాణువు A వేలెన్సీ ఎంత?
ఈ) A మరియు B అనే పరమాణువులచే ఏర్పడే సంయోగపదార్థం యొక్క అణుఫార్ములా ఏమిటి?
జవాబు:
పరమాణువు – A యొక్క ఎలక్ట్రాన్ విన్యాసము – 1s²2s²2p63s²3p¹
పరమాణువు – B యొక్క ఎలక్ట్రాన్ విన్యాసము – 1s²2s²2p4
అ) ‘A’ పరమాణువు ఎలక్ట్రాన్లను కోల్పోయే అవకాశం కలదు, ‘B’ పరమాణువు ‘2’ ఎలక్ట్రాన్లను స్వీకరించే అవకాశం కలదు. కనుక ‘B’ పరమాణువు ఋణ అయానును ఏర్పరుస్తుంది.
ఆ) ‘A’ పరమాణువు మూడు ఎలక్ట్రానులను కోల్పోవుట వలన ధన అయానుగా మారును.
ఇ) పరమాణువు ‘A’ యొక్క వేలన్సీ – 3
ఈ) క్రిస్ క్రాస్ పద్ధతిన A మరియు B పరమాణువులచే ఏర్పడు సంయోగ పదార్థం యొక్క అణుఫార్ములా – A3B2
ఈ అణుఫార్ములా గల పదార్థం – Al3O2
10th Class Physics 8th Lesson రసాయన బంధం ½ Mark Important Questions and Answers
1. క్రింది అణువులలో దేనికి sp³ సంకరీకరణం ఉండదు?
(CH4, BF3, NH3, H2O)
జవాబు:
BF3
2. రెండు పరమాణువుల మధ్య బంధం ఏర్పడుటకు కారణమైనవి ఏమిటి?
జవాబు:
వేలన్సీ ఎలక్ట్రానులు
3. చర్యాశీలత లేని మూలకాలు గల గ్రూపు ఏది?
జవాబు:
18 (VIIIA)
4. He కి తప్ప, మిగిలిన జడవాయువుల బాహ్య కక్ష్యలో ఎలక్ట్రానుల సంఖ్య ఎంత?
జవాబు:
ఎనిమిది
5.
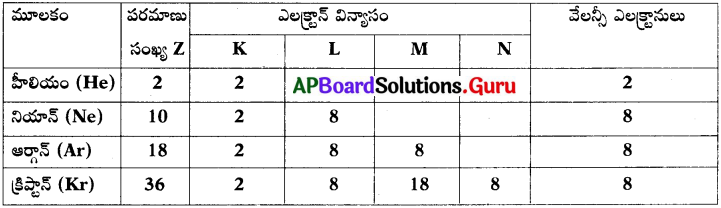
1) హీలియం వాయువు యొక్క వేలన్సీ ఎంత?
జవాబు:
‘O’ (సున్న)
2) ఆర్గాన్ యొక్క వేలన్సీ కర్పరం ఏమిటి?
జవాబు:
‘M’
3) పైన ఇచ్చిన మూలకాలలో ఏది అష్టక నియమాన్ని పాటించదు? (హీలియం తప్ప).
జవాబు:
ఏదీ లేదు.
4) నియాన్ ఎటువంటి చర్యలలో పాల్గొనును?
జవాబు:
అసలు పాల్గొనదు.
6. లూయిస్ గుర్తుల ప్రకారం ఎలక్ట్రానులను ఎలా సూచిస్తారు?
జవాబు:
చుక్క (⋅) లేదా క్రాస్ గుర్తు (×).
7. ‘X’ అనే పరమాణువుకి ‘స’ వేలన్నీ ఎలక్ట్రానులు కలవు. దీనిని లూయిస్ గుర్తు ప్రకారం ఎలా సూచిస్తారు?
జవాబు:
![]()
8. ![]() ఇచ్చిన లూయిస్ చుక్క పటం ప్రకారం Mg యొక్క వేలన్సీని కనుగొనుము.
ఇచ్చిన లూయిస్ చుక్క పటం ప్రకారం Mg యొక్క వేలన్సీని కనుగొనుము.
జవాబు:
‘2’
9. ![]() ఆర్గాన్ యొక్క వేలన్సీ ఎంత?
ఆర్గాన్ యొక్క వేలన్సీ ఎంత?
జవాబు:
‘0’ (సున్న)
10. గ్రూపు – I మూలకం ‘X’ అయిన, దానిని లూయీస్ చుక్క పటం ద్వారా చూపుము.
జవాబు:
![]()
11. ‘వేలన్సీ ఎలక్ట్రాన్ సిద్ధాంతం’ను ప్రతిపాదించిన వారెవ్వరు?
జవాబు:
లూయీస్ మరియు కొస్సెల్
12. “మూలకాలకు చెందిన పరమాణువులు తమ బాహ్య కక్ష్యలో ఎనిమిది ఎలక్ట్రాన్లను మిగిలి ఉండేలా రసాయనిక మార్పు చెందడానికి ప్రయత్నిస్తాయి.” ఈ నియమం పేరు ఏమిటి?
జవాబు:
అష్టక నియమం
13. 11Na+ యొక్క ఎలక్ట్రాన్ విన్యాసం రాయుము.
జవాబు:
2, 8 (లేదా) 1s² 2s² 2p6.
14. Mg2+ యొక్క వేలన్సీ ఎంత?
జవాబు:
‘0’
![]()
15. జతపరుచుము :
a) 8O ( ) i) ఎలక్ట్రాన్లను కోల్పోవును
b) 12Mg ( ) ii) ఎలక్ట్రాన్లను పొందదు, కోల్పోదు
c) 10Ne ( ) iii) ఎలక్ట్రాన్లను పొందును
జవాబు:
a – iii, b-i, c – ii
16. ఏ గ్రూపు మూలకాలు ద్విఋణాత్మక అయాన్లను ప్రదర్శించును?
జవాబు:
VI A
17.
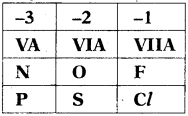
1) ఏకాత్మక ఆనయాన్లను ఇవ్వగల గ్రూపు ఏది?
జవాబు:
VIIA
2) చాల్కోజన్ కుటుంబం ఎన్ని ఎలక్ట్రాన్లను పొందగలదు?
జవాబు:
‘2’
18. వేలన్సీ కర్పరంలో 2 ఎలక్ట్రానులను కలిగి యుండి, అధిక స్థిరత్వం కలిగిన మూలకం ఏది?
జవాబు:
He
19. అయానిక బంధాన్ని ప్రతిపాదించినవారెవరు?
జవాబు:
కొసెల్
20. IA మరియు VIIA గ్రూపు మూలకాల మధ్య ఏర్పడే బంధం ఏ రకమైనది?
జవాబు:
అయానిక బంధం
21. IIA గ్రూపు మూలకాలు ఎటువంటి బంధాలను సులువుగా ఏర్పరచగలవు?
జవాబు:
అయానిక బంధం
22. అయానిక బంధం ఎప్పుడూ వీటి మధ్య ఏర్పడును.
a) రెండు ఒకే పరమాణువుల మధ్య
b) రెండు వేరు వేరు పరమాణువుల మధ్య
c) ‘a’ మరియు ‘b’
d) రెండూ కావు
జవాబు:
b) రెండు వేరు వేరు పరమాణువుల మధ్య
23. అయానిక బంధానికి గల మరొక పేరు రాయుము.
జవాబు:
స్థిర విద్యుత్ బంధం (లేదా) ఎలక్ట్రోవాలెంట్ బంధం.
24. కాటయాన్లు అనగానేమి?
జవాబు:
ధనాత్మక అయాన్లు
25. కాటయాన్లకు ఉదాహరణిమ్ము.
జవాబు:
Na+, Mg2+, Al3+
26. ఋణాత్మక అయాన్లను ఏమందురు?
జవాబు:
ఆనయాన్లు
27. ఆనయాన్లకు ఉదాహరణిమ్ము.
జవాబు:
P3- ; S2- ; Cl–
28. ఎలక్ట్రాన్ల బదిలీ వలన ఏర్పడే బంధం ఏది?
జవాబు:
అయానిక బంధం
29. సోడియం క్లోరైడ్ అణువు ఏర్పడు సమీకరణం
జవాబు:
Na(s) + ½ Cl2(g) → NaCl(s)
30. సోడియం కాటయాన్ ఏర్పడు విధం రాయుము.
జవాబు:
11Na → Na+ + e–
31. సోడియం క్లోరైడ్ ఏర్పడు విధానాన్ని లూయీస్ చుక్క పటం ద్వారా చూపుము.
జవాబు:
![]()
32. మెగ్నీషియం క్లోరైడ్ ఏర్పడునపుడు ఏర్పడే కాటయాన్, ఆనయాన్లు ఏవి?
జవాబు:
Mg2+ (కాటయాన్); Cl–(ఆనయాన్)
33. MgCl2 ఏర్పడు విధానాన్ని సూచించు సమీకరణం రాయుము.
జవాబు:
Mg2+ + 2Cl– → MgCl2
34. AlCl3 ఏర్పాటులో గల రసాయన బంధం పేరేమిటి?
జవాబు:
అయానిక బంధం
35. MgCl2 ఏర్పాటును సూచించు లూయీస్ చుక్కపటం రాయుము.
జవాబు:
![]()
36. సోడియం క్లోరైడ్ స్ఫటికంలో ఒక సోడియం చుట్టూ ఎన్ని క్లోరిన్ అయాన్లు ఉంటాయి?
జవాబు:
‘6’
37. NaCl అణు ఆకృతి ఏమిటి?
జవాబు:
ముఖ కేంద్రక స్ఫటిక నిర్మాణం
38. ఒక నిర్దిష్ట ఆవేశం గల అయాన్ చుట్టూ ఎన్ని వ్యతిరేక ఆవేశం గల అయాన్లు అమరి ఉన్నాయో తెలిపే సంఖ్యను ఏమంటారు?
జవాబు:
సమన్వయ సంఖ్య
39. Nacl లో Na+ యొక్క సమన్వయ సంఖ్య ఎంత?
జవాబు:
‘6’
40. Nacl లో Cl– యొక్క సమన్వయ సంఖ్య ఎంత?
జవాబు:
‘6’
41. సాధారణంగా ఎలక్ట్రాన్లను కోల్పోయే లక్షణాన్నీ ఏమందురు?
a) లోహ ధర్మం
b) ధన విద్యుదాత్మకత
c) a లేదా b
d) అలోహ ధర్మం
జవాబు:
c) a లేదా b
![]()
42. ధన విద్యుదాత్మకత ధర్మం గల మూలకాలు ఏర్పరచేది?
a) ఆనయాన్
b) కాటయాన్
c) a లేదా b
d) రెండూ కాదు రాయుము.
జవాబు:
b) కాటయాన్
43. ఋణ విద్యుదాత్మకత స్వభావాన్ని ప్రదర్శించే కొన్ని మూలకాలను రాయుము.
జవాబు:
ఆక్సిజన్, ఫ్లోరిన్, క్లోరిన్
44. అష్టక విన్యాసం కొరకు ఒక మూలకం ఎలక్ట్రాన్లను గ్రహించే స్వభావాన్ని ఏమంటారు?
జవాబు:
ఋణ విద్యుదాత్మకత
45. రెండు మూలకాలకు చెందిన పరమాణువులు అయానిక బంధంలో పాల్గొనాలంటే వాటి మధ్య ఋణ విద్యుదాత్మకతల మధ్య తేడా ఎంత వుండాలి?
a) 1.9
b) > 1.9
c) a లేదా b
d) <1.9
జవాబు:
c) a లేదా b
46. అయానిక బంధంలో పాల్గొనే పరమాణువులు
a) ఎలక్ట్రాన్లను గ్రహిస్తాయి
b) ఎలక్ట్రాన్లను కోల్పోతాయి
c) a లేదా b
d) ఎలక్ట్రాన్లను పంచుకుంటాయి.
జవాబు:
c) a లేదా b
47. ఒక మూలకం ఎలక్ట్రాన్లను కోల్పోవడం గానీ, గ్రహించడం గానీ ఈ క్రింది ఏ అంశంపై ఆధారపడదు?
a) పరమాణు పరిమాణం
b) అయనీకరణ శక్మం
c) ఎలక్ట్రాన్ విన్యాసం
d) ఏదీ లేదు
జవాబు:
d) ఏదీ లేదు
48. తక్కువ అయనీకరణ శక్మం, తక్కువ ఎలక్ట్రాన్ ఎఫినిటీ మరియు ఎక్కువ పరమాణు పరిమాణం గల మూలకాలు వీటిని ఏర్పరుస్తాయి?
a) కాటయాన్లు
b) ఆనయాన్లు
c) a లేదా b
d) రెండూ కావు
జవాబు:
a) కాటయాన్లు
49. అధిక అయనీకరణ శక్మం గల మూలకాలు ఏర్పరచే అయాన్లు ఎటువంటివి?
జవాబు:
ఆనయాన్లు
50. మూలకం X కు తక్కువ అయనీకరణ శక్మం కలదు.
జవాబు:
కాటయాన్
51. సమయోజనీయ బంధాన్ని ప్రతిపాదించిన వారెవరు?
జవాబు:
జి.యన్. లూయీస్ (G.N. Lewis)
52. పరమాణువులు ఒకటి గాని, అంతకన్నా ఎక్కువగాని వాటి వేలన్సీ ఎలక్ట్రానులను మరొక పరమాణువుతో పంచుకొని ఏర్పరచే బంధం ఏమిటి?
జవాబు:
సమయోజనీయ బంధం
53. జతపరుచుము :
a) సమయోజనీయ బంధం ( ) i) ఎలక్ట్రాన్ల పంపకం
b) అయానిక బంధం ( ) ii) ఎలక్ట్రాన్ల పంపిణీ
జవాబు:
a – i, b – ii
54. సమయోజనీయ బంధాలకి ఉదాహరణిమ్ము.
జవాబు:
F2, Cl2, HCl మొదలగునవి.
55. ఫ్లోరిన్ అణువు ఏర్పాటును సూచించు చుక్క పటం గీయుము.
జవాబు:
![]()
56. ఆక్సిజన్ అణువు ఏర్పాటును సూచించు చుక్క పటం గీయుము.
జవాబు:

57. ![]()
1) F చుట్టూ గల చుక్కలు వేటిని సూచిస్తాయి?
జవాబు:
వేలన్సీ ఎలక్ట్రానులను
2) ఫ్లోరిన్ ఏర్పరచగల ఒక సమయోజనీయ అణువుని రాయుము.
జవాబు:
F2; HF
58. ఆక్సిజన్ అణువులో ఎన్ని బంధాలు కలవు?
జవాబు:
రెండు
59. త్రిబంధం గల ఒక అణువు పేరు రాయుము.
జవాబు:
N2 (N ≡ N)
![]()
60. CH4 లో ఎన్ని సమయోజనీయ బంధాలు గలవు ?
జవాబు:
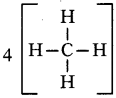
61. CH4 అణు ఆకృతిని యుము.
జవాబు:
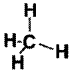
62. అమ్మోనియా అణు ఆకృతిని గీయుము. అయిన అది ఏర్పరచు అయాన్ ఏది?
జవాబు:
63. అమ్మోనియా అణువులో
a) ఎన్ని ఏకబంధాలు కలవు?
జవాబు:
‘3’
b) ఎన్ని ఒంటరి జత ఎలక్ట్రాన్లు కలవు?
జవాబు:
‘1’
c) H\(\hat{\mathbf{N}}\)H బంధకోణం ఎంత?
జవాబు:
107°48′
64. రెండు ఒంటరి జత ఎలక్ట్రాన్లను కలిగియున్న అణువుకి ఉదాహరణనిమ్ము.
జవాబు:
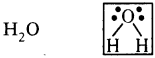
65. H2O అణువు లూయీస్ చుక్క పటం గీయుము.
జవాబు:
66. ఒక అణువులో ఒక పరమాణువులు ఏర్పరచు సమయోజనీయ బంధాల సంఖ్యను ఏమంటారు?
జవాబు:
‘కో-వేలన్సీ’
67. సమయోజనీయ బంధం ఏర్పరచు రెండు పరమాణువుల మధ్య దూరంను ఏమంటారు?
జవాబు:
బంధ దూరం / బంధదైర్ఘ్యం
68. బంధదూరం యొక్క ప్రమాణం ఏమిటి?
జవాబు:
nm (నానోమీటర్) (లేదా) A° (ఆంగ్ స్టాం)
69. రెండు పరమాణువులు గల ఒక అణువులో ఆ పరమాణువులను విడదీయడానికి కావలసిన శక్తిని ఏమందురు?
జవాబు:
బంధ శక్తి (లేదా) బంధవిచ్ఛేదక శక్తి
70. 1 నానోమీటర్
a) 10-8 మీ.
b) 10-9మీ.
c) 10-10మీ.
జవాబు:
b) 10-9మీ.
71. 1 ఆంగ్ సాం
a) 10-9మీ.
b) 10-10మీ.
c) 10-8మీ.
జవాబు:
b) 10-10మీ.
72. Cl\(\hat{\mathbf{Be}}\)Cl లో బంధకోణం ఎంత?
జవాబు:
180°
73. CH4 లో H\(\hat{\mathbf{C}}\)H బంధకోణం ఎంత?
జవాబు:
109°28¹
74. క్రింది వానిని జతపరుచుము.

జవాబు:
a – iii, b – i, c – ii
75. అణు ఆకృతులను వివరించలేకపోయిన సిద్ధాంతం.
a) VSEPRT
b) ఎలక్ట్రాన్ వేలన్సీ సిద్ధాంతం
c) వేలన్సీ బంధ సిద్ధాంతం
జవాబు:
b) ఎలక్ట్రాన్ వేలన్సీ సిద్ధాంతం
76. VSEPRT ని విస్తరించుము.
జవాబు:
Valency – Shell – Electron – Pair – Repulsion – Theory.
(వేలన్సీ- షెల్ – ఎలక్ట్రాన్ – పెయిర్ – రిపల్టన్ – థియరీ)
77. VSEPRT ని ప్రతిపాదించినది ఎవరు?
జవాబు:
సిధ్ధ విక్ మరియు పావెల్ (Sidgwick & Powell)
78. VSEPRT ని అభివృద్ధి చేసినది ఎవరు?
జవాబు:
గిలెస్పీ మరియు నైహామ్ (Gillespie & Nyholm)
79. బంధ జతలు, ఒంటరి జతలు అనే దృగ్విషయం గల సిద్ధాంతం
A) వేలన్సీ ఎలక్ట్రాన్ సిద్ధాంతం
B) ఎలక్ట్రాన్ బంధ సిద్ధాంతం
C) VSEPRT
D) పైవన్నియు
జవాబు:
C) VSEPRT
![]()
80. a) బంధ జంట ఎలక్ట్రాన్లు, ఒంటరి జంట ఎలక్ట్రాన్ల మధ్య వికర్షణ వలన అణువులు ఆకృతులు పొందుతాయి.
b) మధ్య పరమాణువు చుట్టూ బంధ జంటల కంటే ఒంటరి ఎలక్ట్రాన్ జంటలు ఎక్కువ ఖాళీని ఆక్రమిస్తాయి.
పై వాక్యాలలో ఏ వాక్యం సరైనది?
A) a
B) b
C) a మరియు b
D) రెండూ కావు
జవాబు:
C) a మరియు b
81. జతపరచుము :
| ఒంటరి జత ఎలక్ట్రాన్లు లేకుండా | బంధకోణం |
| a) రెండు బంధ జంటలు | i) 120° |
| b) మూడు బంధజంటలు | ii) 180° |
| c) నాలుగు బంధ జంటలు | iii) 109°28′ |
జవాబు:
a – ii, b-i, c – iii
82. CH4 లో బంధకోణం 109°28¹ అయిన ఎన్ని ఒంటరి జత ఎలక్ట్రాన్లు కలవు ?
జవాబు:
సున్న (0)
83. NH3 అణువు ఆకృతి ఏమిటి?
జవాబు:
త్రికోణీయ పిరమిడల్
84.
1) ఇచ్చిన అణువు ఆకృతి ఏమిటి?
జవాబు:
‘V’ లేదా కో ణీయ ఆకృతి
2) ఎన్ని ఒంటరి జంటలు కలవు?
జవాబు:
‘2’
85. VSEPRT యొక్క ఒక పరిమితిని రాయుము.
జవాబు:
బంధశక్తులను వివరించలేదు.
86. వేలన్సీ బంధ సిద్ధాంతాన్ని ఎవరు ప్రతిపాదించారు?
జవాబు:
లైనస్ పౌలింగ్
87. పరమాణువుల కేంద్రకాలను కలిపే అంతర కేంద్రక అక్షం వెంబడి ఆర్బిటాళ్ళు అతిపాతం చెందితే ఏర్పడే బంధం
a) సిగ్మా (σ)
b) పై (π)
c) రెండూ
జవాబు:
a) సిగ్మా (σ)
88. ఆర్బిటాళ్ళ పార్శ్వ అతిపాతం వలన ఏర్పడే బంధం ఏది?
జవాబు:
పై (π)
89. A : ‘σ’ బంధం, ‘π’ బంధం కన్నా బలమైనది.
R: ‘σ’ బంధం పార్శ్వ అతిపాతం వలన ఏర్పడును.
a) A మరియు Rలు సరియైనవి
b) A మరియు R లు తప్పు
c) A మాత్రమే ఒప్పు
d) R మాత్రమే ఒప్పు
జవాబు:
c) A మాత్రమే ఒప్పు
90. i) σ బంధం ఏర్పడిన తర్వాత π బంధం ఏర్పడును.
ii) σ బంధం ఉంది అని అంటే π కూడా ఉందని అర్థం సరియైన వాక్యం ఏది?
జవాబు:
(i)
91. H2 అణువులో s – ఆర్బిటాళ్ళ అతిపాతం పటం గీయుము.
జవాబు:
92. Cl2 లో p- ఆర్బిటాళ్ళ అతిపాతం పటం గీయుము.
జవాబు:
![]()
93. HCl లో ఆర్బిటాళ్ల అతిపాతం పటం గీయుము.
జవాబు:
94. πpz – pz, πpy – py లు N2 లో కలవు. మరియొక బంధం ఏమి ఉండును?
జవాబు:
σpx – px
95. 4Be లో భూస్థాయిలో ఎన్ని జతకూడని ఎలక్ట్రాన్లు కలవు?
జవాబు:
సున్న (లేవు)
96. సంకర ఆర్బిటాళ్ళలో ఇవి సమానం లేదా ఒకే విధంగా ఉంటాయి.
a) శక్తి
b) ఆకృతి
c) రెండూ
d) రెండూ కావు
జవాబు:
c) రెండూ
97. BeCl2 లో ఎటువంటి సంకరీకరణం జరుగును?
జవాబు:
sp
![]()
98. BeCl2 లో Be మరియు CI ల మధ్య ఎటువంటి సంకరీకరణ బంధం కలదు?
జవాబు:
σsp – p
99. BF3 లో సంకరీకరణం పేరు ఏమిటి ? ఏది?
జవాబు:
sp²
100. NH3 లో ఒంటరి జత ఎలక్ట్రాన్లు లేకుంటే HNH ఎంత ఉంటుంది?
జవాబు:
109°28¹
101. జతపరుచుము.
| ఒంటరి జతలు | అణువులు |
| i) 1 | a) BF3 |
| ii) 2 | b) NH3 |
| iii) 0 | c) H2O |
జవాబు:
i – b, ii – c, iii – a
102. H2O లో బంధ కోణాన్ని ప్రభావితం చేసేది
a) ఒంటరి జత – ఒంటరి జత వికర్షణ
b) బంధ జత – బంధ జత వికర్షణ
c) పై రెండూ
d) పై రెండూ కావు
జవాబు:
c) పై రెండూ
103. అయానిక పదార్థానికి ఒక ఉదాహరణనిమ్ము.
జవాబు:
NaCl
104. సమయోజనీయ పదార్థానికి ఒక ఉదాహరణనిమ్ము.
జవాబు:
C2H6
105. ధృవశీల సమయోజనీయ పదార్థానికి ఒక
ఉదాహరణనిమ్ము.
జవాబు:
HCl
106. A : NaCl నీటిలో కరుగును.
R : ధృవ పదార్థాలు, ధృవ పదార్థాలలో మాత్రమే కరుగును.
A ని R సమర్ధిస్తుందా?
జవాబు:
అవును
107. ‘అయానిక పదార్థాలకి అధిక ద్రవీభవన, బాష్పీభవన స్థానాలు ఉంటాయి’.
పై సమాచారం ఆధారంగా క్రింది వానిలో ఏది అధిక ద్రవీభవన స్థానం కలిగి ఉంటుంది?
a) NaCl
b) HCl
c) C2H6
జవాబు:
a) NaCl
108. 1123X అను మూలకం ‘Y’ అను మూలకంతో అయానిక బంధాన్ని ఏర్పరచగలదు. అయితే Y ఎటువంటి అయాను ఏర్పరుచును?
జవాబు:
ఆనయాన్ (ఋణాత్మక)
109. ‘A’ అనే మూలకం ‘ACl4‘ అనే అణువును ఏర్పరచగలదు. A లో వేలన్సీ ఎలక్ట్రాన్లు ఎన్ని వుండవచ్చును?
జవాబు:
1 లేదా 7
110. ‘X’ అనే వాయువు తప్ప మిగిలిన వాటి వేలన్సీ షెల్ లో అష్టకం ఉంది. కాని ‘X’ స్థిరమైనది. అయిన ‘X’ ఏమిటో ఊహించండి.
జవాబు:
He
111. చివరి కక్ష్యలో ఎలక్ట్రానులు : వేలన్సీ ఎలక్ట్రానులు : : సమయోజనీయ బంధాల సంఖ్య : ?
జవాబు:
కో వేలన్సీ
112.  ఈ అణువు ఏమిటో ఊహించుము.
ఈ అణువు ఏమిటో ఊహించుము.
జవాబు:
H2O.
113. మీథేన్ అణువులో బంధ కోణం ఎంత?
జవాబు:
109°28¹
114. అమ్మోనియా అణువులో బంధకోణం ఎంత?
జవాబు:
107°48¹
115. సంకరీకరణ ద్వారా ఏర్పడిన బోరాన్ ట్రై ఫ్లోరైడ్ లో ఎటువంటి బంధాలు ఉంటాయి?
జవాబు:
మూడు σsp² – p బంధాలు
116. ఒంటరి జత ఎలక్ట్రాన్లు లేని అణువు ఏది?
A) NH3
B) H2O
C) BF3
D) ఏదీకాదు
జవాబు:
C) BF3
![]()
117. క్రింది వానిలో సమయోజనీయ బంధం గల అణువు ఏది?
A) NaCl
B) MgCl2
C) BeCl2
D) ఏదీకాదు
జవాబు:
C) BeCl2
118. అతి తక్కువ బంధ దూరం గల అణువు
A) H – H
B ) F – F
C) Br – Br
D) H – Cl
జవాబు:
A) H – H
119. అతి ఎక్కువ బంధశక్తి గల బంధం
A) I – I
B) H -H
C) Cl – Cl
D) H – F
జవాబు:
D) H – F
అదనపు ప్రాక్టీస్ ప్రశ్నలు
ప్రశ్న 1.
19వ శతాబ్ది చివరిలో లేదా 20వ శతాబ్ది మొదట్లో శాస్త్రవేత్తలు, బంధం ఏర్పడడానికి ఏ బలం అవసరమైనదని భావించారు? దీని ఆధారంగా పరమాణువుల మధ్య బంధం ఏర్పడడాన్ని ఎలా వివరించారు?
జవాబు:
విద్యుదాకర్షణ బలం వల్లనే పరమాణువుల మధ్య బంధం ఏర్పడుతుందని 19వ శతాబ్దం చివరలో మరియు 20వ శతాబ్ది మొదట్లో శాస్త్రవేత్తలు నమ్మేవారు.
- పరమాణువులు సాధ్యమైనంత దగ్గరగా వచ్చినపుడు ఒక పరమాణువులోని ఎలక్ట్రాన్లు రెండవ పరమాణువులో గల కేంద్రకం యొక్క ఆకర్షణకు లోనవుతాయి.
- అదే సమయంలో ఒకే ఆవేశం గల ఎలక్ట్రాన్లు పరస్పర వికర్షణకు, ఒకే ఆవేశం గల కేంద్రకాలు కూడా ‘పరస్పర వికర్షణకు లోనవుతాయి.
- పరమాణువుల మధ్య వుండే వికర్షణ / ఆకర్షణ బలాల తీవ్రత బంధం ఏర్పాటును నిర్ణయిస్తుంది.
- ఆకర్షణ బలం కన్నా వికర్షణ బలం ఎక్కువైతే ఆ పరమాణువులు సంయోగం చెందవు.
- రెండు పరమాణువులు సంయోగం చెందేటప్పుడు కేంద్రకం గాని, అంతరకక్ష్యలో వుండే ఎలక్ట్రానులు గాని ప్రభావానికి గురికావు. కేవలం బాహ్యకక్ష్యలో ఉండే ఎలక్ట్రానులు మాత్రమే ప్రభావితమవుతాయి.
- కాబట్టి వేలన్సీ ఎలక్ట్రాన్లు రెండు పరమాణువుల మధ్య బంధం ఏర్పడడానికి కారణమౌతాయి.
ప్రశ్న 2.
జడవాయువుల లక్షణాలేవి?
జవాబు:
- జడవాయువులు ‘O’ గ్రూపుకు చెందుతాయి. (18 వ గ్రూపు / VIIIA)
- హీలియం తప్ప మిగిలిన జడవాయువుల ఎలక్ట్రాన్ విన్యాసం ns² np6.
- వీటి బాహ్య కక్ష్య పూర్తిగా నిండి యుండడం వల్ల, మిగిలిన మూలకాలతో పోల్చుకుంటే వీటి చర్యాశీలత శూన్యం.
- ఇవి చాలా స్థిరమైనవి. ఇవి ఇతర మూలకాలతో కలిసి గాని వాటితో అవి కలిసిగాని ఇతర సంయోగ పదార్థాలను ఏర్పరచలేవు.
ప్రశ్న 3.
ఏకమాత్ర ధనాత్మక అయాన్, ద్విమాత్ర ధనాత్మక అయాన్, త్రిమాత్రక ధనాత్మక అయాన్లు ఏర్పడే విధానాన్ని ఉదాహరణలతో వివరించుము.
జవాబు:
ఏకమాత్ర ధనాత్మక అయాన్ ఏర్పడుట :
IA గ్రూపు మూలకాలు (Li నుండి CS వరకు) వాని పరమాణు బాహ్యకక్ష్య నుండి ఒక ఎలక్ట్రాన్ను కోల్పోయి దానికి సంబంధించిన ఏకమాత్ర ధన్మాతక అయాను ఏర్పరచడం ద్వారా అష్టక విన్యాసాన్ని పొందడానికి ప్రయత్నం చేస్తుంది.
ఉదా : 11Na → 2, 8, 1; 11Na+ → 2, 8.
ద్విమాత్ర ధనాత్మక అయాన్ ఏర్పడుట :
IIA గ్రూపు మూలకాలు (Mg నుండి Ba వరకు) పరమాణువులు రసాయనిక చర్యలలో పాల్గొనేటప్పుడు తమ బాహ్య కక్ష్య నుండి రెండు వేలన్సీ ఎలక్ట్రాన్లను కోల్పోవడం ద్వారా ద్విమాత్రక ధనాత్మక అయాన్ గా మారి అష్టక విన్యాసాన్ని పొందుతాయి.
ఉదా : 12Mg → 2, 8, 2 ; 12Mg+2 → 2, 8.
త్రిమాత్ర ధనాత్మక అయాన్ ఏర్పడుట :
IIIA గ్రూపు మూలకాలు మూడు వేలన్సీ ఎలక్ట్రాన్లను కోల్పోయి త్రిమాత్రక ధనాత్మక అయాన్లుగా ఏర్పడటం ద్వారా అష్టక విన్యాసాన్ని పొందుతాయి.
ఉదా : 13Al → 2, 8, 3 ; 13Al3+ → 2, 8.
![]()
ప్రశ్న 4.
త్రిమాత్ర, ద్విమాత్ర, ఏకమాత్ర ఆనయాన్లు (ఋణాత్మక అయాన్లు) ఏర్పడే విధానాన్ని వివరించుము.
జవాబు:
ఏకమాత్ర ఆనయాన్లు ఏర్పడుట :
VII A గ్రూపు మూలకాల పరమాణువులు రసాయన మార్పుకు లోనయ్యేటప్పుడు ఒక ఎలక్ట్రాన్ ను గ్రహించి, ఏకమాత్ర ఆనయాన్ గా మారి అష్టక విన్యాసాన్ని పొందుతాయి.
ఉదా : 9F → 2, 7 ; 9F3- → 2, 8.
ద్విమాత్ర ధనాత్మక అయాన్ ఏర్పడుట :
VI A గ్రూపు మూలకాలు పరమాణువులు రసాయన మార్పుకు లోనయ్యేటప్పుడు రెండు ఎలక్ట్రాన్లను గ్రహించి – ద్విమాత్ర ఆనయాన్లుగా మారి అష్టక విన్యాసాన్ని పొందుతాయి.
ఉదా : 8O → 2, 6 ; 8O2- → 2, 8.
త్రిమాత్ర ధనాత్మక అయాన్లు ఏర్పడుట :
V A గ్రూపు మూలకాల పరమాణువులు రసాయన మార్పులకు లోనయ్యేటప్పుడు మూడు ఎలక్ట్రాన్లను గ్రహించి త్రిమాత్రక ఆనయాన్లుగా మారి అష్టక విన్యాసాన్ని పొందుతాయి. .
ఉదా : 7N → 2, 5; 7N3- → 2, 8.
ప్రశ్న 5.
లూయిస్ ప్రకారం కెర్నెల్ అనగానేమి?
జవాబు:
కెర్నెల్ అనగా అంతర కక్ష్యలోని ఎలక్ట్రాన్లను కలిగియున్న కేంద్రకం.
ప్రశ్న 6.
అయానిక బంధాన్ని ఎలక్ట్రోవేలెంట్ బంధం అని ఎందుకంటారు?
జవాబు:
అయానిక బంధం రెండు ఆవేశపూరిత కణాలయిన అయాన్ల మధ్య ఏర్పడడం చేత దీనిని ‘అయానిక బంధం’ అంటారు. ఆనయాన్ల మధ్య పనిచేస్తున్న బలాలు, స్థిర విద్యుదాకర్షణ బలాలు కావడం చేత ఈ బంధాన్ని స్థిర విద్యుత్ బంధం అంటారు. వేలన్సీ భావనను ఎలక్ట్రాన్స్ పరంగా వివరిస్తాం కాబట్టి దీనిని ఎలక్ట్రోవేలెంట్ బంధం అంటారు.
ప్రశ్న 7.
వేలన్సీ ఎలక్ట్రాన్ సిద్ధాంతంలోని లోపాలేవి?
జవాబు:
ప్రయోగాత్మకంగా కనుగొనబడిన బంధ దూరాలు, బంధ శక్తులు, విలువలు, పరమాణువులు జంటలుగా మారినపుడు వేరువేరుగా ఉంటాయి. ఈ వివిధ అణువులలో బంధకోణాలు వేరువేరుగా వుండడాన్ని వివరించలేకపోయింది.
10th Class Physics 8th Lesson రసాయన బంధం 1 Mark Bits Questions and Answers
సరియైన సమాధానమును గుర్తించండి.
1. CH4 అణువులో గల σ – బంధాల సంఖ్య …….
A) 2
B) 3
C) 4
D) 1
జవాబు:
C) 4
2. H2O అణువు ఆకృతి …………..
A) రేఖీయం
B) V – ఆకృతి
C) త్రికోణీయ ద్వి పిరమిడ్
D) త్రికోణీయ పిరమిడ్
జవాబు:
B) V – ఆకృతి
3. క్రింది వానిలో అష్టక నియమం పాటింపబడని అణువు.
A) O2
B) F2
C) BCl3
D) N2
జవాబు:
C) BCl3
![]()
4. HCl అణువులో ఉండే బంధం ఏది?
A) అయానిక బంధం
B) ధృవ సమయోజనీయ బంధం
C) అధృవ సమయోజనీయ బంధం
D) ఏదీకాదు
జవాబు:
B) ధృవ సమయోజనీయ బంధం
5. అమ్మోనియా అణువు ఆకృతి
A) రేఖీయం
B) రేఖీయ త్రిభుజం
C) చతుర్ముఖీయ
D) త్రికోణీయ పిరమిడ్
జవాబు:
D) త్రికోణీయ పిరమిడ్
6. కింది వాటిలో అయానిక పదార్థం
A) C2H6
B) HCl
C) NaCl
D) H2
జవాబు:
C) NaCl
7. ‘A’ అనే మూలకం హైడ్రోజన్ సంయోగం చెంది AH2 అను పదార్థం ఏర్పడింది. అయిన ‘A’ వేలన్సీ కక్ష్యలోని ఎలక్ట్రాన్ల సంఖ్య సాధారణంగా
A) 2
B) 3
C) 5
D) 8
జవాబు:
A) 2
8. VESPRT సిద్ధాంతం ప్రకారం NH3లో బంధకోణం 107°48′ ఉండడానికి గల కారణం
A) బంధ ఎలక్ట్రాన్ జంట, ఒంటరి ఎలక్ట్రాన్ జంటల ఆకర్షణ
B) బంధ ఎలక్ట్రాన్ జంట, ఒంటరి ఎలక్ట్రాన్ జంటల వికర్షణ
C) బంధ ఎలక్ట్రాన్ జంట, ఒంటరి ఎలక్ట్రాన్ జంటల ఆకర్షణ సమానంగా ఉండడం
D) బంధ ఎలక్ట్రాన్ జంటల వికర్షణ అధికంగా ఉండడం వలన
జవాబు:
B) బంధ ఎలక్ట్రాన్ జంట, ఒంటరి ఎలక్ట్రాన్ జంటల వికర్షణ
9. ‘X’ అను సమ్మేళనం యొక్క ఆక్సెడ్ XO. క్రింది వాటిలో ‘X’ ఏ సమ్మేళనాన్ని ఏర్పరచదు?
A) X(NO3)2
B) X(SO4)8
C) XCl2
D) X3N2
జవాబు:
B) X(SO4)8
10. క్రింది వానిలో అధిక స్థిరత్వం కలది.
A) Li
B) Be
C) F
D) Ne
జవాబు:
D) Ne
11. వాక్యం 1 : VSEPR సిద్ధాంతాన్ని సిద్ధివిక్, పావెల్ ప్రతిపాదించారు.
వాక్యం 2 : VSEPR సిద్ధాంతాన్ని సివిక్, గిలెస్పీ అభివృద్ధి పరచారు.
A) 1, 2 రెండూ సరియైన వాక్యములు.
B) వాక్యం 1 మాత్రమే సరియైనది.
C) వాక్యం 2 మాత్రమే సరియైనది.
D) రెండు వాక్యములు సరియైనవి కావు.
జవాబు:
B) వాక్యం 1 మాత్రమే సరియైనది.
12. క్రింది వానిలో సరియగు జత ………..
A) BeCl2 – బంధకోణం 120°
B) BF3 – బంధకోణం 180°
C) NH3 – బంధకోణం 104°27′
D) CH4 – బంధకోణం 109°28′
జవాబు:
D) CH4 – బంధకోణం 109°28′
13. C2H4 అణువులోని ‘π’ బంధాల సంఖ్య
A) 1
B) 2
C) 3
D) 4
జవాబు:
A) 1
![]()
14. క్రింది వాటిలో అయానిక బంధం గల సంయోగ పదార్థం
A) H2O
B) NH
C) MgO
D) HCl
జవాబు:
B) NH
మీకు తెలుసా?
డేవి ప్రయోగం :
లండన్ లోని రాయల్ ఇనిస్టిట్యూట్ లో హంఫ్రిడేవి (1778-1819) అనే రసాయన శాస్త్రవేత్త, 250 లోహపు పలకలతో ఒక బ్యాటరీని నిర్మించాడు. బ్యాటరీ నుండి ఉత్పత్తి అయ్యే విద్యుత్ ను ఉపయోగించి లవణ ద్రావణాల నుండి విద్యుత్ విశ్లేషణ ప్రక్రియ ద్వారా అధిక చర్యాశీలత గల మూలకాలైన పొటాషియం, సోడియంలను ఇతను రాబట్టాడు.


ఈ ప్రయోగంలో సంయోగ పదార్థం (లవణ ద్రావణం) లోని లోహ భాగం ఋణధృవం వైపు, ఆలోహభాగం ధనధృవంవైపు కదలడాన్ని గమనించాడు. దీని ఆధారంగా లోహాలు ధనాత్మకమైనవని, లోహలు ఋణాత్మకమైనవని ఈ రెండు కూడా సంయోగ పదార్థంలో విద్యుదాకర్షణ బలంచే బంధించబడి ఉంటాయని అతను ప్రతిపాదించాడు.
ఈ వివరణల ఆధారంగా NaCl, KCI వంటి సంయోగపదార్థాలలోని రసాయనబంధాలను కొంతవరకూ వివరించగలిగినప్పటికీ, కర్బన సమ్మేళనాలలో, ద్విపరమాణుక అణువులలో ఉండే బంధాలను వివరించలేకపోయాడు.
ఒక లోహ పరమాణువు దాని వాలన్సీ కక్ష్యనుండి కోల్పోయే ఎలక్ట్రాన్ల సంఖ్య దాని గ్రూప్ సంఖ్యకు సమానం.
ఉదా : సోడియం మరియు మెగ్నీషియం వేలన్సీలు వరుసగా 1 మరియు 2. ఇవి వాటి గ్రూప్ సంఖ్యలకు సమానం.
అలోహ మూలకం దాని పరమాణువు కోసం గ్రహించే ఎలక్ట్రాన్ల సంఖ్యనే దాని ‘వేలన్సీ’ అంటాం. ఇది (8 – ఆ మూలకం యొక్క గ్రూపు సంఖ్య)కు సమానం అవుతుంది.
ఉదా : క్లోరిన్ వేలెన్సీ (8-7) = 1.
- 1 ఆంగ్ స్ట్రామ్ 10-10 మీ.లకు సమానం ఆంగ్ స్ట్రామ్ అనేది పొడవుకు ప్రమాణం. దీని విలువ 0.1 నానోమీటర్లకు లేదా 100 పికోమీటర్లకు సమానం.
- 1 నానోమీటర్ 10-9 మీటర్లకు సమానం.