SCERT AP 9th Class Physical Science Guide Pdf 6th Lesson రసాయన చర్యలు – సమీకరణాలు Textbook Questions and Answers.
AP State Syllabus 9th Class Physical Science 6th Lesson Questions and Answers రసాయన చర్యలు – సమీకరణాలు
9th Class Physical Science 6th Lesson రసాయన చర్యలు – సమీకరణాలు Textbook Questions and Answers
అభ్యసనాన్ని మెరుగుపరుచుకోండి
ప్రశ్న 1.
తుల్య రసాయన సమీకరణం అంటే ఏమిటి ? ఎందుకు రసాయన సమీకరణాలను తుల్యం చేయాలి? (AS 1)
(లేదా)
శుల్య సమీకరణంను నిర్వచించి, దాని ఆవశ్యకతను తెలుపుము.
జవాబు:
ఏ సమీకరణంలో అయితే క్రియాజనకాల వైపుగల మూలక పరమాణువుల సంఖ్య, క్రియాజన్యాల వైపు గల మూలక పరనూణువుల సంఖ్యకు సమానంగా ఉంటుందో అటువంటి సమీకరణాన్ని తుల్య సమీకరణం అంటారు.
ఒక రసాయన చర్యలో పరమాణువులు సృష్టించబడవు, లేదా నాశనం చెయ్యబడవు. అనగా చర్యకు ముందు మరియు చర్య జరిగిన తరువాత మూలక పరమాణువుల సంఖ్య సమానంగా ఉండాలి. దీనినే ద్రవ్యనిత్యత్వ నియమం అంటారు.
కాబట్టి ఒక రసాయన సమీకరణం ఖచ్చితంగా తుల్యం చేయబడాలి.
ప్రశ్న 2.
కింది రసాయన సమీకరణాలను తుల్యం చేయండి. (AS 1)
a) NaOH + H2SO4 → Na2SO4 + H2O
b) Hg(NO3)2 + KI → HgI2 + KNO3
c) H2 + O2 → H2O
d) KClO3 → KCl + O2
e) C3H8 + O2 → CO2 + H2O
జవాబు:
a) 2NaOH + H2SO4 → Na2SO4 + 2H2O
b) Hg(NO3)2 + 2KI → HgI2 + 2KNO3
c) H2 + Cl2 → 2HCl
d) 2KClO3 → 2KCl + 3O2
e) C3H8 + 5O2 → 3CO2 + 4H2O
ప్రశ్న 3.
ఈ క్రింది రసాయన చర్యలకు తుల్య రసాయన సమీకరణాలు రాయండి. (AS 1)
a) జింక్ + సిల్వర్ నైట్రేట్ → జింక్ నైట్రేట్ + సిల్వర్
b) అల్యూమినియం + కాపర్ క్లోరైడ్ → అల్యూమినియం క్లోరైడ్ + కాపర్
c) హైడ్రోజన్ + క్లోరిన్ → హైడ్రోజన్ క్లోరైడ్
d) అమ్మోనియం నైట్రేట్ → నైట్రస్ ఆక్సైడ్ + నీరు
జవాబు:
a) Zn + 2AgNO3 → Zn(NO3)2 + 2Ag
b) 2Al + 3CuCl2 → 2AlCl3 + 3Cu
c) H2 + Cl2 → 2HCl
d) 2NH4NO3 → 2N2O + 4H2O
ప్రశ్న 4.
క్రింది వాటికి తుల్య రసాయన సమీకరణం రాసి, అవి ఎలాంటి రకమైన చర్యలో తెలపంది. (AS 1)
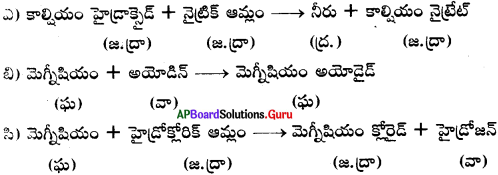
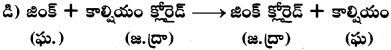
జవాబు:
ఎ)
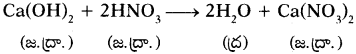
పై చర్య ద్వంద్వ వియోగానికి చెందిన రసాయన సమీకరణం.
ఆమ్లము, క్షారము కలిసినపుడు లవణము, నీరు ఏర్పడు తటస్థీకరణ చర్య ద్వంద్వ వియోగానికి ఒక ఉదాహరణ.
బి)
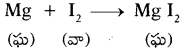
పై చర్య రసాయన సంయోగంకు చెందిన సమీకరణం. క్రియాజనకాలు = 2, క్రియాజన్యం = 1 అయితే ఇది ఎల్లప్పుడు రసాయన సంయోగచర్య అగును.
సి)
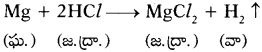
పై చర్య రసాయన స్థానభ్రంశానికి చెందిన సమీకరణం. మెగ్నీషియం లోహం హైడ్రోజన్ కంటే చర్యాశీలత ఎక్కువ. కాబట్టి Mg, H2ను స్థానభ్రంశం చెందించగలదు.
డి)
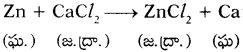
జింక్ లోహం కంటే చర్యాశీలత కాల్షియం లోహానికి ఎక్కువ. కాబట్టి జింక్ లోహం, కాల్షియం లోహాన్ని స్థానభ్రంశం చెందించలేదు. కాబట్టి వీటి మధ్య రసాయనిక చర్య జరగదు.
![]()
ప్రశ్న 5.
ఒక రసాయన చర్యలో వేడి / కాంతి/విద్యుత్ గ్రహించబడే చర్య మరియు వియోగ చర్య అయిన దానికి ఒక ఉదాహరణ రాయండి. (AS 1)
జవాబు:
1) ఒక సమ్మేళనం ఉష్ణం పంపించుట వలన వియోగం చెందితే దానిని ఉష్ణవియోగం అంటారు.
![]()
2) ఒక సమ్మేళనం కాంతి పంపించుట వలన వియోగం చెందితే దానిని కాంతి వియోగం లేదా కాంతి రసాయన చర్యలు అంటారు.
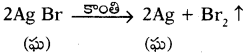
3) ఒక సమ్మేళనంలోకి విద్యుత్ పంపించుట వలన వియోగం చెందితే ఆ చర్యను విద్యుత్ విశ్లేషణ అంటారు.
![]()
ప్రశ్న 6.
అవక్షేప చర్యలు అనగానేమి? (AS 1)
(లేదా)
అవక్షేప చర్యను నిర్వచించి, ఉదహరించుము.
జవాబు:
రెండు సంయోగ పదార్ధాల జలద్రావణాలు ఒకదానితో ఒకటి చర్య జరిపినపుడు ధన, ఋణ ప్రాతిపదికలు మార్పు చెంది నీటిలో కరగని లవణాలు ఏర్పడును. దీనినే అవక్షేపం అంటారు. అవక్షేపాలు ఏర్పడే చర్యలను అవక్షేప చర్యలు అంటారు. అవక్షేపాన్ని రసాయన సమీకరణంలో క్రిందవైపు చూపిస్తున్న బాణం గుర్తుతో సూచిస్తారు.
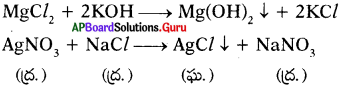
ప్రశ్న 7.
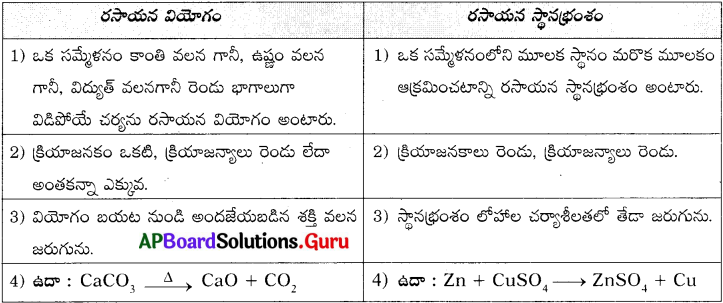
రసాయన స్థానభ్రంశ చర్య, రసాయన వియోగ చర్యకు మధ్య తేడాలు ఏమిటి? ఉదాహరణలతో వివరించండి. (AS 1)
జవాబు:
ప్రశ్న 8.
సూర్యకాంతి సమక్షంలో జరిగే చర్యలను ఉదాహరణలతో వివరించండి. (AS 1)
జవాబు:
సూర్యకాంతి సమక్షంలో జరిగే చర్యలు రెండు రకాలు :
- కాంతి వియోగ చర్య (Photolysis)
- కాంతి సంశ్లేషణ చర్య (Photosynthesis)
1) కాంతి వియోగ చర్య లేదా కాంతి రసాయన చర్య :
కాంతి సమక్షంలో ఒక సమ్మేళనం వియోగం చెందితే ఆ చర్యను కాంతి వియోగ చర్య లేదా కాంతి రసాయన చర్య అంటారు.
![]()
2) కాంతి సంశ్లేషణ చర్య : కాంతి సమక్షంలో రెండు సమ్మేళనాలు కలిసి క్రొత్త పదార్ధం ఏర్పడటాన్ని కాంతి సంశ్లేషణ చర్య అంటారు.
![]()
ప్రశ్న 9.
ఎందుకు శ్వాసక్రియను ఉష్ణమోచక చర్యగా పరిగణిస్తాం? వివరించండి. (AS 1)
(లేదా)
మనోభిరామ్ కు అతని ఉపాధ్యాయుడు శ్వాసక్రియ ఒక ఉష్ణమోచక చర్య అని. చెప్పెను. నీవు ఉపాధ్యాయుని ఏ విధముగా సమర్థిస్తావు?
జవాబు:
- మనం ఆక్సిజన్ తో కూడిన వాయువులను శ్వాసించడం ద్వారా ఆక్సిజన్ ఊపిరితిత్తులలోనికి ప్రవేశిస్తుంది.
- ఆక్సిజన్ రక్తంలోనికి వ్యాపనం చెంది ఎర్రరక్త కణాల ద్వారా శరీరంలోని ప్రతి కణానికి చేరుతుంది.
- కణాల వద్ద ఉన్న గ్లూకోజ్ అణువులు ఆక్సిజన్ తో చర్య జరిపి CO2. నీటిని, శక్తిని విడుదల చేస్తాయి.

- ఈ చర్య ద్వారా శక్తి బయటకు విడుదలగును. కాబట్టి ఈ చర్యను ఉష్ణమోచక, చర్య అంటారు.
- ఈ విడుదలైన శక్తితో శరీరంలోని ముఖ్య అవయవాలైన గుండె, కాలేయం, ఊపిరితిత్తులు మొదలైనవి పనిచేస్తాయి.
![]()
ప్రశ్న 10.
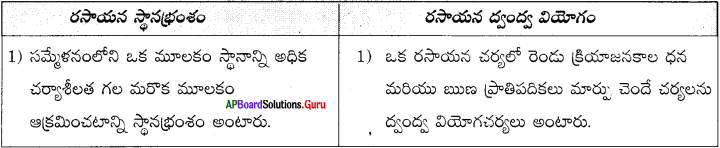
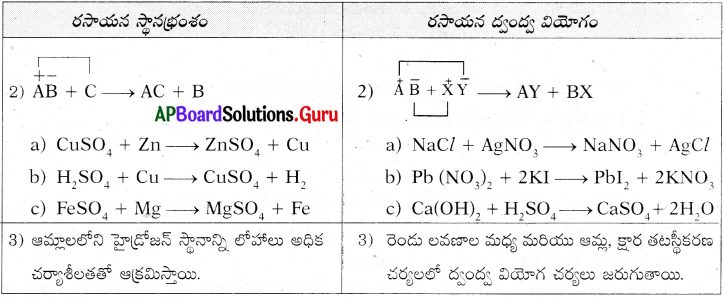
రసాయన స్థానభ్రంశ చర్యకు, ద్వంద్వ వియోగ చర్యకు తేడాలు రాయండి. ఈ చర్యలను తెలిపే సమీకరణాలు రాయండి. (AS 1)
జవాబు:
ప్రశ్న 11.
MnO2 + 4HCl → MnCl2 + 2H2O + Cl2 ఈ సమీకరణంలో ఏ పదార్థం ఆక్సీకరణం చెందుతుంది? ఏది క్షయకరణం చెందుతుంది? (AS 1)
జవాబు:

- క్రియాజనకంలో HCl, క్రియాజన్యంలో క్లోరిన్ మాత్రమే మిగిలింది. అనగా హైడ్రోజన్ తొలగించబడినది కావున HCl ఆక్సీకరణం చెంది క్లోరిన్ వాయువుగా మిగిలింది.
- క్రియాజనకంలో MnO2, క్రియాజన్యంలో ఆక్సిజన్ మూలకాన్ని తొలగించుకొని MnCl2గా మారింది అనగా ఆక్సిజన్ కోల్పోవుటను క్షయకరణం అంటారు. కాబట్టి MnO2 క్షయకరణం చెంది MnCl2 గా మారింది.
ప్రశ్న 12.
ఆక్సీకరణ క్షయకరణ చర్యలకు రెండు ఉదాహరణలు ఇవ్వండి. (AS 1)
జవాబు:
1) ఆక్సీకరణం :
1) ఒక సమ్మేళనానికి ఆక్సిజన్ కలుపుటను ఆక్సీకరణం అంటారు.
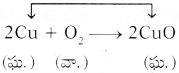
2) ఒక సమ్మేళనం నుండి హైడ్రోజన్ను తొలగించుటను ఆక్సీకరణం అంటారు.
![]()
H2S సమ్మేళనం, హైడ్రోజనను తొలగించుకొని సల్ఫర్ విడుదలైంది. ఇది ఆక్సీకరణ చర్య.
3) కొన్ని మూలకాలు ఎలక్ట్రాన్లను పోగొట్టుకొనుట వలన ఆక్సీకరణం చెందును.
Na → Na+ + e–
సోడియం ఎలక్ట్రాన్లను పోగొట్టుకొని సోడియం అయాన్ గా మారింది. దీనిని ఆక్సీకరణ చర్య అంటారు.
2) క్షయకరణం :
1) ఒక సమ్మేళనానికి హైడ్రోజన్ కలుపుటను క్షయకరణం అంటారు.
![]()
ఇక్కడ బ్రోమిన్, హైడ్రోజనను కలుపుకొంది కాబట్టి ఇది క్షయకరణ చర్య.
2) ఒక సమ్మేళనం నుండి ఆక్సిజనను తొలగించుటను క్షయకరణం అంటారు.
![]()
క్రియాజనకంలోని కాపర్ ఆక్సెడ్ కాపర్గా క్షయకరణం చెందింది.
3) ఒక సమ్మేళనం ఎలక్ట్రాన్లను గ్రహించుటను క్షయకరణం అంటారు.
![]()
క్లోరిన్ అదనంగా ఎలక్ట్రానును గ్రహించింది కాబట్టి క్షయకరణం జరిగినది.
ప్రశ్న 13.
వెండిని శుద్ధి చేసేటప్పుడు సిల్వర్ నైట్రేట్ నుండి వెండి (సిల్వర్) ను సంగ్రహించుటలో కాపర్ లోహ స్థానభ్రంశానికి గురవుతుంది. ఈ ప్రక్రియలో జరిగే చర్యను రాయండి. (AS 1)
జవాబు:
కాపర్ ముక్కను AgNO3 ద్రావణంలో ముంచగా కాపర్ మాయమగును. కానీ తెల్లని మెరిసే పదార్థం పాత్ర అడుగుకు చేరును. ఈ చర్యను ఈ విధంగా తెలియజేయవచ్చు.
Cu + 2AgNO3 → Cu (NO3)2 + 2Ag ↓
- పై చర్యలో కాపర్ వెండిని స్థానభ్రంశం చెందించింది.
- కాపర్ చర్యాశీలత వెండి కంటే ఎక్కువ అనగా కాపరకు ఎలక్ట్రానులను ఇచ్చే గుణం వెండి కంటే ఎక్కువ.
- కాపర్ వెండిని స్థానభ్రంశం చెందించుట వలన Cu(NO3)2 లవణం, మరియు వెండి లోహం ఏర్పడినది.
ప్రశ్న 14.
క్షయం (Corrosion) అంటే ఏమిటి? దానిని ఎలా అరికడతారు? (AS 1)
జవాబు:
కొన్ని లోహాలు తేమగాలికి లేదా కొన్ని ఆమ్లాల సమక్షంలో ఉంచినపుడు లోహ ఆక్సెడులను ఏర్పరచడం ద్వారా వాటి మెరుపుదనాన్ని కోల్పోతాయి. ఈ చర్యనే క్షయము చెందడం లేదా కరోజన్ అంటారు.
ఉదా : 1) వెండి వస్తువులపై నల్లని పూత ఏర్పడును.
4Ag + 2H2S + O2 → 2 Ag2S + 2H2O
2) రాగి వస్తువులు చిలుముపట్టడం. 2Cu + O2 → 2CuO
నివారణ : ఈ సమస్యకు ప్రధాన కారణం గాలిలోని తేమ మరియు ఆక్సిజన్.
- లోహతలంపై రంగు వేయటం, నూనె పూయడం, గ్రీజు, క్రోమియం పూతగా వేయుట వలన కరోజనను అరికట్టవచ్చు.
- మిశ్రమ లోహాలను తయారుచేయుట వలన ఈ సమస్యను అధిగమించవచ్చు.
ప్రశ్న 15.
ముక్కిపోవడం (Rancidity) అంటే ఏమిటి? (AS 1)
జవాబు:
నూనెలు లేదా క్రొవ్వు పదార్థాలను ఎక్కువ కాలం నిల్వ ఉంచడం ద్వారా ఆక్సీకరణం చెంది వాటి రుచి, వాసన మారిపోతాయి. దీనినే ముక్కిపోవటం లేదా ర్యాన్సిడిటీ అంటారు.
- నూనెలతో చేసిన ఆహారపదార్థాలలో ఆక్సిజన్ కలుస్తుంది. కాబట్టి ఇది ఒక ఆక్సీకరణ చర్య.
- ఆహార పదార్థాలు ఎక్కువ కాలం నిల్వ ఉంచుటకు లేదా ముక్కిపోకుండా ఉండుటకు విటమిన్ C మరియు విటమిన్ E లను కలుపుతారు.
- సాధారణంగా నూనెలు లేదా క్రొవ్వులతో చేసిన ఆహార పదార్థాలు ఎక్కువ కాలం నిల్వ ఉండుటకు యాంటీ ఆక్సిడెంట్లు కలుపుతారు.
ప్రశ్న 16.
ఈ క్రింది రసాయన సమీకరణాలను, వాని భౌతిక స్థితులను తెల్పుతూ తుల్యం చేయండి. (AS 1)
a) CH2O → C2H5OH + CO2
b) Fe + O2 → Fe2O3
c) NH3 + Cl2 → N2 + NH4Cl
d) Na + H2O → NaOH + H2
జవాబు:
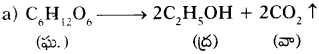
ప్రశ్న 17.
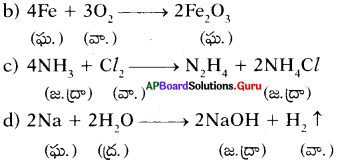
ఈ క్రింది రసాయన చర్యలకు వాటి భౌతిక స్థితులను చూపుతూ సమీకరణాలను రాసి, తుల్యం చేయండి. (AS 1)
a) బేరియం క్లోరైడ్ మరియు ద్రవ సోడియం సల్ఫేట్ చర్యనొంది బేరియం సల్ఫేట్ అవక్షేపంను మరియు ద్రవ సోడియం క్లోరైడ్ లను ఏర్పరుస్తుంది.
b) సోడియం హైడ్రాక్సైడ్, హైడ్రోక్లోరిక్ ఆమ్లంతో చర్యనొంది సోడియం క్లోరైడ్ మరియు నీటిని ఏర్పరుస్తుంది.
c) విలీన హైడ్రోక్లోరిక్ ఆమ్లంతో జింక్ చర్యనొంది హైడ్రోజన్ మరియు జింక్ క్లోరైడ్లను ఏర్పరుస్తుంది.
జవాబు:
ప్రశ్న 18.
బ్రౌన్ రంగులో మెరుస్తూ ఉండే ‘X’ అనే మూలకమును గాలిలో వేడి చేసినపుడు నలుపు రంగులోకి మారుసు. X ఏ మూలకమై ఉంటుందో, ఏర్పడిన నలుపు రంగు పదార్థం ఏమిటో మీరు ఊహించగలరా? మీ ఊహ సరియైనదని ఎలా సమర్థించుకుంటారు? (AS 2)
జవాబు:

X = కాపర్ (Cu) ; నలుపు రంగు పదార్ధం = కాపర్ ఆక్సెడ్ (CuO)
బ్రౌన్ రంగులో మెరుస్తూ ఉండే రాగి, గాలిలోని ఆక్సిజన్ సమక్షంలో రసాయన సంయోగం జరిగి నలుపు రంగులోని CuO ఏర్పడును.
![]()
ప్రశ్న 19.
ఇనుప వస్తువులకు మనం ఎందుకు రంగు వేస్తాం? (AS 7)
(లేదా)
ఇనుప వస్తువులకు రంగు వేయవలసిన ఆవశ్యకత ఏమిటి?
జవాబు:
ఇనుప వస్తువులు గాలిలోని తేమతోనూ మరియు ఆక్సిజన్నూ చర్య జరిపి ఆక్సీకరణం చెందుతాయి. దీనినే తుప్పు పట్టడం అంటారు. ఈ చర్యను ఈ విధంగా తెలియజేస్తాం.
4Fe + 6H2O + 3O2 → 2Fe2O3 . 3H2O
ఈ తుప్పు వలన కారు భాగాలు, బ్రిడ్జిలు, ఇనుప పట్టాలు, ఓడలు మొదలైనవి పాడైపోతాయి. ఈ సమస్యను నివారించటానికి ఆక్సిజన్, తేమ తగలకుండా లోహతలంపై రంగులు వేయటం, నూనె, గ్రీజు, క్రోమియం పూత గానీ, మిశ్రమ లోహాల తయారీ ద్వారా గానీ వస్తువులను కాపాడుకోవచ్చు.
ప్రశ్న 20.
ఆహార పదార్థాలను కొన్నింటిని గాలి చొరబడని డబ్బాలలో ఉంచమంటారు. ఎందుకు? (AS 7)
(లేదా)
పెద్ద పెద్ద కంపెనీలు తయారుచేసిన తినుబండారాలను గాలి ప్రవేశించని ప్యాకెట్లలో ఉంచుతారు. దానికి గల కారణం ఏమిటి?
జవాబు:
సాధారణంగా నూనెలతో గానీ, కొవ్వులతో తయారుచేసే ఆహారపదార్థాలు గాలిలోని తేమతోనూ, ఆక్సిజన్తోనూ కలిసి ఆక్సీకరణం చెందుతాయి. దీనినే ముక్కిపోవటం అంటారు.
ఆహార పదార్థాలు ముక్కిపోవటం వలన రుచి, వాసన మారిపోతుంది. పిల్లలు ఇష్టంగా తినే కుర్ కురే, లేస్, బిస్కెట్లు వంటివి కరకరలాడకుండా మెత్తబడిపోతాయి.
ఇటువంటి ఆక్సీకరణాలను అరికట్టడానికి ఆహార పదార్థాలను గాలి సోకని డబ్బాలలోనూ, కుర్ కురే, లేస్ వంటివి నైట్రోజన్ వాయువు నింపిన ప్యాకెట్లలోనూ నిల్వ చేస్తారు.
ఖాళీలను పూరించండి
1. కూరగాయలు కంపోస్టుగా వియోగం చెందడం ………………. కు ఉదాహరణ. (ఆక్సీకరణం)
2. ఒక రసాయన చర్యలో ఉష్ణం గ్రహించబడి క్రొత్త పదార్ధం ఏర్పడటాన్ని …………… అంటారు. (ఉష్ణగ్రాహక చర్య)
3. 2N2O → 2N2 + O2 ………………. చర్యకు ఉదాహరణ. (రసాయన వియోగం)
4. Ca + 2H2O → Ca(OH)2 + H2 ↑ అనేది ………………. చర్యకు ఉదాహరణ. (స్థానభ్రంశం)
5. రసాయన సమీకరణంలో బాణం గుర్తుకు ఎడమవైపు ఉన్న పదార్థాలను ……………. అంటారు. (క్రియాజనకాలు)
6. ఒక రసాయన చర్యలో సంయోగ పదార్థాలు, ఉత్పన్నాల మధ్య గీచిన బాణం గుర్తు ఆ రసాయన చర్య ………… గురించి తెలుపును. (దిశను)
7. కింది వాటిని జతపరచండి.
1. 2AgNO3 + Na2CrO4 → Ag2CrO4 + 2NaNO3 ( ) ఎ) రసాయన సంయోగం
2. 2NH3 → N2 + 3H2 ( ) బి) రసాయన వియోగం
3. C2H4 + H2O → C2H6O ( ) సి) రసాయన స్థానభ్రంశం
4. Fe2O3 + 3CO → 2Fe + 3CO2 ( ) డి) రసాయన ద్వంద్వ వియోగం
జవాబు:
1-డి, 2-బి, 3-ఎ, 4-సి
సరైన సమాధానాన్ని ఎన్నుకోండి
1. Fe2O3 + 2Al → Al2O3 + 2 Fe. ఈ చర్య దేనికి ఉదాహరణ?
A) రసాయన సంయోగం
B) రసాయన వియోగం
C) రసాయన స్థానభ్రంశం
D) ద్వంద్వ వియోగం
జవాబు:
C) రసాయన స్థానభ్రంశం
2. సజల హైడ్రోక్లోరిక్ ఆమ్లానికి ఇనుపరజను కలిపితే ఏం జరుగుతుంది? సరైన సమాధానం ఎన్నుకోండి.
A) ఐరన్ క్లోరైడ్ ఏర్పడి, హైడ్రోజన్ వాయువు వెలువడుతుంది.
B) ఐరన్ ఆక్సైడ్ ఏర్పడి, క్లోరిన్ వాయువు వెలువడుతుంది.
C) ఎలాంటి చర్య జరగదు.
D) ఐరన్ లవణం మరియు నీరు ఏర్పడును.
జవాబు:
A) ఐరన్ క్లోరైడ్ ఏర్పడి, హైడ్రోజన్ వాయువు వెలువడుతుంది.
3. 2PbO(ఘ) + C(ఘ) → 2Pb(ఘ) + CO2(వా) పై సమీకరణముననుసరించి కిందివానిలో ఏది సరైనది?
i) లెడ్ ఆక్సైడ్ క్షయకరణానికి గురవుతుంది.
ii) కార్బన్ డై ఆక్సైడ్ ఆక్సీకరణం చెందుతుంది
iii) కార్బన్ ఆక్సీకరణం చెందుతుంది
iv) లెడ్ క్షయకరణానికి గురవుతుంది.
A) i మరియు ii
B) i మరియు iii a
C) i, ii మరియు iii
D) అన్నీ
జవాబు:
B) i మరియు iii a
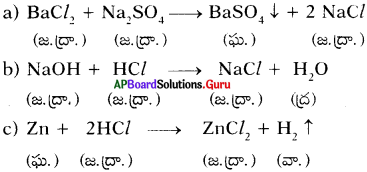
4. BaCl2 + Na2SO4 → BaSO4 + 2NaCl అనే సమీకరణం ఈ రకం చర్యను సూచిస్తుంది.
A) స్థానభ్రంశం
B) వియోగం
C) సంయోగం
D) ద్వంద్వ వియోగం
జవాబు:
D) ద్వంద్వ వియోగం
![]()
5. హైడ్రోజన్ మరియు క్లోరిన్ నుండి హైడ్రోజన్ క్లోరైడ్ ఏర్పడటం ఈ రకం రసాయనిక చర్య
A) వియోగం
B) స్థానభ్రంశం
C) సంయోగం
D) ద్వంద్వ వియోగం
జవాబు:
C) సంయోగం
9th Class Physical Science 6th Lesson రసాయన చర్యలు – సమీకరణాలు Textbook InText Questions and Answers
9th Class Physical Science Textbook Page No. 90
ప్రశ్న 1.
రసాయన చర్య జరిగిందని మనకు ఎలా తెలుస్తుంది?
జవాబు:
రసాయన చర్య జరిగినపుడు
- క్రొత్త పదార్థాలు ఏర్పడతాయి.
- సంఘటనంలో మార్పు వస్తుంది.
- ఉష్ణోగ్రతలో మార్పు అధికంగా ఉండును.
- ఏర్పడిన క్రొత్త పదార్థాల రసాయన ధర్మాలు మారతాయి.
- తిరిగి పాత పదార్థాన్ని మనం పొందలేం.
ఏదైనా రసాయన చర్యలో పై మార్పులు జరిగితే, రసాయన చర్య జరిగిందని మనకు తెలుస్తుంది.
9th Class Physical Science Textbook Page No. 92
ప్రశ్న 2.
Na2SO4 + BaCl2 → BaSO4 + NaCl సమీకరణంలో బాణం గుర్తుకు ఎడమవైపున ఉన్న ప్రతి మూలక పరమాణువుల సంఖ్య, కుడివైపున ఉన్న మూలక పరమాణువుల సంఖ్యకు సమానంగా ఉన్నదా?
జవాబు:
పై చర్యను తుల్యం చేస్తే ఈ క్రింది విధంగా ఉంటుంది.
Na2SO4 + BaCl2 → BaSO4 + 2 NaCl
ఇప్పుడు క్రియాజనకాలలోని మూలక పరమాణువుల సంఖ్య, క్రియాజన్యాలలోని మూలక పరమాణువుల సంఖ్యకు సమానమగును.
ప్రశ్న 3.
క్రియాజనకాలవైపు గల అన్ని మూలకాలకు చెందిన పరమాణువులు, క్రియాజన్యాల వైపు కూడా ఉన్నాయా?
జవాబు:
క్రియాజనకాలవైపు గల అన్ని మూలక పరమాణువులు, క్రియాజన్యాల వైపు కూడా ఉన్నవి.
9th Class Physical Science Textbook Page No. 95
ప్రశ్న 4.
2C3H8 + 10O2 → 6CO2 + 8H2O సమీకరణం నియమాల ప్రకారం తుల్య సమీకరణమేనా? నీవు ఎలా చెప్పగలవు?
జవాబు:
సమీకరణాన్ని తుల్యం చేసే నియమాల ప్రకారం గుణకాలు కనిష్ట పూర్ణాంకాలుగా ఉండాలి. కానీ పై సమీకరణంలో పూర్ణాంకాలు గరిష్ట సంఖ్యలను కలిగి ఉన్నాయి. కావున ఇది తుల్య సమీకరణం కాదు. దీనిని తుల్య సమీకరణంగా మార్చటానికి గుణకాలను సమీప పూర్ణాంకాలకు తగ్గించాలి.
C3H8 + 5O2 → 3CO2 + 4H2O
ఈ సమీకరణం తుల్య సమీకరణం అవుతుంది.
9th Class Physical Science Textbook Page No. 106
ప్రశ్న 5.
వెండి, రాగి వస్తువులపై రంగుపూత (చిలుము) ఏర్పడటం మీరెప్పుడైనా గమనించారా?
జవాబు:
వెండిపై నల్లటిపూత ఏర్పడటం, రాగిపై ఆకుపచ్చ రంగులో పదార్ధం పూతగా ఏర్పడటం చూశాను. దీనిని వాడుక భాషలో చిలుము పట్టడం అంటారు.
9th Class Physical Science Textbook Page No. 107
ప్రశ్న 6.
నూనెతో చేసిన ఆహారపదార్థాలు పాడవకుండా ఉండాలంటే ఏమి చెయ్యాలి?
జవాబు:
నూనెతో చేసిన ఆహారపదార్థాలు పాడవకుండా నిల్వ ఉండాలంటే దానికి విటమిన్-సి, విటమిన్-ఇ లాంటివి కలపాలి. లేదా యాంటీ ఆక్సిడెంట్ పదార్ధాలను కలపాలి.
ఉదాహరణ సమస్యలు
ప్రశ్న 1.

ఉదాహరణకు 1120 కి.గ్రా. ఇనుమును రాబట్టేందుకు ఎంత పరిమాణం గల అల్యూమినియం అవసరమవుతుందో పై సమీకరణం ఆధారంగా లెక్కించండి.
సాధన:
తుల్య సమీకరణం ప్రకారం,
అల్యూమినియం → ఇనుము
54 గ్రా. → 112 గ్రా.
x గ్రా. → (1120 x 1000) గ్రా.
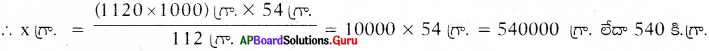
∴ 1120 కి.గ్రా, ఇనుము రాబట్టేందుకు 540 కి.గ్రా. అల్యూమినియం అవసరమవుతుందన్నమాట.
![]()
ప్రశ్న 2.
STP వద్ద 230 గ్రా. సోడియం అధిక నీటితో చర్య పొందినప్పుడు విడుదలైన హైడ్రోజన్ ఘనపరిమాణం, ద్రవ్యరాశి మరియు అణుసంఖ్యను గణించండి. (Na పరమాణు ద్రవ్యరాశి 230, 0 పరమాణు ద్రవ్యరాశి 160, మరియు H పరమాణు ద్రవ్యరాశి 10)
పై చర్యకు తుల్య సమీకరణం,

సాధన:
తుల్య సమీకరణం ప్రకారం,
46 గ్రా. సోడియం 2 గ్రా. హైడ్రోజన్ను ఇస్తుంది.
230 గ్రా. సోడియం …………….. ?
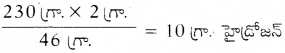
స్థిర ఉష్ణోగ్రతా పీడనాలు అనగా 273 K, 1 బార్ పీడనం వద్ద 1 గ్రాము మోలార్ ద్రవ్యరాశి గల ఏదైనా వాయువు 22.4 లీ. ఘనపరిమాణం కలిగి ఉంటుంది. దీనిని ‘గ్రామ్ మోలార్ ఘనపరిమాణం’ (Gram molar volume) అంటారు.
∴ 2.0 గ్రా. హైడ్రోజనను 22.4 లీ. ఆక్రమిస్తుంది. (STP వద్ద)

పరికరాల జాబితా
సోడియం సల్ఫేట్, బేరియం క్లోరైడ్, శాంకవకుప్పె, పరీక్ష నాళికలు, జింక్ ముక్కలు, అగ్గిపుల్ల, హైడ్రోక్లోరిక్ ఆమ్లం, మెగ్నీషియం రిబ్బన్, నీరు, కాల్షియం ఆక్సైడ్, సున్నపురాయి, బున్సెన్ బర్నర్, లెడ్ నైట్రేట్, 9వోల్ట్ బ్యాటరీ, గ్రాఫైట్ కడ్డీలు, ప్లాస్టిక్ మగ్, రబ్బరు కార్కులు, సిల్వర్ బ్రోమైడ్, కాపర్ సల్ఫేట్, ఇనుపమేకులు, బెలూన్, పొటాషియం అయోడైడ్, రాగిపొడి, చైనా డిష్
9th Class Physical Science 6th Lesson రసాయన చర్యలు – సమీకరణాలు Textbook Activities (కృత్యములు)
కృత్యం – 1
ప్రశ్న 1.
కాల్షియం ఆక్సెడ్, నీటి అణువుల మధ్య రసాయన మార్పు జరిగిందని కృత్యం ద్వారా నిరూపించుము.
(లేదా)
ఇది (కాల్ఫియం ఆక్సెడ్, నీటి అణువుల మధ్య రసాయన మార్పు) ఏ రకపు రసాయన చర్య? ఈ చర్యకు తుల్య సమీకరణంను వ్రాయుము.
జవాబు:
- ఒక గ్రాము పొడి సున్నాన్ని (CaO) ఒక బీకరులో తీసుకోండి.
- దీనికి 10 మి.లీ. నీటిని కలపండి.
- బీకరు అడుగును చేతితో తాకినపుడు వేడిని గమనించండి.
- దీనికి కారణం కాల్షియం ఆక్సైడ్, నీటితో చర్య ఉష్ణమోచక చర్య కాబట్టి ఉష్ణాన్ని విడుదల చేసింది.
- ఈ చర్యలో Ca(OH), అనే రంగులేని ద్రావణం ఏర్పడింది.
- రసాయన చర్యలో క్రొత్త పదార్ధం ఏర్పడింది కాబట్టి ఇది రసాయన మార్పు అని నిర్ధారించబడినది.
- ఈ ద్రావణంలో ఎర్ర లిట్మస్ పేపర్ ను ముంచినపుడు నీలి రంగుకు మారింది.
- కావున క్రొత్తగా ఏర్పడిన Ca(OH), ఒక క్షార స్వభావాన్ని కలిగి ఉందని నిర్ధారించవచ్చు.

కృత్యం – 2
ప్రశ్న 2.
సోడియం సల్ఫేట్, బేరియం క్లోరైడ్ మధ్య రసాయన చర్య జరిగిందని కృత్యం ద్వారా వివరించండి.
(లేదా)
Na2SO4 మరియు BaCl2 లను కలిపినపుడు ఆ మిశ్రమంలో ఏర్పడు రసాయన చర్యను మరియు రసాయన చర్యారకంను, తుల్యసమీకరణంను, కృత్యం ద్వారా వివరింపుము.
జవాబు:

- ఒక బీకరులో 100 మి.లీ. నీటిని తీసుకొని దానిలో కొద్దిగా సోడియం సల్ఫేట్ (Na2SO4)ను కలిపి ద్రావణాన్ని తయారుచేయండి.
- మరొక బీకరులో మరలా 100 మి.లీ. నీటిని తీసుకొని దానిలో NS కొద్దిగా బేరియం క్లోరైడను కలిపి ద్రావణాన్ని తయారుచేయండి.
- రెండు బీకర్లలోని ద్రావణాల రంగును పరిశీలించండి.
- రెండు ద్రావణాలను ఒకదానితో మరొకటి కలపండి.
- ఇపుడు సోడియం క్లోరైడ్ ద్రావణం ఏర్పడి అందులో బేరియం సల్ఫేట్ (BaSO4) అవక్షేపం ఏర్పడింది.

- ఈ చర్యలో BaSO4 అనే క్రొత్త పదార్థం ఏర్పడింది. ఫార్ములా మారింది.
కాబట్టి ఇది ఒక రసాయన మార్పు అని నిర్ధారించబడినది.
![]()
కృత్యం – 3
ప్రశ్న 3.
జింక్ లోహం, హైడ్రోక్లోరిక్ ఆమ్లాల మధ్య రసాయన చర్య జరిగిందని కృత్యం ద్వారా నిరూపించుము.
(లేదా)
సజల HCl మరియు 29 ముక్కల మధ్య చర్య జరిగినపుడు H2 వాయువు ఏర్పడుటను మరియు చర్యా రకంను, తుల్యసమీకరణంను కృత్యం ద్వారా వివరింపుము.
జవాబు:
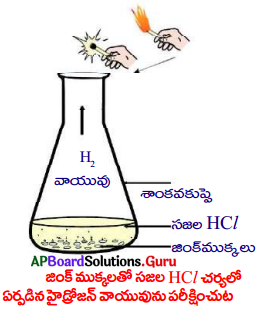
- ఒక శాంకవకుప్పెలో కొన్ని జింకు ముక్కలను తీసుకోండి.
- దానికి 5 మి.లీ. సజల HCl ను కలపండి.
- ఈ రెండింటి మధ్య రసాయన చర్య జరుగును.
Zn + 2 HCl → ZnCl2 + H2 - ఇప్పుడు కుప్పె వద్దకు మండుతున్న అగ్గిపుల్లను ఉంచండి.
- అగ్గిపుల్ల టప్ మని శబ్దం చేస్తూ ఆరిపోవటం గమనించండి.
- Zn, HClల మధ్య రసాయన చర్య జరిగి హైడ్రోజన్ వాయువు జింక్ ముక్కలతో సజల HCl చర్యలో విడుదలైంది.
- క్రొత్త పదార్ధం ఏర్పడింది కాబట్టి ఇది రసాయన మార్పు అని నిర్ధారించవచ్చు.
కృత్యం – 4
ప్రశ్న 4.
రసాయన సంయోగాన్ని కృత్యం ద్వారా వివరించుము.
(లేదా)
మెగ్నీషియం రిబ్బన్ ను గాలిలో మండించినపుడు ఏర్పడు పదార్థాలను, చర్యారకంను, తుల్యసమీకరణంలను తెలుపు కృత్యంను వ్రాయుము.
జవాబు:

- 3 సెం||మీ. పొడవు గల మెగ్నీషియం రిబ్బనన్ను తీసుకొని దానిని గరుకు కాగితంతో బాగా రుద్దండి.
- పట్టకారు సహాయంతో ఒక చివర పట్టుకొని సారాయి దీపం పైన ఉంచి మండించండి.
- మెగ్నీషియం రిబ్బను ఆక్సిజన్ సమక్షంలో మిరుమిట్లు గొలిపే కాంతితో మండి తెల్లని బూడిదను ఏర్పరుచును. దీనిని MgO అంటారు.
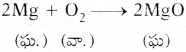
- ఈ చర్యలో మెగ్నీషియం, ఆక్సిజన్ సంయోగం చెంది మెగ్నీషియం ఆక్సెడ్ అనే క్రొత్త పదార్ధం ఏర్పడింది.
- దీనినే రసాయన సంయోగం అంటారు.
కృత్యం – 5
ప్రశ్న 5.
రసాయన వియోగాన్ని కృత్యం ద్వారా వివరించండి.
(లేదా)
CaCO3 ని వేడి చేయుట వలన విడుదలగు వాయువు సున్నపు తేటను పాలవలె మార్చును. దీనికి సరిపడు కృత్యంను వ్రాసి, చర్యారకం, తుల్య సమీకరణంను వ్రాయుము.
(లేదా)
రసాయన వియోగంను ఒక కృత్యం ద్వారా వివరించి, ఆ చర్యలో ఏదైనా వాయువు వెలువడిన ఆ వాయువు ఉనికి పరీక్షను, తుల్యసమీకరణంను, వాయువు చర్యారకంను వివరించుము.
జవాబు:
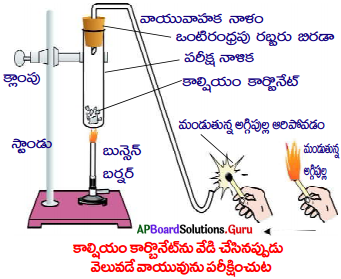
- 2 గ్రా|| కాల్షియం కార్బొనేట్ ను ఒక పరీక్ష నాళికలో తీసుకోండి.
- బున్ సెన్ లేదా సారా దీపంతో పరీక్షనాళికను వేడి చేయండి.
- ఇపుడు మండుతున్న అగ్గిపుల్లను ఆ పరీక్షనాళిక మూతి దగ్గర ఉంచండి.
- అగ్గిపుల్ల టప్ మని శబ్దం చేస్తూ ఆరిపోతుంది.
- పై చర్యలో విడుదలైన వాయువు CO2. ఇది మండుచున్న అగ్గిపుల్లను ‘టప్’ మని శబ్దం చేస్తూ ఆర్పివేస్తుంది.
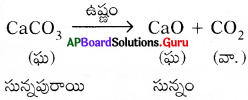
- కాబట్టి కాల్షియం కార్బొనేట్ ను వేడిచేసినపుడు అది కాల్షియం ఆక్సైడ్ గానూ, కార్బన్ డై ఆక్సెడ్ గానూ విడిపోతుంది.
- వేడి చేస్తే పదార్థాలు వియోగం చెందినట్లయితే అట్టి చర్యలను ఉష్ణ వియోగ చర్యలు అంటారు.
కృత్యం – 6
ప్రశ్న 6.
ఉష్ణ వియోగ చర్యను కృత్యం ద్వారా వివరించండి.
(లేదా)
లెడ్ నైట్రేట్ను వేడిచేసిన విడుదలగు వాయువు ఏది? దాని రంగును, తుల్యసమీకరణంను, చర్యారకంను వివరించుము.
జవాబు:

- సుమారు 0.5 గ్రా|| లెడ్ నైట్రేట్ పౌడరను గట్టి పరీక్షనాళికలో తీసుకోండి.
- పరీక్ష నాళికను బున్సెన్ బర్నర్ మంట మీద వేడి చేయండి.
- లెడ్ నైట్రేట్ ను వేడిచేసినపుడు అది లెడ్ ఆక్సేడ్, ఆక్సిజన్ మరియు నైట్రోజన్ డై ఆక్సైడ్లుగా విడిపోయింది.
- పరీక్షనాళిక వెంబడి గోధుమ రంగులో వాయువువెలువడటం గమనించవచ్చు. ఈ వాయువు నైట్రోజన్ డై ఆక్సైడ్ వాయువు.

- ఉష్ణం వలన లెడ్ నైట్రేట్ వియోగం చెందింది కాబట్టి దీనిని ఉష్ణ వియోగ చర్య అంటారు.
![]()
కృత్యం – 7
ప్రశ్న 7.
విద్యుత్ విశ్లేషణ చర్యను కృత్యం ద్వారా వివరించండి.
(లేదా)
ఒక సమ్మేళనమును విద్యుత్ విశ్లేషణ ప్రక్రియలో ఏ విధంగా వియోగం చెందిస్తారు?
(లేదా)
నీటి విద్యుత్ విశ్లేషణ చర్యను కృత్యం ద్వారా వివరించుము.
(లేదా)
నీటియందు హైడ్రోజన్ మరియు ఆక్సిజన్లు 2 : 1 నిష్పత్తిలో ఉండునని నీవు ఏవిధంగా నిరూపిస్తావు?
జవాబు:
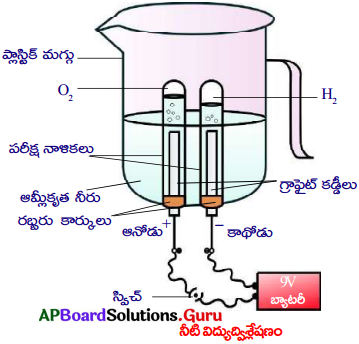
- ఒక ప్లాస్టిక్ మగ్గును తీసుకొని, దాని అడుగున రెండు రంధ్రాలు చేయండి.
- ఆ రెండు రంధ్రాలలో రెండు రబ్బరు కార్కులను బిగించండి.
- ఈ రబ్బరు కార్కులలో రెండు కార్బను ఎలక్ట్రోడులను గుచ్చండి.
- రెండు ఎలక్ట్రోడులను పటంలో చూపినట్లుగా 9V బ్యాటరీకి కలపండి.
- ఎలక్ట్రోడులు మునిగే వరకు నీటితో నింపండి.
- దీనిలోకి కొద్దిగా సజల H2SO4 ఆమ్లం కలపండి.
- నీటితో నింపిన రెండు పరీక్ష నాళికలు తీసుకొని వాటిని నిదానంగా రెండు కార్బన్ ఎలక్ట్రోడులపై బోర్లించండి.
- స్వీచ్ ఆన్ చేసి విద్యుత్ వెళ్ళేలా చేయండి. ఈ అమరికను కొంతసేపు కదపకుండా ఉంచండి.
- పరీక్షనాళికలో ఎలక్రోడుల నుండి బుడగలు వెలువడడాన్ని మీరు గమనించి ఉంటారు.
- ఈ బుడగలలోని వాయువులు పైకి చేరుతూ పరీక్షనాళికలలోని నీటిని స్థానభ్రంశం చెందిస్తాయి.
- రెండు పరీక్షనాళికలలో చేరిన వాయువుల ఘనపరిమాణాలు వేరువేరుగా ఉండుటను గమనించండి.
- ఇప్పుడు ఎక్కువ వాయు ఘనపరిమాణం ఉన్న పరీక్షనాళికను వేరు చేసి అగ్గిపుల్లను వెలిగించి దాని మూతివద్ద ఉంచండి.
- అగ్గిపుల్ల టమని శబ్దం చేస్తూ ఆరిపోయింది.
- దీనినిబట్టి పరీక్షనాళికలో ఉన్న వాయువు హైడ్రోజన్.
- తర్వాత రెండవ పరీక్షనాళికను వేరు చేసి దాని అంచు వద్ద మండుతున్న అగ్గిపుల్లను ఉంచండి. ఇది ప్రకాశవంతంగా మండుతుంది.
- దీనినిబట్టి రెండవ పరీక్షనాళికలో ఉన్న వాయువు ఆక్సిజన్.
- నీటి ద్వారా విద్యుత్ను పంపించినపుడు రెండు వంతుల హైడ్రోజన్ వాయువు, ఒక వంతు ఆక్సిజన్ వాయువు వెలువడుతుంది.
- విద్యుత్ ను పంపించుట వలన H2 గాను, O2 గాను వియోగం చెందింది కాబట్టి దీనినే విద్యుత్ విశ్లేషణ అంటారు.

కృత్యం – 8
ప్రశ్న 8.
కాంతి వియోగ చర్యలను లేదా కాంతి రసాయన చర్యలను ఒక కృత్యం ద్వారా వివరించండి.
(లేదా)
సిల్వర్ బ్రోమైడు సూర్యరశ్మి సమక్షంలో ఉంచిన జరుగు రసాయన చర్యారకంను, ఏర్పడు పదార్థరకమును, తుల్య సమీకరణంను వ్రాయుము.
- 2 గ్రా|| సిల్వర్ బ్రోమైడ్ (AgBr) ను ఒక వాచ్ గ్లాస్ లోకి తీసుకోండి.
- సిల్వర్ బ్రోమైడ్ పసుపు రంగులో ఉండుట గమనించండి.
- AgBr ను కొంత సేపు ఎండలో ఉంచండి.
- తరువాత AgBr రంగు బూడిద రంగులోకి మారటం గమనించండి.
- వాగ్లాస్లోని సిల్వర్ బ్రోమైడ్ సూర్యకాంతి సమక్షంలో సిల్వర్, బ్రోమిన్లుగా విడిపోయింది.
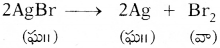
- ఈ చర్య కాంతి సమక్షంలో జరిగింది. ఇటువంటి చర్యలను ‘కాంతి రసాయన చర్యలు’ అంటారు.


కృత్యం – 9
ప్రశ్న 9.
రసాయన స్థానభ్రంశాన్ని కృత్యం ద్వారా వివరించండి.
జవాబు:

- 1 గ్రా, జింకపొడిని ఒక చిన్న నాజిల్ కలిగిన శాంకవకుప్పెలో తీసుకోండి.
- దానికి నిదానంగా సజల HCl ను కలపండి.
- రబ్బరు బెలూను తీసుకొని ఆ శాంకవకుప్పై మూతికి పటంలో చూపిన విధంగా తగిలించండి.
- శాంకవకుప్పెలో మరియు రబ్బరు బెలూన్లోని మార్పులను నిశితంగా పరిశీలించండి.
- శాంకవకుప్పెలోని ద్రావణంలో బుడగలు రావడం మరియు బెలూన్ పెద్దగా ఉబ్బడాన్ని మీరు గమనించండి.
- జింక్ ముక్కలు సజల HClతో చర్య జరిపి హైడ్రోజన్ వాయువును విడుదల చేస్తుంది.
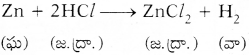
- జింక్ మూలకం హైడ్రోజనను HCl నుండి స్థానభ్రంశం చెందించింది. దీనినే ‘స్థానభ్రంశ చర్య’ అంటారు.
![]()
కృత్యం – 10
ప్రశ్న 10.
ఇనుము కాపర్ ను స్థానభ్రంశం చెందించగలదు. దీనిని ఒక కృత్యం ద్వారా వివరించండి.
(లేదా)
అధిక చర్యాశీలత గల లోహాలు, అల్ప చర్యాశీలత గల లోహాలను వాటి సంయోగ పదార్థాల నుండి స్థానభ్రంశం చెందిస్తాయి అని తెలుపుటకు మీరు ఏ ప్రయోగాన్ని నిర్వహిస్తారో వివరించుము.
(లేదా)
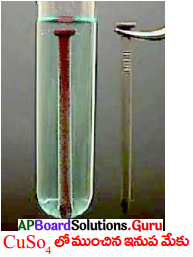
ఇనుప మేకును CuSO4 ద్రావణం నందు ఉంచగా అది గోధుమరంగులోనికి మారినది, ఈ కృత్యంను వివరించుము.
జవాబు:
- రెండు ఇనుప సీలలను (మేకులు) తీసుకొని వాటిని గరుకు కాగితంతో రుద్దండి.
- రెండు పరీక్షనాళికలలో సుమారు 10 మి.లీ. CuSO4 ద్రావణాన్ని తీసుకోండి.
- ఒక ఇనుప సీలను ఒక పరీక్షనాళికలోని CuSO4 ద్రావణంలో వేసి 20 నిమిషాలు కదల్చకుండా ఉంచండి.
- రెండవ ఇనుప సీలను పరిశీలన కోసం ఒక ప్రక్కన ఉంచండి.
- ఇపుడు ఇనుప సీలను CuSO4 ద్రావణం నుండి బయటకు తీయండి.
- రెండు ఇనుప సీలలను ఒకదాని ప్రక్కన మరొకటి ఉంచి పరిశీలించండి.
- ఇపుడు రెండు పరీక్షనాళికల ద్రావణాల రంగును పరిశీలించండి.
- CuSO4 ద్రావణంలో ముంచిన సీల గోధుమ రంగులోకి మారుతుంది.
- అదే విధంగా నీలిరంగులో ఉన్న CuSO4 రంగును కోల్పోతుంది.

- ఈ చర్యను ఈ విధంగా తెలియజేస్తాం,
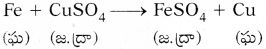
- కాపర్ చర్యాశీలత ఇనుముకంటే తక్కువ కాబట్టి ఇనుము-కాపర్ను స్థానభ్రంశం చెందించింది.
కృత్యం – 11
ప్రశ్న 11.
ద్వంద్వ వియోగ చర్యను కృత్యం ద్వారా వివరించండి.
(లేదా)
రాజు మరియు రాము ఇద్దరు స్నేహితులు. రాజుకు రసాయన ద్వంద్వ వియోగంపై కొన్ని సందేహాలు కలవు. వాటి నివృత్తికి రాము ఏ కృత్యం ద్వారా సందేహాలు తీర్చి ఉంటాడో వివరించుము.
జవాబు:
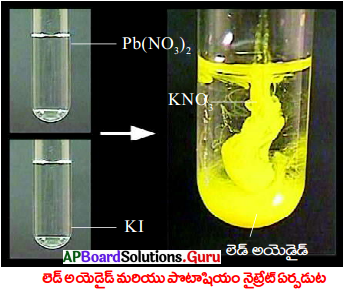
- 2 గ్రాముల లెడ్ నైట్రేట్ Ph(NO.), ను ఒక పరీక్షనాళికలో తీసుకొని దానికి సుమారు 5 మి.లీ. నీటిని కలపండి.
- మరొక పరీక్షనాళికలో 1 గ్రాము పొటాషియం అయొడైడ్ తీసుకొని కొంచెం నీటిలో కరిగించండి.
- పొటాషియం అయొడైడ్ ద్రావణానికి, లెడ్ నైట్రేట్ ద్రావణాన్ని కలపండి.
- నీటిలో కరగని పసుపురంగు పదారం ఏర్పడింది. ఇలా నీటిలో కరగకుండా మిగిలిన పదార్థాన్ని అవక్షేపం అంటారు.
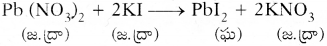
- పై చర్యలో లెడ్ అయాన్ మరియు పొటాషియం అయాను స్థానాలు C టెడ్ అయొడైడ్ పరస్పరం మార్చుకున్నాయి.
- లెడ్ అయాన్ (Pb+2), అయొడెడ్ అయాన్ (I–) కలిసి లెడ్ అయొడైడ్ (PbI2) ఏర్పడింది.
- పొటాషియం అయాన్ (K+), నైట్రేట్ అయాన్ (NO–3) కలిసి పొటాషియం
- ఇటువంటి చర్యలను ద్వంద్వ వియోగ చర్యలు అంటారు.
![]()
కృత్యం – 12
ప్రశ్న 12.
ఆక్సీకరణ, క్షయకరణ చర్యలను ఒక కృత్యం ద్వారా వివరించండి.
జవాబు:


- సుమారు 1 గ్రాము కాపర్ పొడిని చైనా డిలో తీసుకోవాలి.
- ఒక త్రిపాది స్టాండుపైన తీగ వలను ఉంచి దానిపై చైనా డిష్ను ఉంచాలి.
- సారాదీపం లేదా బుస్సేన్ బర్నర్తో దీనిని వేడి చేయాలి.
- కాపరను వేడి చేయగానే అది వాతావరణంలో గల ఆక్సిజన్తో చర్య జరిపి నల్లటి CuO గా మారింది.
- ఈ చర్యను ఈ క్రింది విధంగా సూచించవచ్చు.
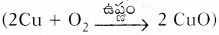
- ఈ చర్యలో కాపర్ ఆక్సిజన్ తో కలిసి కాపర్ ఆక్సెడ్ ఏర్పడింది.

- ఈ చర్యలో ఆక్సిజన్ గ్రహించబడినది కావున ఇటువంటి చర్యలను ఆక్సీకరణ చర్యలు అంటారు.
- ఇపుడు CuO మీదుగా హైడ్రోజన్ వాయువును పంపండి.
- ఇపుడు CuO నల్లటి రంగు నుంచి, గోధుమ రంగులోకి మారటం గమనించండి.
- కారణం CuO ఆక్సిజన్ను కోల్పోయి కాపర్గా మారింది.
- ఈ చర్యను ఈ విధంగా

- ఇలా ఆక్సిజన్ కోల్పోయే చర్యలను క్షయకరణ చర్యలు అంటారు.