Students can go through AP Board 9th Class Physical Science Notes 5th Lesson పరమాణువులో ఏముంది? to understand and remember the concept easily.
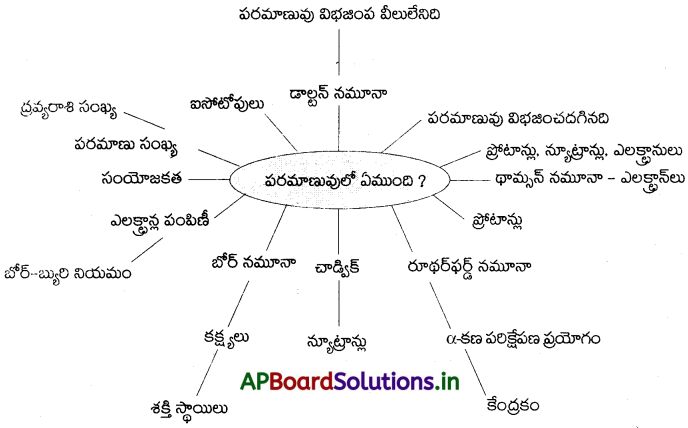
AP Board 9th Class Physical Science Notes 5th Lesson పరమాణువులో ఏముంది?
→ పదార్ధము పరమాణువులచే నిర్మించబడింది.
→ డాల్టన్ సిద్ధాంతము ప్రకారం పరమాణువు విభజించడానికి వీలు లేనిది.
→ పరమాణువు విద్యుత్ పరంగా తటస్థం.
→ తరువాత జరిగిన ప్రయోగాలు పరమాణువు విభజించదగినదని తెలియజేశాయి.
→ పరమాణువు కన్నా చిన్నవిగా ఉండి పరమాణువులోనే ఉండే కణాలను పరమాణు ఉపకణాలుగా పిలిచారు. ముఖ్యమైన పరమాణు ఉపకణాలు : ఎలక్ట్రాన్, ప్రోటాన్, న్యూట్రాన్.
→ డాల్టన్ చే మొట్టమొదటిగా ఆవిష్కరింపబడి, అధ్యయనం చేయబడిన ఉప పరమాణుకణం ఎలక్ట్రాన్. ఇది పరిగణనలోకి తీసుకోలేనంత స్వల్ప ద్రవ్యరాశిని, ఒక ప్రమాణ ఋణావేశాన్ని కలిగి ఉంటుంది.
![]()
→ ధనావేశం కలిగి ఉండి ఎలక్ట్రాన్ ద్రవ్యరాశి కన్నా 2000 రెట్లు ఎక్కువ ద్రవ్యరాశిని కలిగి ఉన్న కణాలను ప్రోటానులు అంటారు.
→ ప్రోటాన్ ద్రవ్యరాశికి సమాన ద్రవ్యరాశి కలిగి ఉండి ఆవేశంలేని కణాలను న్యూట్రానులు అంటారు. వీటిని చాడ్విక్ కనుగొన్నాడు.
→ ఎలక్ట్రానులుగా మనం పిలిచే ఋణావేశ కణాలను పరమాణువు కలిగి ఉంటుందని థామ్సన్ తెలియజేశాడు. మొత్తం పరమాణువు అంతటా ఆవరించుకున్న ధనావేశిత పదార్థంలో ఎలక్ట్రాన్లు పొదగబడి ఉంటాయని థామ్సన్ పరమాణు నమూనా తెలియజేస్తుంది.
→ రూథర్ ఫర్డ్ చేసిన α కణ పరిక్షేపణ ప్రయోగం పరమాణు కేంద్రక ఆవిష్కరణకి దారి తీసింది.
→ పరమాణువులో చాలాభాగం ఖాళీగా ఉంటుందని, పరమాణు మధ్య భాగంలో అత్యంత చిన్నదైన, దట్టమైన ధనావేశంతో కూడిన కేంద్రకం ఉంటుందని చెప్పడం ద్వారా రూథర్ఫర్డ్ పరమాణు నమూనాను ఆధునీకరించాడు. ఇతడు తన ప్రయోగాలు కొనసాగించి కేంద్రకంలో న్యూట్రాన్ల, ప్రోటాన్ల ఉనికిని గుర్తించాడు.
→ రూథర్ ఫర్డ్ నమూనా ప్రకారం ఎలక్ట్రానులు కేంద్రకం చుట్టూ తిరుగుతుంటాయి.
→ పరమాణు స్థిరత్వాన్ని రూథర్ ఫర్డ్ నమూనా వివరించలేకపోయింది.
→ రూథర్ ఫర్డ్ పరమాణు నమూనాని సమీక్షించడం ద్వారా నీల్స్ బోర్, ఎలక్ట్రానులు కేంద్రకం చుట్టూ గల నిర్దిష్ట స్థిర శక్తి స్థాయిలలో ఉంటాయని చెప్పాడు.
![]()
→ భారమూలకాల పరమాణు వర్ణపటాన్ని నీల్స్ బోర్ నమూనా వివరించలేకపోయింది.
→ వివిధ కర్పరాలతో ఎలక్ట్రానుల అమరికను వివరించడానికి బోర్ – బ్యురీ కొన్ని నియమాలు ప్రతిపాదించారు. అవి :
- ఒక కక్ష్యలో ఉండే గరిష్ట ఎలక్ట్రానుల సంఖ్య 2n² సూత్రం ద్వారా నిర్ణయిస్తాం. ఇక్కడ n కర్పరం సంఖ్య.
- ప్రతి కర్పరం లేదా ఎలక్ట్రాన్ కక్ష్య తిరిగి ఉపకర్పరాలుగా విభజించబడింది. ఈ ఉపకర్పరాలలో గరిష్టంగా పట్టే ఎలక్ట్రానుల సంఖ్య 8.
- తక్కువ శక్తిగల లోపలి కర్పరాలలో ఎలక్ట్రానులు పూర్తిగా నిండనంత వరకు తర్వాత కర్పరాలలో ఎలక్ట్రానులు చేరవు.
→ పరమాణువు యొక్క బాహ్యతమ కక్ష్యలో గల ఎలక్ట్రానుల సంఖ్యనే సంయోజకత అంటారు.
→ ఏదేని మూలకం తన బాహ్యతమ కక్ష్యలో 8 ఎలక్ట్రానులు కలిగి ఉంటే ఆ పరమాణువును ‘అష్టకం’ను పొందింది అంటారు.
→ ఒక పరమాణువు బాహ్యతమ కక్ష్యలో 8 ఎలక్ట్రానులు ఉన్న పరమాణువు స్థిరమైనది.
→ ఒక పరమాణు కేంద్రకంలోని ప్రోటాన్ల సంఖ్యనే దాని పరమాణు సంఖ్య అంటాం. దీనిని Z తో సూచిస్తాము.
![]()
→ ప్రోటాన్, న్యూట్రాన్ సంఖ్యల మొత్తాన్ని ద్రవ్యరాశి సంఖ్య అంటారు. దీనిని A తో సూచిస్తాము.
→ ఒక మూలకాన్ని దాని పరమాణు సంఖ్య, ద్రవ్యరాశి సంఖ్యలతో క్రింది విధంగా సూచించవచ్చు.
(పరమాణు సంఖ్య)p F 19(ద్రవ్యరాశి సంఖ్య)
న్యూట్రానుల సంఖ్య N = A-Z
→ ఒకే మూలకానికి చెందిన వేరు వేరు పరమాణువులలో సమాన సంఖ్యలో ప్రోటానులు ఉండి, వేరు వేరు న్యూట్రానుల సంఖ్య కలిగి ఉండే వాటిని ఐసోటోపులు అంటారు.
→ రసాయన, వైద్య రహస్యాలను ఛేదించడానికి కొన్ని ఐసోటోపులను ఉపయోగిస్తారు.
→ పరమాణువు : మూలకం యొక్క ఉనికిని తెలియజేసే అతి సూక్ష్మ కణం పరమాణువు.
→ ఉప పరమాణు కణాలు : పరమాణువులను విభజించవచ్చని, అవి అతి చిన్న కణాలతో తయారవుతాయని ప్రయోగ ఫలితాలు ఋజువు చేశాయి. ఆ కణాలు పరమాణువు కన్నా చిన్నవిగా ఉండి పరమాణువులోనే ఉంటాయి. కావున వాటిని ఉప పరమాణు కణాలుగా పిలిచారు. ముఖ్యమైన పరమాణు ఉపకణాలు ఎలక్ట్రాన్, ప్రోటాన్, న్యూట్రాన్.
![]()
→ ఎలక్ట్రాన్ : మొట్టమొదటిగా ఆవిష్కరింపబడి, అధ్యయనం చేయబడిన ఉపపరమాణుకణం ఎలక్ట్రాన్. దీనిని e తో సూచిస్తారు. ఇది పరిగణనలోనికి తీసుకోలేనంత స్వల్ప ద్రవ్యరాశిని, ఒక ప్రమాణ ఋణావేశాన్ని కలిగి ఉంటుంది.
→ ప్రోటాన్ : ధనావేశం కలిగి ఉండి, పరమాణు కేంద్రకంలో భాగమైన ఒక పరమాణు ఉపకణాన్ని ప్రోటాన్ అంటారు. దీని ద్రవ్యరాశి ఎలక్ట్రాన్ ద్రవ్యరాశి కన్నా 2000 రెట్లు ఎక్కువ.
→ మ్యాట్రాన్ : ప్రోటాన్లో దాదాపు సమాన ద్రవ్యరాశి కలిగి ఉండి ఆవేశంలేని పరమాణు ఉపకణాన్ని న్యూట్రాన్ అంటారు. దీనిని n తో సూచిస్తారు.
→ కేంద్రకము : పరమాణువులో ధనావేశమంతా కేంద్రకం అనే అతి చిన్న సాంద్ర ప్రాంతంలో ఉంటుంది. ఇందులో ప్రోటాన్లు, న్యూట్రాన్లు ఉంటాయి.
→ పరమాణు ద్రవ్యరాశి (A) : పరమాణువులోని ప్రోటానుల, న్యూట్రానుల మొత్తం విలువ.
→ అణు ద్రవ్యరాశి : అణువు యొక్క సాపేక్ష ద్రవ్యరాశి.
![]()
→ పరమాణు సంఖ్య (z) : ఒక పరమాణు కేంద్రకంలోని ప్రోటాన్ల సంఖ్యనే దాని పరమాణు సంఖ్య అంటాం.
→ ద్రవ్యరాశి సంఖ్య : ప్రోటాన్, న్యూట్రాన్ సంఖ్యల మొత్తాన్ని ద్రవ్యరాశి సంఖ్య అంటారు. ఒక పరమాణువు ద్రవ్యరాశి దగ్గరి సంఖ్యే ఆ పరమాణువు ద్రవ్యరాశి సంఖ్య అవుతుంది.
→ సంయోజకత : పరమాణువు యొక్క బాహ్యతమ కక్ష్యలో గల ఎలక్ట్రానుల సంఖ్యనే సంయోజకత అంటారు. పరమాణు సంయోజకత అది ఇతర మూలకాలతో బంధంలో పాల్గొనగలిగే సామర్థ్యాన్ని తెలియజేస్తుంది.
→ ఐసోటోపులు : ఒకే మూలకానికి చెందిన వేరు వేరు పరమాణువులలో సమాన సంఖ్యలో ప్రోటానులు ఉండి, వేరు వేరు న్యూట్రానుల సంఖ్య కలిగి ఉండే వాటిని ఐసోటోపులు అంటారు.
→ స్థిర అణువు : ఒక పరమాణువు బాహ్యతమ కక్ష్యలో 8 ఎలక్ట్రానులు ఉన్న పరమాణువు స్థిరమైనది.
→ అష్టకము : ఏదేని మూలకం తన బాహ్యతమ కక్ష్యలో 8 ఎలక్ట్రానులు కలిగి ఉంటే ఆ పరమాణువు ‘అష్టకం’ను పొందినది అని అంటారు.
![]()
→ జడ వాయువులు : హీలియం, నియాన్, ఆర్గాన్ వంటి వాయువులు మిగతా మూలకాలలో సంయోగం చెంది సమ్మేళనాలను ఏర్పరచవు. ఈ వాయువులు రసాయన చర్యాశీలత లేనివి. కావున వీటిని జడవాయువులు అంటారు.
→ కర్పరాలు : పరమాణువులో గల ప్రత్యేకమైన స్థిర కక్ష్యలలో మాత్రమే ఎలక్ట్రాన్లు ఉంటాయి. ఈ స్థిర కక్ష్యలనే శక్తి స్థాయిలు లేదా కర్పరాలు అంటారు.