Students can go through AP Inter 2nd Year Chemistry Notes 6th Lesson p-బ్లాకు మూలకాలు will help students in revising the entire concepts quickly.
AP Inter 2nd Year Chemistry Notes 6th Lesson p-బ్లాకు మూలకాలు
15వ గ్రూపు మూలకాలు :
→ N, P, As, Sb, Bi లు 15వ గ్రూపు మూలకాలు. వాటి బాహ్య కక్ష్య ఎలక్ట్రాన్ విన్యాసం nS2 nP3.
→ బేరియం జైన్ను ఉష్ణ వియోగ చర్యకు గురి చేయడం ద్వారా అత్యంత స్వచ్ఛమైన డైనైట్రోజన్ ను పొందవచ్చు.
Ba(N3)2 → Ba + 3N2
→ నైట్రోజన్ ద్విపరమాణుక అణువులో రెండు నైట్రోజన్ పరమాణువుల మధ్య త్రికబంధం ఉంటుంది. దీనిని విఘటనం చెందించుటకు అధిక శక్తి (941.4KJ/mole) అవసరం. కావున నైట్రోజన్ అణువు అధిక స్థిరత్వం కలిగి రసాయనికంగా జడత్వం ప్రదర్శిస్తుంది.
→ హేబర్ పద్ధతి ద్వారా అమ్మోనియా తయారీ :
![]()
→ ఆస్వాల్డ్ పద్ధతి ద్వారా HNO3 తయారీ :
![]()
→ PCl3, జల విశ్లేషణ చేయగా H3PO3, PCl5 ను చేయగా H3PO4 ఏర్పడతాయి.
16వ గ్రూపు మూలకాలు :
→ O, S, Se, Te, PO లు 16వ గ్రూపు మూలకాలు. వీటి బాహ్య కక్ష్య ఎలక్ట్రాన్ విన్యాసం ns2 np4.
→ ఆక్సిజన్ తయారీ :
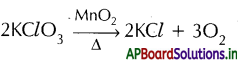
→ ఆక్సిజన్ ను నిశ్శబ్ద విద్యుత్ ఉత్సర్గానికి గురిచేసే ఓజోన్ ఏర్పడును.
3O2 → 2O3
→ SO2, లో ‘S’ సంకరీకరణం Sp2 ఆకృతి కోణీయ సమతల త్రిభుజాకారం.
SO3, లో ‘S’ సంకరీకరణం Sp2 ఆకృతి కోణీయ సమతల త్రిభుజాకారం.
→ సల్ఫర్ పెరాక్స్లో ఆమ్లాలు H2SO5, H2S2O8.
→ H2SO4 ను స్పర్శ పద్ధతి ద్వారా తయారుచేస్తారు.
![]()
17వ గ్రూపు మూలకాలు :
→ F, Cl, Br, I, At లు 17వ గ్రూపు మూలకాలు. వీటి బాహ్య కక్ష్యవిన్యాసం
→ కాల్షియం ఫాస్ఫైడ్ భార జలంతో చర్య జరిపి డ్యుటిరోఫాసీన్ ఏర్పడును.
Ca3P2 + 6D2O → 3 Ca (OD)2 + 2PD3
→ క్లోరిన్ ఆక్సో ఆమ్లాలు HOCl, HClO2, HClO3, HClO4.
→ కాపర్ లోహం సజల HNO3, తో చర్య
3Cu + 8HNO3(సజల) → 3Cu(NO3)2 + 2NO2 + 4H2O
→ కాపర్ లోహం గాఢ HNO3, తో చర్య
Cu + 4HNO3(సజల) → Cu(NO3)2 + 2NO2 + 2H2O
18వ గ్రూపు మూలకాలు :
→ He, Ne, Ar, Kr, Xe Rnలు 18వ గ్రూపు మూలకాలు. వీటి ఎలక్ట్రాన్ విన్యాసం ns2 np6 (He తప్ప).
→ తెల్ల ఫాస్పరస్, ఎర్ర ఫాస్ఫరస్ ధర్మాల్లోని భేదాలు :
| తెల్ల ‘P’ | ఎర్ర ‘P’ |
| 1. ఇది తెల్లటి మైనంలాంటి అర్థ పారదర్శక పదార్థం. | 1. ఇనుప బూడిదరంగు ద్యుతిని కలిగి ఉంటుంది. |
| 2. నీటిలో కరుగదు. CS2 లో కరుగుతుంది. | 2. చల్లని నీటిలో, CS2 లో కరుగుతుంది. |
| 3. అధిక చర్యాశీలత కలిగి ఉండును. | 3. తెల్ల ‘P’ కంటే తక్కువ చర్యాశీలత కలిగి ఉండును. |
| 4. విషపూరితమైనది. | 4. విషపూరితమైనది కాదు. |
| సమ్మేళనం | ఆకృతి |
| XeF2 | రేఖీయం |
| XeF4 | సమతల చతురస్రం |
| XeF6 | విరూపణ అష్టముఖీయం |
| XeO3 | పిరమిడల్ |
| XeO4 | టెట్రాహెడ్రల్ |
| XeOF4 | చతురస్ర పిరమిడల్ |