These AP 10th Class Physical Science Chapter Wise Important Questions 7th Lesson మూలకాల వర్గీకరణ – ఆవర్తన పట్టిక will help students prepare well for the exams.
AP Board 10th Class Physical Science 7th Lesson Important Questions and Answers మూలకాల వర్గీకరణ – ఆవర్తన పట్టిక
10th Class Physics 7th Lesson మూలకాల వర్గీకరణ – ఆవర్తన పట్టిక 1 Mark Important Questions and Answers
ప్రశ్న 1.
నవీన ఆవర్తన నియమమును వ్రాయుము. (లేదా) మోస్లే ఆవర్తన నియమాన్ని వ్రాయండి.
జవాబు:
మూలకాల భౌతిక, రసాయన ధర్మాలు వాటి ఎలక్ట్రాన్ విన్యాసాల ఆవర్తన ప్రమేయాలు.
ప్రశ్న 2.
కార్బన్ కుటుంబం అని ఏ గ్రూప్ మూలకాలను అంటారు?
జవాబు:
14 (లేదా) IVA గ్రూపు మూలకాలను కార్బన్ కుటుంబం అంటాము.
ప్రశ్న 3.
ఏ మూలకానికైనా మొదటి అయనీకరణ శక్తి కంటే 2వ అయనీకరణ శక్తి విలువ ఎక్కువ. ఎందుకు?
జవాబు:
1) ఏ మూలకమైనా, అయనీకరణ శక్తిని తీసుకొని, ఎలక్ట్రాన ను కోల్పోయి అయాగా మారుతుంది.
M(g) + IE1 → M+(g) + e–
2) ఈ ధనాత్మక అయాన్ కేంద్రకంలో ప్రోటాన్ల సంఖ్య ఎలక్ట్రాన్ల సంఖ్యకన్నా ఎక్కువగా ఉండి, చిట్టచివరి ఆర్బిటాల్ లోని ఎలక్ట్రాన్లను బలంగా ఆకర్షిస్తుంది. దీని వలన అయాన్ పరిమాణం కూడా తగ్గుతుంది.
3) కాబట్టి, మరొక ఎలక్ట్రాను తీయడానికి ఎక్కువ అయనీకరణ శక్తి అవసరం అవుతుంది.
M+(g) + IE2 → M+2(g) + e–
4) కావున మొదటి అయనీకరణ శక్తి కన్నా, రెండవ అయనీకరణ శక్తి ఎక్కువగా ఉంటుంది.
ప్రశ్న 4.
Ne మరియు Ar పరమాణువులలో పరిమాణపరంగా ఏది పెద్దది? ఎందుకు?
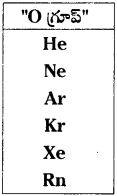
జవాబు:
Ne మరియు Ar పరమాణువులలో పరిమాణ పరంగా Ar పెద్దది.
కారణం :
గ్రూప్ లో పై నుండి కిందికి కక్ష్యల సంఖ్య పెరుగుతుంది. అంటే క్రొత్త కక్ష్యలు ఏర్పడుతుంటాయి.
ప్రశ్న 5.
డోబర్ నీర్ త్రికంకు ఒక ఉదాహరణ వ్రాయమని ఒక ఉపాధ్యాయుడు అడిగాడు. దానికి రాము “Li, Na, Mg” అని వ్రాసాడు. ఈ మూడింటిలో ఏది ఈ త్రికంలోనిది కాదో గుర్తించండి.
జవాబు:
మెగ్నీషియం లేదా (Mg) త్రికంలో లేదు.
![]()
ప్రశ్న 6.
రాబర్ట్ బాయిల్ నియమం ప్రకారం మూలకమును నిర్వచించుము.
జవాబు:
భౌతిక, రసాయన మార్పుల ద్వారా ఏదైనా పదార్థాన్ని అంతకంటే మరింత సూక్ష్మ పదార్థముగా విభజించలేమో, దానిని మూలకం అంటారు.
ప్రశ్న 7.
డాబరీనర్ త్రికము అనగానేమి?
జవాబు:
ఒకే రసాయన ధర్మాలు కలిగి ఉన్న మూడేసి మూలకాల సమూహంను త్రికము అంటారు.
ప్రశ్న 8.
డాబరీనర్ త్రిక సిద్ధాంతంను వ్రాయుము.
జవాబు:
ప్రతీ త్రికములో మధ్య మూలకపు పరమాణుభారం, మిగిలిన రెండు మూలకాల పరమాణుభారాల సరాసరికి దాదాపు సమానముగా ఉంటుంది. దీనినే ‘డాబరీనర్ త్రిక సిద్ధాంతం’ అని అంటారు.
ప్రశ్న 9.
మెండలీవ్ ఆవర్తన నియమమును వ్రాయుము.
జవాబు:
మూలకాల భౌతిక, రసాయన ధర్మాలు వాటి పరమాణు భారాల ఆవర్తన ప్రమేయాలు.
ప్రశ్న 10.
మెండలీవ్ ఆవర్తన పట్టిక లోపాలను వ్రాయుము.
జవాబు:
- అసంగత మూలకాల జతలు.
- సారూప్యత లేని మూలకాలను కలిపి ఉంచడం.
ప్రశ్న 11.
మోస్లే ప్రకారము పరమాణు సంఖ్య అంటే ఏమిటి?
జవాబు:
ఒక మూలక పరమాణువులో ఉన్న ధనావేశిత కణాల సంఖ్యను ఆ మూలకం యొక్క పరమాణు సంఖ్య అంటారు.
ప్రశ్న 12.
గ్రూపులంటే ఏమిటి?
జవాబు:
మూలక పరమాణువుల బాహ్య కక్ష్య ఎలక్ట్రాన్ విన్యాసం ఒకేలా ఉండే మూలకాలన్నీ, ఒకే నిలువు వరుసలో అమర్చబడి ఉంటే, వీటిని గ్రూపులు అంటారు.
ప్రశ్న 13.
పీరియడ్లు ఎలా ఏర్పడతాయి?
జవాబు:
కక్ష్యల సంఖ్య సమానంగా గల మూలకాలు ఒకే అడ్డు వరుసలో అమర్చబడి పీరియడ్లు ఏర్పడతాయి.
ప్రశ్న 14.
లాంథనైడులు అని వేటినంటారు?
జవాబు:
4f మూలకాలను లాంథనాయిడ్లు లేదా లాంథనైడ్లు అంటారు. (లేదా) మూలకాలు 58Ce నుండి 71Lu వరకు గల మూలకాలు 57La లక్షణాలను ప్రదర్శిస్తాయి. కనుక వీటిని లాంథనైడులు అంటారు.
ప్రశ్న 15.
ఆక్టినైడులు అంటే ఏమిటి?
జవాబు:
5f మూలకాలను ఆక్టినైడ్లు లేదా ఆక్టినాయిడ్లు అంటారు. (లేదా) మూలకాలు 90Th నుండి 103Lr వరకు గల మూలకాలు 89Ac లక్షణాలను ప్రదర్శిస్తాయి. కనుక వీటిని ఆక్టినైడులు అంటారు.
ప్రశ్న 16.
మూలకాలను లోహాలు మరియు అలోహాలుగా ఎలా వర్గీకరించారు?
జవాబు:
మూలకాలను బాహ్యకక్ష్యలో గల ఎలక్ట్రానుల ఆధారముగా వర్గీకరించారు.
లోహాలు :
బాహ్యకక్ష్యలో మూడు లేదా అంతకన్నా తక్కువ ఎలక్ట్రాన్లు ఉన్న మూలకాలను లోహాలుగా పరిగణించారు.
అలోహాలు :
బాహ్యకక్ష్యలో 5 లేదా అంతకంటే ఎక్కువ ఎలక్ట్రాన్లు ఉన్న మూలకాలను అలోహాలుగా పరిగణించారు.
ప్రశ్న 17.
సంయోజకత అంటే ఏమిటి?
జవాబు:
ఒక మూలకం యొక్క సంయోగ సామర్థ్యాన్ని సంయోజకత అంటారు.
![]()
ప్రశ్న 18.
పరమాణు వ్యాసార్ధము అంటే ఏమిటి?
జవాబు:
ఘన పదార్థంలోని రెండు ప్రక్కప్రక్క పరమాణువుల కేంద్రకాల మధ్య దూరాన్ని పరమాణు వ్యాసార్ధము అంటారు. (లేక) ఒక పరమాణువు యొక్క కేంద్రకం నుండి వేలన్సీ స్థాయి ఎలక్ట్రాన్లకు మధ్య గల దూరంను పరమాణు వ్యాసార్ధమంటారు.
ప్రశ్న 19.
సమయోజనీయ వ్యాసార్ధము అంటే ఏమిటి?
జవాబు:
సమయోజనీయ బంధాన్ని కలిగి ఉన్న అణువులోని పరమాణువుల కేంద్రకాల మధ్య దూరంలో సగాన్ని సమయోజనీయ వ్యాసార్ధము అని అంటారు.
ప్రశ్న 20.
పరమాణు వ్యాసార్ధాన్ని ఏ ప్రమాణంలో కొలుస్తారు?
జవాబు:
పరమాణు వ్యాసార్ధాన్ని పికోమీటర్లలో కొలుస్తారు.
1pm = 10-12 m
ప్రశ్న 21.
అయనీకరణ శక్తి లేదా అయనీకరణ శక్మం అంటే ఏమిటి?
జవాబు:
వాయుస్థితిలో గల ఒంటరి తటస్థ పరమాణువు యొక్క బాహ్యకక్ష్యలో నుండి చివరి ఎలక్ట్రాన్ ను తీయుటకు కావలసిన శక్తిని అయనీకరణ శక్తి లేదా అయనీకరణ శక్మం అంటారు.
ప్రశ్న 22.
ప్రథమ అయనీకరణ శక్తి (IE1) అంటే ఏమిటి?
జవాబు:
వాయుస్థితిలో గల ఒంటరి తటస్థ పరమాణువు యొక్క బాహ్యకక్ష్యలోని చివరి ఒక ఎలక్ట్రాన్ ను తీసివేయుటకు కావలసిన శక్తిని ప్రథమ అయనీకరణ శక్తి (IE1) అంటాము.
M(g) + IE1 → M(g)+ + e–
ప్రశ్న 23.
ద్వితీయ అయనీకరణ శక్తి (IE2) అంటే ఏమిటి?
జవాబు:
ఏకమాత్ర ధనావేశమున్న అయాన్ నుండి ఒక ఎలక్ట్రాన ను తీసివేయడానికి కావలసిన శక్తిని రెండవ అయనీకరణ శక్తి (IE2) అంటాము.
M(g)+ + IE2 → M(g)+2 + e–
ప్రశ్న 24.
ఎలక్ట్రాన్ ఎఫినిటీ అంటే ఏమిటి?
జవాబు:
వాయుస్థితిలో గల ఒంటరి తటస్థ పరమాణువు ఒక ఎలక్ట్రాన్ ను గ్రహిస్తే విడుదలగు శక్తిని ఎలక్ట్రాన్ ఎఫినిటీ అంటారు.
ప్రశ్న 25.
మొదటి, రెండవ ఎలక్ట్రాన్ ఎఫినిటీలను వ్రాయుము.
జవాబు:
- వాయుస్థితిలో గల ఒంటరి తటస్థ పరమాణువుకు మొదటి ఎలక్ట్రాన్ ను చేర్చడం వలన విడుదలైన శక్తిని మొదటి ఎలక్ట్రాన్ ఎఫినిటీ అంటారు.
- ఏకమాత్ర ఋణావేశమున్న అయాన్ కు మరొక ఎలక్ట్రాన్ ను చేర్చినపుడు విడుదలైన శక్తిని రెండవ ఎలక్ట్రాన్ ఎఫినిటీ అంటారు.
ప్రశ్న 26.
ఋణవిద్యుదాత్మకత అంటే ఏమిటి?
జవాబు:
ఒక మూలక పరమాణువు వేరే మూలక పరమాణువుతో బంధములో ఉన్నపుడు ఎలక్ట్రాన్లను తనవైపు ఆకర్షించే ప్రవృత్తిని ఆ మూలక ఋణవిద్యుదాత్మకత అంటారు.
![]()
ప్రశ్న 27.
ఋణవిద్యుదాత్మకత పరముగా మిల్లికన్ ప్రతిపాదన ఏమిటి?
జవాబు:
ఒక మూలకం యొక్క ఋణవిద్యుదాత్మకత దాని అయనీకరణ శక్తి, ఎలక్ట్రాన్ ఎఫినిటీ విలువల సగటుగా ప్రతిపాదించాడు.

ప్రశ్న 28.
మూలక కుటుంబం అంటే ఏమిటి?
జవాబు:
మూలకాల సమూహమును మూలక కుటుంబం అంటారు.
ఉదా : క్షార లోహాలు (IA గ్రూపు మూలకాలు)
బోరాన్ కుటుంబం (IIIA గ్రూపు మూలకాలు)
ప్రశ్న 29.
అర్దలోహాలు అనగానేమి?
జవాబు:
లోహాల, అలోహాల ధర్మాలకు మధ్యస్థంగా ఉన్న ధర్మాలను కలిగియున్న మూలకాలను అర్ధలోహాలు అంటారు.
ప్రశ్న 30.
ఒక గ్రూపులో ఉన్న మూలకాలు ఒకే రసాయన ధర్మాలను ఎందుకు కలిగి ఉంటాయి?
జవాబు:
మూలకాల భౌతిక రసాయన ధర్మాలు వాటి ఎలక్ట్రాన్ విన్యాసం, ముఖ్యంగా వేలన్నీ ఎలక్ట్రాన్ విన్యాసం ఆధారంగా ఉంటాయి. ఒకే గ్రూపులోని మూలకాల ఎలక్ట్రాన్ విన్యాసం ఒకే విధంగా ఉంటుంది. కాబట్టి ఒకే గ్రూపులోని మూలకాలన్నీ ఒకే రసాయన ధర్మాలను కలిగి ఉంటాయి.
ప్రశ్న 31.
ఒక పీరియడ్ లోని మూలకాలు ఒకే రసాయన ధర్మాలు కలిగి ఉండవు. ఎందుకు?
జవాబు:
పీరియడ్లో ఎడమ నుండి కుడికి పోవుకొలది పరమాణు సంఖ్య ఒక ప్రమాణం పెరుగుతూ ఉంటుంది. అనగా వేలన్సీలో ఒక కొత్త ఎలక్ట్రాన్ వచ్చి చేరుతుంది. అందువల్ల ఏ రెండు మూలకాలూ ఒకే ఎలక్ట్రాన్ విన్యాసాన్ని కలిగి ఉండవు. కావున పీరియడ్లోని మూలకాలన్నీ ఒకే రసాయన ధర్మాలను కలిగి ఉండవు.
ప్రశ్న 32.
ఒక గ్రూపు మరియు పీరియడ్లలో పరమాణు వ్యాసార్ధం ఎలా మారుతుంది?
జవాబు:
గ్రూపులో పైనుండి క్రిందికి పోవుకొలది పరమాణు వ్యాసార్ధం పెరుగుతుంది. పీరియడ్ లో ఎడమ నుండి కుడికి పోవుకొలది పరమాణు వ్యాసార్ధం తగ్గుతుంది.
ప్రశ్న 33.
గ్రూపు మరియు పీరియడ్ లో అయనీకరణ శక్తి ఏ విధంగా మారును?
జవాబు:
అయనీకరణ శక్మం గ్రూపులో పై నుండి క్రిందికి పోవుకొలది తగ్గును మరియు పీరియడ్ లో ఎడమ నుండి కుడికి పోవుకొలది పెరుగును.
ప్రశ్న 34.
గ్రూపు మరియు పీరియలో ఋణవిద్యుదాత్మకత ఎలా మారును?
జవాబు:
గ్రూపు :
గ్రూపులో పై నుండి కిందికి పోవుకొలది ఋణవిద్యుదాత్మకత తగ్గును.
పీరియడ్ :
పీరియడ్లో ఎడమ నుండి కుడికి పోవుకొలది ఋణవిద్యుదాత్మకత పెరుగును.
ప్రశ్న 35.
ఒక బ్లాకులో ఉంచబడిన మూలకాల కోవకు చెందని మూలకాలకొక ఉదాహరణనిమ్ము.
జవాబు:
1) He : 1s² దీనిని. p-బ్లాకులో ఉంచారు.
2) H : 1s¹ దీనికి నిర్దిష్టమైన స్థలాన్ని సూచించలేదు.
ప్రశ్న 36.
స్క్రీనింగ్ ఫలితం అనగానేమి?
జవాబు:
కేంద్రకానికి, వేలన్సీ ఎలక్ట్రాన్లకు మధ్య కక్ష్యల సంఖ్య పెరిగితే అవి తెరల మాదిరిగా పనిచేస్తాయి. అందువల్ల వేలన్సీ ఎలక్ట్రాన్లపై కేంద్రక ఆకర్షణను అడ్డుకుంటాయి. దీనినే స్క్రీనింగ్ ఫలితము అంటారు.
ప్రశ్న 37.
5వ పీరియడ్లో ఎన్ని మూలకాలు ఉంటాయి? కారణమేమిటి?
జవాబు:
5వ పీరియలో 18 మూలకాలు ఉన్నాయి.
కారణం :
5వ పీరియడ్ లోని మూలకాలు 5s తో మొదలై 5p తో ముగుస్తాయి. అనగా 58, 4d, 5p స్థాయిలు నిండుతాయి. వీటిలో నిండే ఎలక్ట్రాన్ల సంఖ్య 18. కావున 18 మూలకాలు ఉంటాయి.
ప్రశ్న 38.
B, N, Be మరియు 0 మూలకాలను వాటి అయనీకరణ శక్మల ఆరోహణ క్రమంలో అమర్చండి.
జవాబు:
B < Be < 0 < N.
10th Class Physics 7th Lesson మూలకాల వర్గీకరణ – ఆవర్తన పట్టిక 2 Marks Important Questions and Answers
ప్రశ్న 1.
జడవాయువుల ప్రత్యేక ప్రవృత్తిని మీరు ఎలా అభినందిస్తారు?
జవాబు:
- జడవాయువుల ప్రత్యేక ప్రవృత్తిని నేను అభినందిస్తాను. ఎందుకంటే అవి మిగిలిన అన్ని మూలకాల పరమాణువుల మధ్య రసాయన బంధాల ఏర్పాటును వాటి స్థిరత్వాన్ని వివరించటంలో సహాయపడుతాయి.
- జడవాయువులు అష్టక విన్యాసంతో స్థిరత్వం కల్గి ఉంటాయి.
![]()
ప్రశ్న 2.
ఒక మూలకం పరమాణు సంఖ్య 35 ఆవర్తన పట్టికలో దాని స్థానం ఎక్కడ ఉంటుంది? ఎందుకు?
జవాబు:
పరమాణు సంఖ్య 35గా గల మూలకం యొక్క ఎలక్ట్రాన్ విన్యాసం 2, 8, 18,7. ఈ మూలక పరమాణువుకు 7 వేలన్సీ ఎలక్ట్రానులు కలవు. కనుక ఇది 17వ గ్రూపు లేక VII A గ్రూపులో ఉండును. మరియు 4వ పీరియడ్ లోని బ్రోమైన్ మూలకము.
ప్రశ్న 3.
మూలకాలను వర్గీకరించడంలో డాబరీనర్, న్యూలాండ్, మెండలీఫ్ ఎందుకు 100% సఫలీకృతం కాలేకపోయారు? వారి వర్గీకరణం కన్నా నవీన ఆవర్తన పట్టిక సరియైనది, ఎందుకు? కారణాలను ఊహించండి.
జవాబు:
- డాబరీనర్ కాలంనాటికి తెలిసిన మూలకాలన్నింటిని త్రికాలుగా అమర్చలేకపోయాడు.
- న్యూలాండ్ అష్టక సిద్ధాంతం కేవలం 56 మూలకాలకు మాత్రమే పరిమితమైనది.
- మెండలీఫ్ పరమాణుభారం ఆధారంగా మూలకాలను వర్గీకరించాడు. దీనివల్ల ఒకే గ్రూపులో వేరువేరు ధర్మాలున్న మూలకాలు అమర్చవలసి వచ్చింది.
- కావున నవీన ఆవర్తన పట్టిక ఎలక్ట్రాన్ విన్యాసం ఆధారంగా. అమర్చడం వలన గ్రూపులు మరియు పీరియడ్స్ అమరిక సరిగా జరిగింది. అంతేగాక భవిష్యత్ లో కనుగొనబోయే మూలకాలకు కూడ స్థానాలు వదిలివేయబడినవి.
పై కారణాల వల్ల నవీన ఆవర్తన పట్టిక డాబరీనర్, న్యూలాండ్, మెండలీఫ్ల వర్గీకరణల కన్నా సరియైనది.
ప్రశ్న 4.
ఇచ్చిన ఎలక్ట్రాన్ విన్యాసాలను పరిశీలించి, ఆ మూలకాల గ్రూప్ ల మరియు పీరియడ్ల సంఖ్యలను రాయండి.
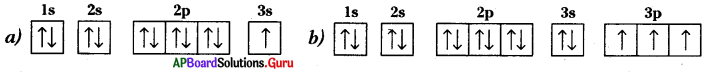
జవాబు:
a) 3వ పీరియడ్, 1వ గ్రూపు.
b) 3వ పీరియడ్, 15వ గ్రూపు.
ప్రశ్న 5.
క్రింది ఫట్టికలో ఇచ్చిన సమాచారంను పరిశీలించి, పట్టిక క్రింద ఇవ్వబడిన ప్రశ్నలకు సమాధానములు రాయండి.

i) పై పట్టికలో S-బ్లాక్ మూలకాలు ఏవి?
ii) పై పట్టికలోని ‘p’ బ్లాక్ మూలకాలు, ‘d’ బ్లాక్ మూలకాలను రాయండి.
జవాబు:
i) s – బ్లాకు మూలకాలు : Na, Ca
ii) p- బ్లాకు మూలకాలు : C, P
d- బ్లాకు మూలకాలు : Ti, Ni.
ప్రశ్న 6.
ఒక మూలకం పరమాణు సంఖ్య 17. ఆ మూలకం స్థానం ఆవర్తన పట్టికలో ఎక్కడ ఉంటుందని ఊహిస్తున్నావు? ఎందుకు?
జవాబు:
- ఇచ్చిన మూలకానికి ఎలక్ట్రాన్ విన్యాసము 1s²2s²2p63s²3p5.
- మూలకం 3వ పీరియడ్, 17వ గ్రూప్ కు చెందినది.
- 3s² 3p5 వేలన్సీ ఎలక్ట్రాన్ విన్యాసము వల్ల ఇది 17వ గ్రూప్, 3వ పీరియడ్ కు చెందుతుంది.
ప్రశ్న 7.
క్రింది జతలలో ప్రతి దానిలోను దేని పరిమాణం రెండవ దానితో పోలిస్తే పెద్దదో ఊహించండి, వివరించండి.
(X) Na, Al (Y) Na, Mg+2
జవాబు:
(X) : Na పరిమాణం పెద్దదిగా ఉంటుంది.
వివరణ : పీరియడ్ లో ఎడమ నుండి కుడికి పోయే కొద్దీ పరమాణు పరిమాణం తగ్గుతుంది.
(Y) : Na పరిమాణం పెద్దదిగా ఉంటుంది.
వివరణ : Mg కన్నా Na పెద్దది.
Mg+2 కన్నా Mg పెద్దది.
కావున Na, Mg+2 కన్నా పెద్దది.
ప్రశ్న 8.
పట్టికను పరిశీలించి క్రింది ప్రశ్నలకు జవాబులు రాయండి.
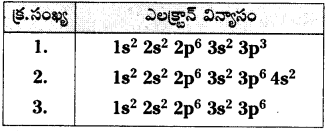
1) వ్యాలెన్సీ ‘2’ గల మూలకం పేరు రాయండి.
2) 3వ పీరియడ్, VA గ్రూపుకు చెందిన మూలకం పేరు రాయండి.
జవాబు:
- కాల్షియం (లేదా) Ca
- పాస్ఫరస్ (లేదా) P
ప్రశ్న 9.
డాబరీనర్ సిద్ధాంతపు పరిమితులను వ్రాయుము.
జవాబు:
- డాబరీనర్ కాలం నాటికి తెలిసిన మూలకాలన్నింటినీ త్రికాలుగా అమర్చలేకపోయాడు.
- ఈ సిద్ధాంతం అత్యధిక లేదా అత్యల్ప ద్రవ్యరాశులున్న మూలకాలకు వర్తించదు.
- పరమాణు ద్రవ్యరాశిని కచ్చితంగా కొలిచే పరికరాలు అభివృద్ధి చెందిన తర్వాత ఈ సిద్ధాంతం కచ్చితమైనదిగా నిలువలేకపోయింది.
ప్రశ్న 10.
న్యూలాండ్స్ అష్టక నియమమును వ్రాయుము.
జవాబు:
మూలకాలను వాటి పరమాణు భారాల ఆరోహణ క్రమములో అమర్చినపుడు వాటి ధర్మాలు నిర్ణీత వ్యవధులలో పున వుతాయి.
(లేదా)
మూలకాలను పరమాణుభారాల ఆరోహణ క్రమములో అమర్చినపుడు ఒక మూలకం నుండి మొదలు పెడితే ప్రతీ ఎనిమిదవ మూలకము ధర్మాలు మొదటి మూలక ధర్మాలను పోలి ఉంటాయి.
![]()
ప్రశ్న 11.
న్యూలాండ్స్ అష్టక నియమపు పరిమితులు వ్రాయుము.
జవాబు:
- న్యూలాండ్స్ ఒకే గడిలో రెండు మూలకాలను పొందుపరిచాడు.
ఉదా : కోబాల్ట్, నికెల్. - పూర్తిగా భిన్నమైన ధర్మాలు కలిగిన కొన్ని మూలకాలను ఒకే గ్రూపులో అమర్చాడు.
- కాల్షియం కంటే ఎక్కువ పరమాణు ద్రవ్యరాశి ఉన్న మూలకాలకు ఇది వర్తించదు.
- ఈ నియమము 56 మూలకాల వరకు మాత్రమే పరిమితమైనది.
ప్రశ్న 12.
అయనీకరణ శక్తి ఆధారపడు అంశాలను వ్రాయుము.
జవాబు:
అయనీకరణ శక్తి క్రింది అంశాలపై ఆధారపడును.
- కేంద్రక ఆవేశం
- స్క్రీనింగ్ లేదా షీల్డింగ్ ఫలితము
- ఆర్బిటాళ్ళు చొచ్చుకుపోయే స్వభావం
- స్థిరమైన ఎలక్ట్రాన్ విన్యాసము
- పరమాణు వ్యాసార్ధము
ప్రశ్న 13.
మెండలీఫ్ ఆవర్తన పట్టిక యొక్క పరిమితులేవి?
జవాబు:
అసంగత మూలకాల జతలు :
అధిక పరమాణు ద్రవ్యరాశి గల మూలకాలు, అల్ప పరమాణు ద్రవ్యరాశి గల మూలకాలకు ముందు ఉన్నాయి.
సారూప్యత లేని మూలకాలను కలిపి ఉంచడం :
విభిన్న ధర్మాలు గల మూలకాలను ఒకే గ్రూపులో, ఉపగ్రూపు A మరియు B లలో ఉంచారు.
10th Class Physics 7th Lesson మూలకాల వర్గీకరణ – ఆవర్తన పట్టిక 4 Marks Important Questions and Answers
ప్రశ్న 1.
అయనీకరణ శక్తి అనగానేమి? అయనీకరణ శక్తిని ప్రభావితం చేసిన అంశాలను వివరించండి.
(లేదా)
అయనీకరణ శక్మమును నిర్వచించి, అది ఏఏ అంశాలపై ఆధారపడి ఉంటుందో వివరించండి.
జవాబు:
అయనీకరణ శక్తి (అయనీకరణ శక్మం) :
ఏదైనా మూలక పరమాణువు వాయు స్థితిలో ఒంటరిగా, తటస్థంగా ఉన్నప్పుడు దానికి తగినంత శక్తిని అందజేసి బాహ్యకక్ష్యలో నుండి చివరి ఎలక్ట్రాన్ ను పరమాణువు నుండి తీసివేయడానికి కావలసిన కనీస శక్తిని “అయనీకరణ శక్తి” అంటాం.
అయనీకరణ శక్తిని ప్రభావితం చేసే అంశాలు (ఆధారపడే అంశాలు) :
1) కేంద్రక ఆవేశం :
కేంద్రకంలో ఆవేశం ఎక్కువ ఉన్నప్పుడు అయనీకరణ శక్తి విలువ పెరుగుతుంది.
ఉదా : 11Na, 17Cl లలో సోడియంతో పోల్చినపుడు క్లోరిన్ అయనీకరణ శక్తి ఎక్కువ.
2) స్క్రీనింగ్ లేదా షీల్డింగ్ ఫలితం :
కేంద్రకానికీ, వేలన్సీ ఎలక్ట్రాన్లకు మధ్య కక్ష్యల సంఖ్య పెరిగితే అవి తెరల మాదిరిగా పనిచేస్తాయి. అందువలన వేలన్సీ ఎలక్ట్రాన్ల పై కేంద్రక ఆకర్షణను అడ్డుకుంటాయి. దీనినే “స్క్రీనింగ్ ఫలితం” లేదా “పరివేశిక ప్రభావం” అంటారు.
– ఈ ఫలితం పెరిగితే అయనీకరణ శక్తి విలువలు తగ్గుతాయి.
ఉదా : 3Li తో పోల్చితే 55CS నందు కక్ష్యల సంఖ్య ఎక్కువ కావున, Li కన్నా CS అయనీకరణ శక్తి తక్కువ.
3) ఆర్బిటాల్ చొచ్చుకుపోయే స్వభావం :
ఒకే ప్రధాన కక్ష్యలో ఉండే ఆర్బిటాల్ లో కేంద్రకం వైపుకు చొచ్చుకుపోయే స్వభావం వేర్వేరుగా ఉంటుంది.
ఉదా : నాలుగో క్యలో ఈ స్వభావం 4s>4p>4d>4f కావున. 4s కన్నా 4f నుండి ఎలక్ట్రాన్లను సులభంగా తొలగించవచ్చును.
4) స్థిరమైన ఎలక్ట్రాన్ విన్యాసం :
ఏదైనా పరమాణువులో ఆర్బిటాళ్ళు పూర్తిగా లేదా సగం నిండినట్లయితే వాటి ఎలక్ట్రాన్ విన్యాసాన్ని “స్థిరమైన ఎలక్ట్రాన్ విన్యాసం” అంటాం. ఇలా పూర్తిగా లేదా సగం నిండిన ఆర్బిటాళ్ళు గల పరమాణువుల నుండి ఎలక్ట్రాన్లు తొలగించడానికి అధిక శక్తి అవసరమవుతుంది.
ఉదా : ఆక్సిజన్ ఎలక్ట్రాన్ విన్యాసం (z = 8) : 1s²2s²2p4
నైట్రోజన్ ఎలక్ట్రాన్ విన్యాసం (z = 7) : 1s²2s²2p³
ఆక్సిజన్ తో పోల్చినపుడు, నైట్రోజన్లో సగం నిండిన ఆర్బిటాళ్ళు ఉన్నాయి. కాబట్టి నైట్రోజన్ అయనీకరణ శక్తి విలువ ఎక్కువ.
5) పరమాణు వ్యాసార్ధం :
పరమాణు వ్యాసార్ధం పెరిగే కొద్దీ అయనీకరణ శక్తి విలువలు తగ్గుతాయి.
ఉదా : ఫ్లోరిన్ అయనీకరణ శక్తి విలువ అయోడిన్ కన్నా ఎక్కువ. అలాగే సోడియం అయనీకరణ శక్తి విలువ సీసియం కన్నా ఎక్కువ.
ప్రశ్న 2.
విస్తృత ఆవర్తన పట్టికలోని ఒక సంక్లిష్ట పీరియడ్ కు చెందిన కొన్ని మూలకాలు ఎడమ నుండి కుడివైపుకు క్రమ పద్ధతిలో ఇవ్వబడినాయి.
Li, Be, B, C, N, F, Ne
క్రింది ప్రశ్నలకు జవాబులివ్వండి.
i) పై మూలకాలు ఆవర్తన పట్టికలో ఏ పీరియడ్ కు చెందినవి?
ii) పైన పేర్కొన్న పీరియడ్ లో విస్మరించబడిన మూలకం ఏది? అది ఉండవలసిన స్థానం ఏది?
iii) పై వాటిలో హాలోజన్ కుటుంబానికి చెందిన మూలకం ఏది? దాని ఋణ విద్యుదాత్మకత విలువ ఎంత?
iv)ఈ పీరియడ్ లో లోహ ధర్మం ఎలా మారుచున్నది?
జవాబు:
i) 2వ పీరియడకు చెందినవి
ii) ఆక్సిజన్ (O) అది ఉండవలసిన స్థానం నైట్రోజన్ (N) మరియు ఫ్లోరిన్ (F) ల మధ్యలో ఉండును.
iii) ఫ్లోరిన్ (F) దీని ఋణ విద్యుదాత్మకత : 4.0
iv)పీరియలో ఎడమ నుండి కుడికి లోహ ధర్మం తగ్గును.
ప్రశ్న 3.
క్రింది పట్టికలో 18వ గ్రూపుకు చెందిన మూలకాలలో వివిధ కర్పరాలలో పంపిణీ అయిన ఎలక్ట్రాన్ల సంఖ్య చూపబడినది.
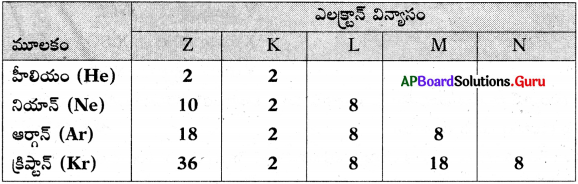
క్రింది ప్రశ్నలకు జవాబులు వ్రాయండి.
i) పై మూలకాల సామాన్య ఎలక్ట్రాన్ విన్యాసం వ్రాయండి. (He తప్ప).
ii) “ఆర్గాన్” యొక్క సంయోజకత ఎంత?
iii) “నియాన్” మూలక పరమాణువును లూయీ చుక్కల నిర్మాణంగా చూపండి.
iv) పై మూలకాలు రసాయన బంధాలను ఏర్పరచవు. ఎందుకు?
జవాబు:
![]()
iv) బాహ్య కర్పరంలో ‘8’ ఎలక్ట్రాన్లను కలిగి ఉండుట (He తప్ప) చే స్థిరత్వాన్ని పొందుతాయి.
ప్రశ్న 4.
కింది పట్టికలో కొన్ని మూలక కుటుంబాలకు సంబంధించిన సమాచారం ఇవ్వబడింది. దీని ఆధారంగా మిగిలిన ఖాళీ గడులలో సమాచారాన్ని పూరించండి.
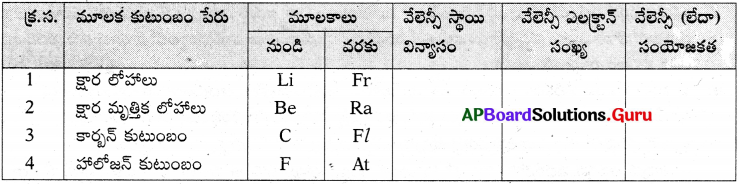
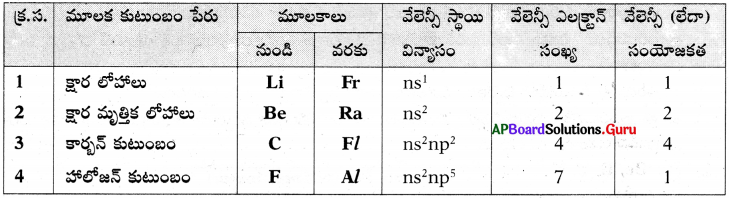
జవాబు:
ప్రశ్న 5.
ఆవర్తన పట్టికలో ఒకే పీరియడ్ కు చెందిన 1వ గ్రూపు మూలకం Y మరియు 2వ గ్రూపు మూలకం Y. కింద తెలిపిన అంశాల పరంగా X, Y మూలకాలను పోల్చండి.
i) బాహ్య కక్ష్యలో ఉండే ఎలక్ట్రాన్ల సంఖ్య
ii) వాటి పరమాణు పరిమాణం మరియు సంయోజకతలు
iii) వాటి అయనీకరణ శక్మం మరియు లోహ లక్షణం
iv) వాటి క్లోరైడ్, సల్ఫేట్ సాంకేతికాలు
జవాబు:
i) X యొక్క బాహ్యకక్ష్యలో ఉండే ఎలక్ట్రాన్ల సంఖ్య = 1
Y యొక్క బాహ్యకక్ష్యలో ఉండే ఎలక్ట్రాన్ల సంఖ్య = 2
ii) X కన్నా Y.పరమాణు పరిమాణం తక్కువ
X యొక్క సంయోజకత = 1
Y యొక్క సంయోజకత = 2
iii) X కన్నా Y యొక్క అయనీకరణం శక్మం విలువ ఎక్కువ
Xకు Y కన్నా లోహ లక్షణం అధికంగా ఉంటుంది.
iv) X యొక్క క్లోరైడ్ …. XCl
Y యొక్క క్లోరైడ్ …. YCl2
X యొక్క సల్ఫేట్…. X2SO4
Y యొక్క సల్ఫేట్ …. YSO4
![]()
ప్రశ్న 6.
ఎలక్ట్రాన్ ఎఫినిటీ (ఎలక్ట్రాన్ స్వీకరణ ఎంథాల్పీ) పై ప్రభావం చూపే అంశాలలో ఏవేని నాలుగింటిని వివరించండి.
జవాబు:
ఎలక్ట్రాన్ ఎఫినిటిపై ప్రభావం చూపే అంశాలు
i. కేంద్రక ఆవేశం :
కేంద్రక ఆవేశం పెరిగితే ఎలక్ట్రాన్ ఎఫినిటి విలువ పెరుగుతుంది. కేంద్రక ఆవేశం తగ్గితే ఎలక్ట్రాన్ ఎఫినిటి విలువ తగ్గుతుంది.
ii. స్క్రీనింగ్ లేదా షీల్డింగ్ ఫలితం :
షీల్డింగ్ ఫలితం విలువ పెరిగితే ఎలక్ట్రాన్ ఎఫినిటి విలువ తగ్గుతుంది. షీల్డింగ్ ఫలితం విలువ తగ్గితే ఎలక్ట్రాన్ ఎఫినిటి విలువ పెరుగుతుంది.
iii. ఆర్బిటాళ్ళు చొచ్చుకు పోయే సామర్థ్యం :
ఆర్బిటాళ్ళు చొచ్చుకుపోయే సామర్థ్యం ఎక్కువ ఉంటే ఎలక్ట్రాన్ ఎఫినిటి విలువ ఎక్కువ చొచ్చుకుపోయే సామర్థ్యం తక్కువ ఉంటే ఎలక్ట్రాన్ ఎఫినిటి విలువ తక్కువ.
iv. సిద్ధమైన ఎలక్ట్రాన్ విన్యాసం :
స్థిరమైన ఎలక్ట్రాన్ విన్యాసం ఉంటే ఎలక్ట్రాన్ ఎఫినిటి విలువ తగ్గుతుంది.
v. పరమాణు వ్యాసార్ధం :
పరమాణు వ్యాసార్ధం పెరిగితే ఎలక్ట్రాన్ ఎఫినిటి విలువ తగ్గుతుంది. వ్యాసార్ధం తగ్గితే ఎలక్రాన్ ఎఫినిటి విలువ పెరుగుతుంది.
vi. లోహ స్వభావం :
లోహ స్వభావం పెరుగుతుంటే ఎలక్ట్రాన్ ఎఫినిటి విలువలు తగ్గుతాయి.
vii. అలోహ స్వభావం :
అలోహ స్వభావం పెరుగుతుంటే ఎలక్ట్రాన్ ఎఫినిటి విలువలు పెరుగుతాయి.
ప్రశ్న 7.
నవీన ఆవర్తన పట్టికలో గ్రూపులు, పీరియడ్ లో మూలకాలను ఎలా అమర్చినారు? ఒకే గ్రూపులోని మూలకాలు వాని ధర్మాలలో సారూప్యతను ప్రదర్శిస్తాయి కానీ ఒకే పీరియడులోని మూలకాలు వాటి ధర్మాలలో సారూప్యతను ప్రదర్శించవు. దీనికి కారణం రాయండి.
జవాబు:
- నవీన ఆవర్తన పట్టికలో గ్రూపులను, పీరియడ్లను ఎలక్ట్రాన్ విన్యాసాల ఆధారంగా అమర్చడం జరిగింది.
- మూలకాల భౌతిక రసాయన ధర్మాలు వాటి బాహ్యకక్ష్య విన్యాసముతో సంబంధం కలిగి ఉంటాయి.
- ఒకే గ్రూపులో ఉన్న మూలక పరమాణువులు ఒకే బాహ్యకక్ష్య ఎలక్ట్రాన్ విన్యాసం కల్గి ఉంటాయి.
- కావున ఆవర్తన పట్టికలోని గ్రూపులో పై నుండి కిందికి పోయే కొద్ది ఆ మూలకాలన్నీ ఒకే రసాయన ధర్మాలను ప్రదర్శిస్తాయి మరియు వాటి భౌతిక ధర్మాలలో క్రమమైన మార్పు కనిపిస్తుంది.
- పీరియలలో ఎడమ నుండి కుడికి పోయేకొద్ది మూలకాల పరమాణు సంఖ్య ఒక యూనిట్ చొప్పున పెరుగుతూ ఉంటుంది.
- అందువల్ల పీరియడ్ లో ఏ రెండు మూలకాల బాహ్యకక్ష్య విన్యాసం ఒకేలా ఉండదు.
- ఈ కారణం చేత పీరియలో, మూలకాల రసాయన ధర్మాలు వేర్వేరుగా ఉంటాయి. కాని భౌతిక ధర్మాలలో క్రమమైన మార్పు కనిపిస్తుంది.
ప్రశ్న 8.
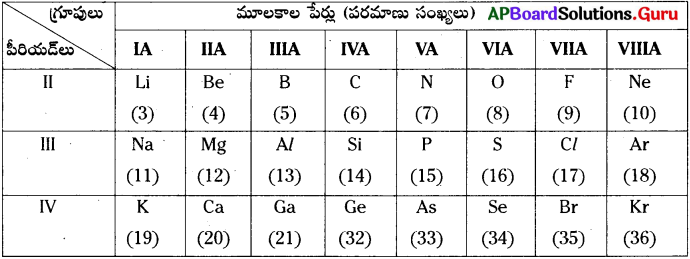
పై సమాచారం ఆధారంగా కింది ప్రశ్నలకు జవాబులు రాయండి.
i) పై మూలకాలలో పరమాణు పరిమాణం అత్యధికంగా గల మూలకం ఏది?
జవాబు:
పరమాణు పరిమాణం అత్యధికంగా గల మూలకం K (పొటాషియం).
ii) అయానిక బంధం ఏర్పరచగల ఏవేని రెండు మూలకాల జతలను రాయండి.
జవాబు:
Na, Cl; Mg, Cl మొదలగునవి.
iii) వేలన్సీ 2 గా గల రెండు మూలకాల పేర్లు రాయండి.
జవాబు:
వేలన్సీ 2గా గల మూలకాలు : Be, Mg, Ca, O, S, Se.
iv) 1s² 2s² 2p6 ఎలక్ట్రాన్ విన్యాసం గల మూలకం ఏది?
జవాబు:
ఆక్సిజన్.
ప్రశ్న 9.
క్రింది పట్టికలోని సమాచారాన్ని పరిశీలించి ప్రశ్నలకు సమాధానాలు రాయండి.
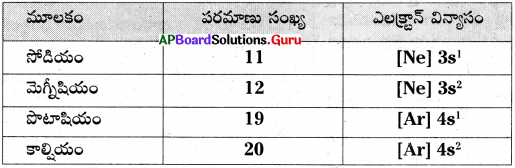
1) మెగ్నీషియం యొక్క వేలన్సీ ఎంత?
2) అధిక ధన విద్యుదాత్మకత గల మూలకం ఏది?
3) మూడవ పీరియడ్ కు చెందిన మూలకాల పేర్లు రాయండి.
4) ఒకటవ గ్రూపునకు చెందిన మూలకాల పేర్లు రాయండి.
జవాబు:
- మెగ్నీషియం యొక్క వేలన్సీ ‘2’.
- అధిక ధన విద్యుదాత్మకత గల మూలకం : పొటాషియం (K).
- మూడవ పీరియడ్ కు చెందిన మూలకాలు : సోడియం (Na), మెగ్నీషియం (Mg).
- ఒకటవ గ్రూపునకు చెందిన మూలకాలు : సోడియం (Na), పొటాషియం (K).
ప్రశ్న 10.
అయనీకరణ శక్మం ఏయే అంశాల మీద ఆధారపడి ఉంటుందో తెలిపి ఏవేని మూడు (3) అంశాలు వివరించండి.
జవాబు:
అయనీకరణ శక్మం ఆధారపడే అంశాలు :
1. కేంద్రక ఆవేశం, 2. స్క్రీనింగ్ లేదా షీల్డింగ్ ఫలితం, 3. ఆర్బిటాళ్ళ చొచ్చుకుపోయే స్వభావం, 4. స్థిరమైన ఎలక్ట్రాన్ విన్యాసం, 5. పరమాణు వ్యాసార్ధం.
1. కేంద్రక ఆవేశం :
కేంద్రకంలో ఆవేశం ఎక్కువగా ఉన్నప్పుడు అయనీకరణ శక్మం విలువ పెరుగుతుంది.
2. స్క్రీనింగ్ లేదా షీల్డింగ్ ఫలితం :
స్క్రీనింగ్ లేదా షీల్డింగ్ ఫలితం పెరిగితే అయనీకరణ శక్మం విలువలు తగ్గుతాయి.
3. ఆర్బిటాళ్ళ చొచ్చుకుపోయే స్వభావం :
ఆర్బిటాళ్ళ చొచ్చుకుపోయే స్వభావం పెరిగితే అయనీకరణ శక్మం విలువలు పెరుగుతాయి.
4. స్థిరమైన ఎలక్ట్రాన్ విన్యాసం :
పరమాణువు స్థిరమైన ఎలక్ట్రాన్ విన్యాసం కలిగి ఉంటే అయనీకరణ శక్మం విలువ ఎక్కువ అవుతుంది.
5. పరమాణు వ్యాసార్థం :
పరమాణు వ్యాసార్థం పెరిగేకొలదీ అయనీకర , శక్మం విలువలు తగ్గుతాయి.
ప్రశ్న 11.
మూలకాల ఆవర్తన పట్టికలో రెండవ పీరియడ్ కు చెందిన కొన్ని మూలకాలు, వాటి పరమాణు వ్యాసార్ధాలు కింద ఇవ్వబడ్డాయి. వాటిని పరిశీలించి సమాధానాలు రాయండి.

అ) పై మూలకాలను పరమాణు వ్యాసార్ధాల ఆరోహణ క్రమంలో రాయండి.
ఆ) 2వ పీరియడ్ లోని మూలకాలలో జడవాయు విన్యాసానికి దగ్గరగా ఉన్న మూలకం ఏది?
ఇ) ఈ మూలకాలన్నింటిలో బాహ్యకక్ష్య ఏమిటి?
ఈ) బెరీలియం, కార్బన్లలో ఏ మూలకపు పరమాణు పరిమాణం ఎక్కువ? ఎందుకు?
జవాబు:
అ) పరమాణు వ్యాసార్ధాల పరముగా మూలకాల యొక్క ఆరోహణ క్రమము O, N, C, B, Be మరియు Li.
ఆ) లిథియంకు జడవాయువైన హీలియం ఎలక్ట్రాన్ విన్యాసంను కల్గి ఉన్నది.
ఇ) ఇవ్వబడిన మూలకాల యొక్క బాహ్య కర్పరము రెండు.
ఈ) బెరీలియంకు కార్బన్ కంటే ఎక్కువ పరమాణు పరిమాణం కలదు. ఎందుకనగా, ఒక పీరియడ్ లో అడ్డముగా పోవుచున్న పరమాణు సంఖ్య పెరుగును. కావున కేంద్రక ఆవేశం పెరుగును. కార్బన్ కంటే బెరీలియంకు పరమాణు పరిమతం ఎక్కువ.
ప్రశ్న 12.
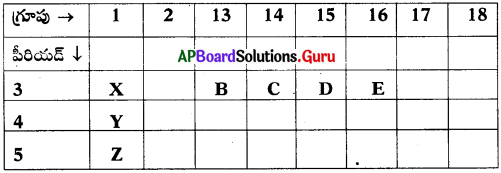
పై ఆవర్తన పట్టిక భాగాన్ని ఉపయోగించి, ఈ కింది ప్రశ్నలకు సమాధానాలివ్వండి.
అ) కనిష్ఠ పరమాణు పరిమాణం కల మూలకం
ఆ) B మరియు E మూలకముల ఎలక్ట్రాన్ విన్యాసాలు రాయండి.
ఇ) Y మూలకం యొక్క భౌతిక, రసాయనిక ధర్మాలతో సారూప్యతను కలిగిన మూలకాలను గుర్తించండి.
ఈ) పట్టికలోని అన్ని మూలకాలను వాటి ఋణ విద్యుదాత్మకత పెరిగే క్రమంలో రాయండి.
జవాబు:
అ) ‘E’ అను మూలకము కనిష్ఠ పరమాణు పరిమాణంను కల్గి ఉన్నది. ఎందుకనగా ఆవర్తన పట్టిక యొక్క పీరియడ్లలో ఎడమ నుండి కుడికి పోయేకొలది పరమాణు పరిమాణం కనిష్ఠము.
ఆ) ‘B’ యొక్క ఎలక్ట్రాన్ విన్యాసము 1s² 2s² 2p63s² 3p¹. కారణమేమనగా ఈ మూలకము 13 వ గ్రూపుకు చెందినది. ఈ గ్రూపు ఎలక్ట్రాన్ విన్యాసము ns² np¹ మరియు ఇది 3 వ పీరియడకు చెందినది. దీని పరమాణు సంఖ్య 13. అదే విధముగా ‘E’ యొక్క ఎలక్ట్రాన్ విన్యాసము 1s² 2s² 2p+ 3s² 3p4 కారణమేమనగా ఈ మూలకం 16వ గ్రూపుకు చెందినది. దీని సాధారణ ఎలక్ట్రాన్ విన్యాసము ns² np4 మరియు 3 వ పీరియడక్కు చెందినది కావున దీని పరమాణు సంఖ్య 16.
ఇ) పట్టికలో Yకు సమాన భౌతిక మరియు రసాయన ధర్మాలు గల మూలకాలు X మరియు Z. కారణమేమనగా ఇవి 1వ గ్రూపుకు చెందిన మూలకాలు. ఒక గ్రూపులోని మూలకాలన్నీ ఒకే భౌతిక మరియు రసాయన ధర్మాలను ప్రదర్శిస్తాయి.
ఈ) Z < Y< X< B < C < D < E.
![]()
ప్రశ్న 13.
ఒక మూలక పరమాణువు A యొక్క ఎలక్ట్రాన్ విన్యాసం 2, 8, 6
అ) A మూలకం యొక్క పరమాణు సంఖ్య ఎంత?
ఆ) మూలకం A యొక్క పరమాణు పరిమాణం, పరమాణుసంఖ్య 14 గా గల మూలకం యొక్క పరమాణు పరిమాణం కంటే ఎక్కువ ఉంటుందా? తక్కువగా ఉంటుందా? తెలపండి. ఎందుకు?
ఇ) A అనే మూలకం C (6), N(7), Ar (18), 0(8) మూలకాలలో దేనితో రసాయనిక ధర్మాల సారూప్యతను కలిగివుంటుంది? ఎందుకు?
ఈ) మూలకం A తన సమీప జడవాయువు విన్యాసాన్ని ఎలా పొందగలదు?
జవాబు:
ఇచ్చిన మూలక పరమాణువు ‘A’ యొక్క ఎలక్ట్రాన్ విన్యాసము 2, 8, 6.
అ) ఇవ్వబడిన మూలకం A యొక్క పరమాణు సంఖ్య 16.
పరమాణు సంఖ్య ’16’ గా గల మూలకము సల్ఫర్.
ఆ) పరమాణు సంఖ్య 14గా గల మూలకం సిలికాన్. సల్ఫర్ మూలకము సిలికాన్ కన్నా తక్కువ పరిమాణంను కల్గి ఉండును. ఎందుకనగా పీరియడ్లలో ఎడమ నుండి కుడికి పోవుకొలది పరమాణు వ్యాసార్ధం తగ్గును.
ఇ) ‘A’ అనే మూలకము ఆక్సిజన్ O(8) తో రసాయనిక ధర్మాల సారూప్యతను కల్గి ఉండును. ఎందుకనగా ఆక్సిజన్ మరియు సల్ఫర్లు ఒకే గ్రూపుకు చెందిన మూలకాలు కాబట్టి.
ఈ) మూలకం ‘A’ తన సమీప జడవాయువైన ఆర్గాన్ యొక్క జడవాయువు విన్యాసమును పొందేందుకు రెండు ఎలక్ట్రాన్లను స్వీకరించాలి.
ప్రశ్న 14.
మెండలీవ్ ఆవర్తన పట్టిక ద్వారా రసాయనశాస్త్ర అధ్యయనానికి కలిగిన లాభాలను వివరించండి.
జవాబు:
- మెండలీవ్ పాటించిన అసాధారణ ఆలోచనా విధానం, మిగిలిన రసాయన శాస్త్రవేత్తలందరినీ మెండలీవ్ ఆవర్తన పట్టికను అంగీకరించేలా, గుర్తించేలా సహాయపడింది.
- మెండలీవ్ ఆవర్తన పట్టికకు, ఆయన ప్రతిపాదించిన ఆవర్తన నియమానికి గొప్ప గుర్తింపు లభించింది.
- మెండలీవ్ తన ఆవర్తన పట్టికను పరిచయం చేసే కాలంలో కనీసం ఎలక్ట్రాన్ కూడా కనుగొనబడలేదు.
- చెల్లాచెదురుగా ఉన్న వంటశాల వంటి రసాయన శాస్త్ర అధ్యయనానికి ఒక శాస్త్రీయ ఆధారాన్ని అందించింది.
- ఇతని గౌరవార్థం 101వ మూలకమునకు “మెండలీవియం” అని పేరు పెట్టారు.
ప్రశ్న 15.
మెండలీవ్ ఆవర్తన పట్టికలోని ముఖ్యాంశాలను పేర్కొనుము.
జవాబు:
మెండలీవ్ ఆవర్తన పట్టికలోని ముఖ్యాంశాలు :
గ్రూపులు మరియు ఉపగ్రూపులు :
మెండలీవ్ ఆవర్తన పట్టికలో 8 నిలువు వరుసలున్నాయి. వీటిని ‘గ్రూపులు’ అంటారు. వీటిని I నుండి VIII వరకు రోమన్ సంఖ్యలతో సూచిస్తారు. ప్రతి గ్రూపు A మరియు B అనే రెండు ఉపగ్రూపులుగా విభజించబడినది. ఏదైనా ఉపగ్రూపులోని మూలకాలన్నీ ఒకదానికొకటి రసాయన ధర్మాల్లో దగ్గరి సంబంధముంటుంది.
పీరియడ్లు :
మెండలీవ్ ఆవర్తన పట్టికలోని అడ్డు వరుసలను ‘పీరియడ్లు’ అంటారు. వీటిని 1 నుండి 7 వరకు అరబిక్ సంఖ్యలచే సూచిస్తారు. ఒక పీరియడ్ లోనున్న మూలకాలన్నింటిలో ఒకేరకమైన ధర్మాలు పునరావృతమవుతుంటాయి.
అప్పటివరకు తెలియని మూలకాల ధర్మాలను ఊహించడం :
ఆవర్తన పట్టికలో మూలకాల అమరిక ఆధారంగా మెండలీవ్ కొన్ని మూలకాలు లభ్యం కావడం లేదని గుర్తించి, వాటికోసం పట్టికలో నిర్దిష్ట స్థానాలలో ఖాళీ గడులను వదిలాడు.
పరమాణు ద్రవ్యరాశి సరిచేయడం :
మెండలీవ్ ఆవర్తన పట్టికలో మూలకాలను సరైన స్థానంలో ఉంచడం ద్వారా కొన్ని మూలకాల పరమాణు ద్రవ్యరాశిని సరిచేయుటకు వీలు కలిగింది.
అసంగత శ్రేణులు :
టెలూరియం (Te), అయొడిన్ (I) వంటి కొన్ని అసంగత శ్రేణులను మెండలీవ్ పట్టికలో గమనించవచ్చు.
ప్రశ్న 16.
నవీన ఆవర్తన పట్టికలో పీరియడ్ల నిర్మాణాన్ని వివరించండి.
జవాబు:
ఆవర్తన పట్టికలో అడ్డు వరుసలను పీరియడ్లు అంటారు. ఇవి మొత్తం 7 ఉన్నాయి.
1) ఏదైనా మూలకపు పరమాణువులో ఎన్ని ప్రధాన కక్ష్యలున్నాయో ఆ సంఖ్య ఆ మూలకం ఏ పీరియడ్ కు చెందుతుంగో తెలియజేస్తుంది.
ఉదా : H, He లలో ఒకే ప్రధానకక్ష్య (K) ఉంటుంది. కావున ఇవి 1వ పీరియడ్ కు చెందుతాయి.
2) ఒక పీరియడ్లో ఉండే మూలకాల సంఖ్య, మూలక పరమాణువుల యొక్క వివిధ కక్ష్యల్లో ఎలక్ట్రాన్లు నిండే విధానంపై ఆధారపడి ఉంటుంది.
ఉదా : మొదటి కక్ష్య (K) లో ఒకే ఉపకక్ష్య (18) ఉన్నది. దీనిలో రెండు ఎలక్ట్రాన్లు మాత్రమే నింపగలము. కావున మొదటి పీరియడ్లో 2 మూలకాలు మాత్రమే ఉన్నాయి.
3) రెండవ పీరియడ్ రెండవ ప్రధానకక్ష్య (C) తో మొదలవుతుంది. దీనిలో 28, 2p అనే రెండు ఉపకక్ష్యలుంటాయి. వీటిలో 8 ఎలక్ట్రాన్లు నింపవచ్చు. కావున 2వ పీరియడ్లో 8 మూలకాలు ఉంటాయి.
4) ఇదే విధంగా 3, 4, 5 పీరియడ్లలో వరుసగా 8, 18, 18 వంతున మూలకాలు ఉంటాయి.
5) 6వ పీరియడ్ లో 32 మూలకాలు (55Cs నుండి 86Rn) వరకు ఉంటాయి.
6) 7వ పీరియడ్ అసంపూర్తిగా నిండి ఉంటుంది.
7) 6వ పీరియడకు చెందిన ‘4f ‘ మూలకాలను లాంథనైళ్లు అని, 7వ పీరియడ్కు చెందిన ‘5f ‘ మూలకాలను ఆక్టి లు అని అంటారు. వీటిని ఆవర్తన పట్టికలో విడిగా ఉంచారు.
ప్రశ్న 17.
ఆధునిక ఆవర్తన పట్టికలోని మూలకాలను s, p, d, f బ్లాకులుగా ఎలా విభజించారు?
జవాబు:
మూలకం యొక్క పరమాణువులో చిట్టచివరి ఎలక్ట్రాన్ ఏ ఉపకక్ష్యలో చేరుతుందో దానిని ఆధారంగా చేసుకొని మూలకాలను s, p, d, f బ్లాకులుగా వర్గీకరించారు.
- సోడియం (Na) ఎలక్ట్రాన్ విన్యాసం : 1s² 2s² 2p6 3s¹ దీనిలో చిట్టచివరి ఎలక్ట్రాన్ ‘S’ ఆర్బిటాల్ లో ఉన్నది. కావున ఇది ‘S’ బ్లాకుకు చెందుతుంది.
- అదే విధంగా (AI) ఎలక్ట్రాన్ విన్యాసం : 1s² 2s² 2p6 3s² 3p¹ ఇది ‘p’ బ్లాకుకు చెందుతుంది.
- స్కాండియం (SC) ఎలక్ట్రాన్ విన్యాసం : 1s² 2s² 2p6 3s² 3p6 4s² 3d¹. ఇది ‘d’ బ్లాకుకు చెందుతుంది.
- సెలెరియం (Ce) ఎలక్ట్రాన్ విన్యాసం : 1s² 2s² 2p6 3s² 3p6 3d10 4s² 4p6 4d10 5s² 5p6 6s² 4f¹. కావున ఇది ‘f ‘ బ్లాకుకు చెందుతుంది.
10th Class Physics 7th Lesson మూలకాల వర్గీకరణ – ఆవర్తన పట్టిక ½ Mark Important Questions and Answers
1. అధిక మరియు అల్ప ఋణవిద్యుదాత్మకత కలిగిన మూలకాలు వరుసగా
A) ఆక్సిజన్, ఫ్లోరిన్
B) ఫ్లోరిన్, ఆక్సిజన్
C) ఫ్లోరిన్, సీజియం
D) కార్బన్, ఫ్లోరిన్
జవాబు:
C) ఫ్లోరిన్, సీజియం
2. ‘భౌతిక, రసాయన మార్పుల ద్వారా ఏదైనా పదార్థాన్ని అంతకంటే మరింత సూక్ష్మ పదార్థంగా విభజించలేమో దానిని మూలకం అంటారు’ అని చెప్పిన వారు ఎవరు?
జవాబు:
రాబర్ట్ బాయిల్
3. మొట్టమొదటగా మూలకాలను వర్గీకరించిన శాస్త్రవేత్త ఎవరు?
జవాబు:
డాబరీనర్
4. డాబర్ నీర్ మూలకాల వర్గీకరణలో ఒక సమూహంలో ఉండే మూలకాలు ఎన్ని?
జవాబు:
మూడు
![]()
5. డాబర్ నీర్ వర్గీకరించిన మూలకాల సమూహాలను ఏమందురు?
జవాబు:
త్రికములు
6. ఊబర్ నీర్ త్రికములకు ఉదాహరణ ఇమ్ము.
జవాబు:
- లిథియం-సోడియం-పొటాషియం (Li – Na – K)
- కాల్షియం -స్ట్రాన్షియం -బేరియం (Ca – Sr- Ba)
- క్లోరిన్-బ్రోమిన్-అయోడిన్ (Cl – Br – I)
- సల్ఫర్ – సెలీనియం-టెలూరియం (S – Se – Te)
- మాంగనీస్-క్రోమియం -ఇనుము (Mn – Cr – Fe)
7. మూలకాలను త్రికములుగా వర్గీకరించినవారు
A) న్యూలాండ్స్
B) డాబరీనర్
C) బాయిల్
D) మోస్లే
జవాబు:
B) డాబరీనర్
8. డాబరనీర్ త్రికములో మొదటి, చివరి మూలకాల పరమాణు భారాలు వరుసగా 7 మరియు 39 అయిన, మధ్య మూలకం పరమాణు భారం ఎంత వుంటుందో ఊహించండి.
జవాబు:
23
9. మూలకాలకు మొదటిసారిగా పరమాణు సంఖ్యలను కేటాయించిన వారు ఎవరు?
జవాబు:
న్యూలాండ్స్
10. న్యూలాండ్స్ మూలకాల వర్గీకరణలో అనుసరించిన నియమం ఏమిటి?
జవాబు:
అష్టక నియమం
11. అష్టక నియమం ప్రకారం మొదటి మూలకం మరియు ఎన్నవ మూలకం ఒకే ధర్మాలను కలిగి ఉంటాయి?
జవాబు:
ఎనిమిదవ
12. న్యూలాండ్స్ ప్రకారం సమానమైన ధర్మాలు గల రెండు మూలకాలు రాయుము.
జవాబు:
ఫ్లోరిన్, క్లోరిన్ లేదా సోడియం , పొటాషియం
13. అష్టక నియమం ఏ మూలకం వరకు సరిగ్గా వర్తిస్తుంది?
జవాబు:
కాల్షియం (Ca)
14. జతపరచుము.
a) ఒకే గడిలో రెండు మూలకాలు గల పట్టిక i) న్యూలాండ్స్
b) ఖాళీ గడులు గల పట్టిక ii) డాబరనీర్
iii) మెండలీవ్
జవాబు:
a – i, b – iii
15. ఎవరి మూలకాల అమరిక పట్టికలో కోబాల్ట్, నికెలు ఒకే గడిలో ఉంచబడినవి?
జవాబు:
న్యూలాండ్స్
16. సంగీత స్వరాలలో ఆవర్తనంతో పోల్చదగినట్లు ఉన్న మూలకాల వర్గీకరణ
A) న్యూలాండ్స్
B) డాబరీనర్
C) మెండలీవ్
జవాబు:
A) న్యూలాండ్స్
17. మెండలీవ్ ఆవర్తన పట్టికలో నిలువు వరుసలు ఎన్ని?
జవాబు:
‘8’
18. మెండలీవ్ గ్రూపులలో మూలకాల సారూప్యతలను దేని ఆధారంగా వివరించడానికి ప్రయత్నించాడు?
జవాబు:
ఉమ్మడి సంయోజకతను
19. మెండలీవ్ ఆవర్తన నియమం రాయుము.
జవాబు:
మూలకాల భౌతిక, రసాయన ధర్మాలు వాటి పరమాణు భారాల ఆవర్తన ప్రమేయాలు.
20. మెండలీవ్ ఆవర్తన పట్టికలో పీరియడ్లు ఎన్ని?
జవాబు:
‘7’
21. అప్పటి వరకు తెలియని మూలకాల ధర్మాలను ఊహించిన శాస్త్రవేత్త ఎవరు?
A) న్యూలాండ్స్
B) మెండలీవ్
C) మోస్లే
D) పైవారందరూ
జవాబు:
B) మెండలీవ్
22. మెండలీవ్ ప్రకారం జతపరుచుము.
a) గ్రూపు – 1 ( ) i) R2O3
b) గ్రూపు – 2 ( ) ii) R2O
c) గ్రూపు – 3 ( ) iii) RO
జవాబు:
a – ii, b – iii, c – i
![]()
23. క్రింది వానిని జతపరుచుము.
a) ఎకా-బోరాన్ ( ) i) గాలియం
b) ఎకా-అల్యూమినియం ( ) ii) స్కాండియం
c) ఎకా-సిలికాన్ ( ) iii)జెర్మేనియం
జవాబు:
a-i, b – ii, c – iii
24. మెండలీవ్ ఇలా చెప్పాడు “నేను దానిని నా అరచేతిలో పట్టుకుంటే కరిగిపోతుంది”. అది ఏ మూలకమో ఊహించండి.
A) స్కాండియం
B) జెర్మేనియం
C) గాలియం
D) సీజియం
జవాబు:
C) గాలియం
25. మెండలీవ్ ఆవర్తన పట్టికలో మూలకాలను సరియైన స్థానంలో ఉంచడం ద్వారా క్రింది మూలకం యొక్క పరమాణు ద్రవ్యరాశిని సరిచేయడం జరిగింది.
a) బెరీలియం
b) ఇండియం
c) బంగారం
d) పైవన్నీ
జవాబు:
d) పైవన్నీ
26. పరమాణు భారాన్ని కనుగొనుటకు మెండలీవ్ అనుసరించిన సూత్రం రాయండి.
జవాబు:
పరమాణు భారం = తుల్యాంక భారం × సంయోజకత
27. ఒక పరమాణువు తుల్యాంక భారం, సంయోజకతలు వరుసగా 4.5, 2 లు. అయిన దాని పరమాణు భారం ఎంత?
జవాబు:
9 (∵ 4.5 x 2)
28. మెండలీవ్ అసంగతశ్రేణికి ఉదాహరణనిమ్ము.
జవాబు:
టెలూరియంను అయోడిన్ కన్నా ముందు ఉంచడం.
29. మెండలీవ్ పేరుపై ఉన్న మూలకం పరమాణు సంఖ్య ఎంత?
జవాబు:
101 (మెండలీవియం)
30. మెండలీవ్ ఆవర్తన పట్టికలోని ఒక పరిమితిని రాయండి.
జవాబు:
- అసంగత మూలకాల జతలు (లేదా)
- సారూప్యత లేని మూలకాలను కలిపి ఉంచడం
31. మెండలీవ్ ‘సారూప్యత లేని మూలకాలను కలిపి ఉంచడం’ అనే పరిమితికి ఉదాహరణనిమ్ము.
జవాబు:
VIIA గ్రూపులో క్లోరిన్ అలోహంను ఉంచడం
32. మో` మూలకాల వర్గీకరణకు ప్రతిపాదించిన పరమాణు ధర్మం ఏది?
జవాబు:
పరమాణు సంఖ్య
33. మెండలీవ్ అసంగత మూలకాలు
A) Be – In – Au
B) Te – I
C) A మరియు B
D) రెండూ కావు
జవాబు:
B) Te – I
34. పరమాణువులో ధనావేశిత కణాల సంఖ్యను ఏమంటారు?
జవాబు:
పరమాణు సంఖ్య
35. పరమాణు భారం అనే భావన నుండి పరమాణు సంఖ్య ఆవర్తన నియమంను మార్చిన శాస్త్రవేత్త ఎవరు?
జవాబు:
మోస్లే
36. విస్తృత ఆవర్తన పట్టికను దేని ప్రాతిపదికన నిర్మించారు?
జవాబు:
పరమాణు సంఖ్యలు / ఎలక్ట్రాన్ విన్యాసం
37. విస్తృత ఆవర్తన నియమాన్ని’ రాయుము.
జవాబు:
మూలకాల భౌతిక రసాయన ధర్మాలు, వాటి ఎలక్ట్రాన్ విన్యాసాల ఆవర్తన ప్రమేయాలు.
38. నవీన ఆవర్తన పట్టికలో గ్రూపులు మరియు పీరియడ్ల సంఖ్య ఎంత?
జవాబు:
గ్రూపులు – 18, పీరియడ్లు – 7
39. మూలకాల ప్రధాన క్వాంటం సంఖ్య పెరిగే క్రమంలో అమర్చినవి.
A) పీరియడ్లు
B) గ్రూపులు
C) రెండూ
D) రెండూ కావు
జవాబు:
B) గ్రూపులు
40. a) బాహ్యకక్ష్య ఎలక్ట్రాన్ విన్యాసం గ్రూపులలో ఉన్న మూలకాలకి ఒకేలా ఉంటాయి.
b) ప్రధాన క్వాంటం సంఖ్య పెరిగే క్రమంలో గ్రూపులలో మూలకాలు అమర్చబడ్డాయి.
పై వాక్యంలో ఏది సరియైనది?
జవాబు:
రెండూ (a మరియు b)
41.

ఖాళీ నింపుము.
జవాబు:
d – ఉపకక్ష్య
42. మూలకాల ఆవర్తన పట్టికలో బ్లాలుగా విభజించడానికి ఆధారమైనది
a) పరమాణు పరిమాణం
b) భేదపరిచే ఎలక్ట్రాన్
c) పై రెండూ
d) వేలన్సీ
జవాబు:
b) భేదపరిచే ఎలక్ట్రాన్
43. పీరియాడిక్ టేబుల్ లో గల బ్లాకులు ఎన్ని?
A) 2
B) 4
C) 6
D) 7
జవాబు:
B) 4
![]()
44. క్రింది వానిలో 6 బ్లాక్ మూలకం
A) 11Na
B) 13Al
C) 21SC
D) 58Ce
జవాబు:
A) 11Na
45. 11Na : 1s²2s²2p63s¹. ఈ మూలకం ఏ బ్లాక్ నకు చెందును?
జవాబు:
S – బ్లాక్
46. IUPAC నిర్ణయం ప్రకారం ప్రస్తుతం గ్రూపులను ఎలా సూచిస్తారు?
జవాబు:
1 నుండి 18 (అరబిక్ అంకెలలో)
47. మూలక కుటుంబం అనగానేమి?
జవాబు:
ఒకే గ్రూపులో ఉన్న మూలకాల సమూహం
48. 1(IA) గ్రూపు మూలకాల బాహ్య కక్ష్యలో ఎలక్ట్రాన్ విన్యాసం ఏమిటి?
జవాబు:
ns¹
49. బాహ్యకక్ష్యలో ns² ఎలక్ట్రాన్ విన్యాసం గల మూలకాలను ఏమంటారు?
జవాబు:
క్షారమృత్తిక లోహాల కుటుంబం
50. మూలకాలు Li, Be, B, …… రెండవ పీరియడ్ కు చెందినవి. ఈ మూలకాలలో ఎన్ని ప్రధానకక్ష్యలు ఉంటాయి?
జవాబు:
రెండు (K, L)
51. ఉత్కృష్ట వాయువుల కుటుంబం ఎన్నవ గ్రూపునకు చెందినది?
జవాబు:
18(VIIIA)
52. మొదటి పీరియడ్ లో గల మూలకాలు ఎన్ని? అవి ఏవి?
జవాబు:
2(H, He)
53. మూడవ పీరియడ్ లో ఎన్ని మూలకాలు ఉంటాయి?
జవాబు:
8
54. 3s, 3p, 3d అనే కక్ష్యలు మొదలయ్యే పీరియడ్ సంఖ్య ఎంత?
జవాబు:
3వ పీరియడ్
55. 32 మూలకాలు ఉన్న పీరియడ్ సంఖ్యను ఒకదానిని రాయండి.
జవాబు:
6వ పీరియడ్
56. 4f మరియు 5f మూలకాలను ఏమని పిలుస్తారు?
జవాబు:
4f – లాంథనైడ్లు; 5f – ఆక్టినైన్లు
57. f- బ్లాక్ మూలకాలు ఎన్నవ పీరియలో ఉంటాయి?
జవాబు:
6 మరియు 7వ పీరియడ్లలో
58. ప్రతి పీరియడ్ లో (1 తప్ప) ఎన్ని S – బ్లాక్ మూలకాలు ఉంటాయి?
జవాబు:
‘2’
59. సాధారణంగా లోహ మూలకాలలో బాహ్యకక్ష్యలో ఎన్ని ఎలక్ట్రాన్లు ఉంటాయి?
జవాబు:
1, 2 లేదా 3
60. d- బ్లాక్ మూలకాలను ఏమని పిలుస్తారు?
జవాబు:
పరివర్తన మూలకాలు
61. లాంథనైన్లు, ఆక్టినైళ్లు ఏ గ్రూపునకు చెందుతాయి?
జవాబు:
3(III B)
62. అంతర పరివర్తన మూలకాలని వేనిని అందురు?
జవాబు:
f- బ్లాక్ మూలకాలు (లేదా) లాంథరైలు, ఆక్టినైట్లు.
63. కొన్ని అర్ధలోహాల పేర్లు రాయుము.
జవాబు:
B, Si, As, Ge
64. లోహాలు, అలోహాలు, అర్ధలోహాలు కలిగియున్న బ్లాక్ ఏమిటి?
జవాబు:
‘d’
65. అన్నీ లోహాలు గల బ్లాక్ ఏమిటి?
జవాబు:
S – బ్లాక్
66. A – పీరియడ్ లో ఉన్న మూలకాలన్నీ ఒకే రసాయన ధర్మాలను ప్రదర్శిస్తాయి.
R – ఒకే గ్రూపులో ఉన్న మూలకాలన్నీ ఒకే బాహ్యకక్ష్య ఎలక్ట్రాన్ విన్యాసం కలిగి ఉంటాయి.
A) A, R లు సరైనవి
B) A మాత్రమే సరైనది
C) R మాత్రమే సరైనది
D) A, Rలు సరైనవి కావు
జవాబు:
C) R మాత్రమే సరైనది
67. జతపరుచుము.
a) 58Ce – 71Lu ( ) i) ఆక్టినాయిడ్లు
b) 90Th – 103Lr ( ) ii) లాంథనాయిడ్లు
జవాబు:
a – ii, b – i
68. ఒక మూలకం యొక్క సంయోగ సామర్థ్యాన్ని ఏమంటారు?
జవాబు:
సంయోజకత
69. ఏదైనా ఒక మూలక పరమాణువు ఎన్ని ………… పరమాణువులతో సంయోగం చెందగలదో ఆ సంఖ్యను
ఆ పరమాణువు యొక్క సంయోజకత అంటారు.
A) ఆక్సిజన్
B) హైడ్రోజన్
జవాబు:
B) హైడ్రోజన్
70. NaH లో Na యొక్క వేలన్సీ ఎంత?
జవాబు:
1
71. Ca0 లో Ca యొక్క వేలన్సీ ఎంత?
జవాబు:
2
![]()
72. గ్రూపు సంఖ్య V కన్నా ఎక్కువ ఉండే గ్రూపు మూలకాలకు సంయోజకతను ఎలా లెక్కిస్తారు?
జవాబు:
8 – గ్రూపు సంఖ్య
73. పీరియాడిక్ టేబుల్ లో ప్రతి పీరియడ్ లో మొదటి, చివరి మూలకాల వేలన్సీలను రాయండి.
జవాబు:
మొదటి మూలకం – 1, చివరి మూలకం – 0
74. పరమాణు వ్యాసార్ధాన్ని ఏ ప్రమాణాలలో కొలుస్తారు?
జవాబు:
పికోమీటర్ (pm)
75. 1 pm = ……………..m.
జవాబు:
10-12
76. a) Cu ( ) i) లోహ వ్యాసార్ధం
b) Cl ( ) ii) సమయోజనీయ వ్యాసార్ధం
జవాబు:
a – i, b – ii
77. ఆవర్తన పట్టికలోని గ్రూప్ లో పై నుండి క్రిందికి పోయే కొద్దీ పరమాణు వ్యాసార్ధం ఎలా మారుతుంది?
జవాబు:
పెరుగుతూ వుంటుంది
78. a) ఒక పీరియడ్లో ఎడమ నుండి కుడికి పోయేకొద్దీ పరమాణు సంఖ్యతో పాటు కేంద్రకావేశం పెరుగుతుంది.
b) వీరియలో భేదాత్మకత ఎలక్ట్రాన్లు ఒకే బాహ్యకక్ష్యలో చేరుతాయి.
c) పీరియలో ఎలక్ట్రాన్ కక్ష్యలు మారవు.
d) పీరియలో పరమాణు వ్యాసార్ధం తగ్గుతుంది.
పై వానిలో సరికాని వాక్యం ఏది?
జవాబు:
ఏదీ లేదు.
79. Na మరియు Na+ లలో ఏది ఎక్కువ పరిమాణం గలది?
జవాబు:
Na
80. Na+ బాహ్యకక్ష్య ఎలక్ట్రాన్ విన్యాసం రాయుము.
జవాబు:
2s² 2p6
81. Cl మరియు Cl– లలో ఎక్కువ సైజ్ గలది. ఏది?
జవాబు:
Cl–
82. Cl– మరియు Cl ల మధ్య దేనికి తక్కువ కేంద్రక ఆకర్షణ ఉంటుంది?
జవాబు:
Cl–
83. A : క్లోరిన్ పరిమాణం, క్లోరిన్ ఆనయాన్ పరిమాణం తో పోల్చితే తక్కువగా ఉంటుంది.
R : క్లోరిన్ పరమాణువుతో పోల్చితే క్లోరిన్ అయాన్ లోని ఎలక్ట్రాన్లపై కేంద్రకావేశం తక్కువగా ఉంటుంది.
A) A, R లు సరైనవి, A ని R సమర్థించును.
B) A, R లు సరైనవి, A ని R సమర్ధించదు.
C) A మాత్రమే సరియైనది.
D) R మాత్రమే సరియైనది.
జవాబు:
A) A, R లు సరైనవి, A ని R సమర్థించును.
84. క్లోరిన్ ఎలక్ట్రాన్ విన్యాసం 1s²2s²2p63s² 3p5 అయిన క్లోరిన్ ఆనయాన్ విన్యాసం ఎంత?
జవాబు:
1s²2s²2p63s²3p6
85. మూలకం యొక్క బాహ్యకక్ష్య నుండి ఒక ఎలక్ట్రాన్ తీసివేయడానికి కావల్సిన శక్తిని ఏమందురు?
జవాబు:
అయనీకరణ శక్తి
86. M+(g) + I.E. → M+2(g) + e– దీనిలో I.E
A) మొదటి అయనీకరణ శక్తి
B) రెండవ అయనీకరణ శక్తి
C) A లేదా B
D) ఏదీకాదు
జవాబు:
B) రెండవ అయనీకరణ శక్తి
87. అయనీకరణ శక్తి ఆధారపడని అంశం
A) కేంద్రక ఆవేశం
B) స్క్రీనింగ్ ఫలితం
C) పరమాణు వ్యాసార్ధం
D) ఏదీకాదు
జవాబు:
D) ఏదీకాదు
88. 11Na మరియు 17Cl లలో దేనికి అయనీకరణ శక్తి ఎక్కువ?
జవాబు:
17Cl
89. 11Na మరియు 17Cl లలో దేనికి కేంద్రక ఆకర్షణ శక్తి ఎక్కువ?
జవాబు:
17Cl
90. 4s, Ap, 4d, 4f లలో కేంద్రకం వైపుకు చొచ్చుకుపోయే స్వభావాన్ని అవరోహణ క్రమంలో రాయండి.
జవాబు:
4s > 4p > 4d > 4f
91. A, B అనే మూలకాలు బాహ్యకక్ష్యలలో 2s మరియు 2p అనే ఆర్బిటాళ్ళు కలవు. అయితే A, B లలో దేని యొక్క అయనీకరణ శక్తి తక్కువ?
జవాబు:
‘B’
92. బెరీలియం మరియు బోరాన్లో దేనికి అయనీకరణ శక్తి తక్కువ?
జవాబు:
బోరాన్
93. ఆక్సిజన్ : 1s22s22p4
నైట్రోజన్ : 1s22s22p3
• పై వానిలో దేని యొక్క అయనీకరణ శక్తి తక్కువ?
జవాబు:
ఆక్సిజన్
• పై వానిలో సగం నిండిన ఆర్బిటాల్ దేనిలో ఉంది?
జవాబు:
నైట్రోజన్
94. ఆక్సిజన్ కన్నా నైట్రోజన్ యొక్క అయనీకరణ శక్తి విలువ ఎక్కువ. కారణం
A) కేంద్రక ఆవేశం
B) షీల్డింగ్ ఫలితం
C) ఆర్బిటాల్ చొచ్చుకుపోయే స్వభావం
D) స్థిరమైన ఎలక్ట్రాన్ విన్యాసం
జవాబు:
D) స్థిరమైన ఎలక్ట్రాన్ విన్యాసం
95. అయనీకరణ శక్తికి ప్రమాణం రాయండి.
జవాబు:
KJmol-1 (లేదా) eV atom-1
96. ఏదైనా మూలక పరమాణువు వాయుస్థితిలో ఒంటరిగా తటస్థంగా ఉన్నపుడు అది ఒక ఎలక్ట్రాను గ్రహిస్తే విడుదలయ్యే శక్తిని ఏమంటారు?
జవాబు:
ఎలక్ట్రాన్ ఎఫినిటీ
![]()
97. a) M(g) + e– → M-2 + Q1
b) M(g)+ + Q2 → M+2 + e–
పై వానిలో ఎలక్ట్రాన్ ఎఫినిటీని సూచించేది
A) Q1
B) Q2
C) రెండూ
D) రెండూ కావు
జవాబు:
A) Q1
98. a) లోహాలకు ఎలక్ట్రాన్ ఎఫినిటీ విలువలు ఎక్కువగా ఉంటాయి.
b) ఎలక్ట్రాన్ ఎఫినిటీ విలువలు ఋణాత్మకంగా ఉంటే శక్తి విడుదలవుతుంది.
పై వానిలో సరికాని వాక్యం
జవాబు:
‘a’
99. ఒక మూలక పరమాణువు వేరే మూలక పరమాణువుతో బంధంలో ఉన్నపుడు ఎలక్ట్రాన్లను తనవైపు ఆకర్షించే ప్రవృత్తిని ఆ మూలకం యొక్క …… అంటారు.
A) అయనీకరణ శక్తి
B) ఎలక్ట్రాన్ ఎఫినిటీ
C) ఋణవిద్యుదాత్మకత
D) ధనవిద్యుదాత్మకత
జవాబు:
C) ఋణవిద్యుదాత్మకత
100. మిల్లికన్ ఋణవిద్యుదాత్మకత సూత్రం రాయుము.
జవాబు:
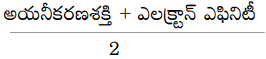
101. బంధశక్తుల ఆధారంగా ఋణవిద్యుదాత్మకతను ప్రతిపాదించినవారు ఎవరు?
జవాబు:
లైనస్ పౌలింగ్
102. హైడ్రోజన్ యొక్క ఋణవిద్యుదాత్మకత ఎంత?
జవాబు:
2.20
103. అత్యధిక ఋణవిద్యుదాత్మకత గల మూలకం ఏది?
జవాబు:
ఫ్లోరిన్
104. అత్యల్ప ఋణవిద్యుదాత్మకత గల స్థిర మూలకం ఏది?
జవాబు:
సీసియం
105. మూడవ పీరియడ్ – Na, Mg, Al, Si, P, S, Cl
1) లోహాలు ఏవి?
జవాబు:
Na, Mg
2) అలోహాలు ఏవి?
జవాబు:
P, S, Cl
3) అర్ధ లోహాలు ఏవి?
జవాబు:
Al, Si
106. IVA (Kosong Swoostev: C, Si, Ge, Sn, Pb
1) లోహాలు ఏవి?
జవాబు:
Sn, Pb
2) అలోహాలు ఏవి?
జవాబు:
C
3) అర్ధలోహాలు ఏవి?
జవాబు:
Si, Ge
107. గ్రూపులలో పై నుండి క్రిందికి పెరిగే ధర్మాలు కొన్నింటిని రాయండి.
జవాబు:
పరమాణు వ్యాసార్ధం, ధన విద్యుదాత్మకత, లోహ స్వభావం
108. పీరియలో ఎడమ నుండి కుడికి తగ్గే మూలక ధర్మాలు రెండింటిని రాయండి.
జవాబు:
పరమాణు వ్యాసార్ధం, ధన విద్యుదాత్మకత, లోహ స్వభావం
109. గ్రూపులలో మారని మూలక ఆవర్తన ధర్మమేది?
జవాబు:
వేలన్సీ
110. A : 1s²2s²
B : 1s²2s²2p63s².
1) A మూలకం ఏ పీరియడ్ కు చెందినది?
జవాబు:
రెండవ
2) B మూలకం ఏ గ్రూపునకు చెందినది?
జవాబు:
రెండవ
3) ‘B’ యొక్క వేలన్సీ ఎంత ?’
జవాబు:
2
111. 2, 8, 7 ఎలక్ట్రాన్ విన్యాసం గల మూలకానికి సారూష్య ధర్మాలు గల ఏదేని మూలకం పేరు రాయుము.
జవాబు:
ఫ్లోరిన్ (Z = 9).
112. 3వ పీరియడ్, 2వ గ్రూపునకు చెందిన మూలక వేలన్సీని ఊహించండి.
జవాబు:
2
10th Class Physics 7th Lesson మూలకాల వర్గీకరణ – ఆవర్తన పట్టిక 1 Mark Bits Questions and Answers
సరియైన సమాధానమును గుర్తించండి.
1. 1వ పీరియడ్ నందు గల మూలకాల సంఖ్య …………..
A) 2
B) 4
C) 6
D) 8
జవాబు:
A) 2
2. అష్టక నియమం పాటింపబడని అణువు …………
A) O2
B) F2
C) BeCl2
D) N2
జవాబు:
C) BeCl2
3. నవీన ఆవర్తన పట్టిక నందు 2వ పీరియడ్ లో గల మూలకాల సంఖ్య
A) 2
B) 18
C) 32
D) 8
జవాబు:
D) 8
![]()
4. క్రింది వానిలో ఏ లోహం అత్యధిక చర్యాశీలత గలది?
A) లిథియం
B) జింక్
C) పొటాషియం
D) రుబీడియం
జవాబు:
D) రుబీడియం
5. గ్రూపులో పై నుండి క్రిందికి వెళ్ళే కొలదీ అయనీకరణ శక్తి విలువ …….
A) పెరుగుతుంది
B) తగ్గుతుంది
C) మారదు
D) చెప్పలేము
జవాబు:
B) తగ్గుతుంది
6. కింది వానిలో అధిక ధనవిద్యుదాత్మకత విలువ గల మూలకం
A) క్లోరిన్
B) కార్బన్
C) ఆక్సిజన్
D) పొటాషియం
జవాబు:
D) పొటాషియం
7. మెండలీవ్ ‘ఏకా-అల్యూమినియం’గా భావించిన మూలకం
A) స్కాండియం
B) గాలియం
C) జెర్మేనియం
D) ఇండియం
జవాబు:
B) గాలియం
8. ఆధునిక ఆవర్తన పట్టికలో నిలువు వరుసల (గ్రూపుల) సంఖ్య (IUPAC విధానంలో)
A) 7
B) 8
C) 10
D) 18
జవాబు:
D) 18
9. కింది వాటిలో డాబరీనర్ త్రికం
A) Cl, Br, I
B) H, He, Li
C) H, Na, Cl
D) C, N, O
జవాబు:
A) Cl, Br, I
10. క్రింది వానిలో డాబరీనర్ త్రికానికి చెందిన పరమాణు భారాల సమూహము
A) 40, 87.5, 120
B) 40, 87.5, 127
C) 40, 77.5, 137
D) 40, 87.5, 137
జవాబు:
D) 40, 87.5, 137
11. క్రింది వాటిలో జడవాయు మూలకపు ఎలక్ట్రాన్ విన్యాసం

జవాబు:
C
12. మెండలీవ్ అసంగతశ్రేణికి ఉదాహరణ
A) టెలూరియం, అయోడిన్
B) సోడియం, పొటాషియం
C) ఎకాబోరాన్, ఎకాసిలికాన్
D) సోడియం, కాల్షియం
జవాబు:
A) టెలూరియం, అయోడిన్
![]()
13. Na, Mg, AI, SI ల పరమాణు సంఖ్యలు వరుసగా 11, 12, 13, 14 అయితే అధిక పరమాణు వ్యాసార్ధం గల మూలకం,
A) Na
B) Mg
C) Al
D) Si
జవాబు:
A) Na
మీకు తెలుసా?
1) మీకు సంగీత స్వరాల గురించి తెలుసా?
భారతీయ సంగీతంలో ఒక స్కేలులో 7 సంగీత స్వరాలుంటాయి. అవి స, రి, గ, మ, ప, ద, ని. పాశ్చాత్య సంగీతంలో do, re, mi, fa, so, la, ti అనే స్వరాలను వాడుతారు. ఒక పాటకు సంగీతంను సమకూర్చడానికి స్వరకర్త (musician) ఈ నోట్లను వాడతాడు. సహజంగా ఈ ‘నోట్’లు పునరావృతమవుతుంటాయి. ప్రతీ ఎనిమిదవ నోట్ మొదటి నోట కు సమానంగా ఉంటుంది. మరియు అక్కడి నుండి కొత్త నోట్ మొదలవుతుంది.
2) ఎకా అల్యూమినియం యొక్క ద్రవీభవనస్థానం గురించి మెండలీవ్ ఇలా చెప్పాడు. “నేను దానిని నా అరచేతిలో పట్టుకుంటే, అది కరిగిపోతుంది.”
ఆ తర్వాత ఎకా అల్యూమినియంగా కనుగొన్న గాలియం యొక్క ద్రవీభవనస్థానం 30.2°C అని కనుగొన్నారు. మన శరీర ఉష్ణోగ్రత 37°C. మెండలీవ్ మూలకాల ధర్మాలను గురించి ఎంత కచ్చితంగా ఊహించాడో కదూ !
3) మెండలీవ్ తన ఆవర్తన పట్టికను పరిచయం చేసే కాలంలో కనీసం ఎలక్ట్రాన్ కూడా కనుగొనబడలేదు. అయినప్పటికీ ఈ ఆవర్తన పట్టిక ఒక చెల్లాచెదురుగా ఉన్న వంటశాల వంటి రసాయనశాస్త్ర అధ్యయనానికి ఒక శాస్త్రీయ ఆధారాన్ని అందించింది. అతని గౌరవార్థం 101వ మూలకానికి ‘మెండలీవియం’ అనే పేరు పెట్టారు.
4. ఆవర్తన పట్టికలో కొన్ని మూలక కుటుంబాలకు ఆ పేరు ఎలా వచ్చిందో మీకు తెలుసా?
1. క్షార లోహాలు :
ఈ కుటుంబంలోని Na, K వంటి మూలకాలను మొక్కల బూడిద నుండి రాబట్టారు. ఆల్కలీ అంటే మొక్కల బూడిద అని అర్థం.
2. చాల్కోజన్లు :
ఈ కుటుంబంలోని అంటే 16 (VI A) వ గ్రూప్ మూలకాలను గనుల. నుండి తవ్వి తీయబడిన లోహాల నుండి రాబట్టారు. చాల్కోజన్లు అంటే ఖనిజ ఉత్పత్తులు అని అర్థం.
3. హాలోజన్లు :
ఈ కుటుంబంలోని అంటే 17 (VII A) గ్రూప్ మూలకాలను సముద్ర లవణాల నుండి రాబట్టారు. ‘హాలోస్’ అంటే సముద్ర లవణం అని అర్థం.
4. ఉతృష్ట వాయువులు :
ఈ కుటుంబంలోని అంటే 18వ (VIII A) వ గ్రూప్ మూలకాలకు రసాయన చర్యాశీలత తక్కువ. దీనికి కారణం బాహ్యకక్ష్యలో పూర్తిగా నిండిన ఆర్బిటాళ్ళు ఉండడమే. వీటిని జడవాయువులు అని కూడా అంటాం.
![]()
5) అయిడ్ (Ide) అనగా సంపద (heir) అని, ఆయిడ్ (Oid) అనగా ‘సమానమైన’ అని అర్థం. ఉదాహరణకు మనం క్లోరిన్ పరమాణువు (Cl)ను క్లోరిన్, దాని అయాన్ Cl– ను క్లోరైడ్ అయాన్ అని పిలుస్తుంటాం కదా! అదే విధంగా లాంథసైడ్స్ (లాంథనమ్ ను పోలినవి), ఆక్టిసైడ్స్ (ఆక్టీనియంను పోలినవి) అనే పేర్లు ప్రాచుర్యం పొందాయి. శాస్త్రవేత్తల్లో కొంతమంది 57La నుండి 70Yb వరకు, మరికొంతమంది 58Ce నుండి 71Lu వరకు ఇంకొందరు 57La నుండి 71Lu వరకు లాంథనైళ్లుగా పరిగణిస్తారు.
21SC మరియు 39Y లను కూడా లాంథనై లుగా పరిగణిస్తున్నారు. ఈ సూచనలన్నీ ఎలక్ట్రాన్ విన్యాసం దృష్ట్యా నిజమైనవే. ఎందుకంటే 21Sc, 39Y మరియు 57La నుండి 71Lu వరకు మూలకాలన్నీ ఒకే బాహ్యకక్ష్య విన్యాసం కలిగి ఉంటాయి. ఆర్టైనైడ్ ల విషయంలో కూడా 90Th నుండి 103Lr వరకు లేదా 98Ac నుండి 102No వరకు లేదా 98Ac నుండి 103Lr వరకు వంటి రకరకాల వాదనలు ఉన్నాయి.