Andhra Pradesh BIEAP AP Inter 1st Year Chemistry Study Material 3rd Lesson రసాయన బంధం – అణు నిర్మాణం Textbook Questions and Answers.
AP Inter 1st Year Chemistry Study Material 3rd Lesson రసాయన బంధం – అణు నిర్మాణం
అతిస్వల్ప సమాధాన ప్రశ్నలు
ప్రశ్న 1.
అష్టక నియమం అంటే ఏమిటి?
జవాబు:
అష్టక నియమము :
“ఒక పరమాణువుకు స్థిరత్వం ఉండాలంటే దాని బాహ్యతమ శక్తిస్థాయిలో ఎనిమిది ఎలక్ట్రాన్లు ఉండాలి అనే సూత్రాన్ని అష్టక నియమం అంటారు.”
ఉదా : సున్నా గ్రూపు మూలకాలకు బాహ్య కక్ష్యలలో ఎనిమిది ఎలక్ట్రాన్లు ఉంటాయి. (స్థిరమైన ఎలక్ట్రాన్ విన్యాసాలు). అందువలన ఈ మూలకాలు చాలా స్థిరమైనవి.
ప్రశ్న 2.
S, S2- లకు లూయీ ఎలక్ట్రాన్ చుక్కల సంకేతాలు రాయండి.
జవాబు:

ప్రశ్న 3.
SO3 కి వీలయినన్ని రెజొనెన్స్ నిర్మాణాలు రాయండి.
జవాబు:
SO3 రెజోనెన్స్ నిర్మాణలు :
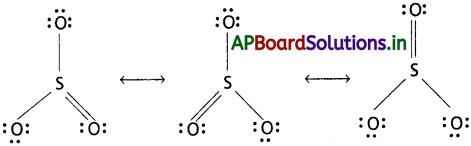
ప్రశ్న 4.
AlCl3 + Cl– → AlCl చర్యలో Al పరమాణువు సంకరకరణంలో మార్పు ఏమైనా ఉంటే ఊహించి రాయండి.
జవాబు:
AlC3 + Cl– → AlCl–4
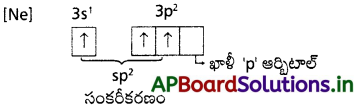
ఎ) AlCl3 నిర్మాణము :
ఉద్రిక్త స్థితిలో ‘A’ విన్యాసము: కేంద్ర పరమాణువైన ‘A’, ‘sp²’ సంకరీకరణానికి లోనవుతుంది. ఏర్పడిన మూడు sp సంకర ఆర్బిటాళ్లు మూడు క్లోరిన్ పరమాణువుల మూడు ‘p’ ఆర్బిటాళ్లతో అతిపాతం జరిపి మూడు σsp²-s బంధాలనేర్పరచును.
‘A’ పరమాణువులో సంకరీకరణంలో పాల్గొనని ఒక శుద్ధ ఖాళీ ‘p’ ఆర్బిటాల్ ఉండును.
బి) Cl– అయాన్ ప్రభావము :
Cl– అయాన్ సమక్షంలో, ‘Al’ పైగల ఖాళీ ‘p’ ఆర్బిటాల్ కూడా సంకరీకరణానికి లోనై, అల్యూమినియం యొక్క సంకరీకరణం sp² నుంచి sp³ కి మారుతుంది. కొత్తగా ఏర్పడిన ఖాళీ sp³ సంకర ఆర్బిటాల్ డేటివ్ బంధం ద్వారా Cl– తో బంధమేర్పరచుకుంటుంది.
సి) AlCl–4 నిర్మాణము :
ఈ అణువులో అల్యూమినియంకు మరియు నాలుగు క్లోరిన్ పరమాణువులకు మధ్య గల బంధాలలో, మూడు బంధాలు సమయోజనీయ బంధాలు మరియు నాల్గవది డేటివ్ బంధము. కేంద్రక ‘Al’ పరమాణువు sp³ సంకరీకరణంలో ఉంటుంది.
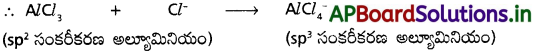
ప్రశ్న 5.
Ca2+, Zn2+ లలో ఏది స్థిరమైనది? ఎందువల్ల?
జవాబు:
అయాన్ల స్థిరత్వాన్ని వాటి ఎలక్ట్రాన్ విన్యాసం ఆధారంగా వివరించవచ్చును.
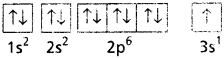
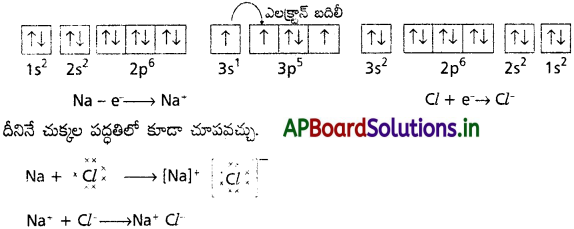
Ca (20) = 1s² 2s² 2p6 3s² 3p6 4s²
Ca+2 = 1s² 2s² 2p6 3s² 3p6
Zn (30) = 1s² 2s²2 2p6 3s² 3p6 4s² 3d10
Zn+2 = 1s² 2s² 2p6 3s² 3p6 3d10
Ca+2 అయాన్కు జడవాయువు అయిన Ar ఎలక్ట్రాన్ విన్యాసము కలదు. దీని బాహ్యకక్ష్యలో అష్టక ఎలక్ట్రాన్ విన్యాసం (ns² np6) ఉండుట వలన దీనికి స్థిరత్వము అధికము.
Zn+2 అయాన్లో బాహ్యకక్ష్యలోని. ఆర్బిటాళ్ళన్నియూ పూర్తిగా ఎలక్ట్రాన్లతో నిండివుండుట వలన దీనికి స్థిరత్వం ఉంటుంది (మిథ్యా జడవాయు విన్యాసము). కానీ బాహ్యకక్ష్యలో అష్టక ఎలక్ట్రాన్ విన్యాసం లేకపోవుటవలన దీని స్థిరత్వం Ca+2 కంటే తక్కువ.
![]()
ప్రశ్న 6.
Cl– అయాను Cl పరమాణువు కంటే స్థిరమైనది. ఎందువల్ల?
జవాబు:
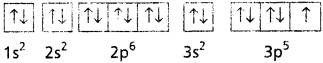
Cl = 1s² 2s² 2p6 3s² 3p5
Cl ̄ = 1s² 2s² 2p6 3s² 3p6
క్లోరిన్ పరమాణువు యొక్క బాహ్యకక్ష్యలో 7 ఎలక్ట్రానులు మాత్రమే కలవు. కానీ క్లోరైడ్ అయాన్ బాహ్యకక్ష్యలో అష్టక ఎలక్ట్రాన్ విన్యాసం (3s² 3p6) కలదు. క్లోరైడ్’ అయాన్కు జడవాయువైన ఆర్గాన్ ఎలక్ట్రాన్ విన్యాసము కలదు. కనుక క్లోరైడ్ అయాన్, క్లోరిన్ పరమాణువు కన్నా స్థిరమైనది.
ప్రశ్న 7.
ఆర్గానన్ను Ar2 గా ఎందుకు రాయకూడదు?
జవాబు:
ఆర్గాన్ నందు కేవలం ఎలక్ట్రాన్ జంటలు మాత్రమే కలవు. దానిలో ఒంటరి ఎలక్ట్రాన్లు లేవు. అందువలన అది వేరొక ఆర్గాన్ పరమాణువుతో బంధములను ఏర్పరచుకొనలేదు.
ప్రశ్న 8.
హైడ్రోజన్ సల్ఫైడ్ కంటే నీటి బాష్పీభవనస్థానం ఎక్కువ. ఎందువల్ల?
జవాబు:
నీటినందు అంతర అణుక హైడ్రోజన్ బంధం ఉంటుంది. అందువలన నీటికి బాష్పీభవన స్థానం ఎక్కువగా ఉంటుంది.
ప్రశ్న 9.
నీటి బాష్పీభవన స్థానం హైడ్రోజన్ ఫ్లోరైడ్ బాష్పీభవన స్థానం కంటే ఎక్కువ. ఎందువల్ల?
జవాబు:
HF లో ప్రతి ఫ్లోరిన్ పరమాణువు ఒక హైడ్రోజన్ బంధాన్ని మాత్రమే ఏర్పరచగలదు.
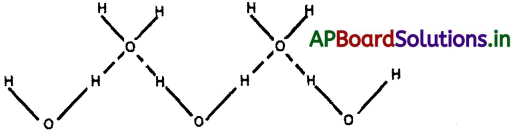
H2O లో ప్రతి ఆక్సిజన్ పరమాణువు రెండు హైడ్రోజన్ బంధాలను ఏర్పరుస్తుంది.
HF లో కన్నా H2O లో హైడ్రోజన్ బంధాల సంఖ్య అధికంగా ఉండుట వలన H2O యొక్క బాష్పీభవన ఉష్ణోగ్రత HF కంటే అధికంగా వుంటుంది.
H2O బాష్పీభవనం చెందించటానికి కావలసిన శక్తి, HF ను బాష్పీభవనం చెందించటానికి కావలసిన శక్తి కంటే ఎక్కువ. అందువలన H2O బాష్పీభవన స్థానం ఎక్కువ.
ప్రశ్న 10.
ఒక పరమాణువు చుట్టూ నాలుగు బంధజంటల ఎలక్ట్రాన్లుంటే వాటి మధ్య కనిష్ట వికర్షణలు ఉండేటట్లు ఎట్లా అమర్చాలి?
జవాబు:
ఒక పరమాణువు చుట్టూ నాలుగు బంధ జంటల ఎలక్ట్రాన్లుంటే వాటి మధ్య కనిష్ట వికర్షణలు ఉండేటట్లు అమర్చాలంటే టెట్రాహెడ్రల్ ఆకృతిలో అమర్చాలి. (బంధకోణం 109°.28′)
![]()
ప్రశ్న 11.
A, B లు రెండు వేర్వేరు పరమాణువులయితే అవి AB అణువునిస్తే ఆ అణువులో సమయోజనీయ బంధం ఎప్పుడు ఉంటుంది?
జవాబు:
A, B ల ఋణ విద్యుదాత్మక విలువల మధ్య భేదం 1.7 కంటే ఎక్కువగా ఉన్నపుడు సంయోజనీయ బంధం ఏర్పడుతుంది.
ప్రశ్న 12.
స్థానీకృత ఆర్బిటాళ్ళు అంటే ఏమిటి?
జవాబు:
సమయోజనీయ బంధం ఏర్పడునపుడు అతిపాతం జరిగిన ఆర్బిటాళ్ళను స్థానీకృత ఆర్బిటాళ్ళు అంటారు.
ప్రశ్న 13.
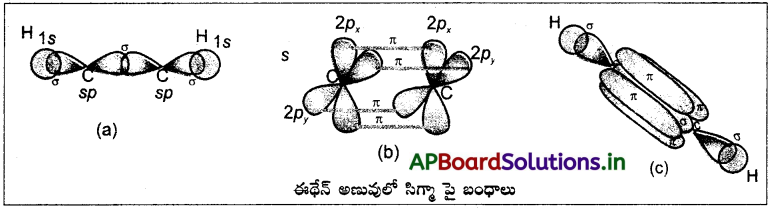
(a) C2H2, (b) C2H4 ఈ రెండు అణువుల్లో వరసగా దేనిలో ఎన్ని సిగ్మా పై బంధాలున్నాయో తెలపండి.
జవాబు:
a) CH ≡ CH (C2H2) లో 3 సిగ్మా, 2 పై బంధాలుంటాయి.
b) CH2 = CH2 (C2H2) లో 5 సిగ్మా, ఒక పై బంధాలు కలవు.
ప్రశ్న 14.
BF3 + NH3 → F3 BNH3 ఈ చర్యలో బోరాన్, నైట్రోజన్ పరమాణువుల సంకరకరణంలో మార్పు ఉంటుందా? ఉంటే ఏమిటి?
జవాబు:
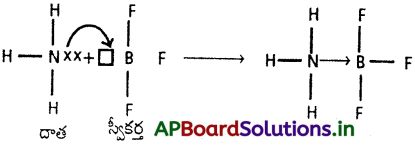
BF3 లో B పరమాణువు sp² సంకరీకరణానికి లోనవుతుంది మరియు దానిపై ఖాళీ సంకరీకరణం చెందని శుద్ధ ‘p’ ఆర్బిటాల్ ఉంటుంది. NH3 సమక్షంలో ఈ ‘p’ ఆర్బిటాల్ కూడా సంకరీకరణంలో పాల్గొనడం వలన, ‘B’ సంకరీకరణం sp² నుంచి sp³ కి మారుతుంది. ఈ ఖాళీ సంకర ఆర్బిటాల్ డేటివ్ బంధం ద్వారా NH3 తో బంధమేర్పరచుకొంటుంది. ఈ మొత్తం విధానంలో NH3 లో N పరమాణువు యొక్క సంకరీకరణంలో ఎటువంటి మార్పు ఉండదు.

స్వల్ప సమాధాన ప్రశ్నలు
ప్రశ్న 1.
రసాయన బంధాన్ని కొస్సెల్, లూయీలు ఎట్లా వివరించారు?
జవాబు:
కొస్సెల్, లూయి సిద్ధాంతం: దీనినే రసాయన బంధ సిద్ధాంతం అంటారు. ఈ సిద్ధాంతంలో లూయీ సంయోజనీయ బంధాన్ని, కొస్సెల్ అయానిక బంధం గురించి వివరించడం జరిగింది.
ప్రతిపాదనలు :
జడవాయువులకు రసాయన జఢత్వం అష్టక విన్యాసం వలన వచ్చినది.
అష్టక నియమం :
పరమాణువులు స్థిరత్వం కోసం బాహ్యశక్తి స్థాయిలో ఎనిమిది ఎలక్ట్రాన్లు కలిగి ఉంటుంది.
- ‘He’ వేలన్సీ’ కర్పరంలో రెండు ఎలక్ట్రాన్లు కలిగినప్పటికి రసాయనికంగా స్థిరత్వాన్ని కలిగి ఉండును.
- సున్నా గ్రూపు కాకుండా మిగతా మూలకాలు రసాయన చర్యాశీలతకు కారణం బాహ్యకక్ష్యలో ఎనిమిది ఎలక్ట్రాన్లు కలిగి ఉండకపోవడమే.
- ప్రతి పరమాణువు అష్టక విన్యాసాన్ని ఎలక్ట్రాన్లను కోల్పోయి, పంచుకొని లేదా సంగ్రహించి స్థిరత్వాన్ని పొందుతాయి.
- లూయీ ప్రకారం వేలన్సీ ఎలక్ట్రాన్లు చుక్కలుగా సూచిస్తారు. వీటినే లూయీ సంకేతాలు అంటారు. ఇవి మూలకం యొక్క గ్రూపు వేలన్సీని గుర్తించుటకు ఉపయోగిస్తారు.
ప్రశ్న 2.
అయానిక సంయోగపదార్థాల సాధారణ ధర్మాలు రాయండి.
జవాబు:
ఆయానిక సమ్మేళనాల ధర్మాలు :
1) భౌతిక స్థితి :
అయాన్ల సున్నిత కూర్పు వలన అయానిక పదార్థాలు స్ఫటికాకృతి గల ఘనాలు.
2) ద్రవీభవన మరియు బాష్పీభవన ఉష్ణోగ్రతలు :
అయానిక స్పటికాలలో వ్యతిరేక విద్యుదావేశ అయాన్ల మధ్య అత్యంత స్థిరవిద్యుత్ ఆకర్షణ బలాలు ఉంటాయి. కనుక అయానిక పదార్థాలలో ఈ ఆకర్షణ బంధాలను తెంచడానికి అధిక శక్తి అవసరం. అందువలన అవి అత్యధిక ద్రవీభవన మరియు బాష్పీభవన ఉష్ణోగ్రతలను కలిగి ఉంటాయి.
3) ద్రావణీయత :
అయానిక పదార్థాలు నీరు లేక ద్రవ అమ్మోనియా వంటి ధృవ ద్రావణిలలో కరుగుతాయి. కానీ, బెంజీన్, కార్బన్ టెట్రాక్లోరైడ్ వంటి అధృవ ద్రావణాలలో కరగవు.
4) చర్యాశీలత :
జలద్రావణాలలో అయానిక పదార్థాల రసాయన చర్యలు అత్యంత వేగంగా జరుగుతాయి.
ఉదా : AgNO3 ద్రావణానికి NaCl ద్రావణమును కలిపిన AgCl అను తెల్లని అవక్షేపం ఏర్పడును.
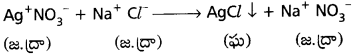
5) అణు సాదృశ్యము :
అయానిక బంధం దిశారహితము కావున అవి ఎటువంటి అణు సాదృశ్యాన్ని ప్రదర్శించవు.
6) విద్యుత్ వాహకత :
అయానిక పదార్థాలు గలన స్థితిలోను, ద్రావణస్థితిలోను విద్యుత్ వాహకత్వమును కలిగి ఉంటాయి.
![]()
ప్రశ్న 3.
ఫాజన్స్ నియమాలు రాసి, సరియైన ఉదాహరణలు ఇవ్వండి. [A.P. Mar. ’15]
జవాబు:
రెండు పరమాణువుల మధ్య ఏర్పడే బంధం స్వభావాన్ని తెలుసుకోవడానికి ఫాజన్ నియమాలు ఉపయోగపడతాయి.
ఫాజన్ నియమాలు :
1. కాటయాన్ పరిమాణం పెరిగే కొద్దీ బంధం అయానిక స్వభావం పెరుగుతుంది.
ఉదా : క్షార లోహాల అయాన్లలో అయానిక బంధస్వభావం క్రింది క్రమంలో ఉంటుంది.
Li+ < Na+ < K+ < Rb– < Cs+
2. ఆనయాన్ పరిమాణం తగ్గిన కొద్దీ అధిక అయానిక స్వభావం గల బంధం ఏర్పడే అవకాశం పెరుగుతుంది.
ఉదా : కాల్షియమ్ హాలైడ్ (CaX2) లలో అయొడైడ్ కంటే ఫ్లోరైడ్కు ఎక్కువ అయానిక స్వభావం ఉంటుంది. అయొడైడ్కి ఎక్కువ కోవలెంట్ స్వభావం ఉంటుంది.
3. కాటయాన్ లేదా ఆనయాన్ లేదా రెండింటికి తక్కువ ఆవేశాలుంటే అయానిక బంధ నిర్మాణానికి అనుకూలంగా ఉంటాయి.
ఉదా : AlCl3 అయానిక స్వభావం కంటే Na+Cl– అయానిక స్వభావం ఎక్కువ. కాటయాన్ Al+3 కి Na+ అయాన్ కంటే ఆవేశం ఎక్కువ. రెండు సమ్మేళనాల్లోనూ ఆనయాన్ ఒకటే. ఫాజన్ నియమం ప్రకారం AlCl3 సమ్మేళనంకు ఎక్కువ కోవలెంట్ స్వభావం ఉంది.
4. జడవాయు విన్యాసం గల కాటయాన్లు అయానిక సమ్మేళనాలనిస్తాయి. మిథ్యా జడవాయు విన్యాసాలు గల కాటయాన్లు కోవలెంట్ బంధ నిర్మాణానికి అనుకూలంగా ఉంటాయి.
ఉదా : Na+Cl– లో Na+ జడవాయు విన్యాసం ఉంది. కాబట్టి Na+Cl– అయానిక పదార్థం. కాని CuCl ఎక్కువ సమయోజనీయ పదార్థం. ఎందుకంటే Cu+ జడవాయు విన్యాసాన్ని ఆపాదించుకోలేదు. దానికి బదులుగా మిథ్యా జడవాయు విన్యాసాన్ని పొందుతుంది.
ప్రశ్న 4.
అష్టక నియమం అంటే ఏమిటి? దీనిని సంక్షిప్తంగా వివరించి దాని లోపాలు తెలపండి.
జవాబు:
అష్టక నియమము :
“ఒక పరమాణువుకు స్థిరత్వం ఉండాలంటే దాని బాహ్యతమ శక్తిస్థాయిలో ఎనిమిది ఎలక్ట్రాన్లు ఉండాలి అనే సూత్రాన్ని అష్టక నియమం అంటారు”.
ఉదా : సున్నా గ్రూపు మూలకాలకు బాహ్య కక్ష్యలలో ఎనిమిది ఎలక్ట్రాన్లు ఉంటాయి. (స్థిరమైన ఎలక్ట్రాన్ విన్యాసాలు). అందువలన ఈ మూలకాలు చాలా స్థిరమైనవి.
సార్థకత :
- సున్నా గ్రూపు మూలకాలు కాకుండా ఇతర గ్రూపు మూలకాలు రసాయన చర్యాశీలత కలవిగా ఉండటానికి వాటి బాహ్యకక్ష్యలో ఎనిమిది కంటే తక్కువ ఎలక్ట్రాన్లుండటమే కారణము.
- ప్రతి పరమాణువు దాని బాహ్యకక్ష్యలో ఎనిమిది ఎలక్ట్రాన్లను పొందడానికి ప్రయత్నిస్తుంది. ఆవర్తన పట్టికలో సున్నా గ్రూపు మూలకపు విన్యాసాన్ని పొందడానికి చూస్తాయి.
- మూలకాలకు సున్నా గ్రూపు మూలకాల స్థిరవిన్యాసాలు (అష్టక నియమం) ఎలక్ట్రాన్ బదిలీ (లేదా) ఎలక్ట్రాన్ జంటలను పంచుకుని రెండు పరమాణువుల మధ్య బంధమేర్పడటం ద్వారా వస్తాయి.
లోపాలు :
- ఈ సిద్ధాంతం అణువుల ఆకృతులను వివరించలేదు.
- ఈ సిద్ధాంతం జడవాయు అణువులు XeF2, XeF4 మొదలైన వాటిని వివరించలేదు.
- మధ్యస్థ పరమాణువులు అసంపూర్ణ అష్టకం కలిగి ఉన్న వాటికి, ఈ సిద్ధాంతం అనువర్తింపబడదు.
ప్రశ్న 5.
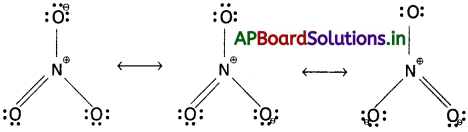
NO2, NO–3 ల రెజొనెన్స్ నిర్మాణాలు రాయండి.
జవాబు:
NO2 రెజొనెన్స్ నిర్మాణాలు :

NO–3 రెజొనెన్స్ నిర్మాణాలు :
ప్రశ్న 6.
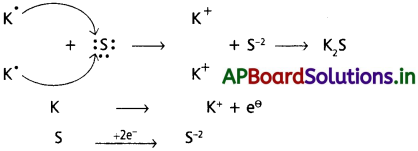
కింది పరమాణు జంటల్లో అవి కాటియాన్లు, ఏనయాన్లు ఏర్పరచేటప్పుడు జరిపే ఎలక్ట్రాన్ల మార్పులను లూయీ ఎలక్ట్రాన్ చుక్కల పద్ధతిలో ఇవ్వండి.
(a) K, S (b) Ca, O (c) Al, N.
జవాబు:
(a) K మరియు ‘S’ ల మధ్య :
(b) Ca మరియు ‘O’ ల మధ్య :
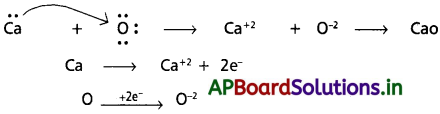
(c) AV మరియు ‘N’ ల మధ్య :
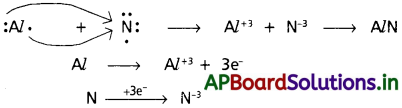
ప్రశ్న 7.
H2O అణువుకు ద్విధ్రువ భ్రామకం ఉన్నది కాని CO2 కు లేదు. ఎందువల్ల?
జవాబు:

- H2O అణువు ధృవ మరియు అసౌష్టవ అణువు
- H2O ఆకృతి కోణీయ (లేదా) V – ఆకృతి
- CO2 అణువు అధృవ మరియు రేఖీయ అణువు
- కావున H2O కు ద్విధృవ భ్రామకం µ = 1.835D మరియు CO2కు ద్విధృవ భ్రామకం µ = 0.
ప్రశ్న 8.
ద్విధ్రువ భ్రామకాన్ని నిర్వచించండి. దీని అనువర్తనాలేమిటి?
జవాబు:
ద్విధృవ భ్రామకం :
ఒక ద్విపరమాణుక ధృవ అణువు ద్విధృవ భ్రామకం ఆ అణువులోని పరమాణువుల్లో ఒక దాని మీద విద్యుదావేశ పరిమాణం, ధన, ఋణ, విద్యుదావేశాల కేంద్రాల మధ్య దూరంల లబ్ధంగా నిర్వచించవచ్చు.
దీనిని µ తో సూచిస్తారు
ద్విధృవ భ్రామకం µ = విద్యుదావేశం (Q) × విద్యుదావేశాల మధ్య దూరం (r)
దీనిని ‘Debye’ లలో కొలుస్తారు. 1 Debye = 3.34 × 10-30 సెం.మీటర్.
అనువర్తనాలు :
- అణువులలో అయానిక స్వభావం యొక్క శాతాన్ని కనుగొనుటకు ఉపయోగిస్తారు.
- అణువుల ఆకృతులు కనుగొనుటకు ఉపయోగిస్తారు.
- అణువుల సౌష్టవ అసౌష్టవతలు గురించి తెలుసుకొనుటకు ఉపయోగిస్తారు.
ప్రశ్న 9.
Be – F బంధాలకు ధ్రువత్వమున్నా BeF2 అణువుకు ద్విధ్రువ భ్రామకం సున్నా. వివరించండి.
జవాబు:
BeF2 లోని Be – F బంధాల ధృవణతను కలిగి ఉన్నా BeF2 యొక్క ద్విధృవ భ్రామకం సున్నా. దీనికి కారణం BeF2 యొక్క అణువు రేఖీయ అణువు.
![]()
ఇచ్చట రెండు Be – F బంధాల ద్విధృవ భ్రామకాల మొత్తం సున్నా. ∴ µ = 0.
ప్రశ్న 10.
CH4 అణువు నిర్మాణాన్ని వివరించండి.
జవాబు:
CH4 అణువు ఏర్పాటులో కార్బన్ sp³ సంకరీకరణం చెంది నాలుగు సగం నిండిన sp³ సంకర ఆర్బిటాళ్ళను ఏర్పరుస్తుంది. ఇది టెట్రాహెడ్రల్ సౌష్ఠవములో విస్తరిస్తాయి. ఇవి నాలుగు హైడ్రోజన్ పరమాణువుల ‘1H s’ ఆర్బిటాళ్ళతో అతిపాతం చెంది మీథేన్ అణువును ఏర్పరుస్తాయి. ఆకృతి చతుర్ముఖీయం. బంధకోణం 109°28′.
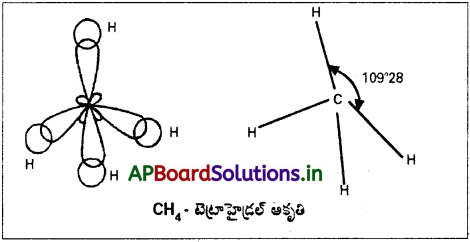
ప్రశ్న 11.
ధ్రువ సమయోజనీయ బంధంను సరియైన ఉదాహరణతో వివరించండి.
జవాబు:
రెండు విభిన్న పరమాణువుల మధ్య ఎలక్ట్రాన్లు పంచుకొనుట వలన ఏర్పడిన సంయోజనీయ బంధాన్ని ధృవ సంయోజనీయ బంధం అంటారు.
ఉదా : HF, HCl, H2O, CO2 etc.,
HCl అణువు ఏర్పడుట :
![]()
H మరియు C పరమాణువులు విభిన్న ఋణ విద్యుదాత్మక విలువలు కలిగి ఉంటాయి.
H మరియు CI పరమాణువుల ఎలక్ట్రాన్లను పంచుకొని ధృవ సంయోజనీయ బంధాన్ని ఏర్పరుస్తాయి.
ప్రశ్న 12.
BCl3 అణువులోని బంధకోణం, అణువు నిర్మాణాలను వేలన్స్ బంధ సిద్ధాంతం ఉపయోగించి వివరించండి.
జవాబు:
sp²- సంకరీకరణం :
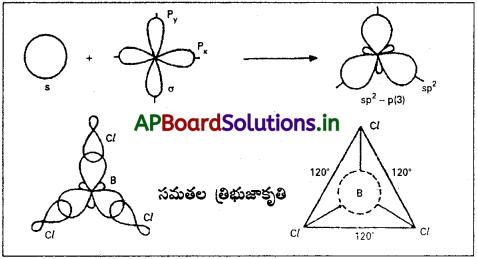
ఈ సంకరీకరణంలో ఒక s- ఆర్బిటాల్ మరియు రెండు p- ఆర్బిటాళ్ళు కలిసిపోయి మూడు సర్వసమానాలైన sp² సంకర ఆర్బిటాళ్ళను ఇస్తాయి. ఈ మూడు sp² సంకర ఆర్బిటాళ్ళు ఒక సమతల త్రిభుజం యొక్క మూడు మూలల వైపుకు విస్తరించి ఉంటాయి. ఏ రెండు sp² సంకర ఆర్బిటాళ్ళ మధ్య కోణమైన 120° ఉంటుంది. ప్రతి సంకర sp² ఆర్బిటాల్లోనూ s- లక్షణం 1/3 (33%), p- లక్షణం 2/3 (67%) ఉంటాయి. దీనిని ట్రైగోనల్ సంకరీకరణం అని కూడా అంటారు.
ఉదా : బోరాన్ ట్రై క్లోరైడ్ అణువు ఏర్పడుట :
బోరాన్ ట్రై క్లోరైడ్ అణువు ఏర్పడేటపుడు దానిలోని కేంద్రక బోరాన్ పరమాణువు sp² సంకరీకరణం పొందుతుంది. అట్లేర్పడ్డ మూడు sp² సంకర ఆర్బిటాళ్ళు, మూడు క్లోరిన్ పరమాణువుల 3pz ఆర్బిటాళ్ళతో అభిముఖంగా అతిపాతం చెంది, మూడు సిగ్మా బంధాలను ఇస్తాయి.
![]()
ప్రశ్న 13.
σ, π బంధాలంటే ఏమిటి? వాటి మధ్య భేదాలను తెలుపండి.
జవాబు:
‘σ’ బంధం :
“రెండు పరమాణువుల మధ్య అంతర కేంద్రక అక్షంపై ఎలక్ట్రాన్ మేఘాల సాంద్రత ఎక్కువయి, స్థూపాకార సౌష్టవంతో ఏర్పడే కోవలెంట్ బంధాన్ని ‘σ’ (సిగ్మా) బంధం అంటారు”.
‘π’ బంధం :
“అప్పటికే – బంధం ద్వారా బంధితమైన రెండు పరమాణువుల p- ఆర్బిటాల్ల పార్శ్వీయ అతిపాతం ద్వారా పరమాణువుల అంతర కేంద్రిత అక్షానికి పైన, క్రింద ఎలక్ట్రాన్ మేఘాల అమరిక ఉన్న రీతిలో ఏర్పరచిన బంధాన్ని’π (పై)’ బంధం అంటారు.
σ, π బంధాల మధ్య భేదాలు :
| σ – బంధం | π – బంధం |
| 1. ఈ బంధం శుద్ధ (లేక) సంకర ఆర్బిటాళ్ల రేఖీయ అతిపాతం వలన ఏర్పడుతుంది. | 1. ఈ బంధం శుద్ధ ఆర్బిటాళ్ల పార్శ్వపు అతిపాతం వల్ల ఏర్పడుతుంది. |
| 2. ‘σ’ బంధం బలమైనది. కారణం దీని అతిపాత తీవ్రత ఎక్కువ. | 2. ‘π’ బంధం బలహీనమైనది. కారణం దీని అతిపాత తీవ్రత తక్కువ. |
| 3. ‘σ’ బంధంలో ఎలక్ట్రాన్ మేఘవిస్తరణ అంతః కేంద్రాక్షంపై కేంద్రీకృతమై ఉంటుంది. | 3. ‘π’ బంధంలో ఎలక్ట్రాన్ మేఘవిస్తరణ అంతః కేంద్రాక్షానికి లంబంగా విస్తరించబడి ఉంటుంది. |
| 4. ‘σ’ బంధం అణువు యొక్క ఆకృతిని నిర్ణయిస్తుంది. | 4. ‘π’ బంధం అణు ఆకృతిని నిర్ణయించలేదు. |
| 5. స్వతంత్ర ప్రతిపత్తి కలదు. | 5. స్వతంత్ర ప్రతిపత్తి కలదు. ‘రో’ బంధం ఏర్పడిన తరువాత మాత్రమే ఏర్పడుతుంది. |
| 6. పరమాణువులు స్వేచ్ఛా భ్రమణాన్ని అనుమతిస్తుంది. | 6. పరమాణువులు స్వేచ్ఛా భ్రమణాన్ని ఆపుతుంది. |
| 7. శుద్ధ మరియు సంకర ఆర్బిటాళ్లు రెండూ ఈ బంధాన్ని ఏర్పరచును. | 7. ఈ బంధాన్ని కేవలం శుద్ధ ఆర్బిటాళ్ళు మాత్రమే ఏర్పరుస్తాయి. |
ప్రశ్న 14.
NH3 అణువులో నైట్రోజన్ పరమాణువు sp³ సంకరకరణ స్థితిలో ఉన్నా HNH బంధకోణం 109°28′ కాకుండా వేరేగా ఉంది. వివరించండి.
జవాబు:
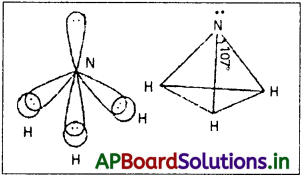
అమ్మోనియా అణువులో కేంద్రక పరమాణువు నైట్రోజన్, దాని బాహ్యస్థాయిలో మూడు బంధ ఎలక్ట్రాన్ జంటలు మరియు ఒక ఒంటరి ఎలక్ట్రాన్ బంధక ఎలక్ట్రాన్ జంటల మధ్య వికర్షణ బంధక బంధక ఎలక్ట్రాన్ జంటల మధ్య వికర్షణ కన్నా అధికంగా ఉండుట వలన బంధక ఎలక్ట్రాన్ జంటలు దగ్గరకు నెట్టబడతాయి. కనుక బంధకోణం 107°18′ కు తగ్గుతుంది. ఈ అణువు ఆకృతి పిరమిడ్.
ప్రశ్న 15.
(a) C2H4 (b) C2H2 లలో వరసగా కార్బన్ పరమాణువుల మధ్య ద్విబంధం, త్రికబంధం ఎలా ఏర్పడతాయో వివరించండి.
జవాబు:
C2H4 అణువులో కార్బన్ పరమాణువుల మధ్య ద్విబంధం ఏర్పడుట :
కార్బన్ భూస్థాయి ఎలక్ట్రాన్ విన్యాసం 1s² 2s² 2p²
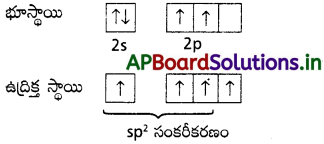
ఇథిలిన్ 2 “C” పరమాణువులు sp²సంకరీకరణం చెందుతాయి.
ఒక కార్బన్ యొక్క ఒక sp² సంకర ఆర్బిటాల్ మరొక కార్బన్ యొక్క sp² సంకర ఆర్బిటాల్తో అతిపాతం చెంది C – C సిగ్మా బంధం ఏర్పడును.
ప్రతి కార్బన్లోని మిగతా రెండు sp² సంకర ఆర్బిటాళ్ళు హైడ్రోజన్ పరమాణువులోని 5 ఆర్బిటాళ్ళతో అతిపాతం చెంది C – H బంధాలను ఏర్పరుచును.
సంకరీకరణం చెందని ఆర్బిటాళ్ళు పార్శ్వ అతిపాతం చెంది π బంధాన్ని ఏర్పరుచును.
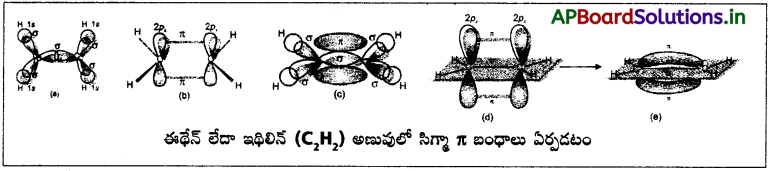
C2H2 అణువులో కార్బన్ పరమాణువుల మధ్య త్రిబంధం ఏర్పడుట :
కార్బన్ భూస్థాయి ఎలక్ట్రాన్ విన్యాసం 1s² 2s²2p²
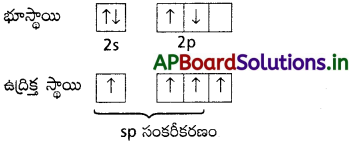
C2H2 నందు 2 “C” పరమాణువులు sp సంకరీకరణం చెందును.
ఒక కార్బన్ పరమాణువులోని sp సంకర ఆర్బిటాల్ మరొక కార్బన్లోని sp సంకర ఆర్బిటాల్తో అతిపాతం చెంది C – C సిగ్మా (σ) బంధం ఏర్పడును.
ప్రతి కార్బన్ పరమాణువులోని మరొక sp – సంకర ఆర్బిటాల్ హైడ్రోజన్ పరమాణువులోని s – ఆర్బిటాళ్ళతో అతిపాతం చెంది C – H బంధాలను ఏర్పరుచును.
రెండు కార్బన్ పరమాణువులలోని సంకరీకరణం చెందని ఆర్బిటాళ్ళు పార్శ్వ అతిపాతం చెంది రెండు π (పై) బంధాలను ఏర్పరుచును.
ప్రశ్న 16.
PCl5 అణువు ఏర్పడటంలో P సంకరకరణం వివరించండి.
జవాబు:
భూ స్థితిలో ‘P’ విన్యాసము = 1s² 2s² 2p6 3s² 3p¹x 3p¹y 3p¹z
ఉద్రిక్తస్థితిలో ‘P’ విన్యాసము : 1s² 2s² 2p6 3s¹ 3p³ 3d¹
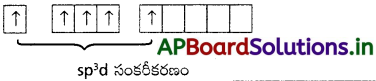
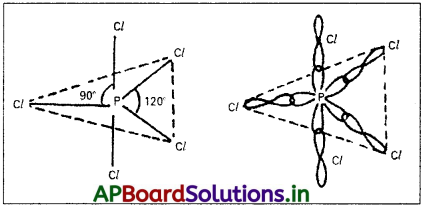
ఫాస్ఫరస్ ఉద్రిక్తస్థితిలో ‘sp d’సంకరీకరణమునకు లోనయి, అయిదు సంకర ఆర్బిటాళ్ళను ఏర్పరుస్తుంది. ఈ అయిదు సంకర ఆర్బిటాళ్ళు, అయిదు క్లోరిన్ల యొక్క ‘pz‘ ఆర్బిటాళ్ళతో అతిపాతం జరిపి అయిదు σsp³d – బంధాలను ఏర్పరుస్తాయి. అణువుకు త్రిభుజాకార బైపిరమిడ్ నిర్మాణం వస్తుంది. బంధకోణాలు 90° మరియు 120°.
ప్రశ్న 17.
SF6 ఏర్పడటంలో సంకరకరణం వివరించండి. [Mar. ’14]
జవాబు:
పరమాణువులోని ఒక ns ఆర్బిటాల్, మూడు np ఆర్బిటాళ్ళు మరియు రెండు (n – 1)d ఆర్బిటాళ్ళు ఒకదానితో ఒకటి మిశ్రమం చెంది ఆరు సర్వసమానమయిన ఆర్బిటాళ్ళను ఏర్పరచుటను d²sp³ సంకరీకరణం అంటారు. ఉదా : SF6
ఈ అణువులో సల్ఫర్ d²sp³ సంకరీకరణంలో పాల్గొంటుంది.
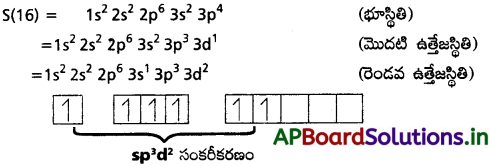
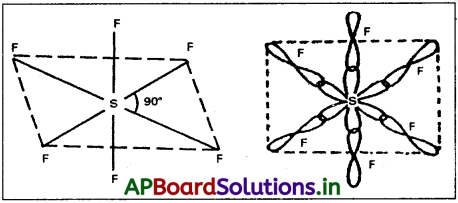
సల్ఫర్ sp³d² సంకరీకరణం వలన దానిపై ఆరు సర్వసమానమయిన ఆర్బిటాళ్ళు F ఏర్పడతాయి. ఈ సంకర ఆర్బిటాళ్ళలో ఒంటరి -ఎలక్ట్రానులు ఉంటాయి. సల్ఫర్ యొక్క ఈ సంకర ఆర్బిటాళ్ళను ఫ్లోరిన్ యొక్క ఒంటరి ఎలక్ట్రాన్లు గల p – ఆర్బిటాళ్ళతో అతిపాతం జరిపి 6 సిగ్మా బంధాలనేర్పరుస్తాయి. అణువుకు ‘ఆక్టాహైడ్రల్’ ఆకృతి వస్తుంది. బంధకోణం 90° (లేదా) 180° (లేదా) 90°.
ప్రశ్న 18.
సమన్వయ సమయోజనీయబంధం ఏర్పడే విధానాన్ని ఉదాహరణతో వివరించండి.
జవాబు:
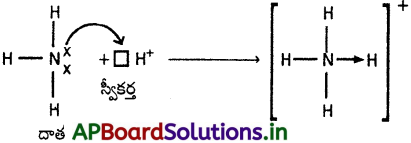
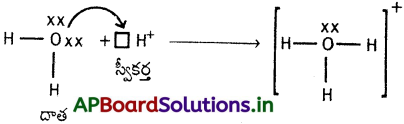
బంధానికి కావలసిన జంట ఎలక్ట్రాన్లను ఒకే పరమాణువు దానం చేయుట ద్వారా ఏర్పడు సమయోజనీయ బంధాన్ని సమన్వయ సమయోజనీయ బంధము అంటారు. దీనినే డేటివ్ బంధమని కూడా అంటారు. ఈ బంధాన్ని బాణం (→) గుర్తుతో సూచిస్తారు.
సమన్వయ సమయోజనీయ బంధం ఏర్పడుటకు జంట ఎలక్ట్రాన్లను దానం చేయుదానిని దాత అనియు, జంట ఎలక్ట్రాన్లను స్వీకరించుదానిని స్వీకర్త అనియూ అంటారు. స్వీకర్తకు ఎలక్ట్రాన్ జంటను గ్రహించుటకు ఖాళీ ఆర్బిటాల్ ఉండవలెను. అట్లే దాతకు ఒంటరి ఎలక్ట్రాన్ జంటలుగల ఆర్బిటాళ్ళు ఉండవలెను. స్వీకర్త యొక్క ఖాళీ ఆర్బిటాల్ దాత యొక్క ఒంటరి ఎలక్ట్రాన్ జంటలు గల ఆర్బిటాళ్ళతో అతిపాతం చెందుట వలన వాటిమధ్య సమయోజనీయ బంధం ఏర్పడుతుంది. ఒకసారి సమన్వయ సమయోజనీయ బంధం ఏర్పడిన తరువాత అది సమయోజనీయ బంధంతో సమానము.
ఉదా : (1) NH+4 (అమ్మోనియం అయాన్)
ఉదా : (2) H3O+ (హైడ్రోనియం అయాన్)
ఉదా : (3) H3N → BF3 (అమ్మోనియా బోరాన్ ట్రైఫ్లోరైడ్)
ప్రశ్న 19.
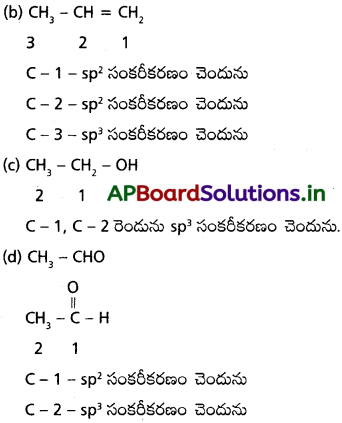
కింది అణువులు ఏర్పడటంలో కార్బన్ పరమాణువులు ఏ సంకర ఆర్బిటాళ్ళనుపయోగించాయి?
(a) CH3 – CH, (b) CH3 – CH = CH2 (c) CH3 – CH2 – OH (d) CH3 – CHO
జవాబు:
(a) CH3 – CH3 లో రెండు కార్బన్ పరమాణువులు కూడా sp³ సంకరీకరణం చెందును.
ప్రశ్న 20.
హైడ్రోజన్ బంధం అంటే ఏమిటి? విభిన్న, హైడ్రోజన్ బంధాలను ఉదాహరణలతో వివరించండి.
జవాబు:
హైడ్రోజన్ పరమాణువుకు, అధిక ఋణవిద్యుదాత్మకత గల పరమాణువుకు మధ్య ఉన్న బలహీన విద్యుదాకర్షణను హైడ్రోజన్ బంధము అంటారు. హైడ్రోజన్ బంధము యొక్క బలం 2 – 10 కిలోకాలరీ/మోల్. ఇది సమయోజనీయ బంధము కన్నా చాలా బలహీనమైనది. కానీ వాండర్వాల్ ఆకర్షణ బలాలకన్నా బలమైనది.
హైడ్రోజన్ బంధము రెండు రకాలు :
1. అణు అంతర హైడ్రోజన్ బంధము :
వివిధ అణువుల మధ్య హైడ్రోజన్ బంధము ఏర్పడితే దానిని అణు అంతర హైడ్రోజన్ బంధము అంటారు.
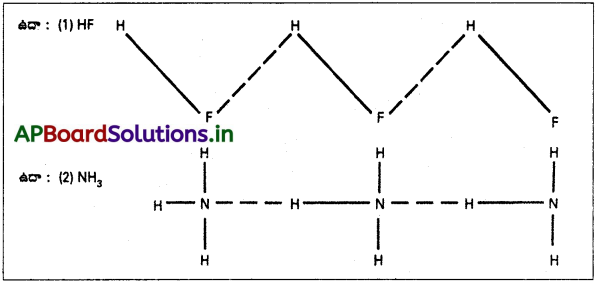
అణు అంతర హైడ్రోజన్ బంధము గల అణువులు సహచరిత అణువులుగా ఉంటాయి. కనుక వాటి ద్రవీభవన, భాష్పీభవన ఉష్ణోగ్రతలు అధికంగా ఉంటాయి. ఇథైల్ ఆల్కహాల్ మరియు ఎసిటిక్ ఆమ్లం వంటి పదార్థాలు నీటిలో అధికంగా కరుగుటకు కారణం వాటి మధ్య ఏర్పడు అణు అంతర హైడ్రోజన్ బంధమే.
2. అణ్వంతర హైడ్రోజన్ బంధము :
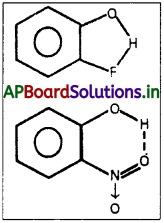
ఒకే అణువులో హైడ్రోజన్ బంధమేర్పడినచో దానిని అణ్వంతర హైడ్రోజన్ బంధము
ఉదా : (1) ఆర్థోఫ్లోరోఫినోల్
ఉదా : (2) ఆర్థోనైట్రోఫినోల్. అణ్వంతర హైడ్రోజన్ బంధం పదార్థాల బాష్పీభవన, ద్రవీభవన ఉష్ణోగ్రతలపై ప్రభావం చూపదు.
ప్రశ్న 21.
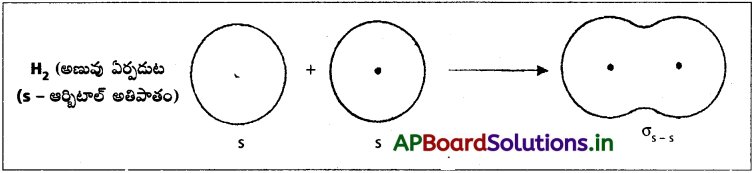
వేలన్స్ బంధ సిద్ధాంతంతో H2 అణువు ఏర్పడటాన్ని వివరించండి.
జవాబు:
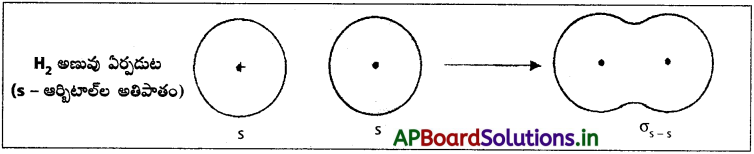
వేలన్స్ బంధ సిద్ధాంతంతో H2 అణువు ఏర్పడుట :
s – s అతిపాతం (హైడ్రోజన్ అణువు ఏర్పడుట) :
పరస్పరం వ్యతిరేక స్పిన్లు గల రెండు H – పరమాణువులలోని ‘1s’ ఎలక్ట్రాన్ మేఘాలు పరస్పరం అంతర్ కేంద్ర అక్షం వెంబడి అతిపాతం చెందుట వలన H2 అణువు ఏర్పడుతుంది. ఈ బంధాన్ని సిగ్మా బంధం అంటారు. అతిపాతం – ఆర్బిటాళ్ళ మధ్య జరిగింది. కాబట్టి దీనిని σs-s బంధం అంటారు.
ప్రశ్న 22.
B2 అణువు పరాయస్కాంత ధర్మం గలది. అణు ఆర్బిటాల్ సిద్ధాంతంతో దానిని వివరించండి.
జవాబు:
‘B’ యొక్క ఎలక్ట్రాన్ విన్యాసం – 1² 2s² 2p¹
B2 యొక్క అణు ఆర్బిటాల్ శక్తి క్రమం
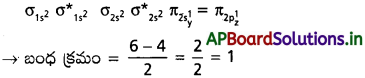
పైన శక్తి క్రమంలో ఒంటరి ఎలక్ట్రాన్లు కలవు.
కావున B2 అణువు పారా అయస్కాంత స్వభావం కలిగియుండును.
![]()
ప్రశ్న 23.
పరమాణు ఆర్బిటాళ్ళ రేఖీయ కలయికకు నియమాలేమిటి ? వివరించండి.
జవాబు:
1) సంకలనం చెందే ఆర్బిటాల్ల సంఖ్యకు, సంయోగ ఫలితంగా ఏర్పడే అణు ఆర్బిటాల్ల సంఖ్య సమానంగా ఉంటుంది. ఉదాహరణకు, రెండు పరమాణు ఆర్బిటాల్లు సంకలనం చెంది రెండు అణు ఆర్బిటాల్లను ఇస్తాయి. ఎక్కువ పరమాణు ఆర్బిటాల్లు సంకలనం చెందితే సగం అణు ఆర్బిటాల్ల శక్తి పరమాణు ఆర్బిటాల్ల శక్తి కంటే తక్కువగాను, మిగిలిన సగభాగం అణు ఆర్బిటాల్ల శక్తి ఎక్కువగాను ఉంటుంది.
2) పరమాణు ఆర్బిటాల్ల శక్తి కంటే తక్కువ శక్తిస్థాయిలో ఉన్న అణు ఆర్బిటాల్లను బంధక ఆర్బిటాల్లు అంటారు. అధిక శక్తిస్థాయిలో ఉన్న ఆర్బిటాల్ ను అపబంధక ఆర్బిటాల్లు అంటారు. సంకలన ప్రక్రియలో పాల్గొనని ఆర్బిటాల్ ను అబంధక ఆర్బిటాల్లు అంటారు. సాధారణంగా ఇవి పరమాణువుల అంతర్ నిర్మాణాల్లో ఉండే ఎలక్ట్రాన్లు. కింది బొమ్మలో దీన్ని చూడవచ్చు.
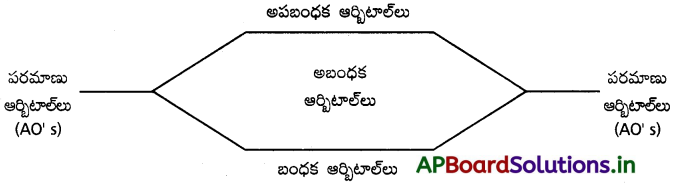
ఈ ఆర్బిటాల్ల శక్తి క్రమాలన్నీ బంధక ఆర్బిటాల్ < అబంధక ఆర్బిటాల్లు < అపబంధక ఆర్బిటాల్లు.
ప్రశ్న 24.
బంధ క్రమం అంటే ఏమిటి? కింది అణువుల్లో బంధ క్రమమెంత? [T.S. Mar. ’15, Mar. ’14]
(a) N2 (b) O2 (c) O2+2 (d) O–2
జవాబు:
బంధ క్రమం :
బంధక ఎలక్ట్రాన్ల సంఖ్య మరియు అపబంధక ఎలక్ట్రాన్ల భేదంలో సగాన్ని బంధక్రమం అంటారు.
a) N2:
అణు ఆర్బిటాల్ శక్తి క్రమం
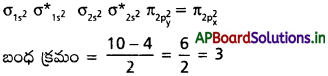

ప్రశ్న 25.
BF3, NF3 అణువుల్లో NF3 కి ద్విధ్రువ భ్రామకం ఉన్నది. BF3 కి లేదు. ఎందువల్ల?
జవాబు:
BF3, NF3 అణువులలో NF3 కి ద్విధృవ భ్రామకం కలదు. BF3 కి లేదు.
వివరణ :
- BF3 అధృవ మరియు సౌష్టవ అణువు. సౌష్టవ అణువుకు µ = 0
- NF3 అణువు ధృవ మరియు అసౌష్ఠవ అణువు. అసౌష్టవ అణువుకు µ ≠ 0
- BF3 అణువు ఆకృతి సమతల త్రిభుజాకారం
- NF3 అణువు ఆకృతి పిరమిడల్
µ(NF3) = 0.8 × 10-30 C × met.

ప్రశ్న 26.
NH3, NF3 రెండు అణువులు సూచ్యాకృతిలో ఉంటాయి. అయినా NH3 కి NF3 కంటే ద్విధ్రువ భ్రామకం ఎక్కువ. ఎందువల్ల?
జవాబు:
→ NH3, NF3 రెండు అణువులు సూచ్యాకృతిలో ఉంటాయి. అయినా NH3 కి NF3 కన్నా ద్విధృవ భ్రామకం ఎక్కువ.
వివరణ :
‘F’ కు ‘N’ కంటే ఋణవిద్యుదాత్మకత ఎక్కువ అయినప్పటికీ µ (NH3) > µ (NF3)
µ (NH3) = 4.9 × 10-30 c × met
µ (NF3) = 0.8 × 10-30 c. met
NH3 లొ ఒంటరి ఎలక్ట్రాన్ జంట వల్ల ఏర్పడే ఆర్బిటాల్ ద్విదృవం N – H బంధ ద్విధృవ భ్రామకంలో ఒకే దిశలో ఉంటుంది.
NF3 లో ఒంటరి ఎలక్ట్రాన్ జంట వల్ల ఏర్పడే ఆర్బిటాల్ ద్విధృవ N – F బంధ ద్విధృవ భ్రామకంలో వ్యతిరేక దిశలో ఉంటుంది.

ప్రశ్న 27.
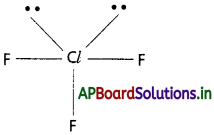
వేలన్స్ కర్పర ఎలక్ట్రాన్ జంటల వికర్షణ (VSEPR) సిద్ధాంతం ఉపయోగించి కింది అణువుల ఆకృతులను తెలపండి.
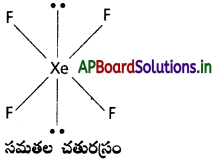
(a) XeF4
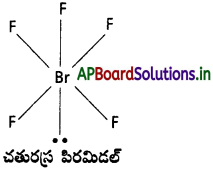
(b) BrF5
(c) ClF3
(d) ICl–4
జవాబు:
→ VSEPR సిద్ధాంతం ప్రకారం అణువు యొక్క ఆకృతి బంధ ఎలక్ట్రాన్ జంటలో మరియు ఒంటరి ఎలక్ట్రాన్ జంటల సంఖ్యను బట్టి నిర్ణయిస్తారు.
a) XeF4 : XeF4 నందు బంధ ఎలక్ట్రాన్ జంటలు 4, ఒంటరి ఎలక్ట్రాన్ జంటలు 2.
∴ అణువు యొక్క ఆకృతి “సమతల చతురస్రం” (ఉండవలసినవి ఆక్టా హెడ్రల్)
b) BrF5 : BrF5. నందు 5 బంధ ఎలక్ట్రాన్ జంటలు, ఒక ఒంటరి ఎలక్ట్రాన్ జంట ఉండును.
∴ అణువు యొక్క ఆకృతి “చతురస్ర పిరమిడల్” (ఉండవలసినది ఆక్టా హెడ్రల్)
c) ClF3 : ClF3 నందు 3 బంధ ఎలక్ట్రాన్ జంటలు, రెండు ఒంటరి ఎలక్ట్రాన్ జంటలు ఉన్నవి.
∴ అణువు యొక్క ఆకృతి T – ఆకృతి. (ఉండవలసినది TBP)
d) ICl4– : ICl4– నందు 4 బంధ ఎలక్ట్రాన్ జంటలు, రెండు ఒంటరి ఎలక్ట్రాన్ జంటలు కలవు.
∴ అణువు యొక్క ఆకృతి “సమతల చతురస్రం” (ఉండవలసినది ఆక్టా హెడ్రల్)
దీర్ఘ సమాధాన ప్రశ్నలు
ప్రశ్న 1.
అయానిక బంధం ఏర్పడటాన్ని సోదాహరణంగా వివరించండి.
జవాబు:
నిర్వచనం :
విరుద్ధ విద్యుదావేశిత అయానుల మధ్య స్థిర విద్యుదాకర్షణ బలాలను అయానిక బంధం అంటారు.
ఆర్బిటాల్ భావన ద్వారా వివరణ :
ఉదా : సోడియం క్లోరైడ్ ఏర్పడుట
సోడియం (Z = 11) ఎలక్ట్రాన్ విన్యాసం = 1s² 2s² 2p6 3s¹
దీనిని ఆర్బిటాల్ చిత్రం ద్వారా కింది విధంగా చూపవచ్చు.
క్లోరిన్ (Z = 17) ఎలక్ట్రాన్ విన్యాసం = 1s² 2s² 2p6 3s² 3p5
దీనిని ఆర్బిటాల్ చిత్రం ద్వారా కింది విధంగా చూపవచ్చు.
సోడియం పరమాణువు నుండి ఒక ఎలక్ట్రాన్, క్లోరిన్ పరమాణువుకు బదిలీ అవడం వలన సోడియం, నియాన్ విన్యాసాన్ని పొందగా, క్లోరిన్, ఆర్గాస్ విన్యాసాన్ని పొందుతుంది.
రెండు అయాన్లలోని అన్ని ఆర్బిటాల్లోనూ ఎలక్ట్రాన్లు జతకూడి ఉండుటచేత అవి స్థిరత్వం పొందుతాయి. ఈ విధంగా రెండు విరుద్ధ ఆవేశాలు గల అయాన్ల మధ్య బలమైన ఆకర్షణ బలాలు ఏర్పడి వాటి మధ్య అయానిక బంధం ఏర్పడుతుంది.
ప్రశ్న 2.
అయానిక సంయోగ పదార్థాలు ఏర్పడటానికి అనువైన పరిస్థితులు వివరించండి.
జవాబు:
అయానిక బంధం ఏర్పడటానికి అనుకూల అంశాలు :
ఎ) “కాటయాన్” ఏర్పడటానికి అనువైన అంశాలు :
1) అధిక పరమాణు పరిమాణం :
పరమాణు పరిమాణం పెరిగే కొలది వేలన్సీ ల పై కేంద్రక ఆకర్షణ తగ్గుతుంది. కనుక అధిక పరమాణు పరిమాణం గల పరమాణువు నుండి ఎలక్ట్రాన్ తొలగించుటకు తక్కువ శక్తి అవసరము. కనుక త్వరగా కాటయానన్ను ఏర్పరుస్తుంది.
ఉదా : IA గ్రూపు మూలకాలలో Li నుండి Cs వరకు పరమాణు పరిమాణం పెరుగును. కనుక కాటయాన్ ఏర్పడుట పెరిగే సరియైన క్రమము. Li < Na+ < K+ < Rb+ < Cs+
2) అయనీకరణ శక్తి :
అత్యల్ప అయనీకరణ శక్తి గల పరమాణువు నుండి ఎలక్ట్రాన్ తీసివేయుటకు ఇవ్వవలసినశక్తి తక్కువ కనుక త్వరగా కాటయానన్ను ఏర్పరుస్తుంది.
ఉదా : Na, Kలలో, ‘K’ త్వరగా K+ గా మారుతుంది.
కారణం : ‘K’ యొక్క ప్రథమ అయనీకరణ శక్తి ‘Na’ కన్నా తక్కువ.
3) అయానుపై గల ధనావేశం : తక్కువ ధనావేశం గల అయాన్ తేలికగా ఏర్పడుతుంది. ఎందువలన అనగా ఏకమాత్ర ధనావేశపు అయాన్ నుంచి రెండవ e– ను తొలగించాలి. అంటే అధిక శక్తి అవసరం. కనుక Na+, Mg+2లలో Na+ త్వరగా ఏర్పడును. Mg+2, Al+3 లలో Mg+2 త్వరగా ఏర్పడును.
ఉదా : Na+, Mg+2, Al+3 లలో కాటయాన్ ఏర్పడు క్రమం Na+ > Mg+2 > Al+3
4) జడవాయు విన్యాసం గల కాటయాన్ ఏర్పడటం :
జడవాయు విన్యాసం గల కాటయాన్ (2,8,8) అధిక స్థిరత్వం కలిగి ఉండును. అందువలన మిథ్యా జడవాయు విన్యాసం గల (2,8,18) కాటయాన్ కంటే త్వరగా ఏర్పడుతుంది.
ఉదా : Ca+(2,8) అధిక స్థిరత్వం కలిగి ఉండుట వలన Zn +2 (2,8,18) కన్నా త్వరగా ఏర్పడుతుంది.
బి) అనయాన్ ఏర్పడుటకు అనుకూల పరిస్థితులు :
అల్ప పరమాణు పరిమాణం : అత్యల్ప పరిమాణం గల మూలకాల పరమాణువులలో కేంద్రక ఆకర్షణ బాహ్య ఎలక్ట్రాన్ల మీద అధికంగా ఉంటుంది. అందుచేత e లను సులభంగా గ్రహించి ఆనయాన్లను ఏర్పరుస్తుంది.
ఉదా : F– > Cl– > Br– > I–
అధిక ఎలక్ట్రాన్ ఎఫినిటి మరియు ఋణవిద్యుదాత్మకత :
అత్యధిక ఎలక్ట్రాన్ ఎఫినిటి మరియు ఋణవిద్యుదాత్మకత ఉండుట వలన గ్రహించిన ఎలక్ట్రాన్ ను మూలకపు పరమాణువు పట్టి ఉంచుతుంది. కనుక అత్యధిక ఎలక్ట్రాన్ ఎఫినిటి గల మూలకము త్వరగా ఆనయాన్ ను ఏర్పరచును.
ఉదా : Cl– అయాన్ Br– కన్నా త్వరగా ఏర్పడుతుంది.
అయాన్పై గల ఆవేశం :
తక్కువ ఋణావేశం గల అయాన్ త్వరగా ఏర్పడుతుంది. కారణం ఎక్కువ ఋణావేశం గల అయాన్లో ఎలక్ట్రాన్ల మధ్య వికర్షణలు అధికంగా ఉండుట వలన అస్థిరత్వాన్ని కల్గి ఉండును.
ఉదా : F–, O-2, N-3 లలో ఆనయాన్ ఏర్పడుట సరియగు క్రమం F > O-2 > N-3.
44. కింది అణువులకు లూయీ నిర్మాణాలు రాయండి.
(a) H2S (b) SiCl4 (c) BeF2 (d) HCOOH
జవాబు:
లూయీ నిర్మాణాలు :

ప్రశ్న 3.
క్రింది వాటిని వివరించండి.
a) బంధకోణం
b) బంధ ఎంథాల్పీ
c) బంధ దైర్ఘ్యం
d) బంధ క్రమం
జవాబు:
a) బంధకోణం :
ఒక అణువులో మధ్యస్థ పరమాణువు కలిగి ఉన్న బంధ ఎలక్ట్రాన్ జంటలను కలిగి ఉన్న ఆర్బిటాళ్ల మధ్య కోణాన్ని బంధకోణం అంటారు.
→ దీనిని డిగ్రీలలో కొలుస్తారు.
→ ఇది ప్రయోగాత్మకంగా వర్ణపట పద్ధతుల ద్వారా నిర్ణయిస్తారు.
ఉదా : H2O అణువులో H – O – H బంధకోణం 104.5°
b) బంధ ఎంథాల్పీ :
వాయుస్థితిలో ఉన్న రెండు పరమాణువుల మధ్య ఏర్పడిన ఒక బంధాన్ని విఘటనం చెందించుటకు అవసరమగు శక్తిని బంధ ఎంథాల్పీ అంటారు.
→ ప్రమాణాలు : KJ/ Mole.
ఉదా : H – H బంధ ఎంథాల్పీ H2 లో 435.8 KJ/mole
H2(వా) → H(వా) + H(వా) ∆H = 435.8 KJ/mole
c) బంధ దైర్ఘ్యం :
ఒక అణువులోని రెండు పరమాణువుల కేంద్రకాల మధ్య దూరంను బంధ ధైర్ఘ్యం అంటారు.
- ప్రమాణాలు : A° (లేదా) cm (లేదా) m (లేదా) pm
- రెండు పరమాణువుల మధ్య బంధాలు పెరిగే కొలది బంధధైర్ఘ్యం తగ్గును.
| బంధం | బంధ ధైర్ఘ్యం |
| C – C | 1.54 Å |
| C = C | 1.33 Å |
| C ≡ C | 1.20 Å |
d) బంధ క్రమం :
ఒక సంయోజనీయ అణువులోని రెండు పరమాణువుల మధ్య బంధాల సంఖ్యను బట్టి బంధ క్రమాన్ని నిర్ణయిస్తారు.
ఉదా : N2 యొక్క బంధ క్రమం – 3
O2 యొక్క బంధ క్రమం – 2
N2 యొక్క బంధ క్రమం – 1
- బంధక్రమం అణువుల స్థిరత్వం కనుగొనటానికి ఉపయోగపడుతుంది.
- బంధక్రమం పెరిగితే బంధ ఎంథాల్పీ పెరిగి బంధధైర్ఘ్యం తగ్గును.
![]()
ప్రశ్న 4.
వేలన్స్ కర్పర ఎలక్ట్రాన్ జంటల వికర్షణ సిద్ధాంతం వివరించండి. దీని అనువర్తనాలు ఏమిటి?
జవాబు:
VSEPR సిద్ధాంతము ముఖ్యాంశాలు :
- అణువులోని కేంద్రక పరమాణువు బాహ్యకర్పరంలోని ఎలక్ట్రాన్ జంటల సంఖ్యపై దాని ఆకృతి ఆధారపడి ఉంటుంది.
- కేంద్రక పరమాణువు బాహ్యస్థాయిలోని ఎలక్ట్రాన్ జంటలు వాటి మధ్య వికర్షణలు అత్యల్పంగా ఉండేట్లుగా ప్రాదేశిక అమరికను పొందుతాయి.
- వివిధ ఎలక్ట్రాన్ జంటల మధ్య వికర్షణ ఈ క్రమంలో ఉంటుంది.
ఒంటరి జంట – ఒంటరి జంట > ఒంటరి జంట బంధ జంట > బంధ జంట – బంధ జంట - ఒంటరి ఎలక్ట్రాన్ జంటల వలన అణువు ఆకృతిలోనూ, బంధ కోణంలోనూ విచలనాలు వస్తాయి.
- ఒక అణువుకు రెండు (లేదా) మూడు రెజొనెన్స్ నిర్మాణాలను చూపించగలిగితే, VSEPR నమూనాని ఏదైనా ఒక రెజొనెన్స్ నిర్మాణానికి వర్తింపచేయవచ్చు.
6. మధ్యస్థ పరమాణువుపై ఒకటి లేదా అంతకంటే ఎక్కువ ఎలక్ట్రాన్ జంటలు ఉన్న అణువుల జ్యామితులు :
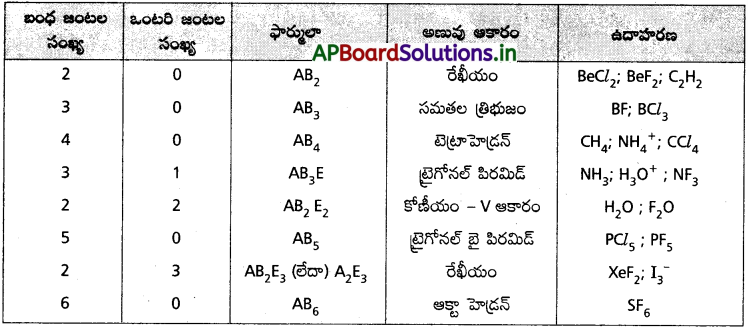
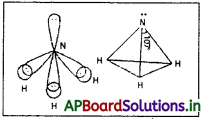
అమ్మోనియా అణువులో కేంద్రక పరమాణువు నైట్రోజన్, దాని బాహ్యస్థాయిలో మూడు బంధ ఎలక్ట్రాన్ జంటలు మరియు ఒక ఒంటరి ఎలక్ట్రాన్ జంట ఉంటాయి. అపబంధక బంధక ఎలక్ట్రాన్ జంటల మధ్య వికర్షణ బంధక – బంధక ఎలక్ట్రాన్ జంటల మధ్య వికర్షణ కన్నా అధికంగా ఉండుట వలన బంధక ఎలక్ట్రాన్ జంటలు దగ్గరకు నెట్టబడతాయి. కనుక బంధకోణం 107°18′ కు తగ్గుతుంది. ఈ అణువు ఆకృతి పిరమిడ్.
ప్రశ్న 5.
వేలన్స్ బంధ సిద్ధాంతం ఉపయోగించి అణువుల జ్యామితిని ఎలా వివరిస్తారు?
జవాబు:
వేలన్స్ బంధ సిద్దాంతంలోని ముఖ్యాంశాలు :
- రెండు పరమాణువుల యొక్క జతకూడని ఎలక్ట్రాన్లు గల పరమాణు ఆర్బిటాళ్ళు పరస్పరం అతిపాతం చెందుట వలన సమయోజనీయ బంధం ఏర్పడుతుంది.
- అతిపాతం జరుపుకునే ఆర్బిటాళ్ళలోని ఎలక్ట్రాన్లకు పరస్పరం వ్యతిరేక స్పిన్లు ఉండాలి.
- ఏర్పడే బంధం యొక్క బలం, అతిపాత అవధిపై ఆధారపడి ఉంటుంది.
- ఆర్బిటాళ్లు వాటి గరిష్ఠ ఎలక్ట్రాన్ సాంద్రత గల దిశలోనే అతిపాతం జరుపుతాయి.
- ఆర్బిటాళ్ళు అతిపాతం జరిపిన దిశలోనే సమయోజనీయ బంధం ఏర్పడుతుంది.
ఆర్బిటాళ్ళ అతిపాతం 3 రకాలు : అవి (1) s – 5 అతిపాతం (2) p – p అతిపాతం (1) s – p అతిపాతం.
s – s అతిపాతం (హైడ్రోజన్ అణువు ఏర్పడుట) :
పరస్పరం వ్యతిరేక స్పిన్లు గల రెండు H- పరమాణువులలోని ‘1s’ ఎలక్ట్రాన్ మేఘాలు పరస్పరం అంతర్ కేంద్ర అక్షం వెంబడి అతిపాతం చెందుట వలన H2 అణువు ఏర్పడుతుంది. ఈ బంధాన్ని సిగ్మా బంధం అంటారు. అతిపాతం S ఆర్బిటాళ్ళ మధ్య జరిగింది. కాబట్టి దీనిని σs-s బంధం అంటారు.
p – p అతిపాతం (ఫ్లోరిన్ అణువు ఏర్పడుట) :
పరస్పరం వ్యతిరేక స్పిన్లు గల రెండు Cl – పరమాణువులలోని 2pz ఎలక్ట్రాన్ మేఘాలు పరస్పరం అంతర్ కేంద్ర అక్షం వెంబడి అతిపాతం చెందుట వలన Cl2 అణువు ఏర్పడుతుంది. ఈ బంధాన్ని సిగ్మా బంధం అంటారు. అతిపాతం p- ఆర్బిటాళ్ళ మధ్య జరగడం వలన దీనిని σp-p బంధం అంటారు.
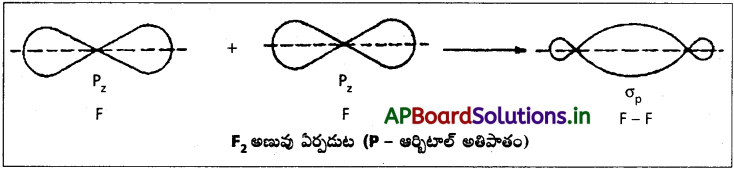
హైడ్రోజన్ క్లోరైడ్ అణువు (s – p అతిపాతం) :
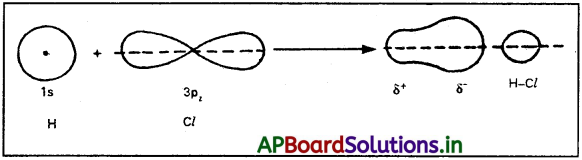
హైడ్రోజన్ పరమాణువులోని జతగూడని ఎలక్ట్రాన్లుగల 1s ఆర్బిటాల్, క్లోరిన్ పరమాణువులోని జతగూడని ఎలక్ట్రాన్లు గల 2pz ఆర్బిటాల్తో అంతర్కేంద్ర అక్షం వెంబడి అతిపాతం జరుపుకోవడం వలన HCl అణువు ఏర్పడుతుంది. ఈ బంధాన్ని సిగ్మా బంధం అంటారు. అతిపాతం s – ఆర్బిటాల్, p – ఆర్బిటాల్ల మధ్య జరగడం వలన దీనిని σs-p బంధం అంటారు.
ఆక్సిజన్ అణువు ఏర్పడుట :
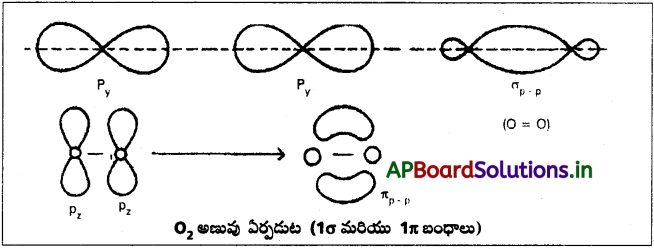
ఆక్సిజన్ పరమాణువులో రెండు జతగూడని ఎలక్ట్రాన్లు గల py, pz ఆర్బిటాళ్ళు ఉంటాయి. ఆక్సిజన్ అణువు ఏర్పడేటపుడు ఒక ఆక్సిజన్ పరమాణువులోని py ఆర్బిటాల్, రెండవ ఆక్సిజన్ పరమాణువులోని py ఆర్బిటాల్తో అభిముఖ అతిపాతం చేసుకొని వాటి మధ్య సిగ్మా బంధాన్ని ఏర్పరచుకుంటాయి. ఇపుడు పరస్పరం లంబదిశలలో ఉన్న రెండు ఆక్సిజన్ పరమాణువులలోని pz ఆర్బిటాళ్ళు ప్రక్కవాటు అతిపాతం చేసుకొని వాటి మధ్య π – బంధాన్ని ఇస్తాయి. ఈ విధంగా ఆక్సిజన్ అణువులో రెండు ఆక్సిజన్ పరమాణువుల మధ్య ద్విబంధం ఏర్పడుతుంది. (0 = 0)
పరమాణు ఆర్బిటాళ్ళు ఒక నిర్దిష్ట దిశలో ఒకదానికొకటి సమీపించి అతిపాతం చెందినపుడు మాత్రమే సమయోజనీయ బంధం ఏర్పడుతుంది. కనుక ఇది దిశాత్మకమైనది. కనుక సమయోజనీయ సమ్మేళనాలు నిర్దిష్ట ఆకృతి మరియు బంధకోణాలు కలిగి ఉంటాయి.
ప్రశ్న 6.
సంకరకరణం అంటే ఏమిటి? s, p ఆర్బిటాళ్ళతో జరిగే విభిన్న రకాల సంకరకరణాల్ని వివరించండి. [Mar. ’13]
జవాబు:
సంకరకరణం – నిర్వచనం :
దాదాపుగా సమాన శక్తి గల పరమాణు ఆర్బిటాళ్ళు ఒకదానితో ఒకటి కలసిపోయి అదే సంఖ్యలో సర్వసమానాలైన క్రొత్త ఆర్బిటాళ్ళు ఏర్పడే ప్రక్రియను సంకరకరణం అంటారు.
(1) sp³ – సంకరకరణం, (2) sp² – సంకరకరణం, (3) sp – సంకరకరణం, (4) sp³ d- సంకరకరణం, (5) sp²d² – సంకరకరణం
(1) sp³ – సంకరకరణం :
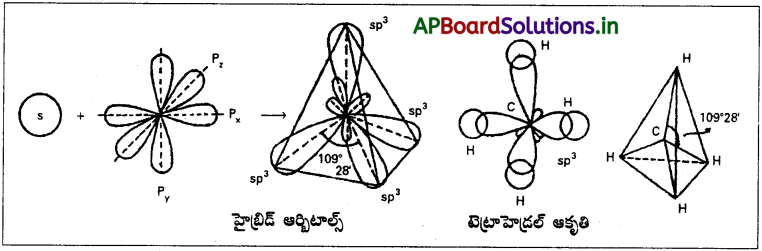
ఈ సంకరకరణంలో ఒక s- ఆర్బిటాల్, మూడు p- ఆర్బిటాల్లు కలిసిపోయి నాలుగు సర్వసమానాలైన sp³ సంకర ఆర్బిటాళ్ళను ఇస్తాయి. ఈ నాలుగు sp³ సంకర ఆర్బిటాళ్ళు ఒక టెట్రా హైడ్రల్ యొక్క నాలుగు మూలలకు విస్తరించి ఉంటాయి. ఏ రెండు sp³ సంకర ఆర్బిటాళ్ల మధ్య కోణం అయినా 109°28′ ఉంటుంది. ప్రతి sp³ సంకర ఆర్బిటాల్లోనూ 5 లక్షణం 1/4 (25%) మరియు p లక్షణం 3/4 (75%) ఉంటుంది. దీనిని టెట్రా హైడ్రల్ సంకరకరణం అని కూడా అంటారు.
ఉదా : మీథేన్ అణువు ఏర్పడుట :
మీథేన్ అణువు ఏర్పడేటప్పుడు దానిలోని కేంద్రక కార్బన్ పరమాణువు sp³ సంకరకరణం పొందుతుంది. అట్లేర్పడ్డ నాలుగు sp సంకర ఆర్బిటాళ్లు నాలుగు ‘H’ పరమాణువుల ‘1s’ ఆర్బిటాళ్లతో అభిముఖంగా అతిపాతం చెంది, నాలుగు సిగ్మా బంధాలను ఇస్తాయి.
(2) sp² – సంకరకరణం :
ఈ సంకరకరణంలో ఒక s – ఆర్బిటాల్ మరియు రెండు p- ఆర్బిటాళ్ళు కలిసిపోయి మూడు సర్వసమానాలైన sp² సంకర ఆర్బిటాళ్ళను ఇస్తాయి. ఈ మూడు sp² సంకర ఆర్బిటాళ్ళు ఒక సమతల త్రిభుజం యొక్క మూడు మూలల వైపుకు విస్తరించి ఉంటాయి. ఏ రెండు sp² సంకర ఆర్బిటాళ్ళ మధ్య కోణమైన 120° ఉంటుంది. ప్రతి సంకర sp² ఆర్బిటాల్లోనూ s – లక్షణం 1/3 (33%), p- లక్షణం 2/3 (67%) ఉంటాయి. దీనిని ట్రైగోనల్ సంకరకరణం అని కూడా
అంటారు.
ఉదా : బోరాన్ ట్రై క్లోరైడ్ అణువు ఏర్పడుట :
బోరాన్ ట్రై క్లోరైడ్ అణువు ఏర్పడేటపుడు దానిలోని కేంద్రక బోరాన్ పరమాణువు sp² సంకరకరణం పొందుతుంది. అట్లేర్పడ్డ మూడు sp² సంకర ఆర్బిటాళ్ళు, మూడు క్లోరిన్ పరమాణువులు 3pz ఆర్బిటాళ్ళతో అభిముఖంగా అతిపాతం చెంది, మూడు సిగ్మా బంధాలను ఇస్తాయి.
3. sp – సంకరకరణం :
ఈ సంకరకరణలో ఒక s – ఆర్బిటాల్ మరియు ఒక p- ఆర్బిటాళ్ళు కలిసిపోయి రెండు సర్వసమానాలైన sp- సంకర ఆర్బిటాళ్ళను ఇస్తాయి. ఈ రెండు sp సంకర ఆర్బిటాళ్ళు ఒక సరళరేఖ మార్గంలో ఉంటాయి. వాటి మధ్య కోణం 180° ఉంటుంది. ప్రతి sp సంకర ఆర్బిటాల్లోనూ s- లక్షణం 1/2 (50%), p- లక్షణం 1/2 (50%) ఉంటాయి. దీనిని రేఖీయ సంకరకరణం లేక డైగోనల్ సంకరకరణం అని కూడా అంటారు.
ఉదా : బెరీలియం క్లోరైడ్ అణువు ఏర్పడుట :
BeCl2 అణువు ఏర్పడేటపుడు కేంద్రక Be పరమాణువు sp సంకరకరణం పొందుతుంది. అట్లేర్పడ్డ రెండు sp సంకర ఆర్బిటాళ్ళు రెండు క్లోరిన్ పరమాణువుల 3pz ఆర్బిటాళ్ళతో అభిముఖంగా అతిపాతం చెంది, రెండు సిగ్మా బంధాలను ఇస్తాయి.
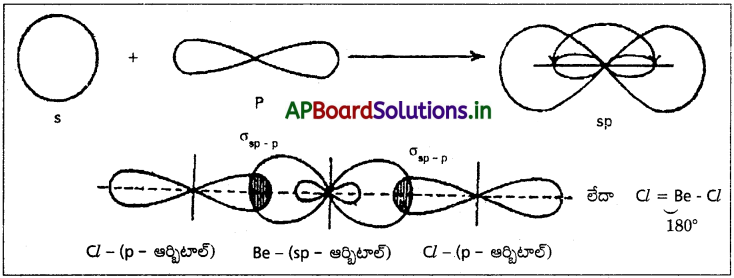
ప్రశ్న 7.
అణు ఆర్బిటాల్ సిద్ధాంతం ముఖ్య లక్షణాలను రాయండి.
జవాబు:
అణు ఆర్బిటాల్ సిద్ధాంతం :
ఈ సిద్ధాంతాన్ని “హుండ్” మరియు “ముల్లికన్” ప్రతిపాదించారు.
ప్రతిపాదనలు :
- బంధక పరమాణువులలోని పరమాణు ఆర్బిటాళ్ళు [AO] రేఖీయ సంయోగం చెంది వాటి ఉనికిని కోల్పోయి అణు ఆర్బిటాళ్ళను ఏర్పరుచును.
కేంద్రకం చుట్టూ ఎలక్ట్రాన్ కనుగొనే సంభావ్యత అధికంగా ఉన్న ప్రాంతమే “అణు ఆర్బిటాల్”. - ఒక అణువులోని అన్ని పరమాణువులకు చెందిన ఎలక్ట్రాన్లు, అణువులోని అన్ని కేంద్రాకాల చుట్టూ తిరుగుతూ ఉంటాయి.
- అణు ఆర్బిటాళ్ళ యొక్క ఆకృతి పరమాణు ఆర్బిటాళ్ళపై ఆధారపడును.
- ప్రతి అణు ఆర్బిటాళ్లలో 2 ఎలక్ట్రాన్లు వ్యతిరేక స్పిన్తో నింపబడతాయి.
- అణు ఆర్బిటాళ్ళలో ఎలక్ట్రాన్లను శక్తి పెరిగే క్రమంలో నింపుతారు.
- పరమాణు ఆర్బిటాళ్ళు ఒకే రకమైన శక్తి కలిగినను సంయోగం చెంది అణు ఆర్బిటాళ్ళను ఏర్పరుచును.
- పరమాణు ఆర్బిటాళ్ళ శక్తి కంటే తక్కువ శక్తి కలిగిన అణు ఆర్బిటాళ్ళను “బంధక అణు ఆర్బిటాళ్ళు” అంటారు. అలానే ఎక్కువ శక్తి కలిగిన వాటిని “అపబంధక అణు ఆర్బిటాళ్ళు” అంటారు.
- బంధక అణు ఆర్బిటాళ్ళను సిగ్మా (σ) మరియు పై (π) లతో సూచిస్తారు.
- అపబంధక అణు ఆర్బిటాళ్ళను σ* మరియు π* లతో సూచిస్తారు.
అణు ఆర్బిటాళ్ళలో ఎలక్ట్రాన్లు నింపులు :

ప్రశ్న 8.
(a) N2, (b) O2 అణువులకు అణు ఆర్బిటాల్ శక్తి పటాలు రాయండి. ఈ రెండు అణువుల అయస్కాంత లక్షణాలేమిటి? వాటి బంధ క్రమాలు గణించండి.
జవాబు:
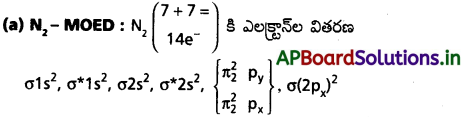
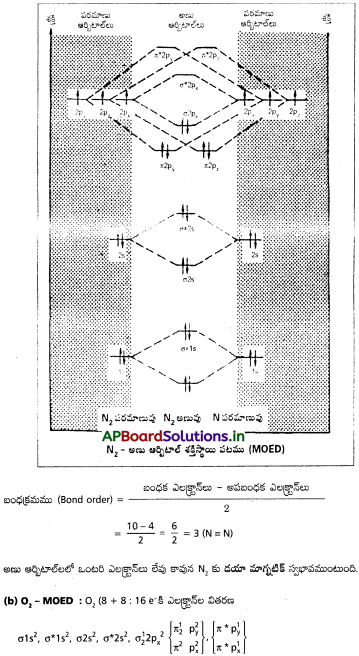
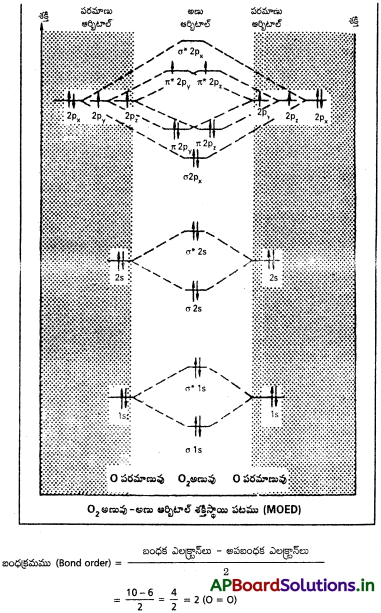
రెండు ఒంటరి ఎలక్ట్రాన్లు (π * 2p¹y, π * 2p¹z) ఆక్సిజన్ అణు ఆర్బిటాళ్లలో ఉండుట వలన, ఆక్సిజన్ అణువుకు పారాయస్కాంత స్వభావముంటుంది.
సాధించిన సమస్యలు (Solved Problems)
ప్రశ్న 1.
‘CO’ అణువు లూయీ ఎలక్ట్రాన్ చుక్క నిర్మాణం రాయండి.
సాధన:
1వ దశ : కార్బన్, ఆక్సిజన్ రెండు పరమాణువుల వేలన్స్ ఎలక్ట్రాన్లు గణించాలి.
![]()
మొత్తం వేలన్స్ ఎలక్ట్రాన్లు 4e– + 6e– = 10e–
2వ దశ : CO నిర్మాణం స్థూల అమరిక : C O
3వ దశ : ముందు C, O ల మధ్య ఒక ఎలక్ట్రాన్ జత (ఏకబంధం) రాయండి. ఆక్సిజన్ పై అష్టకాన్ని పూర్తి చేయండి. మిగిలిన రెండు ఎలక్ట్రాన్లను కార్బన్పై ఒంటరి జంటగా రాయండి.
![]()
ఇది కార్బన్ మీద అష్టకాన్నివ్వదు. అందువల్ల C, O ల మధ్య బహుబంధం రాద్దాం. ఇది C, O రెండు పరమాణువులకూ అష్టక నియమం ఉపయోగిస్తుంది.
![]()
![]()
ప్రశ్న 2.
నైట్రైట్ అయాన్ లూయీ చుక్కల నిర్మాణం రాయండి.
సాధన:
1వ దశ :
నైట్రోజన్ వేలన్స్ కర్పర ఎలక్ట్రాన్లు, ఆక్సిజన్ వేలన్స్ కర్పర ఎలక్ట్రాన్లను కలిపి ఆ విలువకు రుణ విద్యుదావేశం పరంగా ఇంకొక ఎలక్ట్రాన్ కలపండి.
N(2s² 2p3), O (2s² 2p4)
5e– + 6e– + 12e–
2వ దశ :
NO–2 అయాన్ స్థూల నిర్మాణం O NO
3వ దశ :
ప్రతి రెండు పరమాణువుల మధ్య ముందుగా ఒక్కొక్క సమయోజనీయ బంధం (అంటే నైట్రోజన్ – ఆక్సిజన్, నైట్రోజన్ ఆక్సిజన్) రాయండి. తరువాత రెండు ఆక్సిజన్ల అష్టకం పూర్తి చేయండి.
ఇక మిగిలిన రెండు ఎలక్ట్రాన్లను నైట్రోజన్ మీద ఒంటరి జంటగా చూపినప్పటికి దానికి అష్టకం రాదు.
![]()
కాబట్టి నైట్రోజన్ పరమాణువుకు కూడా అష్టకం రావడానికి బహుబంధాలను రాయాలి. ‘N’, ఒక ‘O’ మధ్య ద్విబంధం (బహుబంధం) రాస్తే అన్ని పరమాణువులకూ అష్టకం వస్తుంది.
![]()
ప్రశ్న 3.
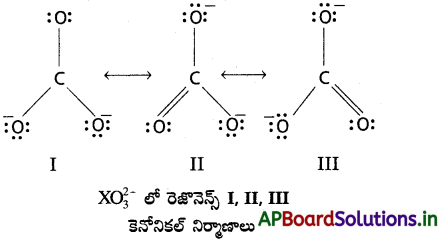
XO2-3 నిర్మాణాన్ని రెజోనెన్స్ ద్వారా వివరించండి.
సాధన:
కేంద్రంలో కార్బన్ పరమాణువును రాసి చుట్టూ మూడు ఆక్సిజన్ పరమాణువులను రెండింటిని కార్బన్ ఏకబంధాలతో మూడోదాన్ని కార్బన్ ద్విబంధంతోను ఒక నిర్మాణం లూయీ సిద్ధాంతం ప్రకారం రాస్తే అది ‘C’ పరమాణువు ‘O’ పరమాణువుల మధ్య వేర్వేరు దైర్ఘ్యాలు గల బంధాలనిస్తుంది. కాని ప్రయోగ పూర్వకంగా గుర్తించేదేమిటంటే కార్బన్కు ఆక్సిజన్ పరమాణువులకు మధ్య బంధాలన్ని ఒకే బంధ దైర్ఘ్యంతో ఉన్నాయని, అందువల్ల కార్బొనేట్ అయాన్ను కింద చూపించిన I, II, III రెజొనెన్స్ నిర్మాణాల రెజోనెన్స్ హైబ్రిడ్గా చూపవచ్చు. ఆ హైబ్రిడ్ నిర్మాణంతో కార్బోనేట్ అయాన్ను యదార్థంగా చూపేందుకు చేసే ప్రయత్నం అందుబాటులో ఉన్న అన్ని ప్రయత్నాల్లోకి అత్యుత్తమం అని భావించవచ్చు.
![]()
ప్రశ్న 4.
CO2 అణువు నిర్మాణాన్ని రెజొనెన్స్ సిద్ధాంతం ప్రకారం వివరించండి.
సాధన:
ప్రయోగపూర్వకంగా CO2 అణువులోని కార్బన్తో రెండు ఆక్సిజన్ పరమాణువులు ఏర్పరచే కార్బన్ – ఆక్సిజన్ బంధాలను సమానమైనవి 115 pm గా గుర్తించారు. C =0 ద్విబంధదైర్ఘ్యం 121pm, అదే C = O త్రికబంధ దైర్ఘ్యం నిజమైన CO2 అణువులో ఉన్న కార్బన్ – ఆక్సిజన్ బంధ దైర్ఘ్యాలు (115 pm) ఈ విలువ C = 0కు = 0 అంటే 121 pm, 110 pm ల మధ్య ఉన్నది. అంటే ఒకే ఒక్క లూయీ నిర్మాణం దీనిని వివరించలేదు. అందువల్ల ఒకటికంటే ఎక్కువ లూయీ నిర్మాణాలను (0) కు ఇవ్వాలి. అందుకే CO2 ను I, II, III కెనోనికల్ లేదా రెజొనెన్స్ నిర్మాణాలతో చూపుతారు.
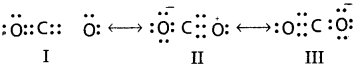
CO2 అణువులో రెజొనెన్స్ I, II, III నిర్మాణాలు CO2కు ఇచ్చే మూడు రెజొనెన్స్ నిర్మాణాలు
సాధారణంగా మనం రెజోనెన్స్ను కింది విధంగా వివరించవచ్చు.
రెజొనెన్స్ హైబ్రిడ్ శక్తి కంటే ఏకెనోనికల్ నిర్మాణానికైనా శక్తి ఎక్కువ. అంటే రెజొనెన్స్ అణువుకు స్థిరత్వాన్నిస్తుంది.
బంధ లక్షణాలను రెజొనెన్స్ మొత్తం మీద సగటు విలువలుగా ఇస్తుంది. అంటే ఓజోన్ O3 రెజొనెన్స్ హైబ్రిడ్ శక్తి ఇతర రెండు I, II కెనోనికల్ నిర్మాణాల శక్తి కంటే తక్కువ.