Andhra Pradesh BIEAP AP Inter 1st Year Chemistry Study Material 5th Lesson స్టాయికియోమెట్రీ Textbook Questions and Answers.
AP Inter 1st Year Chemistry Study Material 5th Lesson స్టాయికియోమెట్రీ
అతిస్వల్ప సమాధాన ప్రశ్నలు
ప్రశ్న 1.
540 gm ల గ్లూకోజ్లో ఎన్ని మోల్ల గ్లూకోజ్ ఉంది? [Mar. ’14]
జవాబు:

ప్రశ్న 2.
0.1 మోల్ సోడియమ్ కార్బొనేట్ భారాన్ని లెక్కగట్టండి.
జవాబు:
a) Na2CO3 అణుభారం = 106
1 మోల్ Na2CO3 భారం = 106 గ్రాములు.
∴ 0.1 మోల్ Na2CO3 అణుభారం = 0.1 × 106 = 10.6 గ్రాములు.
ప్రశ్న 3.
5.23 g ల గ్లూకోజ్లో ఎన్ని అణువులుంటాయి? (గ్లూకోజ్ అణుభారం 180 u).
జవాబు:
అణువుల సంఖ్య = మోల్ల సంఖ్య × అవగాడ్రో సంఖ్య
![]()
మోల్ల సంఖ్య = 0.02906 × 6.023 × 1023 = 1.75 × 1022 అణువులు
ప్రశ్న 4.
STP వద్ద 1.12 × 10-7 c.c. ల వాయువులో ఉండే అణువుల సంఖ్యను లెక్కకట్టండి.
(c.c. cubic centimeters = cm³).
జవాబు:
STP వద్ద ఒక మోల్ వాయువు 22400 cc ఘనపరిమాణం ఆక్రమిస్తుంది.
ఒక మోల్ వాయువు 6.023 × 1023 అణువులు కలిగి ఉంటాయి.
STP వద్ద 1.12 × 10-7 cc ఘనపరిమాణం గల వాయువు – ?
![]()
ప్రశ్న 5.
ఒక సమ్మేళనం అనుభావిక ఫార్ములా CH2O. దాని అణుభారం 90. ఆ సమ్మేళనం అణు ఫార్ములాను కనుక్కోండి. [Mar. ’13]
జవాబు:
అణుభారం = 90
అనుభావిక ఫార్ములా = CH2O
అనుభావిక భారం = 30
అణుఫార్ములా = n (అనుభావిక ఫార్ములా
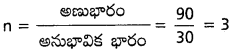
అణుఫార్ములా = 3 (CH2O) = C3H6O3
![]()
ప్రశ్న 6.
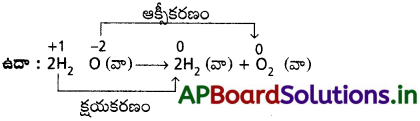
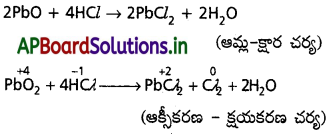
కింది సమీకరణాన్ని ఆక్సిడేషన్ సంఖ్య పద్ధతిలో తుల్యం చేయండి.
Cr(ఘ) + Pb(NO3)2 (జల) → Cr (NO3) (జల) + Pb(ఘ)
జవాబు:
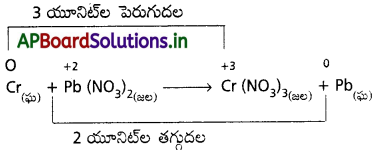
తుల్యం చేయబడిన సమీకరణం 2Cr + 3Pb(NO3)2 → 2Cr(NO3)3 + 3Pb
ప్రశ్న 7.
0.795 g ల CuO ని Cu, H2O లుగా క్షయకరణం చేయడానికి STP వద్ద ఎంత ఘనపరిమాణం H2 అవసరమవుతుంది?
జవాబు:
ఇవ్వబడిన సమీకరణం
CuO + H2 → Cu + H2O
79.5గ్రా. → 1 మోల్ H2 వాయువు (క్షయకరణం చెందించుటకు) అవసరం
→ 22.4 లీ. ఘనపరిమాణం STP వద్ద
79.5 గ్రా CuO → 22.4 లీ. H2 వాయువు
0.795 గ్రా – ?
\(\frac{0.795\times22.4}{79.55}\)= 0.224లీ
ప్రశ్న 8.
100 mL ల ఎసిటిలీన్ని పూర్తిగా దహనం చేయడానికి కావలసిన ౦2 ఘనపరిమాణాన్ని STP వద్ద లెక్కకట్టండి.
జవాబు:
ఎసిటలీన్ దహన ప్రక్రియ సమీకరణం
2C2H2 + 5O2 → 4CO2 + 2H2O
2 మోల్ల C2H2 వాయువు దహనం చేయుటకు 5 మోల్ల O2 అవసరం
2 × 22400 మి.లీ. C2H2 – 5 × 22400 ml ల O2 (STP వద్ద)
100 మి.లీ. C2H2 – ?
![]()
ప్రశ్న 9.
ప్రస్తుత కాలంలో ఎలక్ట్రాన్ సాంద్రత తగ్గుదలను ఆక్సీకరణం అనీ, ఎలక్ట్రాన్ సాంద్రత పెరగడాన్ని క్షయకరణం అనీ అంటారు. దీన్ని మీరు సమర్థించండి.
జవాబు:
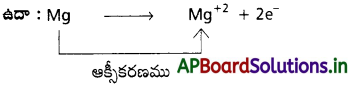
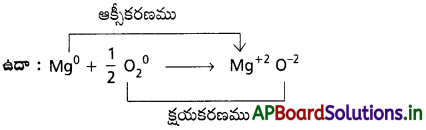
ఎలక్ట్రాన్ సాంద్రతలో తగ్గుదలంటే ఎలక్ట్రాన్లను కోల్పోవడం. దీనినే ఆక్సీకరణం అంటారు.
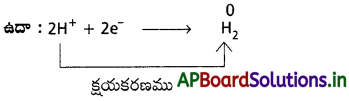
ఎలక్ట్రాన్ సాంద్రతలో పెరుగుదలంటే ఎలక్ట్రాన్లను స్వీకరించడం. దీనినే క్షయకరణం అంటారు.
ప్రశ్న 10.
ఆక్సీకరణ – క్షయకరణ భావన అంటే ఏమిటి? ఉదాహరణ ఇవ్వండి.
జవాబు:
రిడాక్స్ భావన :
ఎలక్ట్రాన్లను కోల్పోయే ప్రక్రియను ఆక్సీకరణ చర్య అని, ఎలక్ట్రాన్లను గ్రహించే ప్రక్రియను క్షయకరణ చర్య అని అంటారు. ఈ రెండింటి మొత్తం చర్యను “ఆక్సీకరణ – క్షయకరణ” లేదా కుదింపుగా ‘రిడాక్స్ చర్య’ అని పిలుస్తారు.
ప్రశ్న 11.
సోడియమ్ సల్ఫేట్ (Na2SO4) లోని వివిధ మూలకాల ద్రవ్యరాశి శాతాలను గణించండి.
జవాబు:
ఇవ్వబడిన సమ్మేళనం Na2SO4
అణుభారం = 2(23) + 1(32) + 4(16)
= 142
Step – 1 :
Na ద్రవ్యరాశి శాతం
142 గ్రా. Na2SO4 → 46గ్రా. Na
100గ్రా. Na2SO4 →
\(\frac{100\times46}{142}\) = 32.39%
Step – III :
‘S’ ద్రవ్యరాశి శాతం
142 గ్రా. Na2SO4 → 32 గ్రా. ‘S’
100 గ్రా. Na2SO4 → ?
\(\frac{100\times32}{142}\) = 22.53%
Step – III :
‘0’ ద్రవ్యరాశి శాతం
142 గ్రా. Na2SO4 → 64 గ్రా. ఆక్సిజన్
100 గ్రా. Na2SO4 → ?
\(\frac{100\times64}{142}\) = 45.07%
Na, S, O ల ద్రవ్యరాశి శాతాలు 32.39, 22.53, 45.07.
![]()
ప్రశ్న 12.
సార్థక అంకెలు అంటే మీరు ఏమి చెబుతారు?
జవాబు:
ప్రాయోగికంగా (లేదా) సిద్ధాంతరీత్యా రాబట్టిన విలువలలో అనిశ్చితత్వం ఉంటుంది. దానిని సార్థక అంకెలలో సూచిస్తారు. కచ్చితంగా తెలిసిన అర్థవంతమైన అంకెలను సార్థక అంకెలు అంటారు.
ప్రశ్న 13.
కాంతి వేగం 3.0 × 108 ms-1 అయితే 2 నానో సెకన్లలో అది ప్రయాణించే దూరాన్ని లెక్క కట్టండి.
జవాబు:
కాంతి వేగం = 3 × 108 మీ / సెకన్
1 సెకన్ → 3 × 108 మీ.
రెండో నానో సెకన్స్లో → ?
2 × 10-9 సెకన్ → ?
\(\frac{2 \times 10^{-9} \times 3 \times 10^8}{1}\) = 6 × 10-1 = 0.6 మీ.
స్వల్ప సమాధాన ప్రశ్నలు
ప్రశ్న 1.
సోడియమ్ కార్బొనేట్ తయారీ నెలకు సుమారు 424 × 108 g, మిథైల్ ఆల్కహాల్ 320 × 106 g. అయితే ఏది ఎక్కువ మోల్లు తయారవుతుంది?
జవాబు:
ఒక నెలకు Na2SO3 తయారీ = 424 × 106 గ్రా.

CH3OH ఎక్కువ మోల్లు తయారు అగును.
ప్రశ్న 2.
1.5 atm పీడనం, 127 °C వద్ద 0.112 L O2 పూర్తిగా చర్య జరిపి CO2 ఏర్పడటానికి STP వద్ద CO ఘనపరిమాణం కనీసం ఎంత కావాలి?
జవాబు:

ప్రశ్న 3.
కర్బన సమ్మేళనంలోని మూలకాల రసాయన విశ్లేషణ చేశారు. భారాత్మకంగా వాటి సంఘటన శాతాలు కింది విధంగా ఉన్నాయి. కార్బన్ = 10.06%, హైడ్రోజన్ = 0.84%, క్లోరిన్ = 89.10%. సమ్మేళనం అనుభావిక ఫార్ములాను కనుక్కోండి.
జవాబు:
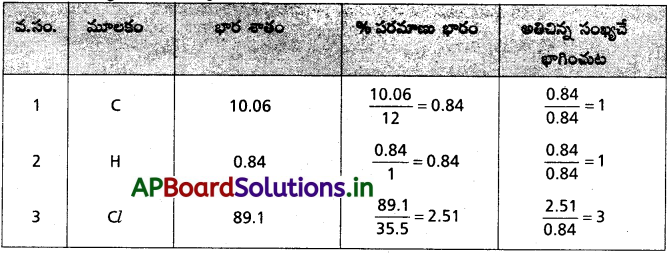
ఇవ్వబడిన సమ్మేళన అనుభావిక ఫార్ములా C1H1Cl3 = CHCl3
ప్రశ్న 4.
ఒక కర్బన సమ్మేళనాన్ని విశ్లేషించగా కింది సంఘటన శాతాలను ఇచ్చింది. కార్బన్ = 14.5%, హైడ్రోజన్ = 1.8%, క్లోరిన్ = 64.46%, ఆక్సిజన్ = 19.24%. సమ్మేళనం అనుభావిక ఫార్ములాను కనుక్కోండి.
జవాబు:
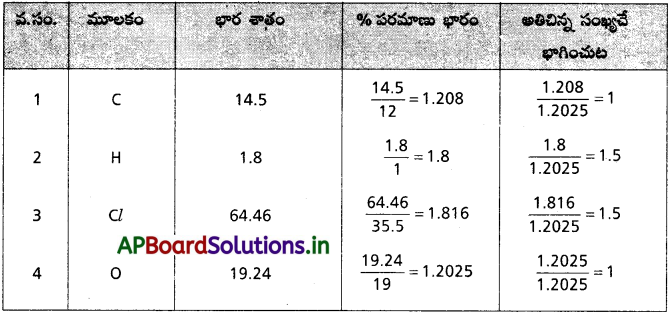
సమ్మేళన ఫార్ములా = C1H1.5 Cl1.5 O1
సమ్మేళన అనుభావిక ఫార్ములా = C2 H3 Cl3 O2
ప్రశ్న 5.
కింది సంఘటన శాతం ఉన్న సమ్మేళనపు అనుభావిక ఫార్ములాను కనుక్కోండి. పొటాషియమ్ (K) = 26.57, క్రోమియమ్ (Cr) = 35.36; ఆక్సిజన్ (0) = 38.07. (K, Cr, O ల పరమాణు భారాలు వరుసగా 39, 52, 16 ఉంటాయి).
జవాబు:
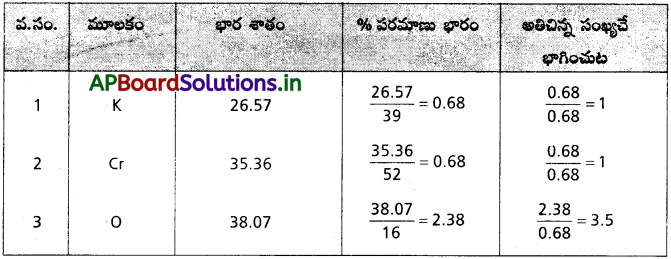
సమ్మేళన ఫార్ములా = K1 Cr1 O3.5
సమ్మేళన అనుభావిక ఫార్ములా = K2 Cr2 O7
ప్రశ్న 6.
ఒక కర్బన సమ్మేళనంలో 12.8% కార్బన్, 2.1% హైడ్రోజన్, 85.1% బ్రోమిన్ ఉంటాయి. దాని అణుభారం 187.9. దాని అణుఫార్ములాను కనుక్కోండి.
జవాబు:
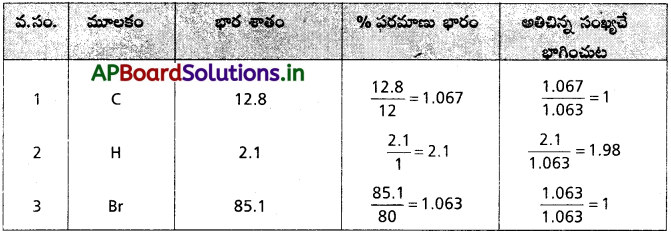
సమ్మేళన అనుభావిక ఫార్ములా = C1 H2 Br
అణుఫార్ములా = n (అనుభావిక ఫార్ములా)
అనుభావిక భారం = 94 (CH2 Br)

ప్రశ్న 7.
ఒక కార్బనిక సమ్మేళనం అనుభావిక ఫార్ములా CH2 Br. 0.188 g ల సమ్మేళనం 14 °C ఉష్ణోగ్రత వద్ద, 752 mm ల పీడనం వద్ద 24.2 c.c. ల గాలిని స్థానభ్రంశం చేసింది. అయితే సమ్మేళనం అణుఫార్ములాను కనుక్కోండి. (జలబాష్పపీడనం 14°C వద్ద 12mm).
జవాబు:
అనుభావిక ఫార్ములా = CH2Br
సమ్మేళన భారం = 0.188గ్రా.
వాయు ఘనపరిమాణం = 24.2 CC
ఉష్ణోగ్రత = 14°C = 287 K
పీడనం = 752 మి.మీ.

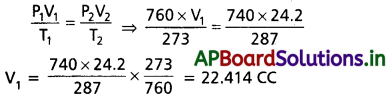
0.188గ్రా. ల కర్బన సమ్మేళనం 22.414 CC గాలి (వాయువు)ని స్థానభ్రంశం చెందించినది
– ? కర్బన సమ్మేళనం 22400 CC గాలి (వాయువు)ని స్థానభ్రంశం చెందిస్తుంది.

ప్రశ్న 8.
420 kg ల HCZ ని తయారు చేయడానికి 90% H2SO4 ఎంత అవసరమవుతుంది?
2 NaCl + H2SO4 → Na2SO4 + 2HCl
జవాబు:
ఇవ్వబడిన సమీకరణం
2 NaCl + H2SO4 → Na2SO4 + 2HCl
1 మోల్ H2SO4 → 2 మోల్స్ HCl
98 గ్రా. H2SO4 → 2 × 36.5 = 73 గ్రా. HCl

420 × 10³ గ్రా. HCI తయారీకి 626.5 × 103 గ్రా. 90% H,SO అవసరము.
![]()
ప్రశ్న 9.
ఒక అంతరిక్ష ప్రయాణికుడికి 34g ల సుక్రోజ్ను దహనం చేయటం వల్ల వచ్చే శక్తి తన శరీరానికి ఒక గంటకు అవసరం అవుతుంది. ఒక రోజుకు తనకు కావలసిన శక్తి కోసం అతడు ఎంత ఆక్సిజన్ను తనతో తీసుకుపోవాలి?
జవాబు:
ఒక గంటకు అంతరిక్ష ప్రయాణికుడికి అవసరమగు సుక్రోజ్ = 34 గ్రా
ఒక రోజుకు అవసరమగు సుక్రోజ్ = 34 × 24 గ్రా
సుక్రోజ్ దహన ప్రక్రియ సమీకరణం
C12 H22 O11 + 12O2 → 12CO2 + 11 H2O + శక్తి
1 మోల్ సుక్రోజ్ → 12 మోల్స్ O2
342 గ్రా. సుక్రోజ్ → 12 × 32 గ్రా. O2
34 × 24 గ్రా. సుక్రోజ్ → ?
\(\frac{34\times34}{342}\) × 12 × 32 = 916.21గ్రా.
∴ అంతరిక్ష ప్రయాణికునికి ఒక రోజుకి 916.21 గ్రా. ఆక్సిజన్ అవసరం.
ప్రశ్న 10.
4g ల CaCO3 వేడిచేస్తే STP వద్ద వెలువడే CO, ఘనపరిమాణం ఎంత?
జవాబు:
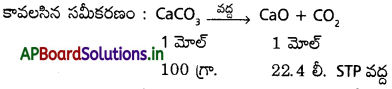
100 గ్రా. CaCO3 నుండి వెలువడిన CO2 STP వద్ద 22.4 లీ. ఘ.ప. ఆక్రమిస్తుంది.
∴ 4 గ్రా. CaCO3 – ?
\(\frac{4\times22.4}{100}\) = 0.894 లీ. STP వద్ద.
ప్రశ్న 11.
50 g ల గంధక నమూనా (s) గాలిలో మండిస్తే 4% నమూనా మిగిలిపోయింది. STP వద్ద 21% ఆక్సిజన్ ఘనపరిమాణం గల గాలి ఘనపరిమాణాన్ని లెక్కించండి.
జవాబు:
50 గ్రా. గంధక నమూనా (s) మండిస్తే 4% నమూనా మిగిలినది.
50 గ్రా. s → 48 గ్రా. సల్ఫర్ మండినది.
s + O2 → SO2
32 గ్రా. S – 22.4 లీ. O2 (STP వద్ద)
48 గ్రా. s – ?
\(\frac{48\times22.4}{32}\) = 33.6.
100 లీ. గాలిలో 21 మి.లీ. ఆక్సిజన్ కలదు
33.6 లీ. ల ఆక్సిజన్ – ఘ.ప. గాలిలో కలదు
\(\frac{33.6\times100}{21}\) = 160 లీ.
దహన ప్రక్రియకు అవసరమగు గాలి = 160 లీ.
ప్రశ్న 12.
20°C, 770 mm Hg పీడనం వద్ద 10 cc మిథేన్ న్ను పూర్తిగా దహనం చేయడానికి STP పరిస్థితిలలో కావలసిన ఆక్సిజన్ ఘనపరిమాణాన్ని లెక్కించండి.
జవాబు:
10 cc CH4, 20°C, 770 మి.లీ. పీడనం వద్ద దహనం జరిగినది.
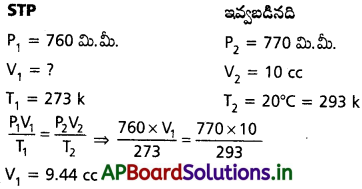
STP వద్ద CH4 ఘనపరిమాణం = 9.44 cc.
CH4 + 2O2 → CO2 + H2O
1 మోల్ CH4 → 2 మోల్స్ ఆక్సిజన్
22,400 cc CH4 → 2 × 22400 cc ఆక్సిజన్
9.44 cc CH4 → ?
\(\frac{9.44}{22400}\) × 2 × 22400 = 18.88 cc
STP వద్ద ఆక్సిజన్ వాయు ఘనపరిమాణం = 18.88 cc.
ప్రశ్న 13.
27°C, 760mm Hg పీడనం వద్ద 0.6g మెగ్నీషియంపై అధిక సజల HCl సమక్షంలో వెలువడే H2 ఘనపరిమాణం గణించండి.
జవాబు:
Mg + 2HCl → MgCl2 + H2
24 గ్రా. ల Mg – 1→ 1 మోల్ H2 (STP వద్ద)
= 22.4 లీ. (STP వద్ద)
0.6 గ్రా. Mg → ?

27°C, 760 మి.మీ. పీడనం వద్ద H2 ఘనపరిమాణం 615.4 మి.లీ.
ప్రశ్న 14.
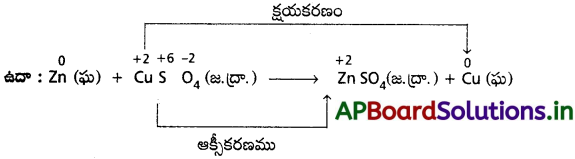
అంశమాపక పద్ధతిలో గాల్వనో ఘటంలో రెడాక్స్ చర్యల పాత్రను వివరించండి.
జవాబు:
ఎ) అంశమాపక పరిమాణాత్మక విశ్లేషణలో రిడాక్స్ చర్యలు :
అంశమాపక విశ్లేషణలో గాఢత తెలిసిన పదార్థ ద్రావణాన్ని సాధారణంగా టైట్రంట్ అనీ, అంశమాపనం చేయవలసిన పదార్ధ ద్రావణాన్ని టైట్రంట్ అనీ అందురు. ప్రమాణద్రావణాన్ని చర్య పూర్తయ్యే వరకు కలపడాన్ని అంశమాపనం అంటారు. ఏ కనీస స్థానం వద్దనైతే టైట్రంట్ అప్పుడే పూర్తిగా చర్య జరిపి ఉంటుందో ఆ స్థానాన్ని తుల్యత స్థానం లేదా సిద్ధాంత స్థానం లేదా అంతిమ స్థానం అంటారు. రిడాక్స్ చర్యలలో అంశమాపనం పూర్తయిన విధానం ఒక అనువైన పద్ధతిలో గుర్తిస్తారు. అలాంటి కొన్ని పద్ధతులు.
i) ఒక భౌతిక ధర్మాన్ని పరిశీలించండి.
ఉదా : KMnO4 ద్రావణపు లేతగులాబి రంగును పరిశీలించడం.
ii) ‘సూచిక’ అనే కారకం ఉపయోగించి, అది తెచ్చే “చూసి గుర్తించగల మార్పు”ను గమనించవచ్చు. రంగులో మార్పు కన్పించే స్థానాన్ని అంతిమ స్థానం అంటారు.
1. Cr2O-27 అంశమాపక చర్యల్లో డైఫినైల్ ఎమైన్ను సూచికగా వాడతారు. ఇది అంతిమ స్థానం వద్ద Cr2O-27 చేత ఆక్సీకరణం చెందించబడి ముదురు నీలిరంగునిస్తుంది.
K2Cr2O7 + 7H2SO4 + 6FeSO4 → K2SO4 + Cr2(SO4)3 + 3Fe2(SO4)3 + 7H2O
2. Cu2+, I– అంశమాపక చర్యల్లో ఏర్పడిన అయోడిన్ స్టార్చ్ ద్రావణంలో ముదురు నీలిరంగునిస్తుంది.
2Cu2+ (జ.ద్రా) + 4I– (జ. ద్రా) → Cu2I2 (ఘ) + I2 (జ. ద్రా)
ఇది ఒక రిడాక్స్ చర్య.
3. I2, S2O2-3 ల చర్యలో స్టాయికియోమెట్రిక్ సమీకరణం
I2 (జ. ద్రా) + 2S2O-23 (జ. ద్రా) → 2I (జ. ద్రా) + S4O2-6 (జ. ద్రా)
ఈ విధంగా రిడాక్స్ చర్యలను అంశమాపక విశ్లేషణంలో ఉపయోగిస్తారు.
బి) రిడాక్స్ చర్యలు – గాల్వానిక్ ఘటాలు :
గాల్వానిక్ ఘటంలో జరుగు ఘటక చర్య (రిడాక్స్ చర్య) :
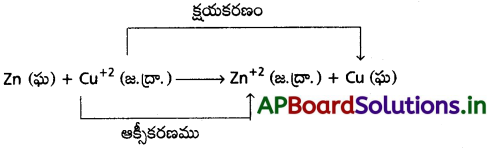
జింక్ నుంచి Cu2+ కు ఎలక్ట్రాన్ల బదిలీ నేరుగా జరుగుతుంది. దీనిని పరోక్షంగా జరపడానికి Zn కడ్డీని జింక్ సల్ఫేట్ ద్రావణంలో ఒక బీకరులో వుంచుతారు. ఇంకో బీకరులో CuSO, ద్రావణాన్ని తీసికొని దానిలో కాపర్ కడ్డీని వుంచుతారు. రెండు బీకర్లు ఇప్పుడు ఆయా పదార్థాల ఆక్సీకరణ, క్షయకరణ స్థితుల రూపాలతో వుంటాయి. కాపర్ సల్ఫేట్, కాపర్ కడ్డీ ఉన్న బీకరులో కాపర్ కడ్డీ అంతర తలం. దగ్గర Cu, Cu2+ రూపాలుంటాయి. అదే రెండో బీకరులో జింక్ కడ్డీ అంతర తలం దగ్గర Zn, Zn2+ రెండు రూపాలుంటాయి. ఒక పదార్థపు ఆక్సీకరణ, క్షయకరణ రూపాల్ని రిడాక్స్ కపుల్ (లేదా) రిడాక్స్ యుగ్మం అంటారు. ఇవి ఆక్సీకరణ అర్థచర్యలో (లేదా) క్షయకరణ అర్థచర్యలో పాల్గొంటాయి. రెండు బీకర్లలో ఒక్కొక్క రిడాక్స్ కపుల్ వుంటుంది. పై అమరికలో రెండు రిడాక్స్ యుగ్మాలను Zn2+ / Zn, Cu2+ / Cu లుగా సూచిస్తారు. గాల్వానిక్ ఘటాన్ని ఈవిధంగా సూచిస్తారు. Zn/zn2+//Cu2+/Cu.
![]()
ప్రశ్న 15.
మోలార్ ద్రవ్యరాశిని నిర్వచించి వివరించండి.
జవాబు:
మోలార్ ద్రవ్యరాశి : ఒక మోల్ ఏ పదార్థం ద్రవ్యరాశియైనా గ్రాముల్లో చెబితే అది దాని మోలార్ ద్రవ్యరాశి.
ఉదా :
i) సల్ఫ్యూరిక్ ఆమ్లం మోలార్ ద్రవ్యరాశి 98 గ్రా.
ii) ఒక గ్రాము పరమాణువు ద్రవ్యరాశి హైడ్రోజన్ అంటే ఒక గ్రాము హైడ్రోజన్, ఒక గ్రాము అణు ద్రవ్యరాశి హైడ్రోజన్ అంటే రెండు గ్రాముల హైడ్రోజన్.
ప్రశ్న 16.
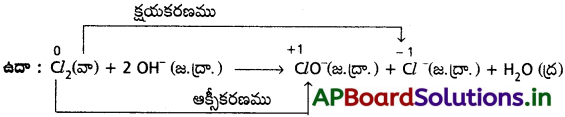
అసౌష్ఠవ విఘటన చర్యలు (అననుపాత చర్యలు) (డిస్ ప్రపోర్షనేషన్ చర్యలు) ఏవి ? ఉదాహరణలు ఇవ్వండి.
జవాబు:
అననుపాత చర్యలు (Disproportionation Reactions) :
ఈ చర్యల్లో ఒకే మూలకం ఇచ్చిన స్థితినుంచి ఆక్సీకరణం, క్షయకరణం రెండూ ఒకే సమయంలో పొందుతుంది.
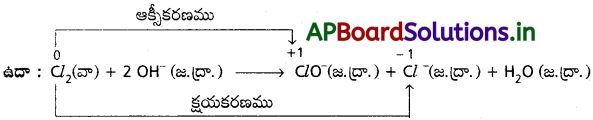
పై చర్యలో ‘Cl2‘ నే ఆక్సీకరణానికి మరియు క్షయకరణానికి కూడా లోనవుతుంది.
ప్రశ్న 17.
కంప్రపోర్షనేషన్ (సహానుపాత) చర్యలను ఉదాహరణలతో వివరించండి.
జవాబు:
సహానుపాత చర్యలు (Comproportionation reactions) :
ఈ చర్యల్లో రెండు వేరు వేరు ఆక్సీకరణ స్థితుల్లో ఉన్న ఒక మూలకం క్రియాజనకాలుగా మధ్యస్థ ఆక్సీకరణ స్థితి వున్నా క్రియాజన్యాన్నిస్తుంది.
ఈ చర్య అననుపాత చర్యకు తిరోగామిచర్య.
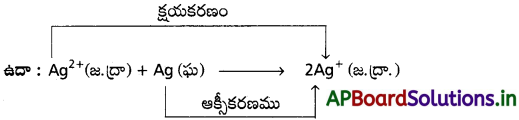
ప్రశ్న 18.
69.9% ఐరన్, 30.1% డై ఆక్సిజన్ గల ఐరన్ ఆక్సైడ్ అనుభావిక ఫార్ములాను కనుక్కోండి.
జవాబు:
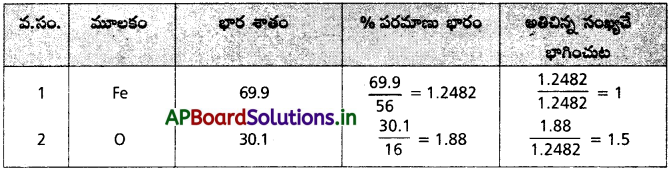
సమ్మేళన ఫార్ములా = Fe1 O1.5
అనుభావిక ఫార్ములా = Fe2O3
ప్రశ్న 19.
82.0245 g mol-1 మోలార్ ద్రవ్యరాశి గల సోడియం ఎసిటేట్ 500 mL 0.375 మోలార్ జల ద్రావణాన్ని తయారుచేయడానికి కావలసిన సోడియం ఎసిటేట్ (CH3 COONa) ద్రవ్యరాశిని గణించండి.
జవాబు:

ప్రశ్న 20.
20 g షుగర్ (C12H22O11) ని 2L నీటిలో కరిగిస్తే వచ్చే గాఢత ఎంత?
జవాబు:
[C12H22OH] అణుభారం = 342
V = 2 లీ
భార = 20 gms
ప్రశ్న 21.
ఈ కింది వాటిలో ఎన్ని సార్థక అంకెలు ఉన్నాయో తెలపండి.
(i) 0.0025 (ii) 208 (iii) 5005 (iv) 126,000 (v) 500.0 (vi) 2.0034
జవాబు:
i) 0.0025 కు 2 సార్థక అంకెలు కలవు
ii) 208 కు 3 సార్థక అంకెలు కలవు
iii) 5005 కు 4 సార్థక అంకెలు కలవు
iv) 126,000 కు 3 సార్థక అంకెలు కలవు
v) 500.0 కు 4 సార్థక అంకెలు కలవు
vi) 2.0034 కు 5 సార్థక అంకెలు కలవు
ప్రశ్న 22.
ఈ కింది వాటిని మూడు సార్థక అంకెల వరకు సరిదిద్దండి.
(i) 34.216 (ii) 10.4107 (iii) 0.04597 (iv) 2808
జవాబు:
i) 34.216 – 34.2
ii) 10,4107- 10.4
iii) 0.04597 – 0.046
iv) 2808-281
ప్రశ్న 23.
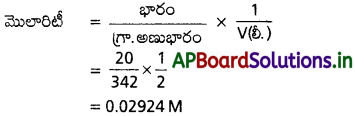
0.040 మోల్ భాగం ఉన్న ఇథనోల్ జలద్రావణంలో ఇథనోల్ మొలారిటీని గణించండి. (నీటి సాంద్రతను ఒకటిగా తీసుకోండి).
జవాబు:
ఇథనోల్ మొలారిటీ = 2.09 M
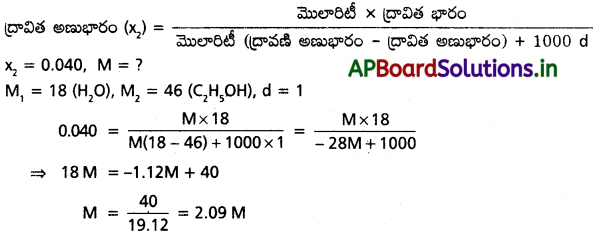
ప్రశ్న 24.
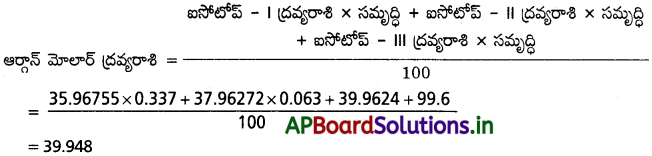
కింది పట్టికలోని దత్తాంశాలనుపయోగించి ప్రకృతిసిద్ధంగా లభించే ఆర్గాన్ ఐసోటోప్ల మోలార్ ద్రవ్యరాశిని గణించండి.

జవాబు:
ప్రశ్న 25.
వెల్డింగ్ చేసే వాయు ఇంధనంలో కార్బన్, హైడ్రోజన్ మాత్రమే ఉంటాయి. కొద్ది నమూనాను ఆక్సిజన్ సమక్షంలో మండిస్తే 3.38 g కార్బన్ డైఆక్సైడ్, 0.690 g నీరు ఏర్పడ్డాయి. మరి ఏ ఇతర ఉత్పన్న పదార్థం రాలేదు. 10.0 L (STP వద్ద కొలిచిన) ఈ వెల్డింగ్ వాయువు 11.6 g బరువు ఉన్నది. దాని (i) అనుభావిక ఫార్ములా, (ii) వాయువు ద్రవ్యరాశి, (iii) అణుఫార్ములా గణించండి.
జవాబు:
1 గ్రా. వాయువు మండించబడినది అని అనుకొనుము.
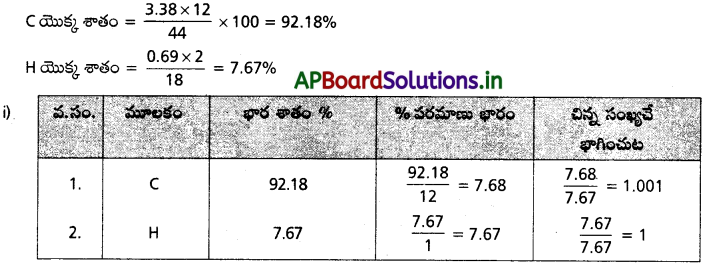
అనుభావిక ఫార్ములా = C1H1 = CH
ii) STP వద్ద 10 లీ. వాయు భారం – 11.6 గ్రా.
22.4 లీ. వాయువు STP వద్ద —– ?
\(\frac{22.4\times11.6}{10}\) = 25.984 గ్రా.
∴ వాయువు అణుభారం = 25.984 గ్రా.
iii) అణుఫార్ములా = n (అనుభావిక ఫార్ములా)
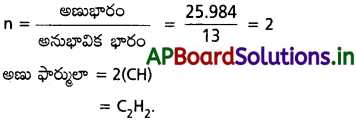
ప్రశ్న 26.
కాల్షియం కార్బొనేట్ సజల HCl తో చర్య జరిపి CaCl2 ను, CO2 ను ఇచ్చే రసాయన చర్య.
CaCO3 (ఘ) + 2 HCl (జల) → CaCl2 (జల) + CO2 (వా) + H2O (ద్ర)
25 mL ల 0.75 M HCI సజల ద్రావణంతో పూర్తిగా చర్య జరగడానికి కావలసిన CaCO3 ద్రవ్యరాశి ఎంత?
జవాబు:
CaCO3 + 2HCl → CaCl2 + CO2 + H2O
ప్రశ్న 27.
50ml 0.1 N సోడియం కార్బొనేట్ ద్రావణానికి 150 ml నీటిని కలిపితే వచ్చిన ద్రావణం నార్మాలిటీని గణించండి.
జవాబు:
N1 = 0.1 N
V1 = 50 మి.లీ.
N2 = ?
V2 = 50 + 150 = 200 మి.లీ.
N1V1 = N2V2
0.1 × 50 = N2 × 200
N2 = 0.025 N
ప్రశ్న 28.
200 ml 0.2 సోడియం హైడ్రాక్సైడ్ ద్రావణాన్ని తటస్థీకరించడానికి కావలసిన 0.1N సల్ఫ్యూరిక్ ఆమ్లం ఘనపరిమాణాన్ని గణించండి.
(ఇది ఆమ్ల – క్షార తటస్థీకరణ చర్య కాబట్టి తటస్థీకరణ స్థానం వద్ద, ఆమ్ల తుల్యతలు = క్షార తుల్యతలు)
జవాబు:
N1 = 0.1 N, V1 = 1 ?
V2 = 200 మి.లీ. N2 = 0.2 N
V1 = 400 మి.లీ.
N1V1 = N2V2
0.1 × V1 = 0.2 × 200
![]()
ప్రశ్న 29.
250 ml ల 0.2 N సోడియం హైడ్రాక్సైడ్ (NaOH) ని తటస్థీకరించడానికి ఎంత నార్మాలిటీ గల 50 ml H2SO4 కావాలి?
జవాబు:
N1 = ?,
N2 = 0.1 N,
V1 = 50 మి.లీ.
V2 = 250 మి.లీ.
N1V1 = N2V2
N1 × 50 = 0.1 × 250
N1 = 0.5 N
ప్రశ్న 30.
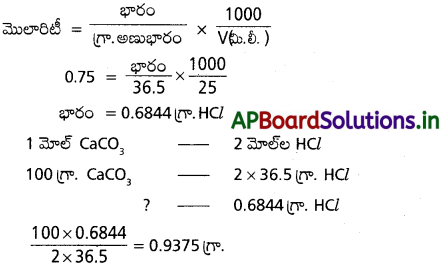
100 ml ల 0.1 M H2C2O4.2H2O ద్రావణంతో సల్ఫ్యూరిక్ ఆమ్లం సమక్షంలో చర్య జరపడానికి కావలసిన 0.1 M KMnO4 ద్రావణం ఘనపరిమాణాన్ని గణించండి.
జవాబు:
రసాయన సమీకరణం
2 KMnO4 + 5H2C2O4 + 3H2SO4 → 2 MnSO4 + 8 H2O + 10 CO2
ప్రశ్న 31.
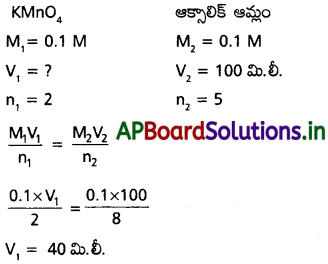
కింది పదార్థాల్లో కింద గీతతో చూపించిన మూలకాల ఆక్సీకరణ స్థితులు తెలపండి.
a) NaH2PO4
b) NaHSO4
c) H4P2O7
d) K2MnO4
e) CaO2
f) NaBH4
g) H2S2O7
h) Kal(SO4)2.12 H2O
జవాబు:
a) NaH2PO4
1(1) + 2(1) + x + 4 (- 2) = 0
x = + 5
b) NaHSO4
1(1) +1(1) + x + 4 (- 2) = 0
x = + 6
c) H4P2O7
4(1)+ 2x + 7(-2) = 0
4 + 2x – 14 = 0
x = + 5
d) K2MnO4
2(1) + x + 4(-2) = 0
x = + 6
e) CaO2
2 + 2x =0
x = -1
f) NaBH4
1(1) + x + 4(-1) = 0
x = + 3
g) H2S2O7
2(1) + 2x + 7(-2) = 0
x = + 6
h) Kal(SO4)2.12 H2O
పొటాష్ ఆలం ఇవ్వబడినది.
∴ Al2(SO4)3 ⇒ 2x + 3(-2) = 0 ⇒ x = 3
ప్రశ్న 32.
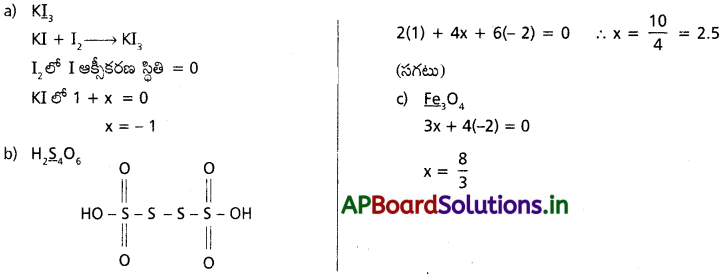
కింది పదార్థాల్లో కింద గీతతో చూపించిన మూలకాల ఆక్సీకరణ స్థితులు ఇవ్వండి. మీరిచ్చిన ఆక్సీకరణ స్థితులను ఎలా వివరిస్తారు? a) KI3 b) H2S4O6 c) Fe3O4
జవాబు:
ప్రశ్న 33.
కింది ఆక్సీకరణ – క్షయకరణ (redox) చర్యలను వివరించండి.
a) CuO (ఘ) + H2(వా) → Cu (ఘ) + H2O(వా)
b) Fe2O3 (ఘ) + 3CO(వా) → 2 Fe (ఘ) + 3 CO2(వా)
c) 4 BCl3(వా) + 3 LiAlH4(ఘ) → 2 B2H6(వా) + 3 LiCl (ఘ) + 3 AlCl3(ఘ)
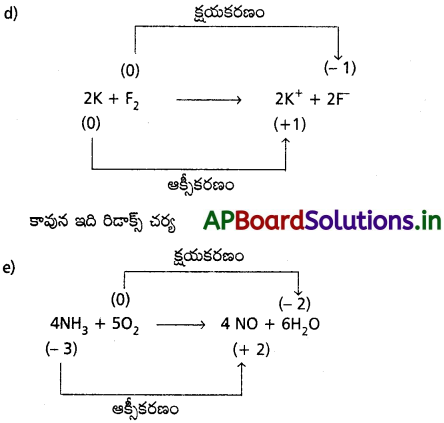
d) 2 K (ఘ) + F2(వా) → 2 K+F –(ఘ)
e) 4 NH3(వా) + 5 O2(వా) → 4 NO(వా) + 6 H2O(వా)
జవాబు:
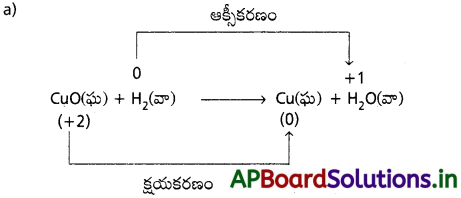
కావున ఇది రిడాక్స్ చర్య
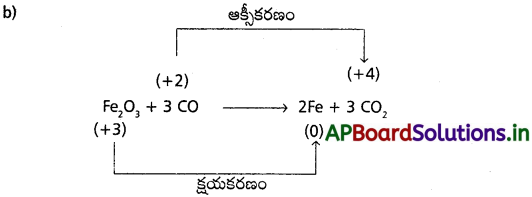
కావున ఇది రిడాక్స్ చర్య
c) 4BCl3 + 3 LiAlH4 → 2B2H6 + 3 LiCl + 4 AlCl3
ఈ సమీకరణంలో మూలకాల ఆక్సీకరణ స్థితులలో మార్పు లేదు కావున ఇది రిడాక్స్ చర్యకాదు
కావున ఇది రిడాక్స్ చర్య
ప్రశ్న 34.
ఫ్లోరిన్ మంచుతో చర్య జరిపి కింది మార్పును ఇస్తుంది.
H2O(ఘ) + F2(వా) → HF(వా) + HOF(వా)
ఇది ఆక్సీకరణ – క్షయకరణ (redox) చర్యగా వివరించండి.
జవాబు:
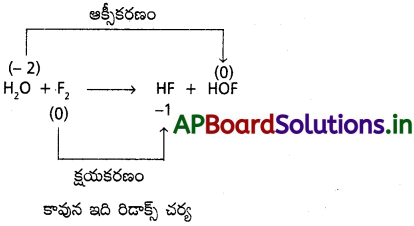
ప్రశ్న 36.
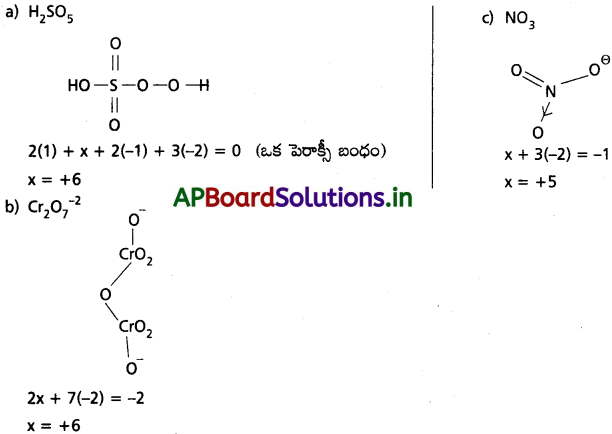
H2SO5, Xρ2O2-7, NO–3 లలో S, Cr, N ల ఆక్సీకరణ సంఖ్యలను ఇవ్వండి. ఆ అణువు లేదా అయానుల నిర్మాణాలు రాయండి.
జవాబు:
ప్రశ్న 37.
కింది సంయోగ పదార్థాల ఫార్ములాలు రాయండి.
(a) మెర్క్యురీ (II) క్లోరైడ్
(b) నికెల్ (III) సల్ఫేట్
(c) టిన్ (IV) ఆక్సైడ్
(d) థాలియం (I) సల్ఫేట్
(e) ఐరన్ (III) సల్ఫేట్
(f) క్రోమియం (III) ఆక్సైడ్
జవాబు:
a) HgCl2
b) NiSO4
c) SnCl4
d) Tl2SO4
e) Fe2(SO4)3
f) Cr2O3
![]()
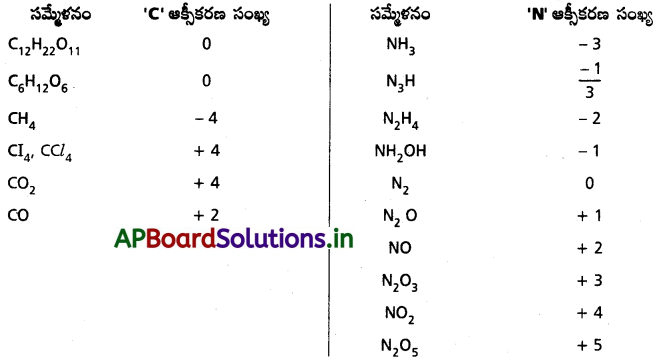
ప్రశ్న 38.
కార్బన్ -4 నుంచి + 4 వరకు నైట్రోజన్ – 3 నుంచి +5 వరకు ఆక్సీకరణ స్థితులు చూపే కొన్ని పదార్థాల పట్టిక ఇవ్వండి.
జవాబు:
ప్రశ్న 39.
SO2, H2O2 లు ఆక్సీకరణులుగాను, క్షయకరణులుగాను రెండు విధాలుగా పనిచేస్తాయి. కానీ HNO3 కేవలం ఆక్సీకరణిగానే పనిచేస్తుంది. ఎందువల్ల?
జవాబు:
- SO3 మరియు H2O2 రెండును ఆక్సీకరణి, క్షయకారిణులుగా పనిచేస్తాయి.
- ఓజోన్ ఆమ్ల యానకంలో బలమైన ఆక్సీకారిణిగా పనిచేయును (ఓజోన్ కొన్ని చర్యలలో క్షయకారిణిగా కూడా పనిచేయును).
- HNO3 బలమైన ఆక్సీకారిణి. ఇది H+ అయాన్ను త్వరితగతిన దానం చేయును మరియు ‘N’ ఆక్సీకరణ స్థితి HNO3 లో +5 కావున ఇది బలమైన ఆక్సీకారిణి.
ప్రశ్న 40.
a) 6CO2 (వా) + 6H2O (ద్ర) → C6H12O6 (జల) + 6O2(వా)
b) O3(వా) + H2O2(ద్ర) → H2O(ద్ర) + 2O2(వా)
పైన ఇచ్చిన చర్యలను కింది విధంగా రాస్తే ఇంకా ఎక్కువ అర్థవంతంగా ఉంటుంది. ఎందువల్ల?
a) 6CO2(వా) + 12H2O(ద్ర) → C6H12O6(జల) + 6H2O(ద్ర) + 6O2(వా)
b) O3(వా) + H2O2 (ద్ర) → H2O(ద్ర) + 2O2 (వా) + O2(వా)
(a), (b) చర్యాగతలు శోధనకు సాంకేతిక ప్రక్రియలను వివరించండి.
జవాబు:
a) 6 CO2 (వా) + 12 H2O(ద్ర) → C6H12O6 (జల)+ 6H2O(ద్ర) + 6O2 (వా)
ఈ చర్యను ఇలా వ్రాయడం అర్థవంతంగా ఉంటుంది. ఎందువలన అనగా ఆక్సీజన్ విడుదల H2O నుండి జరుగును కానీ CO2 నుండికాదు.
b) O3 (వా) + H2O2 (ద్ర) → H2O (ద్ర) + O2(వా)
ఈ చర్యను ఇలా వ్రాయడం అర్ధవంతంగా ఉంటుంది. ఎందువలన అనగా ఈ చర్యలో ఏది ఆక్సీకరణం చెందునో ఏది క్షయకారణం చెందునో సరిగా వివరించబడినది.
ప్రశ్న 41.
AgF2 సంయోగ పదార్థం చాలా అస్థిరమైంది. అది ఏర్పడితే ఒక బలమైన ఆక్సీకరణిగా పనిచేస్తుంది. ఎందువల్ల?
జవాబు:
- AgF2 అనునది చాలా అస్థిరమైన సమ్మేళనం.
- ఇది ఒక వేళ ఏర్పడినచో బలమైన ఆక్సీకారిణి.
వివరణ :
- AgF2 F2 వాయువును విడుదల చేస్తుంది. F2 అనునది బలమైన ఆక్సీకారిణి.
- కావున AgF2 ఒక మంచి (బలమైన) ఆక్సీకారిణి.
ప్రశ్న 42.
ఒక ఆక్సీకరణి, ఒక క్షయకరణిల మధ్య చర్య జరిగితే క్షయకరణి అధికంగా ఉన్నప్పుడు తక్కువ ఆక్సీకరణస్థితి సంయోగ పదార్థం, ఆక్సీకరణి అధికంగా ఉంటే ఎక్కువ ఆక్సీకరణస్థితి సంయోగ పదార్థం ఏర్పడతాయి. దీనిని కనీసం మూడు ఉదాహరణలతో వివరించండి.
జవాబు:
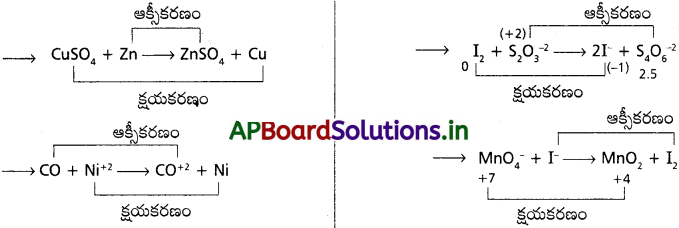
ప్రశ్న 43.
ఈ కింది వాటిని ఏ విధంగా వివరిస్తారు?
(a) క్షారీకృత KMnO4, ఆమ్లీకృత KMnO4 లు ఆక్సీకరణులైనా టొల్వీన్ నుంచి బెంజోయిక్ ఆమ్లం తయారీలో ఆల్కహాలిక్ KMnO4 ను ఆక్సీకరణిగా వాడతారు. ఎందువల్ల ? చర్యకు తుల్య ఆక్సీకరణ – క్షయకరణ సమీకరణం రాయండి.
(b) మూలక రసాయన మిశ్రమంలో క్లోరైడ్ ఉంటే దానికి గాఢ సల్ఫ్యూరిక్ ఆమ్లం కలిపినప్పుడు ఘాటైన వాసనగల HCl వాయువు వెలువడుతుంది. ఐతే మిశ్రమంలో బ్రోమైడ్ లవణం ఉంటే ఎర్రటి బ్రోమిన్ వస్తుంది. ఎందువల్ల?
జవాబు:
a) KMnO4/H+ యొక్క తుల్య సమీకరణం (ఆమ్లయానకం)
MnO–4 + 8H+ + 5e– → Mn+2 + 4H2O
KMnO4/ OH– యొక్క తుల్య సమీకరణం (క్షారయానకం)
MnO–4 + 2H2O + 3e– → MnO2 + 4OH–
టోలీన్ ను బెంజోయిక్ ఆమ్లంగా ఆక్సీకరణం చేయును
![]()
b) గాఢ H2SO4 NaCl తో చర్య జరిపి HCl వాయువును విడుదల చేస్తుంది.
2NaCl + H2SO4 → Na2SO4 + 2 HCl
గాఢ H2SO4, KBr తో చర్య జరిపి చివరగా Br2 భాష్పాలను ఏర్పరచును.
2 KBr + H2SO4 → Na2SO4 + 2 HBr
2 MBr + H2SO4 → 2 H2O + SO2 + Br2 (ఎర్రటి బ్రోమిన్)
ప్రశ్న 44.
కింది చర్యల్లో ఆక్సీకరణి, క్షయకరణి, ఆక్సీకరణం చెందిన పదార్థం, క్షయకరణం చెందిన పదార్థం తెలపండి.
(a) 2AgBr (ఘ) + C6H6O2 (జల) → 2Ag(ఘ) + 2HBr(జల) + C6H4O2 (జల)
(b) HCHO(l) + 2[Ag(NH3)2]+ (జల) + 3OH–(జల) → 2Ag(ఘ) + HCOO– (జల) + 4NH3 (జల) + 2H2O(ద్ర)
(c) HCHO(ద్ర) + 2Cu2+ (జల) + 5OH–(జల) → Cu2O(ఘ) + HCOO–(జల)
(d) N2H4 (ద్ర) + 2H2O2 (ద్ర) → N2(వా) + 4H2O(ద్ర)
(e) Pb (ఘ) + PbO2(ఘ) + 2H2SO4 (జల) → 2PbSO4(ఘ) + 2H2O (X)
జవాబు:
(a) ఇవ్వబడిన సమీకరణం
(a) 2AgBr (ఘ) + C6H6O2 (జల) → 2Ag(ఘ) + 2HBr(జల) + C6H4O2 (జల)
- C6H6O2 ఆక్సీకరణం చెంది C6H4O2 గా మారును.
- Ag+ Br– క్షయకరణం చెంది Ag గా మారును.
- ఆక్సీకరణి Ag+
- క్షయకరణి C6H6O2.
(b) ఇవ్వబడిన సమీకరణం
HCHO(వా) + 2[Ag(NH3)2]+(జల) + 30H–(జల) → 2Ag(ఘ) + HCOO–(జల) + 4NH3(జల) + 2H2O(ద్ర)
- HCHO ఆక్సీకరణం చెంది HCOO– గా మారును.
- [Ag(NH3)2]+ క్షయకరణం చెంది Ag గా మారును.
- ఇందు ఆక్సీకరణి [Ag(NH3)2]+
- క్షయకరణి HCHO
(c) ఇవ్వబడిన సమీకరణం
HCHO (ద్ర) + 2Cu+2 (జల) + 5OH– (జల) → Cu2O(ఘ) + HCOO–(జల) + 3 H2O (ద్ర)
- HCHO ఆక్సీకరణం చెంది HCOO– గా మారును.
- Cu+2 క్షయకరణం చెంది Cu+ గా మారును. (Cu2O లో)
- Cu+2 అయాన్లు ఆక్సీకరణి
- క్షయకరణి HCHO
(d) ఇవ్వబడిన సమీకరణం
N2H4 (ద్ర) + 2H2O2 (ద్ర) → N2(వా) + 4 H2O (ఘ)
- N-2 ఆక్సీకరణం చెంది N2గా మారును.
- O2-2 క్షయకరణం చెంది O-2 గా మారును.
- H2O2 ఆక్సీకరణి
- N2H4 క్షయకరణి
(e) ఇవ్వబడిన సమీకరణం
Pb (ఘ) + PbO2(ఘ) + 2H2SO4 (జల) → 2PbSO4 (ఘ) + 2H2O (ఘ)
- Pb ఆక్సీకరణం చెంది Pb+2 గా మారును.
- PbO2 క్షయకరణం చెంది Pb+2 గా మారును.
- PbO2 ఆక్సీకరణి
- Pb క్షయకరణి
![]()
ప్రశ్న 45.
2S2O32- (జల) + I2 (ఘ) → S4O62- (జల) + 2I– (జల)
S2O32- (జల) + 2Br2 (ద్ర) + 5H2O (ద్ర) → 2SO42- (జల) + 4Br– (జల) + 10H+ (జల).
లలో Br2 I2 లు వేరువేరు విధానాల్లో చర్య జరుపుతున్నాయి. ఎందువల్ల?
జవాబు:
- థయో సల్ఫేట్ అయాన్ ఒక బలహీనమైన క్షయకరణి.
- I2 ఒక బలహీనమైన ఆక్సీకరణి
- I2 మరియు థయో సల్ఫేట్ మధ్య చర్య జరిగి (టెట్రాథయోనేట్) S4O2-6 అయాన్ ఏర్పడును.
2S2O-23 (జల) + I2(ఘ) → S4O-26 (జల) + 2I– (జల) - పై సమీకరణం ఎక్కువ చర్యారేటు కలిగి ఉంటుంది.
- థయో సల్ఫేట్ మరియు బ్రోమిన్ల మధ్య చర్యలో సల్ఫేట్ అయాన్ ఏర్పడును.
S2O-23(జల) + 2Br2 (ద్ర) + 5H2O (ద్ర) → 2SO-24 (జల) + 4Br– (జల) + 10H+ (జల). లల - కావున Br2 I2 కన్నా బలమైన క్షయకారిణి.
కావున పై చర్యలలో విభిన్నత్వం గమనించబడినది.
ప్రశ్న 46.
హాలోజన్లలో ఫ్లోరిన్ బలమైన ఆక్సీకరణి, హైడ్రో హాలిక్ సంయోగ పదార్థాల్లో హైడ్రో అయొడిక్ ఆమ్లం బలమైన క్షయకరణి వివరించండి.
జవాబు:
a) ఒక పదార్థం యొక్క ఆక్సీకరణ సామర్థ్యం కొన్ని శక్తి అంశాలపై ఆధారపడును. (చర్య ఎంథాల్పీ, ప్రమాణ విద్యుత్ పొటెన్షియల్.)
ఫ్లోరిన్కు ఎంథాల్పీ విలువ ఎక్కువ. ఎంథాల్పీ నందు ఋణాత్మక మార్పు ఎక్కువగా ఉన్నచో ఆక్సీకరణ శక్తి ఎక్కువగా ఉండును.
ఫ్లోరిన్ యొక్క ఆక్సీకరణ స్వభావాన్ని ఈ కింది చర్యలు బలపరుస్తాయి.
C + 2 F2 → CF4
ఫ్లోరిన్కు సూపర్ హాలోజన్ అని కూడా అంటారు.
హైడ్రోహాలిక్ సమ్మేళనాల మంచి క్షయకారిణులు, వాటి స్థిరత్వ క్రమం
HF >> HCl > HBr > HI
HI కు తక్కువ స్థిరత్వం కలిగి బలమైన క్షయకారిణిగా పనిచేయును.
![]()
ప్రశ్న 47.
కింది చర్య ఎందుకు జరుగుతుంది?
XeO4-6(జల) + 2F– (జల) + 6H+ (జల) → XeO3(వా) + F2 (వా) + 3H2O (ద్ర)
ఈ చర్య నుంచి Na4XeO6 అనే పదార్థం (దీనిలో XeO4-6 ఒక భాగం) గురించి ఏమి నిర్థారించవచ్చు?
జవాబు:
ఇవ్వబడిన సమీకరణం
XeO4-6 (జల) + 2F– (జల) + 6H+ (జల) → XeO3(వా) + F2 (వా) + 3H2O (ద్ర)
- పై చర్యలో Xe క్షయకరణం చెందును.
- F– అయాన్ F2 గా ఆక్సీకరణం చెందును. XeO4-6 అయాన్ బలమైన ఆక్సీకారిణి
- ఈ పర్బీనేట్ (XeO4-6) అయాన్ క్షారద్రావణంలో స్థిరమైనది.
- Na4XeO6 అనునది బలమైన ఆక్సీకారిణి.
ప్రశ్న 48.
కింది చర్యలను పరిశీలించండి.
(a)H3PO2 (జల) + 4 AgNO3 (జల) + 2H2O (ద్ర) → H3PO4 (జల) + 4Ag (ఘ) + 4HNO3 (జల)
(b)H3PO2 (జల)+ 2CuSO4 (జల) + 2H2O (ద్ర) → H3PO4 (జల) + 2Cu (ఘ) + H2SO4 (జల)
(c) C6H5CHO (ద్ర) + 2[Ag (NH3)2]+ (జల) + 3OH– (జల) → C6H5COO– (జల) + 2Ag (ఘ) + 4NH3 (జల) + 2H2O (ద్ర)
(d) C6H5CHO (ద్ర) + 2Cu2+ (జల) + 5OH– (జల) → మార్పు లేదు.
ఈ చర్యల నుంచి Ag+, Cu2+ ల ప్రవృత్తి గురించి మీరు ఏమని నిర్ధారించగలరు?
జవాబు:
- H3PO2 బలమైన క్షయకారిణి కావున ఇది Ag+ ను Ag గా మరియు Cu+2 ను Cu గా క్షయకరణం చెందించును.
- C6H5CHO క్షయకారిణి.
ఇది Ag+ ను Ag గా టాలెన్స్ కారకంలో క్షయకరణం చెందించింది.
కాని Cu+2 ను Cu గా క్షయకరణం చెందించలేదు.
ప్రశ్న 49.
కింది ఆక్సీకరణ- క్షయీకరణ చర్యలను అయాన్ – ఎలక్ట్రాన్ పద్ధతి ద్వారా తుల్యం చేయండి. [T.S. Mar. ’15; Mar. ’14]
(a) MnO–4 (జల) + I– (జల) → MnO2 (ఘ) + I2(ఘ) (క్షార యానకంలో)
(b)MnO–4 (జల) + SO2 (వా) → Mn2+ (జల) + HSO–4 (జల) (ఆమ్ల ద్రావణంలో)
(c) H2O2 (జల) + Fe2+ (జల) → Fe3+ (జల) + H2O (ద్ర) (ఆమ్ల ద్రావణంలో)
(d) Cr2O72- + SO2 (వా) → Cr3+ (జల) + SO42- (జల) (ఆమ్ల ద్రావణంలో)
జవాబు:
a) MnO4– + I– → MnO2 + I2 (క్షార యానకంలో)

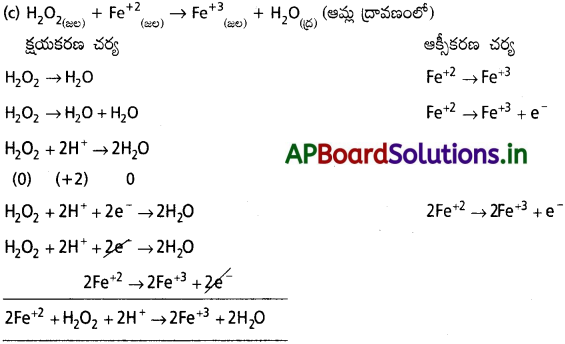

ప్రశ్న 50.
ఈ కింది సమీకరణాలను క్షార యానకంలో అయాన్ – ఎలక్ట్రాన్ పద్ధతి ద్వారా, ఆక్సీకరణ సంఖ్యా పద్ధతి ద్వారా తుల్యం చేసి, ఆక్సీకరణ కారకాన్ని, క్షయీకరణ కారకాన్ని గుర్తించండి.
(a) P4(ఘ) + OH (జల) → PH3(వా) + HPO2–(జల)
(b) N2H4 + ClO3–(జల) → NO(వా) + Cl–(వా)
(c) Cl2O7(వా) + H2O2(జల) → ClO2–(జల) + O2(వా) + H+
జవాబు:

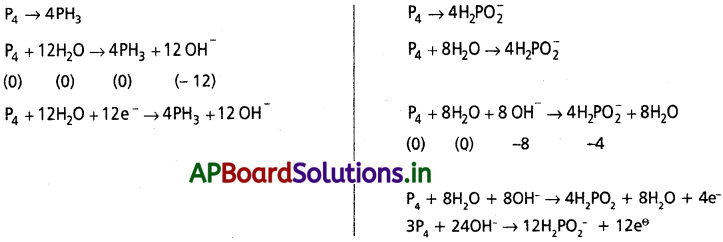
P4 + 12H2O + 12e– → 4PH3 + 12 OH–
3P4 + 24 OH– → 12H2PO2– + 12e–
4P4 + 12H2O + 12OH– → 12H2PO2– +4PH3
ఇచ్చట P4 ఆక్సీకారిణి, క్షయకారిణిగా పనిచేయును.


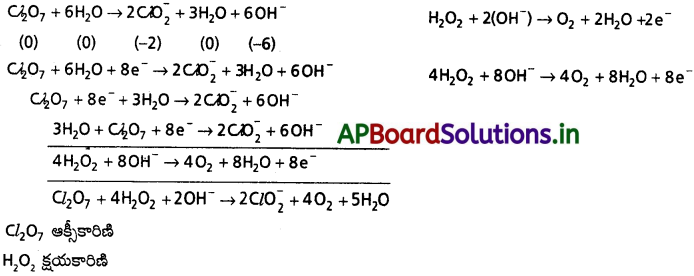
ప్రశ్న 51.
కింది చర్య ద్వారా మీకు ఏమి తెలుస్తోంది?
(CN)2(వా) + 2OH– (జల) → CN– (జల) + CNO– (జల) + H2O (ద్ర)
జవాబు:
(CN)2(వా) + 2OH–(జల) → CN–(జల) + CNO–(జల) + H2O(ద్ర)
(CN)2 + 2e– → 2 CN– (క్షయకరణం)
(జల)
(CN)2 + 2H2O → 2 CNO– + 4H+ + 2e– (ఆక్సీకరణం)
ఇచ్చట (CN)2 ఆక్సీకరణం మరియు క్షయకరణం చెందును.
కావున ఇది అననుపాత చర్య.
![]()
ప్రశ్న 52.
Mn3+ అయాన్ ద్రావణంలో అస్థిరంగా ఉండి, అననుపాతం చెంది Mn2+, MnO2, H+ అయాన్లనిస్తుంది. ఈ చర్యకు తుల్య అయానిక సమీకరణాన్ని రాయండి.
జవాబు:
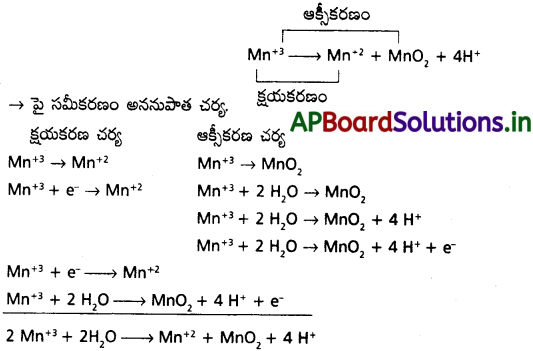
ప్రశ్న 53.
Cs, Ne, I, F
(a) రుణ ఆక్సీకరణస్థితిని మాత్రమే ప్రదర్శించే మూలకం ఏది?
(b) ధన ఆక్సీకరణస్థితిని మాత్రమే ప్రదర్శించే మూలకం ఏది?
(c) ధన, రుణ ఆక్సీకరణ స్థితులు రెండింటినీ ప్రదర్శించే మూలకం ఏది?
(d) ధన, రుణ ఆక్సీకరణ స్థితులలో దేనిని కూడా ప్రదర్శించని మూలకం ఏది?
జవాబు:
a) ‘F’ (ఫ్లోరిన్) మూలకం మాత్రమే రుణ ఆక్సీకరణస్థితిని ప్రదర్శిస్తుంది.
b) ‘Cs’ (సీజియం) మూలకం మాత్రమే ధన ఆక్సీకరణస్థితిని ప్రదర్శిస్తుంది.
c) ‘I (అయోడిన్) మూలకం ధన, రుణ ఆక్సీకరణ స్థితులను ప్రదర్శిస్తుంది.
d) ‘Ne’ (నియాన్) మూలకం ధన, రుణ ఆక్సీకరణ స్థితులలో దేనిని ప్రదర్శించదు.
ప్రశ్న 54.
తాగునీటిని శుద్ది చేయడానికి క్లోరినన్ను వాడతారు. అధిక క్లోరిన్ హానికరమైంది. అధికంగా ఉన్న క్లోరిన్ను సల్ఫర్ డైఆక్సైడ్తో చర్యనొందించి తొలగిస్తారు. నీటిలో జరిగే ఈ ఆక్సీకరణ క్షయీకరణ మార్పుకు తుల్య సమీకరణాన్ని ఇవ్వండి.
జవాబు:
ఇవ్వబడిన సమాచారమునకు తుల్య సమీకరణం
Cl2 + SO2 + H2O + SO3 + 2H+ + Cl–
ప్రశ్న 55.
మీ పుస్తకంలో ఇచ్చిన ఆవర్తన పట్టికను పరిశీలించి, కింది ప్రశ్నలకు జవాబు ఇవ్వండి.
(a) అననుపాత చర్యలను ప్రదర్శించే అలోహాలను ఎంపిక చేయండి.
(b) అననుపాత చర్యలను ప్రదర్శించే మూడు లోహాలను ఎంపిక చేయండి.
జవాబు:
a) క్లోరిన్, బ్రోమిన్, ఆక్సిజన్, సల్ఫర్, ఫాస్ఫరస్, అయోడిన్ అలోహాలు అననుపాత చర్యలను ప్రదర్శిస్తాయి.
b) క్రోమియం, మాంగనీసు మరియు Pb లోహాలు అననుపాత చర్యలను ప్రదర్శిస్తాయి.
ప్రశ్న 56.
ఆస్వాల్డ్ పద్ధతిలో నత్రికామ్లం తయారుచేసే చర్యల్లో మొదటి అంచెలో అమ్మోనియా ఆక్సిజన్తో ఆక్సీకరణం చెంది నైట్రిక్ ఆక్సైడ్, నీటి ఆవిరి వస్తాయి. చర్యను 10.0 g. అమ్మోనియా 20.0 g ఆక్సిజన్తో జరిపితే గరిష్ఠంగా ఎంత నైట్రిక్ ఆక్సైడ్ వస్తుంది?
జవాబు:
రసాయన చర్య
4NH3 + 5SO2 → 4NO + 6H2O
4 మోల్ల NH3 – 5 మోల్ O2
NH3 (అమ్మోనియా) యొక్క భారము 10 గ్రా అని ఇవ్వబడినది.

4 మోల్స్ అమ్మోనియా 5 మోల్ల ఆక్సిజన్ (02 ) తో చర్య జరుపుతుంది.
0.588 మోల్ల NH3 …. ?
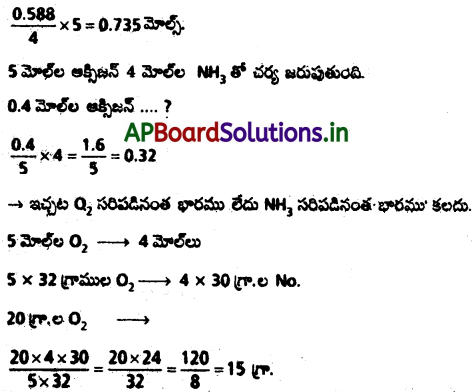
ప్రశ్న 57.
కింది లోహాలను వాటి లవణాల నుంచి ఒక దానితో ఒకటి స్థానభ్రంశం చెందించే క్రమంలో అమర్చండి
Al, Cu, Fe, Mg, Zn.
జవాబు:
Al – -1.66 v
Cu – +0.34 v
Fe – -0.40 v
Mg – -2.37 v
Zn – -0.76 v
పై లోహాలను వాటి లవణాల నుంచి ఒక దానితో ఒకటి స్థానభ్రంశం చెందించే క్రమం Mg > AM > Zn > Fe > Cu,
దీర్ఘ సమాధాన ప్రశ్నలు
ప్రశ్న 1.
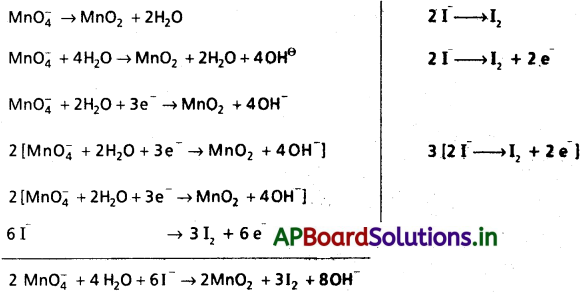
క్షార యానకంలో పర్మాంగనేట్ అయాన్, అయొడైడ్ (I -) అయాను ఆక్సీకరణం చేసి, అయొడిన్ (I2), మాంగనీస్ డై ఆక్సైడ్ (MnO2) ఇచ్చే చర్యకు తుల్య అయానిక సమీకరణాన్ని రాయండి.
జవాబు:
MnO4– + I– → MnO2 + I2 (క్షార యానకం)
(R.H.R) క్షయకరణ చర్య
MnO4– → MnO2
(OHR) ఆక్సీకరణ చర్య
I → I2
ప్రశ్న 2.
ఆమ్ల యానకంలో పర్మాంగనేట్ అయాన్, సల్ఫైట్ అయాన్లను, సల్ఫేట్ అయాన్లుగా ఆక్సీకరణం చేసే చర్యకు తుల్య సమీకరణాన్ని రాయండి.
జవాబు:
MnO4– + SO32- → Mn+2 + SO4-2

ప్రశ్న 3.
ఆమ్ల యానకంలో ఆక్జాలిక్ ఆమ్లం, పర్మాంగనేట్ అయాన్ తో Mn2+ గా ఆక్సీకరించబడుతుంది. అయాన్ – ఎలక్ట్రాన్ పద్ధతిలో చర్యను తుల్యం చేయండి.
జవాబు:

ప్రశ్న 4.
ఫాస్ఫరస్ ను NaOH ద్రావణంలో వేడిచేస్తే, ఫాస్ఫేన్ (PH3), H2PO–2 లను ఇస్తుంది. తుల్య సమీకరణాన్ని ఇవ్వండి.
జవాబు:
P4 + NaOH + H2O → PH3 + NaH2PO2
P4 + OH– → PH3 + H2PO2–
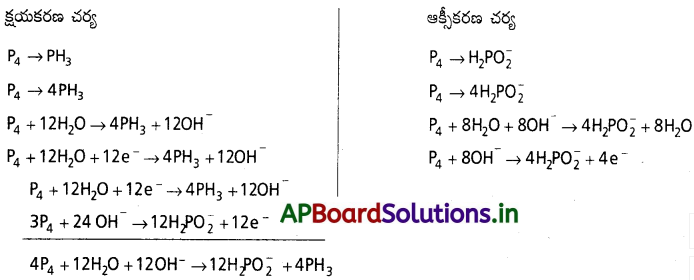
ఈ చర్యలో P4 ఆక్సీకారిణి మరియు క్షయకారిణిగా పనిచేయును.
![]()
ప్రశ్న 5.
కింది సమీకరణాన్ని తుల్యం చేయండి.
![]()
జవాబు:

ప్రశ్న 6.
కింది సమీకరణాన్ని ఆక్సీకరణ సంఖ్య పద్ధతిలో తుల్యం చేయండి.
MnO-24 + Cl2 → MnO-24 + Cl–
జవాబు:
MnO4-2 + Cl2 → MnO4-2 + Cl–
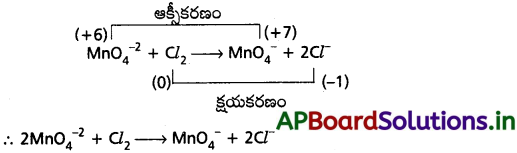
ప్రశ్న 7.
వివిధ రకాల ఆక్సీకరణ – క్షయకరణ (రెడాక్స్) చర్యలను వివరించండి.
జవాబు:
రెడాక్స్ చర్య :
ఎలక్ట్రాన్లను కోల్పోయే ప్రక్రియను ‘ఆక్సీకరణ చర్య’ అని, ఎలాక్ట్రాన్లను గ్రహించే ప్రక్రియను ‘క్షయకరణ’ చర్య’ అని అంటారు. ఈ రెండింటి మొత్తం చర్యను ‘ఆక్సీకరణ – క్షయకరణ’ (లేదా) కుదింపుగా ‘రెడాక్స్ చర్య’ అందురు.
రెడాక్స్ చర్యలు – వివిధ రకాలు :
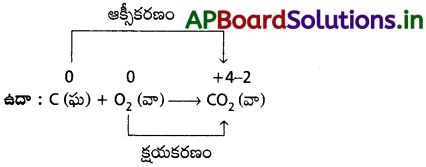
ఎ) రసాయన సంయోగ చర్యలు :
ఈ చర్యలలో రెండు మూలకాలు సంయోగము చెంది ఉత్పన్నాన్ని ఏర్పరుస్తాయి. ఈ ప్రక్రియలో ఒక మూలకము ఆక్సీకరణానికి మరియు రెండవ మూలకం క్షయకరణానికి లోనవుతుంది.
బి) వియోగ చర్యలు :
రసాయన సంయోగ పదార్థాలు రసాయనికంగా రెండు లేక అంతకంటే ఎక్కువ పదార్థాలుగా విడిపోవడాన్ని వియోగచర్యలంటారు. ఇవి చాలావరకు రెడాక్స్ చర్యలు.
సి) స్థానభ్రంశ చర్యలు :
ఈ చర్యల్లో సమ్మేళనంలోని ఒక అనుఘటకం వేరే ఘటకంతో ప్రతిక్షేపించబడితే ఆ చర్యను స్థానభ్రంశ చర్య అందురు.
డి) అననుపాత చర్యలు :
ఈ చర్యల్లో ఒకే మూలకం ఇచ్చిన స్థితినుంచి ఆక్సీకరణం, క్షయకరణం రెండూ ఒకే సమయంలో పొందుతుంది.
ఇ) సహానుపాత చర్యలు :
ఈ చర్యల్లో రెండు వేరు వేరు ఆక్సీకరణ స్థితుల్లో ఉన్న ఒక మూలకం క్రియాజనకాలుగా చర్య జరిపి మధ్యస్థ ఆక్సీకరణ స్థితివున్నా క్రియాజన్యాన్నిస్తుంది. ఈ చర్యలు, అనుపాత చర్యల తిరోగామిచర్యలు.
ప్రశ్న 8.
స్థిరానుపాత నియమాన్ని తెలపండి. ఒక సమస్యను సాధన చేయడం ద్వారా ఈ నియమాన్ని విశదీకరించండి.
జవాబు:
స్థిరానుపాత నియమము :
“ఒక నిర్ధిష్ట రసాయన సంయోగ పదార్ధంలో ఒకే మూలకాలు స్థిరభార నిష్పత్తిలో కలిసి ఉంటాయి.”
ఈ నియమాన్ని “జోసఫ్ ప్రౌస్ట్” ప్రతిపాదించాడు.
ఉదాహరణ :
“ప్రౌస్ట్” రెండు రకాల కాపర్ కార్బొనేట్ నమూనాలను తీసికొన్నాడు. అందులో ఒకటి ప్రకృతిలో లభించింది (సహజం). రెండోది ప్రయోగశాలలో సంశ్లేషణ చేసినది.
రెండు నమూనాల్లోను వివిధ మూలకాల భారశాతాన్ని తెలుసుకొన్నాడు. రెండు నమూనాలూ ఒకే భారశాతం సంఘటనతో వున్నాయి.
| మూలకం | భారశాతం | |
| సహజ నమూనా | ప్రయోగశాలలో చేసినది | |
| Cu | 51.35 | 51.35 |
| O | 9.74 | 9.74 |
| C | 38.91 | 38.91 |
అంటే తయారుచేసిన ప్రాంతం, చేసిన వ్యక్తి, తయారుచేసిన విధానంలాంటి వాటితో సంబంధం లేకుండా ఒక సంయోగ పదార్థం ఎల్లప్పుడూ ఒకే రకం మూలకాలను స్థిరభార నిష్పత్తిని కలిగి ఉంటుంది.
![]()
ప్రశ్న 9.
కింది చర్యల అంశమాపనంలో అంతిమ స్థానాలను ఎట్లా గుర్తిస్తారు?
i) MnO-24తో Fe2+ ను ఆక్సీకరించుట
ii) Cr2O2-7 తో Fe2+ ను ఆక్సీకరించుట
iii) Cu2+ తో I– ను ఆక్సీకరించుట
జవాబు:
i) KMnO4 ను ఉపయోగించే అంశమాపనాల్లో ప్రత్యేకంగా సూచికను వాడవలసిన అవసరంలేదు. KMnO4 స్వీయ సూచికగా పనిచేస్తుంది. అంతిమ స్థానం స్థిరమైన గులాబిరంగుగా పరిశీలించవచ్చు.
ii) Cr2O2-7 ను ఉపయోగించే అంశమాపనాల్లో, డైఫినైల్ ఎమీన్ ను సూచికగా వాడతారు. అంతిమస్థానం వద్ద ముదురు నీలిరంగును పరిశీలించవచ్చు.
iii) 2Cu2+ + 4I– → Cu2I2 + I2
ఈ రిడాక్స్ చర్యలో I2 స్టార్చ్ ద్రావణంతో అంతిమస్థానం వద్ద ముదురు నీలిరంగు నిస్తుంది.
ప్రశ్న 10.
కింది చర్యలలో వెలువడే కార్బన్ డై ఆక్సైడ్ భారాన్ని లెక్కకట్టండి.
(i) గాలిలో ఒక మోల్ కార్బన్ను మండించినప్పుడు
(ii) 16 g డైఆక్సిజన్లో 2 మోల్ల కార్బన్ను మండించినప్పుడు
(iii) 16 g డైఆక్సిజన్లో 2 మోల్ల కార్బన్ను మండించినప్పుడు
జవాబు:

ప్రశ్న 11.
కింది రసాయన సమీకరణాన్ని అనుసరించి, డైనైట్రోజన్ డైహైడ్రోజన్ ఒకదానితో ఒకటి చర్య జరిపినప్పుడు అమ్మోనియా ఏర్పడుతుంది.
N2(వా) + H2(వా) → 2NH3 (వా)
(i) 2.00 × 10³ g డై నైట్రోజన్, 1.00 × 10³ g డైహైడ్రోజన్ తో చర్య జరిపినప్పుడు ఏర్పడే అమ్మోనియా భారాన్ని లెక్కకట్టండి.
(ii) రెండు క్రియాజనకాలలో ఏదైనా చర్య జరపకుండా మిగిలిపోతుందా?
(iii) అవును అయితే, ఏ క్రియాజనకం మిగిలిపోతుంది, దాని భారం ఎంత?
జవాబు:
i) N2 + 3H2 → 2NH3
ఇవ్వబడిన నైట్రోజన్ = 2 × 10³ గ్రా.
మోల్ల సంఖ్య = \(\frac{2000}{28}\) = 71.4285
ఇవ్వబడిన హైడ్రోజన్ = 1 × 10³ గ్రా
మోల్ల సంఖ్య = \(\frac{1000}{2}\)
∴ 28 గ్రాముల N2 → 2 × 17 గ్రాముల NH3
2000 గ్రాముల N2 → ?
2000×2×17 \(\frac{2000\times2\times17}{28}\) = 2428.57 గ్రాములు
ii) ఉపయోగింపబడిన హైడ్రోజన్
28 → 6 గ్రా.
1000 గ్రా. → ?
\(\frac{1000\times6}{28}\) = 214.285 గ్రా.
iii) హైడ్రోజన్ భారము మిగిలినది.
= 1000 – 214.285
= 785.715 గ్రాములు.
ప్రశ్న 12.
కింది సమ్మేళనపు అణువులలో కింద గీతలో చూపించిన మూలకాల ఆక్సీకరణ సంఖ్యలను తెలపండి.
(a) NaH2PO4
(b) NaHSO4
(c) H4P2O7
(d) K2MnO4
(e) CaO2
(f) NaBH4
(g) H2S2O7
(h) KAl(SO4)2. 12 H2O
జవాబు:
a) NaH2-pO4 (p)
1(+1) + 2(+1) + x + 4 (- 2) = 0
1 + 2 + x – 8 = 0
x – 5=0
x = + 5
‘P’ యొక్క ఆక్సీకరణ సంఖ్య = + 5
b) NaHSO4 (s)
1(+1) +1(+1) + x+4(-2) = 0
1 + 1 + x – 8 = 0
x = +6
NaHsO4 లో S యొక్క ఆక్సీకరణ సంఖ్య = + 6
c) H4P2O7 (p)
4(+1) + 2x + 7(- 2) = 0
4 + 2x – 14 = 0
2x – 10= 0
x = +5
H4P2O7 లో P యొక్క ఆక్సీకరణ సంఖ్య = +5
d) K2MnO4
(+1) + x + 4(-2) = 0
x = + 7
K2MnO4 లో Mn యొక్క ఆక్సీకరణ సంఖ్య = + 7
e) CaO2 (0)
2 + 2x = 0
x = -1
CaO2 లో O యొక్క ఆక్సీకరణ సంఖ్య = -1
f) NaBH4 (B)
1(+1) + x + 4 (- 1) = 0
1 + x – 4 = 0
x = + 3
NaBH4 లో B యొక్క ఆక్సీకరణ సంఖ్య = +3
‘B’ ఎక్కువ శాతం -3 ఆక్సీకరణ సంఖ్య ప్రదర్శిస్తుంది.
g) H2S2O7 (s)
2(1) + 2x + 7(- 2) = 0
2 + 2x – 14 = 0
2x – 12= 0
x = + 6
H2S2O7లో ‘S’ యొక్క ఆక్సీకరణ సంఖ్య = + 6
h) k Al(SO4)2 12H2O (s)
ఇవ్వబడినది ద్విగుణ లవణము
పైన లవణము నుండి Al2(SO4)3
2x + 3(-2) = 0
x = + 3
![]()
ప్రశ్న 13.
కింది వాటిలో కింద గీత చూపించిన మూలకాల ఆక్సీకరణ సంఖ్యలు లెక్కకట్టండి. మీరు ఆ ఫలితాలను ఎలా సమర్థించుకొంటారు?
(a) H2S4O6
(b) Fe3O4
(c) CH3CH2OH
(d) CH3COOH
జవాబు:


Fe3O4, FeO మరియు Fe2O3 ల మిశ్రమము.
FeO నందు ఐరన్ ఆక్సీకరణ సంఖ్య +2
Fe2O3 నందు ఐరన్ ఆక్సీకరణ సంఖ్య + 3.
c) CH3 – CH2 – OH
C2H6O
2x + 6(1) + (-2) = 0
2x = -4
x = -2
d) CH3 COOH
C2H4O2
2x + 4(1) + 2 (-2) = 0
x = 0
సాధించిన సమస్యలు (Solved Problems)
ప్రశ్న 1.
గ్లూకోజ్ (C6H12O6) అణువుకు అణుద్రవ్యరాశిని లెక్కించండి.
సాధన:
గ్లూకోజ్ (C6H12O6) అణు ద్రవ్యరాశి
6(12.011 u) + 12(1.008 u) + 6(16.00 u)
= (72.066 u) + (12.096 u) + (96.00 u)
= 180.162 u
ప్రశ్న 2.
ఒక సమ్మేళనంలో 4.07 % హైడ్రోజన్, 24.27 % కార్బన్, 71.65 % క్లోరిన్ ఉన్నాయి. దాని మోలార్ ద్రవ్యరాశి 96.96 g. అయితే దాని. అనుభావిక ఫార్ములాను, అణుఫార్ములాను కనుక్కోండి.
సాధన:
1వ దశ :
ద్రవ్యరాశి శాతాన్ని గ్రాముల్లోకి మార్చుకోవడం మనకు ద్రవ్యరాశి శాతం తెలుసు కాబట్టి 100 g ‘సమ్మేళనాన్ని ఆరంభ ద్రవ్యరాశిగా అనుకోవడం వీలుగా ఉంటుంది. అప్పుడు 100gల పై సమ్మేళనంలో 4.07g హైడ్రోజన్ 24.27g కార్బన్ 71.65g క్లోరిన్ ఉంటాయి.
2వ దశ :
ప్రతి మూలకపు ద్రవ్యరాశిని మోల్ల సంఖ్య లుగా మార్చుకోవడం
పైన వచ్చిన ద్రవ్యరాశులను వాటి మూలకాల పరమాణు ద్రవ్యరాశులతో భాగించడం.

3వ దశ :
పైన వచ్చిన మోల్ల సంఖ్యలని వాటిలో అతి తక్కువ దానితో భాగించడం
2.021 అన్నింటికన్నా తక్కువ విలువ. కాబట్టి దానితో భాగిస్తే H:C:Cl నిష్పత్తి 2:1:1 అని వస్తుంది.
ఒకవేళ సరళ నిష్పత్తి పూర్ణాంకాలది కాకపోతే అప్పుడు ఆ నిష్పత్తిని అనువైన గుణకంతో గుణించి పూర్ణాంకాల నిష్పత్తిగా మార్చవచ్చు.
4వ దశ :
ఇలా వచ్చిన సంఖ్యలు మూలకాల పరమాణువుల సాపేక్ష సంఖ్యలను తెలుపుతాయి. ఈ సంఖ్యలను ఆయా మూలకాల సంకేతాలు రాసిన తరవాత పాదాంకాలుగా చూపించి అనుభావిక ఫార్ములాను రాయాలి.
ఆ విధంగా పైన చెప్పిన సమ్మేళనానికి అనుభావిక ఫార్ములా CHCl అవుతుండి.
5వ దశ :
అణు ఫార్ములాని రాయడం
(a) అనుభావిక ఫార్ములా ద్రవ్యరాశిని నిర్ణయించండి. దీనికోసం అనుభావిక ఫార్ములాలో ఉన్న వివిధ మూలకాల మొత్తం పరమాణువుల ద్రవ్యరాశులను కలపాలి.
CH2Cl కి అనుభావిక ఫార్ములా ద్రవ్యరాశి
12.01 + 2 × 1.008+ 35.453
= 49.48 u
(b) అణు ద్రవ్యరాశిని,అనుభావిక ఫార్ములా ద్రవ్యరాశితో భాగిస్తే

(c) అనుభావిక ఫార్ములాను పైనవచ్చిన ‘n’ తో గుణిస్తే. అణుఫార్ములా వస్తుంది.
అనుభావిక ఫార్ములా – CH2Cl, n = 2. కాబట్టి అణుఫార్ములా C2H4Cl2
![]()
ప్రశ్న 3.
16g ల మీథేనిని నుండిస్తే తయారయ్యే నీటి పరిమాణాన్ని (గ్రాములలో) గణించండి.
సాధన:
మీథేన్ దహన చర్యకు సమతుల సమీకరణం
CH4(వా) + 2O2 → CO2(వా) + 2H2(వా)
(i) 16 g ల మీథేన్ అంటే 1 మోల్కి సమానం.
(ii) పై సమీకరణం నుంచి 1 మోల్ మీథేన్ వాయువు
CH4(వా), 2 మోల్ల నీరు H2O (వా) ని ఇస్తుంది.
2 మోల్ల నీరు (H2O) = 2 × (2 + 16)
= 2 × 18 = 36 g

ప్రశ్న 4.
వహన చర్యలో 22 g ల CO2 (వా) ని ఏర్పరచ దానికి ఎన్ని మోత్ల మీథేన్ కావాలి?
సాధన:
కింది రసాయన చర్య ప్రకారం
CH4(వా) + 2O2(వా) → CO2(వా) + 2H2O(వా)
44g CO2 (వా) ని 16 g CH4 (వా) ఇస్తుంది.
[∵ 1 mol CO2 (వా) 1mol CH4 (వా) నుంచి తయారవుతుంది.]
CO2 (వా) మోల్లు
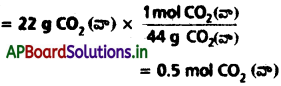
కాబట్టి 0.5 mol ల CH4 (వా) నుంచి 0.5 mol CO2 (వా) ఏర్పడుతుంది. లేదా 0.5 mol ల CH4 (వా), 22 gCO2 (వా) ని తయారుచేయడానికి అవసరమవుతుంది.
ప్రశ్న 5.
50.0 kg N2 (వా), 10.0 kg u N2 (వా) కలిపి NH3 (వా) ని తయారు చేశారు. ఏర్పడిన NH3 (వా) ని లెక్క చేయండి.. ఈ పరిస్థితుల్లో NH3 (పా) ని తయారు చేయడానికి ఏదైనా పరిమిత కారకం ఉంటే దానిని గుర్తించండి.
సాధన:
పై చర్యకు సమతుల సమీకరణం కింది విధంగా రాస్తారు. మోల్లను లెక్క చేయడం :

పై చర్యకి సమీకరణం ప్రకారం 1 mol N2 (వా) కి 3 mol H2(వా) అవసరమవుతుంది. కాబట్టి 17.86 × 10² mol ల. N2 కి కావలసిన H2 (వా)
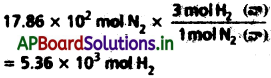
కానీ చర్యకు 4.96 × 10³ mol H2 మాత్రమే ఉంది. కాబట్టి డైహైడ్రోజన్ ఈ చర్యలో పరిమిత కారకం అవుతుంది. కాబట్టి అందుబాటులో ఉన్న ఈ హైడ్రోజన్, అంటే 4.96 × 10³ mol ల నుంచి మాత్రమే NH3 (వా) ఏర్పడుతుంది.
3 mol H2 (వా) 2 mol: NH3 (వా) నిస్తుంది. కాబట్టి
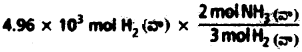
= 3.30 × 10³ mol NH3 (వా) వస్తుంది.
ఈ మోల్లను గ్రామ్లలోకి మార్చవలసి వస్తే, కింది విధంగా చేస్తారు.
1 mol NH3 (వా) = 17.0 g NH3 (వా)
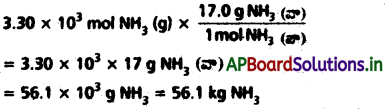
ప్రశ్న 6.
2g ల ‘A’ ని 18 g ల నీటిలో కలిపి ఒక ద్రావణాన్ని తయారు చేశారు. ద్రావితం ద్రవ్యరాశి శాతాన్ని లెక్క చేయండి.
సాధన:
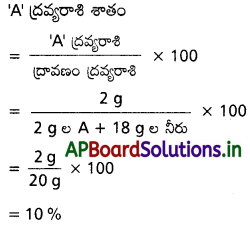
ప్రశ్న 7.
4 g ల NaOH ని తగినంత నీటిలో కరిగించి 250 mL ద్రావణం చేయగా దాని మొలారిటీని లెక్కగట్టండి.
సాధన:
మొలారిటీ (M)

ప్రశ్న 8.
3 M NaCl ద్రావణం సాంద్రత 1.25 g mL-1 ద్రావణం మొలాలిటీని లెక్క చేయండి.
సాధన:
M = 3 mol L-1
NaCl ద్రవ్యరాశి 1 L ద్రావణంలో ఉంది
= 3 × 58.5 = 175.5 g
1 లీటర్ ద్రావణం ద్రవ్యరాశి = 1000 × 1.25 = 1250g
(సాంద్రత 1.25 g mL-1 కాబట్టి)
ద్రావణంలో ఉన్న నీటి ద్రవ్యరాశి)
= 1250 175.5
= 1074.5 g = 1.0745 kg.

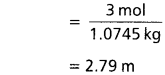
ప్రశ్న 9.
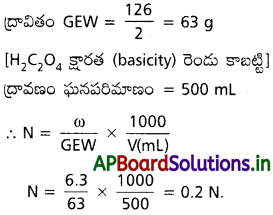
500 ml ల ద్రావణంలో 6.3 g ల H2C2O4. 2H2O ఉంటే దాని నార్మాలిటీని గణించండి.
సాధన:
దత్తాంశాలు : ద్రావితం భారం = 6.3 g
ప్రశ్న 10.
250 ml ల 0.5 N ద్రావణాన్ని తయారు చేయడానికి కావలసిన Na2 CO3 ద్రవ్యరాశిని కనుక్కోండి.
సాధన:
దత్తాంశాలు :
కావలసిన ద్రావణపు నార్మాలిటీ = 0.5 N
ద్రావణపు ఘనపరిమాణం = 250 mL

ప్రశ్న 11.
కింద ఇచ్చిన చర్యలలో ఆక్సీకరణం, క్షయ కరణం చెందే పదార్థాలను గుర్తించండి.
(i) H2S(వా) + Cl2 (వా) → 2 HCl(వా) + S (ఘ)
(ii) 3Fe3O4 (ఘ) + 8 Al (ఘ) → 9 Fe (ఘ) + 4 Al2O3 (ఘ)
(iii) 2 Na (ఘ) + H2(వా) → 2 NaH (ఘ)
సాధన:
(i) H2S ఆక్సీకరణం చెందింది. అధిక రుణ సాధన. విద్యుదాత్మకత గల క్లోరిన్ని హైడ్రోజన్కి సంకలనం చేయబడింది. (లేదా ఎక్కువ ధన విద్యుదాత్మక మూలకం, హైడ్రోజన్ 5 నుంచి తొలగించబడింది). క్లోరిన్ క్షయకరణం చెందింది. ఎందుకంటే అది హైడ్రోజన్తో సంకలనం చెందింది కనుక.
(ii) ఆక్సిజన్తో సంకలనం చెందింది కాబట్టి అల్యూమినియమ్ ఆక్సీకరణం చెందింది. ఐరన్ ఆక్సైడ్ నుంచి ఆక్సిజన్ని తీసివేశారు. (ఐరన్ ఆక్సైడ్ ఐరన్గా) కాబట్టి అది క్షయకరణం చెందింది.
(iii) ఈ చర్య ఆసక్తికరమైంది. పై నిర్వచనాల ప్రకారం ఈ చర్య క్షయకరణ చర్య మాత్రమే. ఎందుకంటే ఈ చర్యలో సోడియమ్ సంకలనం (ధన విద్యుదాత్మక లోహం) లేదా హైడ్రోజన్ సంకలనం జరిగింది కాబట్టి. కానీ సోడియమ్ ఆక్సీకరణం చెందుతుంది. హైడ్రోజన్ క్షయకరణం చెందుతుంది. అంటే ఏమిటంటే పై నిర్వచనాలు ఈ చర్యను వివరించలేవు. అవి మనం చూసినట్లుగా కొన్ని పరిమితులను కలిగి ఉంటాయి. అందుకని ఆక్సీకరణం, క్షయకరణాలకు కొత్త భావనని పరిగణనలోకి తీసుకోవలసి ఉంది.
![]()
ప్రశ్న 12.
2 Na (ఘ) + H2 (వా) → 2 NaH (ఘ) ఒక ఆక్సీకరణ – క్షయకరణ చర్య అని సమర్థించండి.
సాధన:
పై చర్యలో ఏర్పడిన సమ్మేళనం అయానిక సమ్మేళనం కాబట్టి దానిని Na+H– (ఘ) అని సూచించవచ్చు. దీనిని బట్టి ఈ ప్రక్రియలో ఒక అర్ధ చర్యను
2 Na (ఘ) → 2 Na+ (వా) + 2e–
అనీ, ఇంకొక అర్ధ చర్యను
H2 (వా) + 2e– → 2 H– (వా) అని రాయవచ్చు.
చర్యను ఈ విధంగా రెండు అర్ధ చర్యలుగా విడదీయ వచ్చు. అలా చేస్తే సోడియమ్ ఆక్సీకరణం చెందిందని, హైడ్రోజన్ క్షయకరణం చెందిందని తనంతట తానే చర్య తెలుపుతుంది. కాబట్టి పూర్తి చర్య ఆక్సీకరణ – క్షయకరణ చర్య అవుతుంది.
ప్రశ్న 13.
స్టాక్ శాస్త్రీయ పద్ధతిననుసరించి కింది సమ్మేళనాలను రాయండి :
HAuCl4, Tl2O, FeO, Fe2O3, CuI, CuO, MnO, MnO2.
సాధన:
ఒక సమ్మేళనంలో కావలసిన మూలకం ఆక్సీకరణ సంఖ్యను లెక్కగట్టడానికి వివిధ నియమాలను వర్తింప చేయాలి. ఒక్కొక్క లోహ మూలకం దాని సమ్మేళనంలో చూపించే ఆక్సీకరణ సంఖ్యకు కింది విలువలు ఉంటాయి.
HAuCl4 → Au కి 3 ఆక్సీకరణ సంఖ్య
Τl2Ο → Tl కి 1
FeO → Fe కి 2
Fe2O3 → Fe కి 3
Cul – Cu కి 1
CuO → Cu కి 2
MnO → Mn కి 2
MnO2 → Mn కి 4
కాబట్టి ఈ సమ్మేళనాలను వీటికి అనుగుణంగా రాయవచ్చు.
HAu (III)Cl4, Tl2(I)O, Fe(II)O, Fe2(III)O3, Cu(I)I, Cu(II)O, Mn(II)O, Mn(IV)O2.
ప్రశ్న 14.
2Cu2O (ఘ) + Cu2S (ఘ) → 6Cu(ఘ) + SO2 (వా) ఆక్సీకరణ – క్షయకరణ చర్య. దీనిని సమర్థించండి. ఆక్సీకరణం క్షయకరణం చెందిన కణాలను గుర్తించండి. వీటిలో ఏది ఆక్సీకరణిగా పనిచేస్తుంది? ఏది క్షయకరణిగా పనిచేస్తుంది?
సాధన:
పరిశీలనలో ఉన్న చర్యలో ప్రతి కణానికి ఆక్సిడేషన్ సంఖ్యను ఇద్దాం. దీని ఫలితంగా వచ్చేది
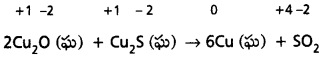
కాబట్టి ఈ చర్యలో కాపర్ క్షయీకృతం చెంది ఉంటుంది. ఇది +1 స్థితి నుంచి సున్నా స్థితికి వస్తుంది. సల్ఫర్ – 2 ఆక్సీకరణ స్థితి నుంచి +4 స్థితికి ఆక్సీకరణం చెందు తుంది. అందువలన పై చర్య ఆక్సీకరణ – క్షయకరణ చర్య. Cu2S లో సల్ఫర్ ఆక్సిడేషన్ సంఖ్య పెరిగేందుకు Cu2O సహాయపడుతుంది. కాబట్టి Cu(I) ఆక్సీకరణి. Cu2S లో సల్ఫర్ Cu2S లో కాపరి, Cu2O లో కాపర్ది ఆక్సిడేషన్ సంఖ్య తగ్గడానికి దోహదం చేస్తుంది. కాబట్టి Cu2S లో S క్షయకరణి.
ప్రశ్న 15.
కింద ఇచ్చిన కణాలలో ఏవి సౌష్ఠవ విఘటనాన్ని జరపవు? ఎందుకు?
CIO–, CIO–2, CIO–3, CIO–4
అననుపాత చర్యను జరిపే ప్రతి ఒక్క కణానికి సమీకరణం రాయండి.
సాధన:
పైన ఇచ్చిన క్లోరిన్ ఆక్సో ఆనయాన్ల జాబితాలో CIO–4 అసౌష్ఠవ విఘటనం జరపదు. ఇందులో క్లోరిన్ అత్యధిక ఆక్సీకరణ స్థితిలో, అంటే +7 స్థితిలో, ఉండడం దీనికి కారణం. మిగిలిన మూడు క్లోరిన్ ఆక్సో ఆనయాన్లు అననుపాత చర్యలు కింది విధంగా రాస్తారు.

ప్రశ్న 16.
కింది ఆక్సీకరణ – క్షయకరణ చర్యలను వర్గీకరణ ప్రణాళికను ప్రతిపాదించండి.
(a) N2(వా) + O2 (వా) – 2 NO (వా)
(b) 2Pb(NO3)2(ఘ) → 2PbO(ఘ) + 2 NO2(వా) + ½O2 (వా)
(c) NaH(ఘ) + H2O (ద్ర) → NaOH (జల) + H2(వా)
(d) 2NO2 (వా) + 2OH– (జల) → NO–2 (జల) + NO–3(జల) + H2O(ద్ర)
సాధన:
చర్య (a) లో నైట్రోజన్, ఆక్సిజన్ మూలకాలు సంయోగం చెంది నైట్రిక్ ఆక్సైడ్ ఏర్పడుతుంది. కాబట్టి ఈ చర్య సంకలన ఆక్సీకరణ – క్షయకరణ చర్య. (b) చర్యలో లెడ్ నైట్రేట్ మూడు ఘటక పదార్థాలుగా వియోజనం చెందుతుంది. కాబట్టి ఈ చర్య విఘటన ఆక్సీకరణ క్షయకరణ చర్య అవుతుంది. చర్య (c) లో హైడ్రైడ్ అయాన్లు నీటిలోని హైడ్రోజనిని స్థానభ్రంశం చేసి డైహైడ్రోజన్ని ఏర్పరుస్తుంది. అందువల్ల ఈ చర్యను స్థానభ్రంశం ఆక్సీకరణ- క్షయకరణ చర్య అని చెప్పవచ్చు. చర్య (d) లో NO2 (+4 స్థితి) అననుపాతం చెంది NO–2 (+3 స్థితి) గాను, N–3 (+5 స్థితి) గాను మారుతుంది. కాబట్టి ఈ చర్యని అననుపాత ఆక్సీకరణం – క్షయకరణం చర్యగా ఉదహరించవచ్చు.
ప్రశ్న 17.
కింది చర్యలు ఎందుకు భిన్నంగా జరుగుతాయి?
Pb3O4 + 8HCl → 3PbCl2 + Cl2 + 4H2O
Pb3O4 + 4HNO3 → 2Pb(NO3)2 + PbO2 + 2H2O
Pb3O4 నిజానికి 2 మోల్ల PbO, 1 మోల్ PbO2 గల స్థాయికియోమెట్రిక్ మిశ్రమం. PbO2 లో లెడ్ +4 ఆక్సీకరణ స్థితిలో ఉంటుంది. PbO లో లెక్కి స్థిరమైన ఆక్సీకరణ స్థితి +2. PbO2 అప్పుడు ఆక్సీకరణిగా పనిచేయగలదు. అందుకని అది Cl– ని ఆక్సీకరణం చేసి క్లోరిన్ని ఇస్తుంది. ఇంకొక విషయం కూడా మనం దృష్టిలో పెట్టుకోవాలి. PbO ఒక క్షార ఆక్సైడ్. కాబట్టి జరిగే చర్యను
Pb3O4 + 8HCl → 3PbCl2 + Cl2 + 4H2O
రెండుగా విభజించవచ్చు. అవి :
HNO3 ఒక ఆక్సీకరణి. కాబట్టి PbO2, HNO3 ల మధ్య చర్య జరగడం సంభవం కాకపోవచ్చు. అయినప్పటికీ ఆమ్ల క్షార చర్య PbO, HNO3 ల మధ్య చర్య విభిన్న చర్యగా కనిపిస్తుంది.
2PbO + 4HNO3 → 2Pb(NO3)2 + 2H2O
PbO2 తన క్రియారహిత స్వభావాన్ని HNO3 తో చర్యలో చూపిస్తుంది. ఈ స్వభావాన్నే HCl తో చర్య భిన్నంగా ఉండేలా చేస్తుంది.
ప్రశ్న 18.
ఆమ్ల యానకంలో పొటాషియమ్ డైక్రోమేట్ (VI), K2Cr2O7 చర్య సోడియమ్ సల్ఫైట్తో జరుగుతుంది. ద్రావణంలో క్రోమియమ్ (II), సల్ఫేట్ అయాన్లు ఏర్పడతాయి. ఈ ఫలిత చర్యకు అయానిక సమీకరణం రాయండి.
సాధన:
1వ దశ : సంక్షిప్త అయానిక సమీకరణం

ఈ సమీకరణంలో డైక్రోమేట్ అయాన్ ఆక్సీకరణి (అది సల్ఫైట్ అయాన్ని సల్ఫేట్ అయాన్ ఆక్సీకరణం చెందుతుంది) అనీ, సల్ఫైట్ అయాన్ క్షయకరణి (అది డైక్రోమేట్ అయాన్ని క్రోమియమ్ (III) గా క్షయకరణం చేస్తుంది) అనీ సూచిస్తుంది.
3వ దశ :
ఆయా జాతుల ఆక్సిడేషన్ సంఖ్యల్లో పెరుగుదలను లేదా తగ్గుదలను లెక్కగట్టాలి. తరవాత వాటిని సమం చేయాలి.

రెండు Cr3+ లు ఏర్పడ్డాయి కాబట్టి మొత్తం క్షయ కరణంలో 6 యూనిట్లు మార్పు ఉండాలి. SO2-3 ని 3తో హెచ్చవేస్తే అది అవుతుంది.
4వ దశ :
క్రియాజన్యాల గుణకాలను దానికి అనుగుణంగా సరిచేయాలి.

5వ దశ :
(a) హైడ్రోజన్ పరమాణువుల కొరత ఉన్న వైపున చర్య ఆమ్ల యానకంలో జరిగినట్లైతే H+ అయాన్లనీ, క్షార యానకంలో జరిగినట్లైతే H2O ని తగిన సంఖ్యలో
కలపాలి.
(b) ఆక్సిజన్ పరమాణువుల కొరత ఉన్న వైపున చర్య ఆమ్ల యానకంలో జరిగినట్లైతే H2O ని, క్షార యానకంలో జరిగినట్లైతే OH– అయాన్లను తగిన సంఖ్యలో కలపాలి. (a), (b) ప్రక్రియలని ఎన్నిసార్లైనా చేయవచ్చు. దాగుడు మూతల పద్ధతిలో తుల్యం చేస్తూ చివరకు హైడ్రోజన్, ఆక్సిజన్ పరమాణువులు ఆక్సీకరణ – క్షయకరణ చర్యలో రెండువైపులా సమానమయ్యేంతవరకు పొడిగిస్తారు. కావలసిన చర్య ఆమ్ల యానకంలో జరుగుతుంది.

ప్రశ్న 19.
పెర్మాంగనేట్ అయాన్ క్షార యానకంలో బ్రోమైడ్ అయాన్తో చర్య జరుపుతుంది. మాంగనీస్ డై ఆక్సైడ్, బ్రోమేట్ అయాన్లు ఏర్పడతాయి. దీనికి సమతుల అయానిక సమీకరణాన్ని రాయండి.
సాధన:
1వ దశ : సంక్షిప్త అయానిక సమీకరణం

ఈ సమీకరణం MnO–4 ఆక్సీకరణి అనీ, Br క్షయకరణి అనీ సూచిస్తుంది.
3వ దశ :
ఒక పరమాణువుకు ఆక్సిడేషన్ సంఖ్యలో పెరుగుదలను లేదా తగ్గుదలను లెక్క చేయండి. తరవాత ఆ మూలకం ఉండే అణువు మొత్తానికి లేదా అయాన్కి కలిగే పెరుగుదలను లేదా తగ్గుదలను కనుక్కోవాలి. ఆక్సీకరణ ప్రక్రియలో వచ్చిన ఆక్సిడేషన్ సంఖ్య యూనిట్ లలో వచ్చిన మార్పు, క్షయకరణ ప్రక్రియలో వచ్చిన ఆక్సిడేషన్ సంఖ్య యూనిట్లలో వచ్చిన మార్పుకు సమానం కావాలి. అలా కాకపోతే ఆక్సీకరణ కారకాన్ని, క్షయకరణ కారకాన్ని అనుకూలమైన సంఖ్యలతో గుణించాలి. అంటే ఆక్సీకరణి MnO–4 ని 2 తోనూ, క్షయకరణి Br– ని 1తోనూ గుణించాలి.
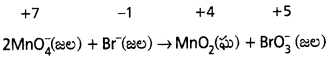
ఆక్సీకరణంలో మార్పు వచ్చిన యూనిట్ల సంఖ్య = క్షయకరణంలో మార్పు వచ్చిన యూనిట్ల సంఖ్య
4వ దశ :
క్రియాజన్యాల గుణకాలను సరిచేయాలి.
2MnO–4 (జల) + Br– (జల) → 2MnO2(ఘ) + BrO–3 (జల)
5వ దశ :
(a) హైడ్రోజన్ పరమాణువుల కొరత ఉన్న వైపున, చర్య ఆమ్ల యానకంలో జరిగినట్లైతే H+ అయాన్లనీ, క్షార యానకంలో జరిగినట్లైతే H2O ని తగిన సంఖ్యలో కలపాలి.
(b) ఆక్సిజన్ పరమాణువుల కొరత ఉన్న వైపున, చర్య ఆమ్ల యానకంలో జరిగినట్లైతే H2O ని, క్షార యానకంలో జరిగిన OH– ని, తగిన సంఖ్యలో కలపాలి. (a), (b) ప్రక్రియలను ఎన్నిసార్లైనా చేయవచ్చు. దాగుడుమూతల పద్ధతిలో తుల్యం చేస్తూ చివరకు హైడ్రోజన్, ఆక్సిజన్ పరమాణువులు ఆక్సీకరణం క్షయకరణం చర్యల్లో రెండువైపులా సమానమయ్యే వరకు పొడిగిస్తారు. ఈ చర్య క్షార యానకంలో జరుగుతుంది.
2MnO–4(జల) + Br– (జల) + H2O (ద్ర) → 2MnO2(ఘ) + BrO–3(జల) + 2OH– (జల)
![]()
ప్రశ్న 20.
పెర్మాంగనేట్ (VII) అయాన్, MnO–4 క్షార యానకంలో అయొడైడ్ అయాన్ని (I– ని) ఆక్సీ కరణం చేసి అయొడిన్ అణువులను (I2 ని), మాంగనీస్ (IV), ఆక్సైడ్ (MnO2) ని ఇస్తుంది. ఈ ఆక్సీకరణ – క్షయకరణ చర్యకి సమతుల అయానిక, సమీకరణాన్ని రాయండి.
సాధన:
1వ దశ :
మొదటగా సంక్షిప్త అయానిక సమీకరణాన్ని రాయండి.
MnO–4 (జల) + I–(జల) → MnO2 (ఘ) + I2 (ఘ)
2వ దశ : రెండు అర్ధ చర్యలను రాయాలి.
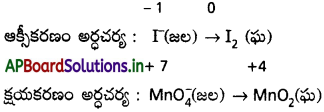
3వ దశ :
| పరమాణువులను ఆక్సీకరణ అర్ధ చర్యలో తుల్యం చేయడానికి,
2I–(జల) → I2 (ఘ)
4వ దశ :
చర్య క్షారయానకంలో జరుగుతుంది కాబట్టి ౦ పరమాణువులను తుల్యం చేయడానికి క్షయకరణ అర్ధ చర్యలో OH– అయాన్లను తగిన సంఖ్యలో కలపాలి.
MnO–4(జల) → MnO2(ఘ) + 2 HO– (ద్ర)
H పరమాణువులను తుల్యం చేయడానికి ఎడమ పక్కన రెండు H2O అణువులను కలపాలి.
MnO–4(జల) + 2 H2O (జల) → MnO2(ఘ) + 2HO– (ద్ర)
H, O పరమాణువులను దాగుడుమూతల పద్ధతిలో తుల్యం చేయాలి. అవసరమైతే ఈ పద్ధతిని చాలాసార్లు చేయాలి. ఫలితంగా వచ్చే సమీకరణం
MnO–4(జల) + 2 H2O (ద్ర) → MnO2(ఘ) + 4OH– (జల)
గమనిక :
H, O పరమాణువులను తుల్యం చేసేటప్పుడు ఇతర కణాల గుణకాలను మార్చరాదు. (ఆక్సీకరణి, క్షయకరణి, క్రియాజన్యాలు).
5వ దశ :
ఈ దశలో రెండు అర్థ చర్యలలోను ఆవేశాలను తుల్యం చేస్తాం. దీనికి ముందు చెప్పిన పద్ధతిని ఉపయో గించుకొంటాం.
2I–(జల) → I2(ఘ) + 2e–
MnO–4(జల) + 2 H2O (ద్ర) + 3e– → MnO2(ఘ) + 4OH– (జల)
ఇప్పుడు ఎలక్ట్రాన్ల సంఖ్యలను సమానం చేయడానికి ఆక్సీకరణం అర్ధ చర్యను 3 పెట్టి, క్షయకరణం అర్ధ చర్యను 2 పెట్టి హెచ్చవేయాలి.
6I–(జల) → 3I2 (ఘ) + 6e–
2 MnO–4(జల) + 4H2O (ద్ర) + 6e– → 2MnO2 (ఘ) + 8OH– (జల
6వ దశ :
రెండు అర్థ చర్యలను కలిపితే మొత్తం మీది చర్య వస్తుంది. రెండు వైపుల ఎలక్ట్రాన్లను కొట్టివేయాలి.
6I–(జల) + 2MnO–4(జల) + 4H2O (ద్ర) → 3I2(ఘ) + 2MnO2(ఘ) + 8OH– (జల)
7వ దశ :
చివరగా సమీకరణాన్ని పరమాణువులు, ఆవేశాల పరంగా రెండువైపులా సరిచూసుకోవాలి.