Andhra Pradesh BIEAP AP Inter 1st Year Chemistry Study Material 6th Lesson ఉష్ణగతిక శాస్త్రం Textbook Questions and Answers.
AP Inter 1st Year Chemistry Study Material 6th Lesson ఉష్ణగతిక శాస్త్రం
అతిస్వల్ప సమాధాన ప్రశ్నలు
ప్రశ్న 1.
ఉష్ణగతికశాస్త్రం అనే పదం ఏమి తెలియజేస్తుంది?
జవాబు:
- ఉష్ణగతికశాస్త్రం రసాయన చర్యలో శక్తి మార్పులను గురించి తెలియజేస్తుంది.
- ఉష్ణగతికశాస్త్ర నియమాలు పెద్ద పెద్ద వ్యవస్థల (ఎక్కువ సంఖ్యలో అణువులు గతబీ) లోని శక్తి మార్పుల గురించి తెలియజేస్తుంది.
ప్రశ్న 2.
ఉష్ణగతికశాస్త్రం నియమాలకు, సమతాస్థితికి మధ్య సంబంధమేమిటి?
జవాబు:
- ఉష్ణగతికశాస్త్ర నియమాలు వ్యవస్థ సమతాస్థితిలో ఉన్నపుడు మాత్రమే అనువర్తనం చెందుతాయి.
- సమతాస్థితి వద్ద పీడనం మరియు ఉష్ణోగ్రత వంటి నియమాలు కాలంతో పాటు మార్పు చెందవు.
ప్రశ్న 3.
వ్యవస్థను నిర్వచించండి. ఉదాహరణ ఇవ్వండి.
జవాబు:
వ్యవస్థ:
ఉష్ణగతికశాస్త్ర అథ్యయనానికి ఎంచుకున్న విశ్వంలోని ఒక లఘుభాగాన్ని “వ్యవస్థ” అంటారు.
ప్రశ్న 4.
స్థిరోష్ణక గోడ ఉంది ∆U = Wad. వ్యవస్థపరంగా ఉష్ణం, ఉపని అంటే ఏమి అర్థమయింది?
జవాబు:
- స్థిరోష్ణక పద్ధతిలో ఉష్ణం వ్యవస్థ మరియు పరిసరాల మధ్య మార్పిడి జరగదు.
- స్థిరోష్ణక పద్ధతిలో జరిగిన పని వ్యవస్థ అంతరిక శక్తికి సమానం
W = U2 – U1 = ∆U - ఇచ్చట వ్యవస్థపై జరిగిన పని ధనాత్మకం, వ్యవస్థ ద్వారా జరిగిన పని రుణాత్మకం.
ప్రశ్న 5.
వ్యవస్థ మీద పని ఏమీ జరగలేదు. వ్యవస్థ ‘q’ పరిమాణంలో ఉష్ణం కోల్పోయింది. ఈ వ్యవస్థ ఎలాంటి గోడను కలిగి ఉంది?
జవాబు:
ఇచ్చట ఉష్ణం మార్పిడీ ఉష్ణవాహకత కలిగిన గోడ ద్వారా జరుగుతుంది.
![]()
ప్రశ్న 6.
వ్యవస్థకు ‘q’ పరిమాణంలో ఉష్ణం అందించబడింది, వ్యవస్థ పనిచేసింది. ఈ వ్యవస్థ ఏ రకంపై ఎలాంటిదై ఉంటుంది?
జవాబు:
ఈ వ్యవస్థ మూసిన వ్యవస్థ
గణిత రూపం
∆U = q – W
∆U = ఆంతరిక శక్తి మార్పు
q = అందించబడిన `ఉష్ణం
W = వ్యవస్థ ద్వారా జరిగిన పని
ప్రశ్న 7.
ఒక ఆదర్శ వాయువు స్వేచ్ఛావ్యాకోచంలో (free expansion) ఉత్రమణీయ, అనుత్రమణీయ ప్రక్రియల్లో వాయువు చేసే పని ఏమిటి?
జవాబు:
- ఒక ఆదర్శ వాయువు స్వేచ్ఛా వ్యాకోచంలో పీడనం సున్నా అగును.
- ఉత్రమణీయ, అనుత్రమణీయ చర్యలలోని ఆదర్శ వాయువు స్వేచ్ఛా వ్యాకోచస్థితిలో పని జరుగదు.
ప్రశ్న 8.
సమీకరణం ∆U = q – Pex ∆V నుంచి ఘనపరిమాణం స్థిరంగా ఉన్నప్పుడు ∆U విలువ ఎంత?
జవాబు:
ఘనపరిమాణం స్థిరము అయిన ΔV = 0
ΔU = q – pex ΔV
ΔU = q – 0
ΔU = q
∴ ఆంతరిక శక్తి మార్పు = ఉష్ణం అందింపబడినది.
ప్రశ్న 9.
సమోష్ణ స్వేచ్ఛా వ్యాకోచ ప్రక్రియలో ఒక ఆదర్శ వాయువు q, ΔU విలువలు ఎంత?
జవాబు:
ΔU = q + W
సమోష్ణ స్వేచ్ఛా వ్యాకోచ ప్రక్రియలో
W = 0, q = 0, ΔU = 0
∴ జరిగిన పని W = 0
∴ q = 0, U = 0
ప్రశ్న 10.
సమోష్ణ అనుక్రమణీయ ప్రక్రియ మార్పులో ఆదర్శ వాయువుకు ‘q’ విలువ ఎంత?
జవాబు:
ఆదర్శ వాయువు యొక్క సమోష్ణ అనుక్రమణీయ మార్పు
q + W = 0
q = -W
= pEx (Vf – Vi)
![]()
ప్రశ్న 11.
ఆదర్శ వాయువు సమోష్ణ ఉత్రమణీయ మార్పులో ‘q’ విలువ ఎంత?
జవాబు:
ఆదర్శ వాయువు యొక్క సమోష్ణ ఉత్ర్కమణీయ మార్పు
q = W

ప్రశ్న 12.
ఆదర్శ వాయువు స్థిరోష్ణక మార్పులో ΔU, W(adiabatic) ల సంబంధమేమిటి?
జవాబు:
స్థిరోష్ణక పద్ధతిలో q = 0
ΔU = q + W
ΔU = 0 + W
ΔU = W
ఆంతరిక శక్తి మార్పు = స్థిరోష్ణక పద్ధతిలో జరిగిన పని.
ప్రశ్న 13.
ఉష్ణగతికశాస్త్రం మొదటి నియమం ఇవ్వండి.
జవాబు:
ఉష్ణగతికశాస్త్ర మొదటి నియమము : ఈ నియమాన్ని “శక్తి నిత్యత్వ నియమం” అని కూడా అంటారు. ఈ నియమాన్ని భిన్న విభాగాలుగా నిర్వచిస్తారు.
- ఏ ప్రక్రియలోనైనా ఒక రూపం నుంచి వేరొక రూపంలోకి శక్తి మారుతుందే కాని, క్రొత్తగా శక్తి జనించడం (లేదా) ఉన్న శక్తిన నశించడం జరగదు.
- మొదటి రకం సతతచలన యంత్రాన్ని నిర్మించలేం.
- వ్యవస్థ, పరిసరాల మొత్తం శక్తి స్థిరంగా ఉంటుంది లేదా నిత్యత్వం చేయబడుతుంది.
ప్రశ్న 14.
వ్యవస్థ చేసిన పనికి, వ్యవస్థపై జరిగిన పనికి సంప్రదాయ గుర్తులు ఏమిటి?
జవాబు:
- వ్యవస్థపై జరిగిన పనికి ధనాత్మక గుర్తు (+Ve)
- వ్యవస్థ చేసిన పనికి రుణాత్మక గుర్తు (-Ve)
ప్రశ్న 15.
ఘనపరిమాణం (V), పీడనం (p), ఉష్ణోగ్రత (T) లు స్థితి ప్రమేయాలు, ఇలా చెప్పడం సరైందా?
జవాబు:
ఘనపరిమాణం (V), పీడనం (P) మరియు ఉష్ణోగ్రత (T) లు స్థితి ప్రమేయాలు. ఇవి చర్య మార్గంపై ఆధారపడవు. కేవలం స్థితిపై ఆధారపడతాయి.
ప్రశ్న 16.
ఉష్ణ పరిసరాల నుంచి వ్యవస్థకు, వ్యవస్థ నుంచి పరిసరాలకు మారినప్పుడు దాని సంప్రదాయక గుర్తులు ఏమిటి?
జవాబు:
q = ధనాత్మకం (+Ve) → పరిసరాల నుండి ఉష్ణం వ్యవస్థకు మార్పిడి.
q = రుణాత్మకం (-Ve) → వ్యవస్థ నుండి ఉష్ణం పరిసరాలకు మార్పిడి.
ప్రశ్న 17.
పరిసరాల నుంచి వ్యవస్థ ఎలాంటి ఉష్ణం గ్రహించలేదు. అయితే వ్యవస్థ మీద పని జరిగింది. వ్యవస్థకు ఎలాంటి సరిహద్దు గోడ ఉంది?
జవాబు:
పరిసరాల నుండి వ్యవస్థకు ఉష్ణమార్పిడి జరుగలేదు. కాని పని (w) వ్యవస్థపై జరిగినది. ఇది స్థిరోష్ణక మార్పు. కావున ఇది స్థిరోష్ణక గోడ.
ప్రశ్న 18.
వ్యవస్థ మీద పని ఏమీ జరగలేదు. అయితే ‘q’ ఉష్ణం వ్యవస్థ నుంచి పరిసరాలకు మారింది. వ్యవస్థకు ఎలాంటి సరిహద్దు గోడ ఉంది?
జవాబు:
వ్యవస్థపై పని జరుగలేదు. కాని (q) ఉష్ణం వ్యవస్థ నుండి పరిసరాలకు మార్పిడి జరిగినది. ఇచ్చట గోడ ఉష్ణవాహక గోడ.
ప్రశ్న 19.
వ్యవస్థ పనిచేసింది, వ్యవస్థకు ‘q’ ఉష్ణం కూడా ఇవ్వబడింది. ఇది ఎలాంటి వ్యవస్థ?
జవాబు:
ఈ వ్యవస్థ మూసిన వ్యవస్థ
గణిత రూపం
ΔU = q – W
ΔU ఆంతరిక శక్తి మార్పు
q = అందించబడిన ఉష్ణం
W = వ్యవస్థ ద్వారా జరిగిన పని
![]()
ప్రశ్న 20.
q = w = – Pext (vf – vi). ఇది అనుత్రమణీయ ….. మార్పు.
జవాబు:
q = w = -Pext (vf – vi) అనునది అనుత్రమణీయ సమోష్ణక మార్పు.
ప్రశ్న 21.
q = −w = nRT In (vf/vi). ఇది సమోష్ఠీయ ……… మార్పు.
జవాబు:
q = -w = nRT ln \(\frac{v_f}{v_i}\) అనునది సమోష్ణ ఉత్రమణీయ మార్పు.
ప్రశ్న 22.
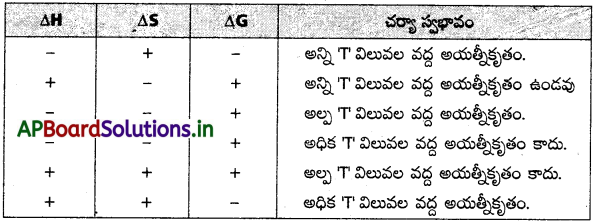
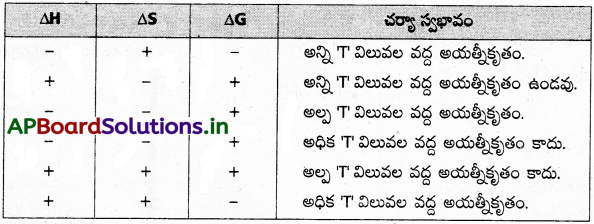
ΔH కి ఉష్ణమోచక, ఉష్ణగ్రాహక చర్యల్లో సాంప్రదాయిక గుర్తు (sign) లు ఏమిటి ?
జవాబు:
- ఉష్ణమోచక చర్యలో ΔHf = రుణాత్మకం (−Ve)
- ఉష్ణగ్రాహక చర్యలో ΔHf = ధనాత్మకం (+Ve)
ప్రశ్న 23.
విస్తార (extensive), గహన (intensive) ధర్మాలంటే ఏమిటి?
జవాబు:
ఒక వ్యవస్థ యొక్క కొలవదగిన ధర్మాలను రెండు రకాలుగా వర్గీకరిస్తారు.
1. విస్తార ధర్మాలు (Extensive properties) :
“ఈ ధర్మాలు వ్యవస్థలోని ద్రవ్యం మొత్తం పరిమాణం మీద ఆధారపడి ఉండే ధర్మాలు”.
ఉదా : ద్రవ్యరాశి (m), ఘనపరిమాణం (V), అంతరిక శక్తి (E), ఎంథాల్పీ (H), గిబ్స్ శక్తి (G), ఎంట్రోపీ (S) మొ||నవి.
2. గహన ధర్మాలు (Intensive properties) :
“ఈ ధర్మాలు వ్యవస్థలోని పదార్థం పరిమాణం మీద ఆధారపడని ధర్మాలు”.
ఉదా : పీడనం (P), ఉష్ణోగ్రత (T), బాష్పీభవన స్థానం (B.P), ఘనీభవన స్థానం (F.P), బాష్పీపీడనం (V.P), స్నిగ్ధత (n), తలతన్యత (σ) మొ||నవి.
ప్రశ్న 24.
సమీకరణం q = c. m. ΔT లో ΔT ఉష్ణోగ్రత మార్పు ‘m’ పదార్థం ద్రవ్యరాశి ‘q’ కావలసిన ఉష్ణం. అయితే ‘c’ ఏమిటి?
జవాబు:
q = c. m. ΔT లో ఇవ్వబడినది
పై సమీకరణంలో c = విశిష్టోష్టం
ఉష్ణధారణ :
1 గ్రా. పదార్థం యొక్క ఉష్ణోగ్రతను 1°C పెంచుటకు అవసరమైన ఉష్ణాన్ని ఉష్ణధారణ అంటారు.
ప్రశ్న 25.
ΔU, ΔH ల సంబంధం తెలిపే సమీకరణం రాయండి.
జవాబు:
ΔH = ΔU + ΔnRT
ΔH = ఎంథాల్పీ మార్పు
ΔU = ఆంతరిక శక్తి మార్పు
Δn = nP – nR,
R = సార్వత్రిక వాయు స్థిరాంకం
T = ఉష్ణోగ్రత
ప్రశ్న 26.
Cp, Cv ల మధ్య సంబంధం ఏమిటి?
జవాబు:
Cp – Cv = R
Cp = స్థిర పీడనం వద్ద ఉష్ణ సామర్థ్యం
Cv = స్థిర ఘనపరిమాణం వద్ద ఉష్ణసామర్థ్యం
R = సార్వత్రిక వాయు స్థిరాంకం.
ప్రశ్న 27.
బాంబ్ కెలోరిమీటర్లో ఆక్సిజన్ సమక్షంలో 298K, 1 atm పీడనం 1g గ్రాఫైట్ ఇచ్చిన సమీకరణం ప్రకారం దహనం చెందింది.
C(graphite) + O2 (వా) → CO2 (వా)
చర్య జరగడం వల్ల ఉష్ణోగ్రత 298K నుంచి 299K కు పెరిగింది. బాంబ్ కెలోరిమీటర్ ఉష్ణధారణ 20.7kJK-1. పై చర్యకు 298 K, 1 atm పీడనం వద్ద ఎంథాల్పీ మార్పు ఎంత?
జవాబు:
C(గ్రాఫైట్) + O2(వా) → CO2(వా)
ΔT = 299 – 298 = 1K
q Cv × ΔT = −20.7 × 1 = – 20.7 KU
1 గ్రా. గ్రాఫైట్ ఇవ్వబడినది.
ΔH = ΔU (Δn = 0)
ΔU = -20.7 Kj/k
ఒక మోల్కు
ΔU = 12 × -20.7
= -248 KJ/mole
![]()
ప్రశ్న 28.
పై చర్యకు అంతరిక శక్తి మార్పు ΔU ఎంత?
జవాబు:
పై చర్యకు అంతరిక శక్తి మార్పు ΔU = – 20.7 KJ/K.
ప్రశ్న 29.
CH4 (వా) + 2O2(వా) → CO2 (వా) + 2H2O (ద్ర) చర్యకు క్రియాజనకాలు, క్రియాజన్యాల మోలార్ ఎంథాల్పీల ఆధారంగా చర్యోష్టం ΔrH ఎంత?
జవాబు:
ΔrH = క్రియాజన్యాల ఎంథాల్పీల మొత్తం – క్రియాజనకాల ఎంథాల్పీల మొత్తం
= ΔHp = ΔHr
ΔrH = H(CO2) + 2 × H(H2O) – (H(CH4) + 2 × H(O2))
ప్రశ్న 30.
కేవలం ఎంథాల్పీ తగ్గుదల మాత్రమే చర్య అయత్నీకృతానికి కారణం కాదు. ఎందువల్ల?
జవాబు:
ఎంథాల్పీ మార్పు ΔH = రుణాత్మకం (-ve) అనునది స్వచ్ఛంద చర్యలకు (లేదా) ప్రక్రియలకు ఒక తోడ్పడే అంశమే కానీ అన్ని సందర్భాలలో కాదు.
ప్రశ్న 31.
కేవలం ఎంట్రోపీ పెరుగుదల చర్య అయత్నీకృతానికి కారణం కాదు. ఎందువల్ల?
జవాబు:
ఎంట్రోపీ మార్పు ΔH = ధనాత్మకం (+ve) అనునది స్వచ్ఛంద చర్యలకు (లేదా) ప్రక్రియలకు ఒక తోడ్పడే అంశమేకానీ అన్ని సందర్భాలలో కాదు.
ప్రశ్న 32.
గిబ్స్ శక్తి మార్పు ΔG కు, సమతాస్థితి స్థిరాంకం K కు మధ్య సంబంధం తెలపండి.
జవాబు:
ΔG° = 2.303 RT logk
ΔG° = గిబ్స్ శక్తిలో మార్పు
K = సమతా స్థితి స్థిరాంకం
ప్రశ్న 33.
ΔHθ, ΔSθ లు తెలిస్తే ΔGθ గణించవచ్చు. ఇది నిజమా? కాదా? ఎందువల్ల?
జవాబు:
ఇవ్వబడినది సత్యము
ΔG° = ΔH° – T ΔS°
పై సమీకరణం బట్టి ΔH°, ΔS° తెలిస్తే ΔG° గణించవచ్చు.
ప్రశ్న 34.
సమతాస్థితి స్థిరాంకం ‘K’ ని ప్రయోగశాలలో ఇచ్చిన ఉష్ణోగ్రత వద్ద ఖచ్చితంగా కొలిస్తే ΔGθ ని వేరే ఏ ఉష్ణోగ్రత వద్దనన్నా కొలవవచ్చా ? ఎట్లా ?
జవాబు:
ΔH°, ΔS° తెలిస్తే ΔG° ను గణించవచ్చు. కావున సమతాస్థితి స్థిరాంకం (K) ను ఏ ఉష్ణోగ్రత వద్దనైనా కనుగొనవచ్చు.
ΔG° ΔH° – T ΔS°
ΔG° = 2.303 RT logk
ప్రశ్న 35.
NO(వా) ఉష్ణగతిక స్థిరత్వాన్ని కింది చర్యల ఆధారంగా వివరించండి.
\(\frac{1}{2}\)N2(వా) + \(\frac{1}{2}\)O2(వా) → NO(వా); ΔrHθ = 90kJ mol-1
NO(వా) + \(\frac{1}{2}\)O2(వా) → NO2(వా); ΔrHθ = -74kJ mol-1
జవాబు:
\(\frac{1}{2}\)N2(వా) + \(\frac{1}{2}\)O2(వా) → NO(వా) ; ΔrHθ = 90kJ mole
NO(వా) + \(\frac{1}{2}\)O2(వా) → NO2(వా) ; ΔrHθ = -74kJ mole
NO(వా) ఏర్పడుట ఉష్ణగ్రాహక చర్య (ΔH = + ve)
NO2(వా) ఏర్పడుట ఉష్ణమోచక చర్య (ΔH = -ve)
కావున NO(వా) ఉష్ణగతికంగా అస్థిరమైనది.
ప్రశ్న 36.
1.00 మోల్ H2O (ద్ర) ప్రమాణ పరిస్థితుల్లో ఏర్పడితే పరిసరాల ఎంట్రోపీ మార్పు ఎంత?
ΔfHθ [H2O(l)] = – 286k Jmol-1.
జవాబు:

ప్రశ్న 37.
ఒక చర్యకు సమతాస్థితి స్థిరాంకం విలువ 10. ΔGθ విలువ ఎంత? R = 8.314 JK-1 mol-1, T = 300 K.
జవాబు:
ΔG° = -RTlnk
K = 10, R = 8.314J/K.mole, T = 300 K
= – 2.303 RT log K
= -2.303 × 8.314 × 300 × log 10
= -5774.14J/mole
![]()
ప్రశ్న 38.
ఉష్ణగతికశాస్త్రం మూడో నియమం ఏమిటి?
జవాబు:
ఉష్ణగతికశాస్త్రం మూడవ నియమం :
పరిపూర్ణ శుద్ధ స్ఫటిక పదార్థాల ఎంట్రోపి విలువ పరమశూన్య ఉష్ణోగ్రత వద్ద (- 273° C) శూన్య విలువను కలిగి వుంటుంది.
Sఅవధిక T → 0 = 0
స్వల్ప సమాధాన ప్రశ్నలు
ప్రశ్న 1.
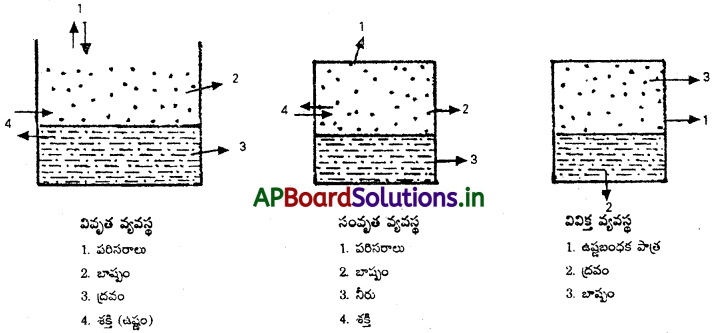
వివృత (open), సంవృత (closed), వివిక్త (isolated) వ్యవస్థలంటే ఏమిటి? ఒక్కొక్కదానికి ఒక ఉదాహరణ ఇవ్వండి.
జవాబు:
ఉష్ణగతికశాస్త్ర అధ్యయనం కోసం, మొత్తం విశ్వాన్ని రెండు భాగాలుగా విభజిస్తారు. అవి
(i) వ్యవస్థ :
ఉష్ణగతికశాస్త్ర అధ్యయనానికి ఎంచుకున్న విశ్వంలోని ఒక లఘు భాగాన్ని “వ్యవస్థ” అంటారు.
(ii) పరిసరాలు :
వ్యవస్థతో సంపర్కంలో ఉండే మిగిలిన విశ్వ భాగాన్ని “పరిసరాలు” అంటారు.
వ్యవస్థ – వర్గీకరణ :
(ఎ) వివృత (లేదా) తెరచి ఉన్న వ్యవస్థ :
“పరిసరాలలో ద్రవ్యం, శక్తి రెండింటినీ వినిమయం చేసుకోగలిగే వ్యవస్థను, “వివృత వ్యవస్థ” అంటారు.
ఉదా : ఒక తెరచిన పాత్రలో ద్రవాన్ని తీసుకోవాలి. ఇది పరిసరాల నుంచి ఉష్ణశక్తిని గ్రహిస్తుంది. అంతేగాక బాష్పీభవన, ద్రవీకరణ ప్రక్రియలలో పరిసరాలకు ఉష్ణశక్తిని అందించగలుగుతుంది. ఈ విధంగా నీరు బాష్పం రూపంలో పరిసరాలలోకి పోతుంది. ద్రవం రూపంలో బాష్పం బీకరులోకి చేరుతుంది.
(బి) సంవృత (లేదా) మూసివున్న వ్యవస్థ :
“పరిసరాలతో ద్రవ్యాన్ని గాక శక్తిని మాత్రమే వినిమయం చేసుకునే వ్యవస్థ “సంవృత వ్యవస్థ”
ఉదా : సచ్ఛిద్రం కాని, మూసివుండే పాత్రలో నీరు తీసుకున్నాం అనుకుందాం. ఇది పరిసరాల నుంచి ఉష్ణాన్ని గ్రహించి బాష్పీభవనం చెందుతుంది. అయితే బాష్పం ద్రవంగా తిరిగి బీకరులోనే సాంద్రీకరణం చెందుతుంది. అయితే ఉష్ణశక్తిని మాత్రం పరిసరాలకు వెలువరిస్తుంది. అయితే నీరు పాత్రను వదిలివెళ్ళలేదు (లేదా) నీరు పాత్రలోకి రాదు. ఎందుకంటే పాత్ర మూసి వుంది. అంతేగాక సచ్ఛిద్రంగా లేదు.
(సి) వివిక్త వ్యవస్థ :
“పరిసరాలతో పదార్థంగానీ శక్తిగానీ, వినిమయం చెందని వ్యవస్థ”.
ఉదా : సీలు చేసిన ఉష్ణబంధక ద్రవం ఉన్న సచ్ఛిద్రం కాని పాత్ర. ద్రవం లేదా దాని బాష్పం పరిసరాలలోకి పోలేదు. పాత్రలోవున్న ద్రవానికి లేదా బాష్పానికి పరిసరాలకు మధ్య వినిమయం ఉండదు. శక్తి వినిమయం కూడా ఉండదు. ఎందుకంటే, పాత్ర ఉష్ణబంధకం.
ప్రశ్న 2.
స్థితి ప్రమేయాలు (state functions), స్థితి చరాంశాలు (state variables) వీటిని నిర్వచించండి. ఉదాహరణలు ఇవ్వండి.
జవాబు:
స్థితి ప్రమేయాలు :
వ్యవస్థ యొక్క ఏ ధర్మాలు అయితే తొలి మరియు తుది స్థితులపై ఆధారపడి ఉంటాయో మరియు చర్య మార్గముపై ఆధారపడవో. వాటిని స్థితి ప్రమేయాలు అంటారు.
ఉదా : శక్తి, ఘనపరిమాణం, ఎంథాల్పీ, గిబ్స్ శక్తి.
స్థితి చరాంశాలు :
చరరాశులు P, V, T మొదలైన వాటిని స్థితి చరాంశాలు అంటారు. ఇవి వ్యవస్థ గురించిన పూర్తి వివరణ ఇచ్చుటకు ఉపయోగపడతాయి.
ప్రశ్న 3.
“ఆంతరిక శక్తి ఒక స్థితి ప్రమేయం” వివరించండి.
జవాబు:
అంతరిక శక్తి (U) :
స్థిర ఉష్ణోగ్రత మరియు వీడవాల వద్ద ఒక పదార్థంలో నిల్వ ఉంచబడిన మొత్తం శక్తిని ఆంతరిక శక్తి అంటారు.
ఇది స్థితి ప్రమేయం మరియు విస్తార ధర్మం.
ఆంతరిక శక్తి మార్పు ∆U = UP – UR
UP = క్రియాజన్యాల ఆంతరిక శక్తి
UR = క్రియాజనకాల ఆంతరిక శక్తి
∆U = Q – W
Q = ఉష్ణం
W = పని
ఆంతరిక శక్తి స్థితిప్రమేయం ఇది తొలి మరియు తుది స్థితులపై ఆధారపడును.
ప్రశ్న 4.
“పని స్థితి ప్రమేయం కాదు”. వివరించండి.
జవాబు:
పని అనునది స్థితి ప్రమేయం కాదు
- వ్యవస్థ యొక్క ఒక స్థితి మరొక స్థితిలోనికి ఉష్ణ మార్గాలలో మారును. వివిధ మార్గాలలో ఉన్న పని పరిమాణంలో మారును.
- పని చర్య మార్గంపై ఆధారపడును కానీ వ్యవస్థ స్థితిపై ఆధారపడును.
![]()
ప్రశ్న 5.
ఉష్ణం అంటే ఏమిటో వివరించండి.
జవాబు:
- పరిసరాల నుండి వ్యవస్థకు ఉష్ణం మార్పిడి జరిగినపుడు వ్యవస్థలోని ఆంతరిక శక్తి మారును. మరియు పని జరగనపుడు విపర్యయం సత్యము.
- ఉష్ణోగ్రత మార్పు. ఫలితంగా శక్తి, మార్పిడి జరుగుకు దీనినే ఉష్ణం (q) అంటారు.
ప్రశ్న 6.
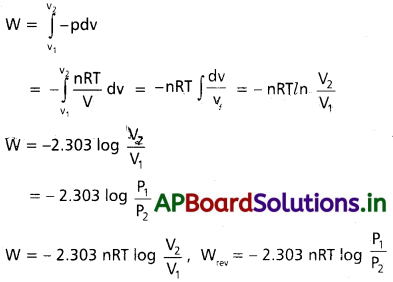
సమోష్ణక ఉమణీయ చర్యకు ‘Wrev‘ ను ఉత్పాదించండి.
జవాబు:
సమోష్ణక ఉత్రమణీయ చర్యకు Wrev కు సమీకరణం ఉత్పాదన :
పీడనంకు వ్యతిరేకంగా జరుగుపని W = – P.dv
V1 ఘనపరిమాణం నుండి V2 ఘనపరిమాణం (సమోష్ణోగ్రత వ్యాకోచం)
ప్రశ్న 7.
10 a tm పీడనం వద్ద ఆదర్శ వాయువు సమోష్ణక విజ్ఞానంలో 30 కు శూన్యంలోకి వ్యాకోచం చెందుతుంది. ఈ వ్యాకోచంలో ఎంత ఉష్ణం గ్రహించబడుతుంది? ఎంత పని జరుగుతుంది.?
జవాబు:
ఉష్ణం శోషించబడినది = 0
వాయువు పీడనం = 10 at m
PExt = 0
V1 = 2 లీ.
V2 = 20 లీ.
= pex(v2 – v1)
= pex (20 – 2)
= 0 (18)
p = 0
సమోష్ణగ్రత పద్దతి కావున
∆U = 0
q + w = 0
q = -w
D (20-2)
కావున పని జరిగినది W = 0
ప్రశ్న 8.
పై 45 న సమస్యలోని ఆదర్శ వాయువులు 1 a tm స్థిరపీడనానికి వ్యతిరేకంగా వ్యాకోచిస్తే ‘q’ విలువ ఎంత?
జవాబు:
pex = 1 అట
p(వా) = 10 అట్మా
V1 = 2 లీ.
V2 = 20 లీ.
q = – W
= Pex(V2 – V1)
= 1 (20 – 2)
= 10 లీ, అట్మా
ప్రశ్న 9.
పై 46వ ప్రశ్నలోని ఆదర్శ వాయువు 20a. ఘనపరిమాణానికి ఉత్క్రమణీయంగా వ్యాకోచం చెందితే ‘q’ విలువ ఎంత?
జవాబు:
q = -w
= 2.303 nRT log\(\frac{V_2}{V_1}\)
2.303 × 20 log\(\frac{20}{2}\)
= 46.06 లీ. అట్మా
ప్రశ్న 10.
స్థితి ప్రమేయం V ను వివరించండి. ∆U, ∆V ల మధ్య సంబంధం ఏమిటి?
జవాబు:
ఎంధార్ళీ (∆H) :
స్థిరపీడనం మరియు ఉష్ణోగ్రత వద్ద వ్యవస్థకు పరిసరాలకు మధ్య మార్పిడి జరిగే ఉష్ణ పరిమాణాన్ని ఎంథాల్పీ (M) అంటారు.
ఎంథాల్పీ మార్పు ∆H = ∆U + P ∆V
∆U = అంతరిక శక్తి మార్పు
ఎంథాల్పీ అనునది స్థితి ప్రమేయం
∆H = [Hక్రియాజన్యాలు – Hక్రియాజనకాలు]
∆H = ∆U + ∆nRT
ప్రశ్న 11.
∆H = ∆U + ∆n(వా) RT ను ఉత్పాదించండి.
జవాబు:
ఎంథాల్పీ (H) :
స్థిరపీడనం మరియు ఉష్ణోగ్రత వద్ద వ్యవస్థకు పరిసరాలకు మధ్య మార్పిడి జరిగే ఉష్ణ పరిమాణాన్ని ఎంథాల్పీ (H) అంటారు.
ఎంథాల్పీ మార్పు ∆H = ∆U + P ∆V
∆U = ఆంతరిక శక్తి మార్పు
ఎంథాల్పీ అనునది స్థితి ప్రమేయం
∆Η [Hక్రియాజన్యాలు – Hక్రియాజనకాలు]
∆H = ∆U + ∆nRT
ఉత్పాదన :
PV1 = n1 RT
PV2 = n2 RT
PV2 – PV1 = (n2 – n1) RT
P ∆V = ∆n(g) RT
∆H = ∆U + P∆V అని మనకు తెలుసు
∆H = ∆U + ∆n(g) RT
ప్రశ్న 12.
1 మోల్ నీటిని 1 బార్ పీడనం, 100°C వద్ద ఆదర్శ వాయువులా ప్రవర్తించే నీటి బాష్పం ఏర్పరిస్తే ఆ చర్యలో మోలార్ బాష్పీకరణ ఎంథాల్పీ 41 kJ mol-1. క్రింది వాటికి ఆంతరిక శక్తి మార్పును లెక్కకట్టండి.
a) 1 మోల్ నీరు 1 బార్, 100°C వద్ద బాష్పీకరణం చెందినప్పుడు
b) 1 మోల్ నీరు ద్రవ స్థితి నుంచి మంచుగా మారినప్పుడు.
జవాబు:

ప్రశ్న 13.
గహన, విస్తార ధర్మాలు వివరించండి.
జవాబు:
ఒక వ్యవస్థ యొక్క కొలవదగిన ధర్మాలను రెండు రకాలుగా వర్గీకరిస్తారు.
1. విస్తార ధర్మాలు (Extensive properties) :
“ఈ ధర్మాలు వ్యవస్థలోని ద్రవ్యం మొత్తం పరిమాణం మీద ఆధారపడి ఉండే ధర్మాలు”.
ఉదా : ద్రవ్యరాశి (m), ఘనపరిమాణం (V), అంతరిక శక్తి (E), ఎంథాల్పీ (H), గిబ్స్ శక్తి (G), ఎంట్రోపీ (S) మొ||నవి.
2. గహన ధర్మాలు (Intensive properties) :
“ఈ ధర్మాలు వ్యవస్థలోని పదార్థం పరిమాణం మీద ఆధారపడని ధర్మాలు”.
ఉదా : పీడనం (P), ఉష్ణోగ్రత (T), బాష్పీభవన స్థానం (B.P), ఘనీభవన స్థానం (F.P), బాష్పీపీడనం (V.P), స్నిగ్ధత (η), తలతన్యత (σ) మొ||నవి.
![]()
ప్రశ్న 14.
ఉష్ణధారణ అంటే ఏమిటి? CP – CV = R ను ఉత్పాదించండి.
జవాబు:
ఉష్ణధారణ (C) :
ఒక పదార్థం ఉష్ణోగ్రతను 1°C పరిమాణంలో పెంచడానికి అవసరమయ్యే ఉష్ణరాశి పరిమాణాన్ని “ఉష్ణధారణ (C)” అంటారు.
(లేదా)
పదార్థం శోషించుకున్న ఉష్ణరాశి పరిమాణానికి (q) మరియు ఉష్ణోగ్రతలో వచ్చిన పెరుగుదలకి (dT) గల నిష్పత్తి.
C = \(\frac{q}{dT}\)
ఉష్ణగతికశాస్త్ర మొదటి నియమం ఆధారంగా
q = dE + W = dE + P. dV
![]()
i) స్థిర ఘనపరిమాణం వద్ద ఉష్ణం గ్రహించబడితే, ఉష్ణధారణను ‘Cv‘ తో సూచిస్తారు.
dV = 0

“Cv” నిర్వచనం :
స్థిర ఘనపరిమాణం వద్ద ఉష్ణధారణ (Cv) :
“స్థిర ఘనపరిమాణం వద్ద ఉష్ణోగ్రత మార్పుతో ఒక వ్యవస్థ యొక్క అంతరిక శక్తి (E) లో వచ్చిన మార్పు రేటు”.
ii) ఉష్ణం, స్థిర పీడనం దగ్గర గ్రహించితే, ఉష్ణధారణను ‘CP‘ తో సూచిస్తారు.
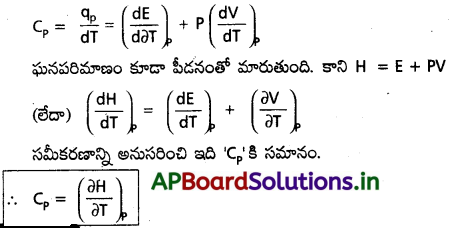
“CP” నిర్వచనం :
స్థిర పీడనం వద్ద ఉష్ణధారణ (CP) అనగా :
“స్థిర పీడనం వద్ద ఉష్ణోగ్రత మార్పుతో ఒక వ్యవస్థ యొక్క ఎంథాల్పీ (H) లో వచ్చిన మార్పు రేటు”.
CP – Cv = R ఉత్పాదన :
H = E + PV

ప్రశ్న 15.
∆U ను ప్రయోగపూర్వకంగా కెలోరి మెట్రిక్ విధానంలో ఏ విధంగా నిర్ణయిస్తారు?
జవాబు:
ఆంతరిక శక్తి మార్పు ∆U కొలిచే విధానం :
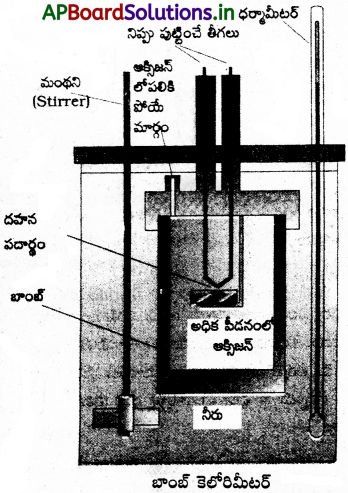
రసాయన చర్యల్లో స్థిర మనపరిమాణం వద్ద గ్రహించబడిన ఉష్ణాన్ని బాంబ్ కెలోరిమీటర్లో కొలుస్తారు. బాంబ్ కెలోరిమీటర్ ఒక దృఢమైన గోడలు గల ఉక్కుపాత్ర. ఇది ఒక జలతాపకం (water battle) లో ముంచబడి ఉంటుంది. ఈ మొత్తం పాత్రల అమరికనే కెలోరిమీటర్ అంటారు. తేలికగా దహనం (combustion) చెందే పదార్థాన్ని ఉక్కు బాంబులో ఉంచి ఆక్సిజన్ను కలిపి దహనం చేస్తారు. చర్య ఉష్ణమోచకమై (దహన చర్యలు ఉష్ణమోచక చర్యలు) ఉష్ణం వెలువడుతుంది. ఇది కెలోరిమీటర్ ఉష్ణోగ్రతను పెంచుతుంది. బాంబ్ కెలోరిమీటర్ ఉష్ణబంధకం దహన చేయబడి ఉంటుంది. అందువల్ల కెలోరి మీటర్ నుంచి పరిసరాలకు పదార్థం ఉష్ణ వినిమయం జరగదు.
బాంబ్ కెలోరిమీటర్ చర్య జరిగేటప్పుడు పూర్తిగా మూసి ఉంచబడి ఉంటుంది కాబట్టి దాని ఘనపరిమాణంలో బాంబ్ మార్పు ఉండదు. అంటే చర్యలో శక్తి మార్పులు స్థిర ఘనపరిమాణంలో జరిగిన వాటిగా అనుకొని కొలతలు చేయాలి. స్థిర ఘనపరిమాణ మంటే ∆V = 0, W = p∆V 0, అంటే పని ఏమీ జరగదు. చర్యలో వాయు పదార్థాలున్నప్పటికీ ఘనపరిమాణంలో మార్పు రాదు. చర్య వల్ల కెలోరిమీటర్ పెరిగిన ఉష్ణోగ్రతను ఉపయోగించి కెలోరిమీటర్ ద్రవ్యరాశి, దాని ఉష్ణధారణ విలువల ద్వారా వెలువడిన ఉష్ణాన్ని (qv) నుంచి q = c × m × ∆T = C∆T గణించవచ్చు.
ప్రశ్న 16.
∆H ను ప్రయోగపూర్వకంగా కెలోరిమెట్రిక్ విధానంలో ఏ విధంగా నిర్ణయిస్తారు?
జవాబు:

స్థిర పీడనం వద్ద ఉష్ణశక్తి (∆H) ని కొలవడం
మూత లేకుండా తెరచి ఉన్న కెలోరిమీటర్ సాధారణంగా వాతావరణ పీడనం దగ్గర ఉంటుంది. వాతావరణ పీడనం స్థిరంగా ఉంటుంది (కనీసం ప్రయోగం జరిగిన సమయం వరకు) కాబట్టి కెలోరీ మీటర్ చర్య వల్ల వచ్చిన ఉష్ణ మార్పు స్థిరపీడనం వద్ద కొలిచిందిగా భావించవచ్చు. (పటం 6.8). దీనిని qp గా రాస్తే ∆H కు సమానమవుతుంది. ∆H = qp (స్థిర పీడనం వద్ద). కాబట్టి స్థిర పీడనం వద్ద కొలిచిన ఉష్ణ మార్పు చర్యోష్ణం (అది వెలువడిన ఉష్ణం కావచ్చు లేదా గ్రహించబడిన ఉష్ణం కావచ్చు) లేదా చర్యా ఎంథాల్పి ∆rH అవుతుంది.
ఉష్ణమోచక చర్యలో ఉష్ణం వెలువడుతుంది. అంటే వ్యవస్థ నుంచి పరిసరాలకు ఉష్ణం ఇవ్వబడుతుంది. అందువల్ల qp రుణాత్మకమవుతుంది. ∆rH కూడా రుణాత్మకం. అదే విధంగా ఉష్ణగ్రాహక చర్యలో వ్యవస్థ లేదా చర్య ఉష్ణం గ్రహిస్తుంది. అంటే పరిసరాల నుంచి చర్యకు ఉష్ణం ఇవ్వబడుతుంది. దీనికి qp ధనాత్మకం, ∆rH కూడా ధనాత్మకమే.
స్థిర పీడనం వద్ద ఉష్ణశక్తి మార్పులు కొలవడానికి ఉపయోగించే కెలోరిమీటర్ (వాతావరణ పీడనం వద్ద)
ప్రశ్న 17.
చర్యా ఎంథాల్పీ అంటే ఏమిటి? ప్రమాణ చర్యా ఎంథాల్పీని వివరించండి.
జవాబు:
ఎంథాల్పీ (H) :
స్థిరపీడనం మరియు ఉష్ణోగ్రత వద్ద వ్యవస్థకు పరిసరాలకు మధ్య మార్పిడి జరిగే ఉష్ణ పరిమాణాన్ని ఎంథాల్పీ. (H) అంటారు.
ఎంథాల్పీ మార్పు ∆H = ∆U + P ∆V
∆U = ఆంతరిక శక్తి మార్పు
ఎంథాల్పీ అనునది స్థితి ప్రమేయం
ΔΗ = [Hక్రియాజన్యాలు – Hక్రియాజనకాలు]
ΔΗ = ΔU + ΔnRT
ప్రశ్న 18.
“సంఘటనోష్ణం”ను నిర్వచించండి. ఒక ఉదాహరణనివ్వండి.
జవాబు:
ఒక మోల్ పదార్థం ఏర్పడినపుడు ఆ చర్యలో జరిగే ఉష్ణమార్పును సంఘటనోష్ణం అంటారు.
‘చర్యలోని పదార్థాలన్నీ ప్రమాణస్థితిలో ఉంటే ఆ ఎంథాల్పీని ప్రమాణ సంఘటనోష్ణం అంటారు.
ఉదా : 1) C(గ్రాఫైట్) + 2S(వా) → CS2, ΔH = 91.9 KJ
2) S(రాంబిక్) + O2(వా) → SO(వా), ΔH = -297.5 KJ
ప్రశ్న 19.
ప్రావస్థ మార్పు ఎంథాల్పీని నిర్వచించి వివరించండి.
జవాబు:
ప్రావస్థ మార్పు ఎంథాల్పీ :
ఒక మోల్ పదార్థం ప్రావస్థ (లేదా) భౌతిక స్థితి మార్పు చెందినపుడు జరిగిన ఉష్ణమార్పును ప్రావస్థ మార్పు ఎంథాల్పీ అంటారు.
a) మోలార్ ద్రవీభవన ఎంథాల్పీ : (ΔfusH°) :
ప్రమాణ స్థితిలో ఉన్నటువంటి ఒక మోల్ ఘనపదార్థాన్ని ద్రవీభవనం చేయుటకు అవసరమగు ఎంథాల్పీ మార్పును మోల్దార్ ద్రవీభవన ఎంథాల్పీ అంటారు.
ఉదా : H2O(ఘ) →H2O(ద్ర) ΔfusH° = 6.0 KJ mole
b) మోలార్ బాష్పీభవన ఎంథాల్పీ : (ΔvapH°) :
ప్రమాణస్థితిలో ఉన్నటువంటి ఒక మోల్ ద్రవాన్ని బాష్పీభవనం చేయుటకు అవసరమగు ఎంథాల్పీ మార్పును మోలార్ బాష్పీభవన ఎంథాల్పీ అంటారు.
ఉదా : H2O(ద్ర) → H22O(వా) ΔvapH° = 40.79 KJ mole
c) మోలార్ ఉత్పాతన ఎంథాల్పీ : (ΔsubH°) :
ప్రమాణస్థితిలో ఉన్నటువంటి ఒక మోల్ ఘన పదార్థం నేరుగా బాష్పీభవనం చేయుటకు అవసరమగు ఎంథాల్పీ మార్పును మోలార్ ఉత్పాతన ఎంథాల్పీ అంటారు.

ప్రశ్న 20.
ద్రవీభవన ఎంథాల్పీ (మోలార్ ద్రవీభవన ఎంథాల్పీ)ని నిర్వచించి వివరించండి.
జవాబు:
మోలార్ ద్రవీభవన ఎంథాల్పీ : (ΔfusH°) :
ప్రమాణ స్థితిలో ఉన్నటువంటి ఒక మోల్ ఘనపదార్థాన్ని ద్రవీభవనం చేయుటకు అవసరమగు ఎంథాల్పీ మార్పును మోలార్ ద్రవీభవన ఎంథాల్పీ అంటారు.
ఉదా : H2O(ఘ) → H2O(ద్ర) ΔfusH° = 6.0 KJ mole
![]()
ప్రశ్న 21.
బాష్పీభవన ఎంథాల్పీ (మోలార్ బాష్పీభవన ఎంథాల్పీ)ని నిర్వచించి వివరించండి.
జవాబు:
మోలార్ బాష్పీభవన ఎంథాల్పీ : (ΔvapH°) :
ప్రమాణస్థితిలో ఉన్నటువంటి ఒక మోల్ ద్రవాన్ని బాష్పీభవనం చేయుటకు అవసరమగు ఎంథాల్పీ మార్పును మోలార్ బాష్పీభవన ఎంథాల్పీ అంటారు.
ఉదా : H2O(ద్ర) → H2O(వా) ΔvapH° = 40.79 KJ mole
ప్రశ్న 22.
ప్రమాణ ఉత్పతన ఎంథాల్పీని నిర్వచించి వివరించండి.
జవాబు:
మోలార్ ఉత్పాతన ఎంథాల్పీ : (ΔsubH°) :
ప్రమాణస్థితిలో ఉన్నటువంటి ఒక మోల్ ఘన పదార్థం నేరుగా బాష్పీభవనం చేయుటకు అవసరమగు ఎంథాల్పీ మార్పును మోలార్ ఉత్పాతన ఎంథాల్పీ అంటారు.

ప్రశ్న 23.
ప్రమాణ సంఘటనోష్ణం (సంశ్లేషనోష్ణం ) (ΔfHθ) ను నిర్వచించి వివరించండి.
జవాబు:
ఒక మోల్ పదార్థం ఏర్పడినపుడు ఆ చర్యలో జరిగే ఉష్ణమార్పును సంఘటనోష్ణం అంటారు. చర్యలోని పదార్థాలన్నీ ప్రమాణస్థితిలో ఉంటే ఆ ఎంథాల్పీని ప్రమాణ సంఘటనోష్ణం అంటారు.
ఉదా : 1) C(గ్రాఫైట్) + 2S(వా) → CS2, ΔH = 91.9 KJ
2) S(రాంబిక్) + O2(వా) → SO2(వా), ΔH = – 297.5 KJ
ప్రశ్న 24.
హెస్ స్థిరోష్ణ నియమాన్ని నిర్వచించి వివరించండి. [A.P. Mar. ’15 Mar. ’14]
జవాబు:
హెస్ నియమము :
“ఒక రసాయన చర్య ఒక దశలో జరిగినా లేక ఎక్కువ దశలలో జరిగినా గ్రహించిన లేదా వెలువడిన మొత్తం ఉష్ణ పరిమాణం ఒకే విలువలో ఉంటుంది”.
వివరణ :
(i) సాధారణ సమీకరణం ద్వారా :
A అనే పదార్థం రెండు భిన్న మార్గాల ద్వారా చర్య జరిపి D అనే పదార్థాన్ని ఇస్తుంది.
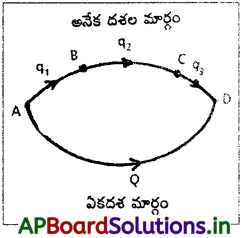
ఏక దశ : A → D, ΔH = Q
అనేక దశలు : A → B, ΔH1 = q1
B → C, ΔH2 = q2
C → D, ΔH3 = q3
ΔH1 + ΔH2 + ΔH3 = q1 + q2 + q3
హెస్ నియమం ప్రకారం, Q = q1 + q2 + q3 అవుతుంది.
(ii) విశిష్ట ఉదాహరణ ద్వారా :
CO(వా) నుC(గ్రాఫైట్) O(వా) ల నుంచి రెండు విధాలుగా పొందవచ్చు.
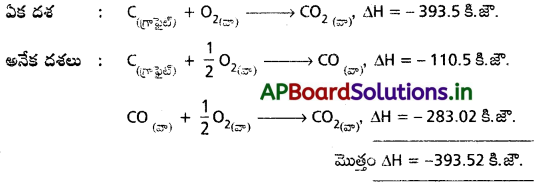
ప్రశ్న 25.
దహనచర్య ఎంథాల్పీ (ΔHθ) ను నిర్వచించి వివరించండి.
జవాబు:
- నిర్ధిష్ట ఉష్ణోగ్రత వద్ద ఒక మోల్ పదార్థాన్ని దహనం చేయునపుడు జరుగు ఎంథాల్పీ మార్పును దహన చర్య ఎంథాల్పీ అంటారు.
- ఇచ్చట క్రియాజనకాలు, జన్యాలు ప్రమాణస్థితిలో ఉండవలెను.

పై చర్య బ్యూటేన్ యొక్క దహనచర్య. ఇచ్చట దహన చర్య ఎంథాల్పీ = -2658 kJ/mole
ప్రశ్న 26.
ΔaHθ, పరమాణీకరణ ఎంథాల్పీని నిర్వచించి వివరించండి.
జవాబు:
వాయుస్థితిలో ఉన్న ఒక మోల్ సరళ అణువు, పరమాణువులుగా విఘటనం చెందుటకు అవసరమైన ఎంథాల్పీని పరమాణీకరణ
ఎంథాల్పీ అంటారు. (ΔaHθ)
→ ఇది ఉష్ణగ్రాహక చర్య
ఉదా : N2(వా) → 2N(వా) ΔH = 937.4 KJ
O2(వా) → 2O(వా) ΔH = 489.5 KJ
ప్రశ్న 27.
బంధ ఎంథాల్పీ (ΔbondHθ) నిర్వచించి వివరించండి.
జవాబు:
బంధ ఎంథాల్పీ (ΔbondHθ) :
వాయు స్థితిలో ఉన్న ఒక సంయోజనీయ సమ్మేళనంలోని ఒక మోల్ సంయోజనీయ బంధాన్ని విఘటనం చేసి వాయుస్థితిలో ఉత్పన్నాలను ఏర్పరచుటకు అవసరమైన ఎంథాల్పీని బంధ ఎంథాల్పీ అంటారు.
ఉదా : H2(వా) → 2H(వా) ΔH= 435.9 KJ / mole
ప్రశ్న 28.
CH4 లోని C – H బంధ ఎంథాల్పీని వివరించండి.
జవాబు:

ప్రశ్న 29.
ద్రావణోష్ణం (ΔsolHθ), విలీన ప్రక్రియ ఉష్ణం (ΔsolHθ) లను నిర్వచించి వివరిచండి.
జవాబు:
ద్రావణోష్ణం (ΔsolHθ) :
ఒక మోల్ ద్రావితం, అధికమొత్తం ద్రావణిలో కరిగినపుడు శోషించబడిన (లేదా) విడుదల చేయబడ్డ ఉష్ణాన్ని ద్రావణోష్ణం అంటారు.
ఉదా : KCl(ఘ) + జలద్రావణం → KCl(జ) ΔH = 19.75 kJ
విలీన ప్రక్రియోష్టం :
ఒక మోల్ ద్రావితం కలిగియున్న ద్రావణంను విలీనం చేసి ఒక గాఢత నుండి వేరొక గాఢతకు మార్చునపుడు జరిగే ఎంథాల్పీ మార్పును విలీన ప్రక్రియోష్టం అంటారు.
ఉదా : HCl(వా) + జలద్రావణం → HCl(జ) ΔH = -75.4 kJ
ప్రశ్న 30.
అయొనైజేషన్ ఎంథాల్పీ, ఎలక్ట్రాన్ స్వీకరణ ఎంథాల్పీలను నిర్వచించండి.
జవాబు:
అయొనైజేషన్ శక్తి, ఎలక్ట్రాన్ ఎఫినిటీ :
ఈ రెండింటిని పరమ ఉష్ణోగ్రత సున్న (absolute zero లేదా OK) దగ్గర నిర్వచించేవారు. ఎందుకంటే ఏ ఇతర ఉష్ణోగ్రతలైనా తీసుకొంటే క్రియాజనకాల, క్రియాజన్యాల ఉష్ణధారణ విలువలు పరిగణనలోకి తీసుకోవలసి ఉంటుంది. చర్యా ఎంథాల్పీలు కింది చర్యలకు చూడండి :
M(వా) → M+(వా) + e– (అయొనైజేషన్కు)
M(వా) + e– → M–(వా) (ఎలక్ట్రాన్ స్వీకరించినప్పుడు)
పై రెండు చర్యలు ‘T’ ఉష్ణోగ్రత వద్ద జరిగితే
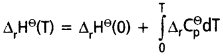
ప్రతి కణానికి (species) CP విలువ పై చర్యల్లో 5/2 R (అదే Cv = 3/2R)
కాబట్టి ΔrCpᎾ = + 5/2 R (అయొనైజేషన్కు)
ΔrCpᎾ = -5/2 R (ఎలక్ట్రాన్ స్వీకరణకు)
కాబట్టి,
ΔrHᎾ (అయొనైజేషన్ ఎంథాల్పీ)
= E0 (అయొనైజేషన్ శక్తి) + (5/2) RT
ΔrHᎾ (ఎలక్ట్రాన్ స్వీకరణ (gain) ఎంథాల్పీ)
= -A (ఎలక్ట్రాన్ ఎఫినిటీ) – (5/2) RT
ప్రశ్న 31.
ఒక ప్రక్రియ అయత్నీకృతాన్ని వివరించండి.
జవాబు:
అయత్నీకృత చర్య :
ఏ రూపంలో అయినా బయటి (బాహ్య) ఏజన్సీని ఉపయోగించకుండా స్వచ్ఛందంగా జరిగే చర్యలను అయత్నీకృత చర్యలు అంటారు.
- సహజ సిద్ధమైన ప్రక్రియలు అయత్నీకృతమైనవి.
అన్ని అయత్నీకృత చర్యలలో ఎంట్రోపీ పెరుగును. - అయత్మీకృత చర్య యొక్క నిబంధనను వివరించడానికి “గిబ్స్” ఒక ఉష్ణగతిక శాస్త్ర ప్రమేయాన్ని ప్రవేశపెట్టాడు. దీనిలో ఎంథాల్పీ (H), ఎంట్రోపీ (S) ప్రమేయాలున్నాయి. దీన్ని G = H – TS) గా వ్రాస్తారు.
‘G’ ని “గిబ్స్ శక్తి” (లేక) “గిబ్స్ ప్రమేయం” అంటారు.
అన్ని అయత్నీకృత చర్యలు (లేదా) ప్రక్రియలకు ΔG = ఋణవిలువ.
అయత్నీకృత చర్యలు – నిబంధనలు :
ప్రశ్న 32.
ఒక అయత్నీకృత ప్రక్రియకు కారణం ఎంథాల్పీ తగ్గుదల మాత్రమే కారణమా? వివరించండి.
జవాబు:
ఎంథాల్పీ మార్పు ΔH = రుణాత్మకం (−ve) అనునది స్వచ్ఛంద చర్యలకు ఒక తోడ్పడే అంశమే కానీ అన్ని సందర్భాలలో కాదు.
ఈ క్రింది అయత్నీకృత చర్యలను గమనించగా
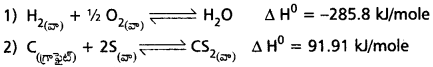
చర్య (1) లో ΔH = —ve, చర్య (2) లో ΔH = +ve కావున ఎంథాల్పీ మార్పు ΔH = రుణాత్మకం (-ve) తగ్గుదల ఒక తోడ్పడే అంశమే కానీ అన్ని సందర్భాలలో కాదు.
ప్రశ్న 33.
ఎంట్రోపీ అంటే ఏమిటి? ఉదాహరణలతో వివరించండి.
జవాబు:
ఎంట్రోపి (S) :
“ఒక వ్యవస్థలోని అణువుల క్రమరాహిత్యాన్ని (లేదా) అనియత స్వభావాన్ని (randomness) కొలిచేదే “ఎంట్రోపి”.
- అణువుల క్రమరాహిత్యం పెరిగినకొద్దీ దాని ఎంట్రోపీ కూడా పెరుగుతుంది.
- అంతరిక శక్తి లాగానే ఇది కూడా ఒక స్థితి ప్రమేయము.
- ఒక వివక్త వ్యవస్థలో జరిగే అయత్మీకృత ప్రక్రియకు ఎంట్రోపీ మార్పు (ΔS) ధన విలువలో ఉంటుంది.
ప్రశ్న 34.
ఎంట్రోపీ పెరుగుదలే అయత్నీకృత ప్రక్రియకు కారణం. వివరించండి.
జవాబు:
ఎంట్రోపీ మార్పు ΔS = ధనాత్మకం (+ve) అనునది అయత్నీకృత చర్యలకు ఒక తోడ్పడే అంశమే కానీ అన్ని సందర్భాలలో కాదు.
- అయత్నీకృత చర్యలకు ΔS = +ve
- ΔS = +ve (తిరోగామి చర్య అయత్నీకృతం)
ΔS = 0 (సమతాస్థితి చర్య) - ΔH = -ve, ΔS = +ve, ΔG = -ve అయిన అన్ని ఉష్ణోగ్రతల వద్ద చర్య అయత్నీకృతం.
![]()
ప్రశ్న 35.
ΔU, ΔS ఉత్రమణీయ, అనుత్రమణీయ ప్రక్రియలను వివరించగలుగుతాయా? వివరించండి.
జవాబు:
ΔU = ఆంతరిక శక్తి మార్పు
- ఉష్ణమోచక చర్య – ఆంతరిక శక్తి తగ్గును – చర్య అయత్నీకృతం
- ఉత్రమణీయ చర్యలలో ఆంతరిక శక్తి తగ్గేవైపుకు చర్య జరుగును.
ఎంట్రోపీ మార్పు ΔS = ధనాత్మకం (+ve) అనునది అయత్నీకృత చర్యలకు ఒక తోడ్పడే అంశమే కానీ అన్ని సందర్భాలలో కాదు - అయత్నీకృత చర్యలకు ΔS = +ve
- ΔS = -ve (తిరోగామి చర్య అయత్నీకృతం)
ΔS = 0 (సమతాస్థితి చర్య) - ΔH = =ve, ΔS = +ve, ΔG = -ve అయిన అన్ని ఉష్ణోగ్రతల వద్ద చర్య అయత్నీకృతం.
ప్రశ్న 36.
4Fe(ఘ) + 3O2(వా) → 2Fe2O3(ఘ) అనే ఐరన్ ఆక్సీకరణ చర్యకు 298K వద్ద ఎంట్రోపీ మార్పు -549.45JK-1 mol-1 దీనికి రుణాత్మక ఎంట్రోపీ ఉన్నా చర్య అయత్నీ కృతంగా జరుగుతుంది. ఎందువల్ల?
జవాబు:


మొత్తం ఎంట్రోపీ మార్పు
ΔrSమొత్తం = 5530 – 549.4
= 4980.6 J/K mole
ప్రశ్న 37.
కింది వాటిల్లో ఏ ఫార్ములాలు సరైనవి?

జవాబు:
a) సరైనది
b) స్థిర ఉష్ణోగ్రత వద్ద సరైనది
c) సరైనది
d) సరైనది
e) సరైనది కాదు
ప్రశ్న 38.
ఆక్సిజన్ను ఓజోన్ గా మార్చడానికి ΔrGθ ను 298K. వద్ద గణించండి. చర్య Kp విలువ 2.47 × 10-29.
జవాబు:
ΔG° = -2.303 RT log Kp
= -2.303 × 8.314 x 298 × log 2.43 × 10-29
= -16300 J/mole
= 163 kJ/mole
ప్రశ్న 39.
ఉష్ణగతికశాస్త్రం రెండో నియమాన్ని నిర్వచించి వివరించండి.
జవాబు:
ఉష్ణగతికశాస్త్ర రెండవ నియమం :
ఈ క్రింది విధంగా నిర్వచించవచ్చు.
- బాహ్య కారకం ప్రమేయం లేకుండా తక్కువ ఉష్ణోగ్రత ప్రదేశం నుంచి ఎక్కువ ఉష్ణోగ్రత ప్రదేశానికి ఉష్ణాన్ని ప్రసరింపచేయగలిగి, చక్రీయంగా పనిచేసే యంత్రాన్ని నిర్మాణం చేయడానికి వీలుకాదు.
- వ్యవస్థలో లేదా దాని పరిసరాలలో శాశ్వత మార్పులను కలిగించకుండా ఉష్ణశక్తిని పూర్తిగా పనిగా మార్చలేం.
- అన్ని అయత్నీకృత చర్యలు, ఉష్ణగతిక శాస్త్రాన్ని అనుసరించి అద్విగత చర్యలే. ఈ అయత్నీకృత చర్యలు అన్నింటిలో వ్యవస్థ ఎంట్రోపి పెరుగుతుంది.
ప్రశ్న 40.
ఉష్ణగతికశాస్త్రం మూడో నియమాన్ని నిర్వచించండి. దీన్ని గురించి మీకు ఏమి తెలిసింది?
జవాబు:
ఉష్ణగతికశాస్త్రం మూడవ నియమం : పరిపూర్ణ శుద్ధ స్ఫటిక పదార్థాల ఎంట్రోపి విలువ పరమశూన్య ఉష్ణోగ్రత వద్ద (- 273° C) శూన్య విలువను కలిగి వుంటుంది.
Sఅవధిక T → 0 = 0
ఈ క్రింది సమీకరణాన్ని అనుసరించి ఏ పదార్థానికైనా ఉష్ణోగ్రత మీద, ‘Cp‘ విలువ ఏవిధంగా ఆధారపడి వుంది అనే విషయం తెలిసినట్లయితే ఆ పదార్థానికి వుండే ఎంట్రోపి (S) విలువను లెక్కించవచ్చు.
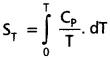
రసాయనిక చర్యలలోని ఎంట్రోపి (∆S) మార్పును లెక్కించడంలో, మూడవ నియమం ఎంతగానో ఉపయోగపడుతుంది.
మూడవ నియమం ప్రాముఖ్యత :
- ఎంట్రోపి విలువ అవధిని గురించి తెలుపుతుంది.
- రసాయన చర్యలో ఎంట్రోపి మార్పులను గణించడంలో ఉపయోగపడుతుంది.
- మొత్తం ఎంట్రోపి మార్పు (∆Sమొత్తం) ఏ స్వచ్ఛంద ప్రక్రియకైనా లేదా చర్యకైనా ధన విలువ ఉండాలి.
∆Sమొత్తం = {∆Sమొత్తం + ∆Sసరిసరాలు}
ప్రశ్న 41.
ఎంట్రోపీ భావనను వివరించండి.
జవాబు:
ఎంట్రోపి (S) :
“ఒక వ్యవస్థలోని అణువుల క్రమరాహిత్యాన్ని (లేదా) అనియత స్వభావాన్ని (randomness) కొలిచేదే “ఎంట్రోపి”.
- అణువుల క్రమరాహిత్యం పెరిగినకొద్దీ దాని ఎంట్రోపీ కూడా పెరుగుతుంది.
- అంతరిక శక్తి లాగానే ఇది కూడా ఒక స్థితి ప్రమేయము.
- ఒక వివక్త వ్యవస్థలో జరిగే అయత్నీకృత ప్రక్రియకు ఎంట్రోపీ మార్పు (∆S) ధన విలువలో ఉంటుంది.
ప్రశ్న 42.
గిబ్స్ శక్తిపరంగా ప్రక్రియ అయత్నీకృత మార్పును వివరించండి.
జవాబు:
అయత్నీకృత చర్య యొక్క నిబంధనను వివరించడానికి “గిబ్స్” ఒక ఉష్ణగతిక శాస్త్ర ప్రమేయాన్ని ప్రవేశపెట్టాడు. దీనిలో ఎంథాల్పీ (H), ఎంట్రోపీ (S) ప్రమేయాలున్నాయి. దీన్ని G = H – TS గా వ్రాస్తారు.
‘G’ ని “గిబ్స్ శక్తి” (లేక) “గిబ్స్ ప్రమేయం” అంటారు.
అన్ని అయత్నీకృత చర్యలు (లేదా) ప్రక్రియలకు ∆G = ఋణవిలువ.
అయత్నీకృత చర్యలు – నిబంధనలు :
ప్రశ్న 43.
గిబ్స్ శక్తి మార్పు విలువ, గుర్తుల ఆధారంగా ఒక రసాయనిక చర్య అయత్నీకృత మార్పును, దాని నుంచి లభించే ఉపయోగకరమైన పనిని తెలుసుకోవచ్చు. దీన్ని వివరించండి.
జవాబు:
∆G = ∆H – T∆S
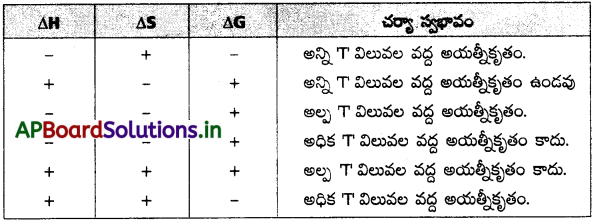
∆Gవ్యవస్థ = ఋణ విలువ, అయత్నీకృత చర్యలకు, (∆G < 0)
∆Gవ్యవస్థ = ధన విలువ, అయత్నీకృతం కాని చర్యలకు, (∆G > 0)
∆Gవ్యవస్థ = 0, సమతాస్థితి చర్యలకు (∆G = 0)
∆G = -ve, ∆S = +ve, ∆H = -ve అయితే అన్ని ఉష్ణోగ్రతల వద్ద చర్య అయత్నీకృతమగును.
గిబ్స్ శక్తి మరియు విలువ, గుర్తుల ఆధారంగా ఒక రసాయనిక చర్య అయత్నీకృత మార్పును, దాని నుండి లభించే ఉపయోగకరమైన పనిని తెలుసుకోవచ్చు.
∆G = ∆G° + RTlnK
∆G = 0 సమతాస్థితి వద్ద .
∆G° = -RTlnK = -2.303 RT log k
∆G° = ∆rH° – T∆rS° = -RT log k
ఉష్ణగ్రాహక చర్యకు ∆rH° > 0.
ఇచ్చట K < 1
ఉష్ణమోచక చర్యకు ∆rH° < 0 ఇచ్చట K > 1
అధిక K విలువ, ∆rG° < 0, ∆rS° > 0 అనునవి చర్య దిగుబడి (ఉత్పన్నాలను ఊహించుటకు అంశాలు.
![]()
ప్రశ్న 44.
ఒక ప్రక్రియలో 701 J ల ఉష్ణం వ్యవస్థ గ్రహించగా వ్యవస్థ 394 J పనిని చేసింది. వ్యవస్థ అంతరిక శక్తి మార్పు ఎంత?
జవాబు:
∆U = q + w q = 701 J
∆U = 701-394 w = -394 J.
= 307 J
ప్రశ్న 45.
సయనమైడ్ NH2CN, డైఆక్సిజన్ల మధ్య బాంబ్ కెలోరిమీటర్ లో 298 K వద్ద చర్య జరిగితే ∆U = – 742, 7ku mol-1. ఇదే ఉష్ణోగ్రత వద్ద ఎంథాల్పీ మార్పు ఎంత?
NH2CN(వా) + \(\frac{3}{2}\)O2(వా) → N2(వా) + CO2(వా) + H2O(ద్ర)
జవాబు:
NH2CN(వా) + \(\frac{3}{2}\)O2(వా) → N2(వా) + H2O(ద్ర)
∆H = ∆U + ∆n RT ∆n = 2 – \(\frac{5}{2}\) = -0.5
∆H = -742 + (-0.5) × 8.314 × 10-3 × 298 ∆U = – 742 kJ/mole
= -742.7-1.238
= -743.94 kJ/mole
ప్రశ్న 46.
60 g అల్యూమినియం ఉష్ణోగ్రతను 35°C నుంచి 55°C కు మార్చడానికి ఎన్ని ఉష్ణం కావాలి ? అల్యూమినియం మోలార్ ఉష్ణధారణ = 24 J mol-1 K-1.
జవాబు:
అల్యూమినియం మోలార్ ఉష్ణధారణ = 24 J mol-1 K-1
= \(\frac{24}{27}\) J/gm.k
35°C నుండి 55°C ఉష్ణోగ్రత మార్చునపుడు 60 గ్రా. Al కు అవసరమైన ఉష్ణం

ప్రశ్న 47.
1.0 mol నీటిని 10°C నుంచి మంచుగా 10°C కు మార్చడానికి ఎంత ఎంథాల్పీ మార్పు తేవాలి?
∆fus H = 6.03 kJ mol-1 at 0°C వద్ద.
Cp [H2O(ద్ర)] = 75.3J mol-1 K-1
Cp [H2O(ఘ)] = 36.8 J mol-1 K-1
జవాబు:
∆H Cp dt = Cp × ∆t
= 75.3 × 10
= 753 kJ
10°c నుండి 0°c కు ఉష్ణోగ్రత తగ్గించినపుడు ఒక మోల్ నీరు ఘనీభవించినది
∆Hfus = 6.03 kJ fus
ఒక మోల్ నీరు – 10°C నుండి 0°C ను పెంచినపుడు
∆H = Cp × ∆T = 36.5 × -10
= – 3650 kJ = -0.368 kJ.
మొత్తం ఎంథాల్పీ = 6.03 +0.753 -0.368
= 6.415 kJ/mole.
ప్రశ్న 48.
C(ఘ) ను CO2 మార్చడానికి దహనక్రియ ఎంథాల్పీ – 393.5 kJ mol-1. కార్బన్, డై ఆక్సిజన్ వాయువు నుంచి 35.2 g CO2 ఏర్పడినపుడు విడుదలయ్యే ఉష్ణశక్తి ఎంత? [T.S. Mar. ’15]
జవాబు:
C(ఘ) O2(వా) + → CO2(వా) ∆H = -393.5 kJ/mole
44గ్రా. CO2 → -393.5 kJ
35.2గ్రా. CO2 → ?
\(\frac{35.2\times393.5}{44}\) = -314.8 kJ
ప్రశ్న 49.
CO(వా), CO2(వా), N2O(వా), N2O4 (వా) ల సంఘటన ఎంథాల్పీలు వరుసగా -110, -393, 81, 9.7 kJ mol-1. కింది చర్య ∆rH.విలువ కనుక్కోండి.
N2O4(వా) + 3CO(వా) → N2O(వా) + 3CO2(వా)
జవాబు:
N2O4(వా) + 3CO(వా) → N2O(వా) + зCO2(వా)
∆H = క్రియాజన్యాల మొత్తం ఎంథాల్నీ – క్రియాజనకాల మొత్తం ఎంథాల్పీ.
∆HCO = -110 KJ, ∆HCO2 = -393 KJ
∆HNN2O= – 81 KJ, ∆HN2O4 = -9.7 KJ
∆H = -1017-(-320.3)
∆H = -696.7kJ
ప్రశ్న 50.
N2(వా) + 3H2(వా) → 2NH3(వా) ; ∆rHᎾ = – 92.4 kJ mol-1. అయితే అమ్మోనియా ప్రమాణ సంఘటన ఎంథాల్పీ ఎంత?
జవాబు:

ప్రశ్న 51.
CH3OH(ద్ర) ప్రమాణ సంఘటన ఎంథాల్పీని కింది చర్యల ద్వారా గణించండి.
CH3OH(వా) + \(\frac{3}{2}\)O2(వా) → CO2(వా) + 2H2O(ద్ర); ∆rHᎾ = -726 kJ mol-1
C(గ్రాఫైట్) + O2(వా) → CO2(వా) ; ∆cHᎾ = -393 kJ mol-1
H2(వా) + \(\frac{1}{2}\)O2(వా) → H2O(ద్ర) ; ∆fHᎾ = -286 kJ mol-1.
జవాబు:
∆fH° (CO2) = -393 KJ mole
∆fH°(H2O) = -286 KJ mole
CH3OH + \(\frac{3}{2}\)O2(వా) → CO2(వా) + 2H2O(ద్ర) ∆Hr0 = -726 KJ mol-1
∆rH° = ఉత్పన్నాల ∆H° – క్రియాజనకాల ∆H°
-726 = -393 + 2 (-286) – [∆H° (CH3OH)]
=- 239 KJ/mole
![]()
ప్రశ్న 52.
CCl4 (వా) → C(వా) + 4 Cl(వా) చర్యకు ఎంథాల్పీ మార్పు గణించండి.
CCl4 లోని C – C బంధానికి బంధ ఎంథాల్పీ ఎంత?
∆vapHᎾ(CCl4) = 30.5 kJ mol-1.
∆fHᎾ (CCl4) = 135.5 kJ mol-1.
∆aHᎾ(C) = 715.0 kJ mol-1, ఇక్కడ ∆aHᎾ అనేది పరమాణీకరణ ఎంథాల్పీ.
∆aHᎾ(Cl2) = 242 kJ mol-1
జవాబు:
CCl4(వా) → C(వా) + 4Cl(వా)
∆vapH°(CCl4) = 30.5 KJ/mole
∆rH°(CCl4) = -135 KJ/mole
∆H°(C) = 715 KJ/mole
∆H° (Cl2) : = 242 KJ/mole
∆rH° = [AH (ఉత్పన్నాలు) ] – [AH (క్రియాజనకాలు)]
= 715 + 484 + 135.5 – 30.5
= 1334.5 – 30.5 = 1304 kJ
C – Cl బంధ ఎంథాల్పీ = \(\frac{1304}{4}\) = 326 KJ/mole
ప్రశ్న 53.
ఒక వివిక్త వ్యవస్థ ∆U = 0 అయితే ∆S ఏమవుతుంది?
జవాబు:
వివక్త వ్యవస్థ ఇవ్వబడినది.
వివక్త వ్యవస్థకు ∆U = 0
∆H = ∆U + ∆nRT
∆H = ∆nRT

ప్రశ్న 54.
298 K వద్ద 2A + B → C చర్యకు ∆H = 400 kJ mor-1, ∆S = 0.2 kU K-1 mol-1 ఉష్ణోగ్రతా విస్తృతిలో ∆H, ∆S లు స్థిరంగా ఉంటాయనుకొంటే ఏ ఉష్ణోగ్రత వద్ద చర్య అయత్నీకృతం అవుతుంది?
జవాబు:
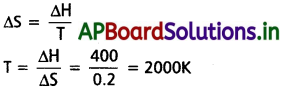
ప్రశ్న 55.
2Cl(వా) → Cl2(వా) చర్యకు ∆H, ∆S ల గుర్తులు ఇవ్వండి.
జవాబు:
2Cl(వా) → C2(వా)
పై చర్యలో క్లోరిన్ పరమాణువులు స్థిరమైన Cl2 అణువులుగా ఏర్పడ్డాయి. ఇది ఉష్ణమోచక చర్య.
కావున ∆H = – ve, ∆S = + ve
ప్రశ్న 56.
2A(వా) + B(వా) → 2D (వా) చర్యకు ∆UᎾ = – 10.5 kJ ∆SᎾ = – 44.1 JK-1 చర్యకు 25°C వద్ద ∆GᎾ విలువ ఎంత? చర్య అయత్నీకృతమా, కాదా?
జవాబు:
2A(వా) + B(వా) → 2D(వా)
n(g) = 2 – 3 = -1
ΔΗ = ∆U + ng RT
∆H = – 10.5 + (-1) × \(\frac{8.314}{10^{3}}\) × 298
= -10.5 – 2.477 = -12.977 KJ/mole
∆S = – 44.1 J/ mole
∆G° = ∆H – T∆S
∆G° = -12.977 – 298 (-44.1)
= – 12977 +13141.8
= 1648 J (లేదా) 0.1648 kJ
∴ ∆G° = ధనాత్మకం (> 0)
కావున చర్య అయత్నీకృతం కాదు.
ప్రశ్న 57.
ఒక చర్యకు 300 K సమతాస్థితి స్థిరాంకం 10. దీనికి ∆GᎾ విలువ ఎంత?
R = 8.314 JK1 mol-1.
జవాబు:
∆G°=- RT/nk
∆G° = -2.303 RT log k
∆G° = – 2.303 × 8.314 × 300 × log 10
= -5744 J/mole
∆G° = -5.744 KJ/mole
ప్రశ్న 58.
ఉష్ణగతిక శాస్త్రం ప్రథమ నియమం నిర్వచించండి. దాని గణితరూప సమీకరణం రాయండి.
జవాబు:
ఉష్ణగతిక శాస్త్ర మొదటి నియమము :
ఈ నియమాన్ని “శక్తినిత్యత్వ నియమం” అని కూడా అంటారు.
నిర్వచనాలు :
- “శక్తిని ఒక ప్రక్రియలో ఒక రూపం నుంచి వేరొక రూపంలోకి మార్పు చెందించవచ్చు. కాని శక్తిన జనింపచేయడం లేదా నశింపచేయడం వీలుపడదు”.
- “మొదటి రకం సతత చలన యంత్రాన్ని నిర్మించలేము”.
- “వ్యవస్థ, పరిసరాల మొత్తం శక్తి స్థిరం (లేదా) నిత్యత్వం చేయబడుతుంది”.
గణిత రూపంలో :
స్థితి ‘A’ లో అంతరిక శక్తి EA గల ఒక వ్యవస్థ, పరిసరాల నుంచి ఉష్ణశక్తిని (Q) గ్రహించి స్థితి ‘B’ కి మారింది అనుకుందాము. స్థితి ‘B’ లో అంతరిక శక్తి, ‘EB‘ మరియు వ్యవస్థ అంతరిక శక్తిలో పెరుగుదల ∆E అనుకుందాము.
అప్పుడు ∆E = EB – EA
‘W’ ఈ ప్రక్రియలో వ్యవస్థ జరిపిన పని అయితే శక్తిలో నికర లాభం (Q – W) అవుతుంది. ఇది మొదటి నియమాన్ని అనుసరించి ∆E కి సమానం అయివుండాలి. కాబట్టి అంతరిక శక్తిలో పెరుగుదల.
ΔΕ = (EB – EA) = (Q – W)
(లేదా) Q = ∆E + W
అతి తక్కువ మార్పులకు q = ∆E + W
ప్రశ్న 59.
ఉష్ణగతికశాస్త్రం రెండో నియమానికి ఏవైనా రెండు వేరువేరు నిర్వచనాలు ఇవ్వండి.
జవాబు:
ఉష్ణగతికశాస్త్ర రెండవ నియమం : ఈ క్రింది విధంగా నిర్వచించవచ్చు.
- బాహ్య కారకం ప్రమేయం లేకుండా తక్కువ ఉష్ణోగ్రత ప్రదేశం నుంచి ఎక్కువ ఉష్ణోగ్రత ప్రదేశానికి ఉష్ణాన్ని ప్రసరింపచేయగలిగి, చక్రీయంగా పనిచేసే యంత్రాన్ని నిర్మాణం చేయడానికి వీలుకాదు.
- వ్యవస్థలో లేదా దాని పరిసరాలలో శాశ్వత మార్పులను కలిగించకుండా ఉష్ణశక్తిని పూర్తిగా పనిగా మార్చలేం.
- అన్ని అయతీకృత చర్యలు, ఉష్ణగతిక శాస్త్రాన్ని అనుసరించి అద్విగత చర్యలే. ఈ అయత్నికృత చర్యలు అన్నింటిలో వ్యవస్థ ఎంట్రోపి పెరుగుతుంది.
![]()
ప్రశ్న 60.
గిబ్స్ శక్తిని వివరించండి.
జవాబు:
గిబ్స్ శక్తి (G) :
అయత్నీకృత చర్యల నిబంధనను వివరించడానికి ‘గిబ్స్’ ఒక ఉష్ణగతికశాస్త్ర ప్రమేయాన్ని ప్రవేశపెట్టాడు. దీనిలో ఎంథాల్పీ (H), ఎంట్రోపి (S) ప్రమేయాలున్నాయి. దీన్ని స్వేచ్ఛాశక్తి (G) అంటారు.
క్రింది సమీకరణం ద్వారా ఈ ప్రమేయాన్ని వ్యక్తం చేస్తారు.
G = H – TS
‘G’ ని ప్రస్తుతం “గిబ్స్ శక్తి” (లేదా) “గిబ్స్ ప్రమేయం” అంటారు.
∆G = ∆H – T ∆S
∆Gవ్యవస్థ = ఋణ విలువ, అయత్నీకృత చర్యలకు, (∆G < 0)
∆Gవ్యవస్థ = ధన విలువ, అయత్నీకృతం కాని చర్యలకు, (∆G > 0)
∆Gవ్యవస్థ = 0, సమతాస్థితి చర్యలకు (∆G = 0)
ప్రశ్న 61.
చర్య అయత్నీకృతాన్ని గిబ్స్ శక్తితో వివరించండి.
జవాబు:
∆G = ∆H – T ∆S
∆Gవ్యవస్థ = ఋణ విలువ, అయత్నీకృత చర్యలకు, (∆G < 0)
∆Gవ్యవస్థ = ధన విలువ, అయత్నీకృతం కాని చర్యలకు, (∆G > 0)
∆Gవ్యవస్థ = 0, సమతాస్థితి చర్యలకు (∆G = 0)
∆G = -ve, ∆S = +ve, ∆H = -ve అయితే అన్ని ఉష్ణోగ్రతల వద్ద చర్య అయత్నీకృతమగును.
గిబ్స్ శక్తి మరియు విలువ, గుర్తుల ఆధారంగా ఒక రసాయనిక చర్య అయత్నీకృత మార్పును, దాని నుండి లభించే ఉపయోగకరమైన పనిని తెలుసుకోవచ్చు.
∆G = ∆G° + RTŪnK
∆G = 0 సమతాస్థితి వద్ద
∆G° = -RTlnK = -2.303 RT log k
∆rG° = ∆rH° – T∆rS° = -RT log k
ఉష్ణగ్రాహక చర్యకు ∆rH° > 0
ఇచ్చట K < 1
ఉష్ణమోచక చర్యకు ∆rH° < 0 ఇచ్చట K > 1
అధిక K విలువ, ∆rG° < 0, ∆rS° > 0 అనునవి చర్య దిగుబడి (ఉత్పన్నాలను) ఊహించుటకు అంశాలు.
దీర్ఘ సమాధాన ప్రశ్నలు
ప్రశ్న 1.
హెస్ స్థిర ఉష్ణ సంకలనం నియమం నిర్వచించి వివరించండి. ఉదాహరణ ఇవ్వండి.
జవాబు:
హెస్ నియమము :
“ఒక రసాయన చర్య ఒక దశలో జరిగినా లేక ఎక్కువ దశలలో జరిగినా గ్రహించిన లేదా వెలువడిన మొత్తం ఉష్ణ పరిమాణం ఒకే విలువలో ఉంటుంది”.
వివరణ :
(i) సాధారణ సమీకరణం ద్వారా :
A అనే పదార్థం రెండు భిన్న మార్గాల ద్వారా చర్య జరిపి D అనే పదార్థాన్ని ఇస్తుంది.

ఏక దశ : A → D, ∆H = Q
అనేక దశలు :
A → B, ∆H1 = q1
B → C, ∆H2 = q2
C → D, ∆H3 = q3
∆H1 + ∆H2 + ∆H3 = q1 + q2 + q3
హెస్ నియమం ప్రకారం, Q = q1 + q2 + q3 అవుతుంది.
(ii) విశిష్ట ఉదాహరణ ద్వారా :
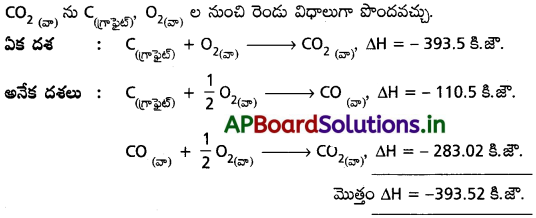
రెండు ∆H విలువలు సమానం.
హెస్ నియమం ఉపయోగాలు :
- ప్రయోగం ద్వారా ప్రత్యక్షంగా నిర్ణయించడానికి వీలుకాని, మాధ్యమిక సమ్మేళనాల సంఘటనోష్టాన్ని హెస్ నియమం ద్వారా గణించవచ్చు.
ఉదా : ‘CO’ సంశ్లేషణోష్ణమును లెక్కించుట. - నెమ్మదిగా జరిగే చర్యల చర్యోష్ణాన్ని సులభంగా నిర్ణయించవచ్చు. ఉదా : α – సల్ఫర్ → B – సల్ఫర్
- కొన్ని సంయోగ పదార్థాల (C2H2) ఎంథాల్పీ విలువలను గణించవచ్చు.
- అయానిక పదార్థాల స్ఫటికజాలక శక్తిని నిర్ణయించవచ్చు. ఉదా : NaCl స్ఫటికజాలక శక్తి, (V) ని నిర్ణయించడం.
ప్రశ్న 2.
ప్రయోగపూర్వకంగా ఒక ప్రక్రియలో అంతరిక శక్తి మార్పు కొలిచే విధానం వివరించండి.
జవాబు:
ఆంతరిక శక్తి (U) :
స్థిర ఉష్ణోగ్రత మరియు పీడనాల వద్ద ఒక పదార్థంలో నిల్వ ఉంచబడిన మొత్తం శక్తిని ఆంతరిక శక్తి అంటారు.
ఇది స్థితి ప్రమేయం మరియు విస్తార ధర్మం.
ఆంతరిక శక్తి మార్పు ∆U = UP – UR
UP = క్రియాజన్యాల ఆంతరిక శక్తి
UR = క్రియాజనకాల ఆంతరిక శక్తి
∆U = Q – W
Q = ఉష్ణం
W = పని
ఆంతరిక శక్తి స్థితిప్రమేయం ఇది తొలి మరియు తుది స్థితులపై ఆధారపడును.
ఆంతరిక శక్తి మార్పు ∆U కొలిచే విధానం :

రసాయన చర్యల్లో స్థిర ఘనపరిమాణం వద్ద గ్రహించబడిన ఉష్ణాన్ని బాంబ్ కెలోరిమీటర్లో కొలుస్తారు. బాంబ్ కెలోరిమీటర్ ఒక దృఢమైన గోడలు గల ఉక్కుపాత్ర. ఇది ఒక జలతాపకం (water battle) లో ముంచబడి ఉంటుంది. ఈ మొత్తం పాత్రల అమరికనే కెలోరిమీటర్ అంటారు. తేలికగా దహనం (combustion) చెందే పదార్థాన్ని ఉక్కు బాంబులో ఉంచి ఆక్సిజన్ను కలిపి దహనం చేస్తారు. చర్య ఉష్ణమోచకమై (దహన చర్యలు ఉష్ణమోచక చర్యలు) ఉష్ణం వెలువడుతుంది. ఇది కెలోరిమీటర్ ఉష్ణోగ్రతను పెంచుతుంది. బాంబ్ కెలోరిమీటర్ ఉష్ణబంధకం చేయబడి ఉంటుంది. అందువల్ల కెలోరి మీటర్ నుంచి పరిసరాలకు ఉష్ణ వినిమయం జరగదు.
బాంబ్ కెలోరిమీటర్ చర్య జరిగేటప్పుడు పూర్తిగా మూసి ఉంచబడి ఉంటుంది కాబట్టి దాని ఘనపరిమాణంలో మార్పు ఉండదు. అంటే చర్యలో శక్తి మార్పులు స్థిర ఘనపరిమాణంలో జరిగిన వాటిగా అనుకొని బాంబ్ కొలతలు చేయాలి.స్థిర ఘనపరిమాణమంటే ∆V = 0, W = p∆V = 0, అంటే పని ఏమీ జరగదు. చర్యలో వాయు పదార్థాలున్నప్పటికీ ఘనపరిమాణంలో మార్పు రాదు. చర్య వల్ల కెలోరిమీటర్ పెరిగిన ఉష్ణోగ్రతను ఉపయోగించి కెలోరిమీటర్ ద్రవ్యరాశి, దాని ఉష్ణధారణ విలువల ద్వారా వెలువడిన ఉష్ణాన్ని (qv) నుంచి
q = c × m × ∆T = C∆T గణించవచ్చు.
![]()
ప్రశ్న 3.
ప్రయోగ పూర్వకంగా ఒక ప్రక్రియలో ఎంథాల్పీ మార్పు కొలిచే విధానం వివరించండి.
జవాబు:
ఎంథాల్పీ (H) :
స్థిరపీడనం మరియు ఉష్ణోగ్రత వద్ద వ్యవస్థకు పరిసరాలకు మధ్య మార్పిడి జరిగే ఉష్ణ పరిమాణాన్ని ఎంథాల్పీ (H) అంటారు.
ఎంథాల్పీ మార్పు ∆H = ∆U + P ∆V
∆U = ఆంతరిక శక్తి మార్పు
ఎంథాల్పీ అనునది స్థితి ప్రమేయం
∆H = [Hక్రియాజన్యాలు – Hక్రియాజనకాలు]
∆H = ∆U + AnRT
స్థిర పీడనం వద్ద ఉష్ణశక్తి (∆H) ని కొలవడం

మూత లేకుండా తెరచి ఉన్న కెలోరిమీటర్ సాధారణంగా వాతావరణ పీడనం దగ్గర ఉంటుంది. వాతావరణ పీడనం స్థిరంగా ఉంటుంది (కనీసం ప్రయోగం జరిగిన సమయం వరకు) కాబట్టి కెలోరీ మీటర్ చర్య వల్ల వచ్చిన ఉష్ణ మార్పు స్థిరపీడనం వద్ద కొలిచిందిగా భావించవచ్చు. (పటం 6.8). దీనిని qp గా రాస్తే ∆H కు సమానమవుతుంది. ∆H = qp (స్థిర పీడనం వద్ద). కాబట్టి స్థిర పీడనం వద్ద కొలిచిన ఉష్ణ మార్పు చర్యోష్ణం (అది వెలువడిన ఉష్ణం కావచ్చు లేదా గ్రహించబడిన ఉష్ణం కావచ్చు) లేదా చర్యా ఎంథాల్పి ∆rH అవుతుంది.
ఉష్ణమోచక చర్యలో ఉష్ణం వెలువడుతుంది. అంటే వ్యవస్థ నుంచి పరిసరాలకు ఉష్ణం ఇవ్వబడుతుంది. అందువల్ల qp రుణాత్మకమవుతుంది. ∆rH కూడా రుణాత్మకం. అదే విధంగా ఉష్ణగ్రాహక చర్యలో వ్యవస్థ లేదా చర్య ఉష్ణం గ్రహిస్తుంది. అంటే పరిసరాల నుంచి చర్యకు ఉష్ణం ఇవ్వబడుతుంది. దీనికి qp ధనాత్మకం, ∆rH కూడా ధనాత్మకమే.
ప్రశ్న 4.
ఒక చర్య అయత్నీకృతమా కాదా అన్నది ఎంథాల్పీ, ఎంట్రోపీ, గిబ్స్ శక్తులు ఉపయోగించి వివరించండి.
జవాబు:
అయల్నీకృత చర్య:
“బాహ్య కారకం ప్రమేయం లేకుండా స్వచ్ఛందంగా జరిగే చర్యను “అయత్నీకృత చర్య” అంటారు. అయత్నీకృత చర్యలు అన్నీ ఉష్ణగతిక శాస్త్ర పరంగా “అద్విగత చర్యలే”.
- ప్రకృతిలో జరిగే చర్యలు అన్నీ అయత్నీకృత చర్యలే.
- అన్ని అయత్నీకృత చర్యలలో ఎంట్రోపి పెరుగుదల ఉంటుంది.
- అయత్నీకృత చర్యలలో, ఎంట్రోపి మార్పు (∆S) = ధనాత్మకం.
- అయత్నీకృత చర్యలలో, ఎంథాల్నీ మార్పు (∆H) = ఋణాత్మకం.
- అయత్నీకృత చర్య యొక్క నిబంధనను వివరించడానికీ “గిబ్స్” ఒక ఉష్ణగతిక శాస్త్ర ప్రమేయాన్ని ప్రవేశపెట్టాడు.
దీనిలో ఎంథాల్నీ (H), ఎంట్రోపీ (S) ప్రమేయాలున్నాయి. దీన్ని G = H – TS గా వ్రాస్తారు.
‘G’ ని “గిబ్స్ శక్తి” (లేక) “గిబ్స్ ప్రమేయం” అంటారు.
అన్ని అయత్నీకృత్త చర్యలు (లేదా) ప్రక్రియలకు ∆G = ఋణవిలువ.
అయత్నీకృత చర్యలు – నిబంధనలు :
సాధించిన సమస్యలు (Solved Problems)
ప్రశ్న 1.
ఒక వ్యవస్థలోని అంతరిక శక్తి మార్పును కింద ఇచ్చిన పరిస్థితుల్లో తెలపండి.
(i) వ్యవస్థపై పని జరుగుతుంది కానీ వ్యవస్థ ఉష్ణశక్తిని గ్రహించదు. ఈ వ్యవస్థ గోడ ఎలాంటిది?
(ii) వ్యవస్థ మీద పని జరగదు కానీ ”q’ పరి మాణంలో వ్యవస్థ ఉష్ణశక్తిని పరిసరాలకు కోల్పోతే అది ఎలాంటి వ్యవస్థ?
(iii) ‘w’ పరిమాణంలో వ్యవస్థ పని చేస్తుంది. q పరిమాణంలో ఉష్ణశక్తి వ్యవస్థకు ఇవ్వబడింది. ఇది ఎలాంటి వ్యవస్థ?
సాధన:
(i) ∆U = wస్థిరోష్ణక, స్థిరోష్ణక గోడ
(i) ∆U = – q, ఉష్ణవాహక గోడలు
(ii) ∆ U = q – w, సంవృత వ్యవస్థ
ప్రశ్న 2.
రెండు లీటర్ల ఘనపరిమాణం గల ఒక ఆదర్శ వాయువు సమోష్ణక విధానంలో పది లీటర్ల ఘనపరిమాణం వరకు శూన్యంలోకి వ్యాకోచించింది. వాయువు పీడనం పది అట్మాస్ఫియర్లయితే ఈ వ్యాకోచంలో గ్రహించిన ఉష్ణమెంత? వ్యాకోచంలో ఎంతపని జరిగింది?
సాధన:
ఇక్కడ వాయువు శూన్యంలోకి స్వేచ్ఛగా వ్యాకోచించింది.
Vతుది = 10 L; Vతొలి = 2L
q = – W = pబాహ్య (Vతుది – Vతొలి) = 0(10 – 2) = 0
అంటే పని ఏమీ జరగదు. అదేవిధంగా ఉష్ణం ఏమీ గ్రహింపబడదు.
ప్రశ్న 3.
పై సమస్యనే తీసుకొని వాయువు వ్యాకోచం శూన్యంలోకి కాకుండా బాహ్య పీడనం ఒక అట్మాస్ఫియర్ అయినప్పుడు q, W తెలపండి. (V తుది – V తొలి)
సాధన. 9 = – W = Pబాహ్య (Vతుది – Vతొలి)
= 1 atm (10 – 2)L
= 8 L. atm
ప్రశ్న 4.
పై వ్యాకోచాన్ని ఉత్రమణీయంగా జరిపితే గ్రహించే ఉష్ణం, జరిగే పనిని తెలపండి.
సాధన:
ఆదర్శ వాయువుకి pV = nRT, p = 10 atm,
V = 2 L
nRT = 10 × 2 = 20 L. atm
q = -w = 2.303 × 20 L.atm log \(\frac{10}{2}\)
= 32.2 L-atm
ప్రశ్న 5.
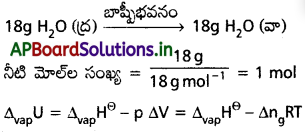
నీటి బాష్పాన్ని ఒక ఆదర్శ వాయువుగా తీసుకొంటే ఒక మోల్ నీటిని 1 బార్, 100°C వద్ద బాష్పీ కరించినప్పుడు బాష్పీభవన మోలార్ ఎంథాల్పీ 41 kJ mol-1. అంతరికశక్తిని కింది పరిస్థితుల్లో గణించండి.
(i) 1 బార్ పీడనం 100° C ఉష్ణోగ్రత వద్ద 1 మోల్ నీరు బాష్పీకరణం చెందితే.
(ii) ఒక మోల్ నీరు మంచు (ice) గా మార్చితే.
సాధన:
(i) H2O (ద్రవం) → H2O (వాయువు) మార్పు
∆Η = ∆U + ∆ngRT
or ∆U = ∆H – ∆ngRT ̧
∆ng = వాయు స్థితిలోని క్రియాజన్యాల అణువులు వాయు స్థితిలోని క్రియాజనకాల అణువులు
= 1 – 0 = 1; ∆H = 41 ki mol-1
T = 373 K, R = 8.3J mol-1 K-1;
∆U = 41.00 kJ mol-1 – 1 × 8.3 J mol-1 K-1 × 373 K
= 41.00 ki mol-1 – 3.096 ki mol-1
= 37.904 kJ mol-1
(ii) H2O (ద్రవం) → H2O (ఘన)
ఈ మార్పులో ఘనపరిమాణం మార్పు అతి స్వల్పం, పరిగణించదగింది కాదు. కాబట్టి
p∆V = ∆n RT ≈ 0, కాబట్టి
∆Η ≅ ΔU
కాబట్టి ∆U = 41.00 kJ mol-1
![]()
ప్రశ్న 6.
298 K. 1 అట్మాస్ఫియర్ పీడనం వద్ద 1 g. గ్రాఫైట్ను అధిక ఆక్సిజన్ సమక్షంలో దహన పరిస్తే చర్య ద్వారా కెలోరిమీటర్ ఉష్ణోగ్రత 298 K నుంచి 299K కు పెరిగింది. బాంబ్ కెలోరి మీటర్ ఉష్ణధారణ 20.7 kJ/K. 1 అట్మాస్ఫియర్ పీడనం, 298 K వద్ద పై చర్యలో ఎంథాల్పీ మార్పు ఎంత?
C(గ్రాఫైట్) + O2 (వా) → CO2 (వా)
సాధన:
చర్యలో చర్యామిశ్రమం నుంచి q పరిమాణంలో ఉష్ణం వెలువడిందనుకొందాం. Cv, కెలోరిమీటర్ ఉష్ణధారణ అనుకొందాం. అప్పుడు కెలోరిమీటర్ గ్రహించిన ఉష్ణం q = Cv × ∆T
చర్యలో విడుదలైన ఉష్ణం పరిమాణం కెలోరిమీటర్ గ్రహించిన ఉష్ణానికి సమానం కానీ వాటి సంజ్ఞలు మారతాయి.
q = – Cv × ∆T = – 20.7 kJ/K × (299 – 298) K
= – 20.7 kJ
రుణ సంజ్ఞ చర్య ఉష్ణమోచక చర్య అని తెలియజేస్తుంది) అప్పుడు 19 గ్రాఫైట్ దహనమైతే
∆U = – 20.7 kJ
ఒక మోల్ గ్రాఫైట్ దహనమైతే వెలువడే ఉష్ణం

∆n (వా) = 1 (క్రియాజన్యం CO2) – 1 (క్రియాజనకం) = 0,
∆H = ∆U = – 2.48 × 10² kJ mol-1.
ప్రశ్న 7.
ఒక నీటి కొలను నుంచి బయటకు వచ్చిన ఈతగాడి వంటి మీద 18 గ్రా. బరువు గల నీటి ఫిల్మ్ ఏర్పడింది. దీనిని 298 K దగ్గర ఇగర్చడానికి (evaporisation)ఎంత ఉష్ణం కావాలి? 100° C వద్ద అంతరిక బాష్పీభవన శక్తిని కనుక్కోండి.
373 K వద్ద నీటి బాష్పీభవనోష్ణం
∆vap HΘ = 40.66 kJ mol-1.
సాధన:
ఇగిర్చే (evaporation) ప్రక్రియను కింది సమీకరణంలో చూడండి.
నీటి ఆవిరిని ఆదర్శ వాయువులా భావిస్తే
∆vap HΘ – ∆ng RT = 40.66 kJ mol-1 – (1 mol)
(8.314 JK-1 mol-1) (373K) (10-3 kJ J-1)
∆vap UΘ = 40.66 kJ mol-1 – 3.10 kJ mol-1
= 37.56 kJ mol-1
ప్రశ్న 8.
298 K, 1 అట్మా పీడనాల వద్ద ఒక మోల్ బెంజీన్ దహనం చెంది CO2 (వా), H2O (ద్ర)లను ఇస్తూ 3267.0 kJ ఉష్ణాన్ని విడుదల చేస్తుంది. బెంజీన్ ప్రమాణ సంఘటన ఎంథాల్పీని (Stan- dard enthalpy of formation) గణించండి. ప్రమాణ సంఘటన ఎంథాల్పీలు CO2 (వా), H2O (ద్ర) లకు వరసగా – 393.5 kJ mol-1, – 285.83 kJ mol-1.
సాధన:
బెంజీన్ తన అనుఘటక మూలకాల నుంచి ఏర్పడే చర్యను కింది విధంగా రాయాలి.
6C (గ్రాఫైట్, s) + 3H2(వా) → C6H6 (వా) ; ∆f HΘ = ? …………. (i)
ఈ చర్య ఎంథాల్పీ మార్పు ∆f HΘ కనుక్కోవాలి.
1 మోల్ బెంజీన్ దహన చర్య సమీకరణం:
C6H6(ద్ర) \(\frac{15}{2}\) (వా) → 6CO2 (వా) + 3H2O(ద్ర) ;
∆c HΘ = 3267 kJ mol-1 …. (ii)
1 మోల్ CO2 (g) ఏర్పడినప్పుడు ఎంథాల్పీ మార్పిడి అంటే CO2 (g) సంఘటన ఎంథాల్పీ
C (గ్రాఫైట్) + O2 (వా) → CO2 (వా);
∆f HΘ = – 393.5 kJ mol-1 …………. (iii)
1 మోల్ H2O (ద్ర) ఏర్పడినప్పుడు ఎంథాల్పీ మార్పిడి అంటే H2O (ద్ర) సంఘటన ఎంథాల్పీ :
H2(వా) + \(\frac{1}{2}\)O2 (వా) → H2O (ద్ర) ;
∆f HΘ = – 285.83 ki mol-1 …. (iv)
సమీకరణం (ii) ను, 6 తోను సమీకరణం (iv) ను 3తోను గుణిస్తే
6C (గ్రాఫైట్) 6O2 (వా) → 6CO2 (వా);
∆f HΘ = -2361 kJ mol-1
3H2(వా) + \(\frac{3}{2}\)O2 (వా) → 3H2O (ద్ర);
∆f HΘ = -857.49 kJ mol-1
రెండు సమీకరణాల్ని కలిపితే
6C (గ్రాఫైట్) + 3H2(వా) + \(\frac{15}{2}\)O2 (వా) → 6CO2(వా) + 3H2O (ద్ర);
∆f HΘ = -3218.49 kJ mol-1 …. (v)
సమీకరణం (ii) ను ఉత్రమం చేసి రాస్తే
6CO2(వా) + 3H2O(ద్ర) → C6H6(ద్ర) ;
∆f HΘ = 3267.0 kJ mol-1 …. (vi)
(v), (vi) సమీకరణాల్ని కలిపితే
6C (గ్రాఫైట్) + 3H2(వా) → C6H6(ద్ర);
∆f HΘ = 48.51 kJ mol-1
ప్రశ్న 9.
కింది చర్యలు లేదా ప్రక్రియల్లో దేనికి ఎంట్రోపీ పెరుగుతుంది, దేనికి తగ్గుతుంది చెప్పండి.
(i) ఒక ద్రవం ఘనపదార్థంగా స్ఫటికీకరణం చెందింది.
(ii) ఒక స్ఫటిక ఘన పదార్థం ఉష్ణోగ్రత 0K నుంచి 115 K కు పెరిగంది.
(iii) 2NaHCO3(ఘ) Na2CO3(ఘ) + CO2(వా) + H2O(వా)
(iv) H2(వా) → 2H(వా)
సాధన:
(i) ద్రవం నుంచి ఘనంగా మారితే కణాల అమరికలో క్రమత్వం పెరుగుతుంది. అందువల్ల ఎంట్రోపీ తగ్గుతుంది.
(ii) OK దగ్గర అనుఘటక కణాలు స్థిరంగా ఉండి అత్యల్ప ఎంట్రోపీతో ఉంటాయి. ఉష్ణోగ్రత 115K పెరిగితే లాటిస్ అనుఘటక కణాలు సమతా స్థానాల్లో డోలనాలు చేస్తుంటాయి. అంటే కదలిక పెరుగుతుంది. ఫలితంగా వ్యవస్థ క్రమరాహిత్యం పెరుగుతుంది. అంటే ఎంట్రోపీ పెరుగుతుంది.
(iii) క్రియాజనకం_NaHCO3 ఘనపదార్థం. అంటే ఎంట్రోపీ తక్కువ. క్రియాజన్యాల్లో ఒక ఘనపదార్థం (Na2CO3), రెండు వాయు పదార్థాలు (CO2, H2O) ఉన్నాయి. కాబట్టి క్రియాజన్యాల వల్ల అధిక ఎంట్రోపీ వస్తుంది.
(iv)ఇక్కడ ఒక అణువు రెండు పరమాణువులనిస్తుంది. అంటే కణాల సంఖ్య పెరుగుతుంది. అంటే ఎంట్రోపీ పెరుగుతుంది. దీనికి కారణం ఒక మోల్ డై హైడ్రోజన్ అణువు కంటే రెండు మోల్ల హైడ్రోజన్ పరమాణువుల్లో ఎంట్రోపీ ఎక్కువ.
![]()
ప్రశ్న 10.
ఐరన్ ఆక్సీకరణానికి
4 Fe (ఘ) + 3O2 (వా) – 2Fe2O, (ఘ)
298 K వద్ద ఎంట్రోపీ మార్పు – 549.4JK1 mol-1. దీనికి రుణ విలువలో ఎంట్రోపీ ఉన్నప్పటికి చర్య స్వచ్ఛందంగా జరుగుతుంది. ఎందుకు?
(ఈ చర్యకు ∆r HΘ = -1648 × 10³ mol-1)
సాధన:
చర్య స్వచ్ఛందతను నిర్ణయించాలంటే మనం ∆Stotal i.e., (∆Ssys + ∆Ssurr) గణించాలి. ∆Ssurr గణించాలంటే పరిసరాలు గ్రహించిన ఉష్ణశక్తి తెలుసుకోవాలి. ఇది ∆r HΘ ఇవ్వబడింది. ఉష్ణోగ్రత T తెలియాలి ఇవ్వబడింది.
పరిసరాల ఎంట్రోపీ మార్పు ∆Ssurr = ∆r HΘ/T (స్థిరపీడనం వద్ద)
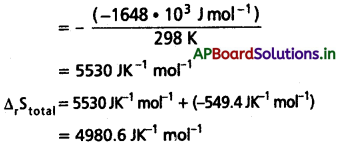
∆Stotal ధనాత్మకం కాబట్టి చర్య అయత్నకృతం లేదా స్వచ్ఛందం.
ప్రశ్న 11.
ఆక్సిజన్ ను ఓజోన్గా మార్చే చర్య (3/2) O2(వా) → O3(వా) కు 298 K వద్ద Kp విలువ 2.47 × 10-29 అయితే ఈ చర్యకు ∆r GΘ గణించండి.
సాధన:
∆r GΘ = -2.303 RT log Kp,
R = 8.314 JK-1 mol-1
-కాబట్టి, ∆r GΘ =
– 2.303 (8.314 J K-1 mol-1) × (298 K) (log 2.47 × 10-29)
= 163000 J mol-1
= 163 kJ mol-1.
ప్రశ్న 12.
![]()
(జల) + H2O (ద్ర) చర్యకు 298 K ఉష్ణోగ్రత వద్ద ప్రమాణ గిబ్స్ శక్తి మార్పు ∆G = – 13.6 J mol-1 అయితే ఆ చర్య సమతాస్థితి స్థిరాంకం విలువను అదే ఉష్ణోగ్రత వద్ద కనుక్కోండి.
సాధన:

ప్రశ్న 13.
60° C వద్ద డైనైట్రోజన్ టెట్రాక్సైడ్ 50% వియోజనం చెందింది. దీనికి అదే ఉష్ణోగ్రత, 1 atm పీడనం వద్ద ప్రమాణ స్వేచ్ఛాశక్తి (గిబ్స్ శక్తి) మార్పు గణించండి.
సాధన:
