Andhra Pradesh BIEAP AP Inter 1st Year Chemistry Study Material 7th Lesson రసాయనిక సమతాస్థితి, అమ్లాలు – క్షారాలు Textbook Questions and Answers.
AP Inter 1st Year Chemistry Study Material 7th Lesson రసాయనిక సమతాస్థితి, అమ్లాలు – క్షారాలు
అతిస్వల్ప సమాధాన ప్రశ్నలు
ప్రశ్న 1.
రసాయన సమతాస్థితి నియమం తెల్పండి.
జవాబు:
క్రియాజన్యాల మోలార్ గాఢతల లబ్దంనకు, క్రియజనకాల మోలార్ గాఢతల లబ్దానికి నిష్పత్తి ఒక స్థిరమైన విలువ కలిగి ఉండును. దీనినే రసాయన సమతాస్థితి నియమం అంటారు.
ప్రశ్న 2.
తెరచిన పాత్రలో నీరు, దాని బాష్పం మధ్య సమతాస్థితిని పొందగలమా? వివరించండి.
జవాబు:
తెరచిన పాత్రలో నీటికి మరియు నీటి బాష్పానికి మధ్య సమతాస్థితి ఏర్పడదు. మూసిన పాత్రలో నీటికి మరియు నీటిబాష్పానికి మధ్య సమతాస్థితి ఏర్పడును.
![]()
ప్రశ్న 3.
సమతాస్థితి స్థిరాంకాల సమాసాలలో శుద్ధ ద్రవాల, శుద్ధ ఘన పదార్థాల గాఢతను ఎందుకు విస్మరిస్తాం?
జవాబు:
సమతాస్థితి స్థిరాంకాల సమాసాలలో శుద్ధ ద్రవాల, శుద్ధ ఘన పదార్థాల గాఢతను విస్మరిస్తారు. ఎందువలన అనగా శుద్ధ ద్రవాలు, శుద్ధ ఘన పదార్థాల గాఢత ఒకటికి సమానం.
ప్రశ్న 4.
సమజాతి సమతాస్థితి అంటే ఏమి? సమజాతి సమతాస్థితి, చర్యలకు రెండు ఉదాహరణలు రాయండి. [Mar. ’14]
జవాబు:
చర్యలో పాల్గొనే పదార్థాల భౌతిక స్థితులు ఒకే విధంగా ఉంటే ఆ సమతాస్థితిని సమజాతి సమతాస్థితి అంటారు.
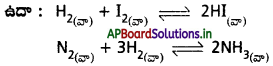
ప్రశ్న 5.
విజాతి సమతాస్థితి అంటే ఏమిటి? విజాతి సమతాస్థితి చర్యలకు రెండు ఉదాహరణలు రాయండి.
జవాబు:
చర్యలో పాల్గొనే అన్ని (లేదా) కొన్ని పదార్థాల భౌతిక స్థితులు విభిన్నంగా ఉంటే ఆ సమతాస్థితిని విజాతి సమతాస్థితి అంటారు.
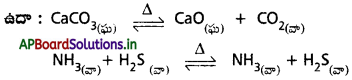
ప్రశ్న 6.
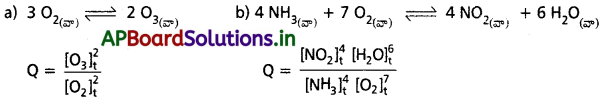
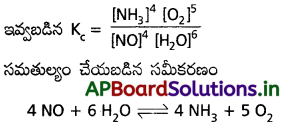
కింది చర్యలకు, చర్యా భాగఫలం Q విలువను రాయండి.
![]()
జవాబు:
ప్రశ్న 7.
సమతాస్థితి స్థిరాంకం నిర్వచించండి.
జవాబు:
క్రియాజన్యాల మోలార్ గాఢతల లబ్దానికి, క్రియాజన్యాల మోలార్ గాఢతల లబ్దానికి నిష్పత్తిని సమతాస్థితి స్థిరాంకం (K) అంటారు.
![]()
ప్రశ్న 8.
ఒక వాయుస్థితి చర్యకు, సమతాస్థితి స్థిరాంక సమాసం కింది విధంగా ఉంది.
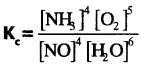 దీనికి సంబంధించిన సమతుల్యం చేయబడిన రసాయన సమీకరణం రాయండి.
దీనికి సంబంధించిన సమతుల్యం చేయబడిన రసాయన సమీకరణం రాయండి.
జవాబు:
ప్రశ్న 9.
Kp, Kc ల మధ్య సంబంధం రాయండి.
జవాబు:
Kp, Kc ల మధ్య సంబంధం
Kp = Kc(RT)∆n
Kp & Kc = ఆదర్శ వాయు పదార్ధాలు.
∆n = [(వాయు క్రియాజన్యాల మోల్ల సంఖ్య) – (వాయు క్రియజనకాల మోత్ల సంఖ్య)]
R = వాయు స్థిరాంకం
T = పరమ ఉష్ణోగ్రత
ప్రశ్న 10.
ఏ పరిస్థితులలో ఒక చర్యకు Kp, Kc లు సంఖ్యాపరంగా సమానం ?
జవాబు:
∆n = 0 అయినపుడు అనగా వాయుస్థితి క్రియాజన్యాల సంఖ్య వాయుస్థితి క్రియాజనకాల సంఖ్య = 0
∴ Kp = Kc(RT)∆n = Kc(RT)°
∴ Kp = Kc
ప్రశ్న 11.
Kp = Kc అయినటువంటి రెండు రసాయనిక సమతాస్థితి చర్యలను తెలపండి.
జవాబు:

ప్రశ్న 12.
Kp > Kc అయినటువంటి రెండు రసాయనిక సమతాస్థితి చర్యలను
జవాబు:

ప్రశ్న 13.
Kp < Kc అయినటువంటి రెండు రసాయనిక సమతాస్థితి చర్యలను తెలపండి.
జవాబు:

ప్రశ్న 14.
Kc ను Kp గా మార్చే సమీకరణాలను కింది చర్యలకు రాయండి.

జవాబు:
ప్రశ్న 15.
రసాయనిక సమతాస్థితిని ప్రభావితం చేసే కారణాంశాలు ఏవి?
జవాబు:
రసాయన సమతాస్థితిని ప్రభావితం చేసే అంశాలు :
- క్రియాజనకాల, క్రియాజన్యాల గాఢతలు
- చర్య ఉష్ణోగ్రత
- చర్య పీడనం
- జడవాయు సంకలనం
![]()
ప్రశ్న 16.
వాయుస్థితి రసాయన సమతాస్థితిపై పీడనం ప్రభావం ఏమిటి ?
జవాబు:
పీడన ప్రభావం :
(a) సమతాస్థితి వద్ద ఉండే వ్యవస్థపై పీడనాన్ని పెంచితే దాని ప్రభావం రద్దయ్యే దిశవైపుకు అనగా ఘనపరిమాణం తగ్గే దిశవైపుకు వ్యవస్థ జరుగుతుంది.
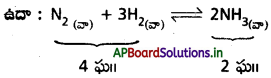
పురోగామి చర్య (4 ఘ॥ → 2 ఘ॥)లో ఘనపరిమాణం తగ్గుతుంది కాబట్టి లీచాట్లియర్ సూత్రం ప్రకారం
అధిక పీడనాలు NH3 ఏర్పడే చర్యను ప్రోత్సహిస్తాయి.
(b) ఇదేవిధంగా సమతాస్థితి వద్ద ఉండే వ్యవస్థపై పీడనాన్ని తగ్గిస్తే దాని ప్రభావం రద్దయ్యే దిశవైపుకు అనగా ఘనపరిమాణం పెరిగే దిశ వైపుకు వ్యవస్థ జరుగుతుంది.
ఉదా : పై చర్యలో సమతాస్థితి వద్ద పీడనాన్ని పెంచితే తిరోగామి చర్య (2NH3 → N2 + 3H2) ప్రోత్సహించబడుతుంది.
ప్రశ్న 17.
సమతాస్థితి వద్ద ఉండే రసాయన చర్యలో క్రియాజనకాల గాఢతల మార్పు ప్రభావం ఏమిటి?
జవాబు:
క్రియాజనకాలు గాఢతను పెంచినా, ఉత్పన్నాల గాఢతను తగ్గించినా పురోగామి చర్య ప్రోత్సహించబడుతుంది.
![]()
సమతాస్థితి వద్ద N2 గాఢతను గాని (లేదా) H2 గాఢతను గాని (లేదా) రెండింటి గాఢతను పెంచినా పురోగామి చర్య ప్రోత్సహించబడి అధిక NH3 ఏర్పడుతుంది. పురోగామి చర్యలో ఏర్పడిన NH3 గాఢతను ఎప్పటికప్పుడు తొలగిస్తూ వున్నా అంటే ఉత్పన్న గాఢతను తగ్గిస్తూ వున్నా పురోగామి చర్య ప్రోత్సహింపబడుతుంది.
ప్రశ్న 18.
సమతాస్థితిని ఉత్ప్రేరకం ప్రభావితం చేస్తుందా?
జవాబు:
సమతాస్థితిని ఉత్ప్రేరకం ప్రభావితం చేయదు. కేవలం సమతాస్థితి త్వరితగతిన ఏర్పడేట్లు చేయును.
ప్రశ్న 19.
సమతాస్థితి స్థిరాంకం విలువ ఏ కారణాంశం మీద ఆధారపడి ఉంటుంది?
జవాబు:
సమతాస్థితి స్థిరాంకం విలువపై క్రియాజనకాల, క్రియాజన్యాల ప్రమాణ స్థితి ప్రభావం ఉంటుంది మరియు ఉష్ణోగ్రత ప్రభావం ఉంటుంది.
ప్రశ్న 20.
ఒక చర్య సమతాస్థితి స్థిరాంకాలు వరుసగా 27°C, 127° C ల వద్ద 1.6 × 10-3, 7.6 × 10-2 ఈ చర్య ఉష్ణగ్రాహక చర్యా లేదా ఉష్ణమోచక చర్యా?
జవాబు:
27°C వద్ద – K = 1.6 × 10-3
127°C వద్ద – K = 7.6 × 10-2
పై విలువలను బట్టి ఉష్ణోగ్రత పెరిగిన సమతాస్థితి స్థిరాంకం విలువ పెరిగినది కావున
ΔΗ = +ve
చర్య ఉష్ణగ్రాహక చర్య.
ప్రశ్న 21.
సమతాస్థితి వద్ద ఉండే వ్యవస్థపై ఉష్ణోగ్రత ప్రభావం ఏమి?
జవాబు:
సమతాస్థితిపై ఉష్ణోగ్రత ప్రభావం :
ఉష్ణమోచక చర్యలలో ఉష్ణోగ్రత పెరిగితే తిరోగామి చర్య ప్రభావితం అవుతుంది. ఉష్ణగ్రాహక చర్యలలో ఉష్ణోగ్రతను పెంచితే పురోగామి చర్య ప్రభావితం అవుతుంది.
ప్రశ్న 22.
ఒక ఉష్ణమోచక చర్య ఉష్ణోగ్రతను పెంచితే, ఆ చర్య సమతాస్థితి స్థిరాంకం ఏ మార్పుకు గురవుతుంది?
జవాబు:
ΔH = ఋణాత్మకం అయితే, T2 > T1 అయినపుడు K2 < K1 అవుతుంది. అంటే ఉష్ణమోచక చర్యలలో ఉష్ణోగ్రత పెరిగితే, సమతాస్థితి స్థిరాంకం విలువ తగ్గుతుంది.
ప్రశ్న 23.
వాయువులు మాత్రమే పాల్గొనే చర్యకు ΔG° ద్వారా ఏ రకపు సమతాస్థిరాంకాన్ని లెక్కించవచ్చు?
జవాబు:
ఉష్ణగతిక శాస్త్ర ఆధారంగా
ΔG = ΔG° + RTlnQ
సమతాస్థితి వద్ద ΔG = 0, Q = K
ΔG = ΔG° + RTlnK = 0
ΔG° = -RTlnK
lnK = \(\frac{-\Delta \mathrm{G}^{\circ}}{\mathrm{RT}}\) ⇒ K = eΔG°/RT
పై సమీకరణం నుండి చర్య అయతీకృతాన్ని కనుగొనవచ్చు.
![]()
ప్రశ్న 24.
బ్రాన్డ్ క్షారం అంటే ఏమిటి? ఒక ఉదాహరణ తెలపండి. [A.P. Mar. ’15]
జవాబు:
“ఇతర పదార్థాల నుంచి ప్రోటాను స్వీకరించే ప్రవృత్తి ఉన్న రసాయన పదార్ధం (లేదా) రసాయన జాతిని బ్రాన్డ్ క్షారం అంటారు”.
ఉదా : NH3, H2O మొదలైనవి.
ప్రశ్న 25.
లూయీ ఆమ్లం అంటే ఏమిటి? ఒక ఉదాహరణ తెలపండి.
జవాబు:
“ఒక దాత నుంచి ఎలక్ట్రాన్ జంటను స్వీకరించి, దానిలో సమన్వయ సమయోజనీయ బంధాన్ని ఏర్పరచగలిగే పదార్ధం (లేదా) రసాయన జాతిని ‘లూయీ ఆమ్లం’ అంటారు”.
ఉదా : H+, BF3, Sncl4 మొదలైనవి.
ప్రశ్న 26.
నీటి అయానిక లబ్దం అంటే ఏమిటి?
జవాబు:
“స్థిర ఉష్ణోగ్రత వద్ద శుద్ధ జలంలో లేదా జల ద్రావణాలలో హైడ్రోజన్ [H+], హైడ్రాక్సైడ్ [OH–] అయాన్ల గాఢతల నీటి అయానిక లబ్దం (K) అని అంటారు”.
ప్రశ్న 27.
K విలువ ఏమి? దీని పరిమితులు ఏమి?
జవాబు:
K = [H+] [OH–] దాని విలువ Kw = 1.008 × 10-14 మోల్ /లీ. (25°C వద్ద)
ప్రశ్న 28.
నీటి అయానిక లబ్దం విలువపై ఉష్ణోగ్రత ప్రభావం తెలపండి.
జవాబు:
ఉష్ణోగ్రత పెరిగే కొద్ది నీటి అయనీకరణం పెరుగుతుంది. కాబట్టి K విలువ పెరుగుతుంది.
ప్రశ్న 29.
![]()
25°C, 40°C ఉష్ణోగ్రతల వద్ద వరుసగా నీటి అయానిక లబ్దం విలువలు 1 × 10-14, 3.0 × 10-14 పై చర్య ఉష్ణమోచక చర్యా? లేదా ఉష్ణగ్రాహక చర్యా?
జవాబు:
ఇవ్వబడినది
![]()
25°C వద్ద Kw = 1 × 10-14 మోల్ /లీ.
40°C వద్ద Kw = 3 × 10-14 మోల్ /లీ.
ఉష్ణోగ్రత పెరుగుదలతో Kw విలువ పెరిగినది కావున ఇది ఉష్ణగ్రాహక చర్య.
ప్రశ్న 30.
‘బ్రానెడ్ క్షారాలు అన్నీ లూయీ క్షారాలే’. వివరించండి.
జవాబు:
బాన్డ్ క్షారమనగా ప్రోటాన్ గ్రహీత మరియు లూయి క్షారం ఎలక్ట్రాన్ జంట దాత. కానీ రెండు సిద్ధాంతాల ప్రకారం క్షారం ఎలక్ట్రాన్ జంటను కలిగియుండును. కావున అన్ని బ్రాన్స్టెడ్ క్షారాలు లూయి క్షారాలు.
ప్రశ్న 31.
‘లూయీ ఆమ్లాలు అన్నీ బ్రాన్డెడ్ ఆమ్లాలు కావు’. ఎందువల్ల?
జవాబు:
- లూయీ ఆమ్లం అనగా ఎలక్ట్రాన్ జంట స్వీకర్త మరియు బ్రాన్స్టెడ్ ఆమ్లం అనగా ప్రోటాన్ దాత.
- లూయీ సిద్ధాంతంకు వ్యతిరేకంగా చేసుకొనగా ప్రోటాన్ దానం చేయనటువంటి ఆమ్లాలు కలవు.
కావున అన్ని లూయీ ఆమ్లాలు బ్రాన్డెడ్ ఆమ్లాలు కావు.
ప్రశ్న 32.
అయనీకరణం అవధి అంటే ఏమిటి?
జవాబు:
అయనీకరణం అవధి (α) :
దుర్భల ఆమ్లం (లేదా) క్షారం అయనీకరణం పరిమితిని అయనీకరణ అవధి (α) ద్వారా తెలుపుతారు. ‘α’ విలువ ‘ఒకటి’ కంటే తక్కువగా వుంటుంది. ద్రావణంగాఢత ‘C’ మోల్/లీటరు అనుకొందాము.
ప్రశ్న 33.
ఒక ఆమ్లం లేదా క్షారం బలాన్ని వ్యక్తం చేసే రాశి ఏది?
జవాబు:
- ఆమ్ల బలాన్ని వ్యక్తం చేసే రాశి ఆమ్ల వియోజన స్థిరాంకం (Ka)
- క్షార బలాన్ని వ్యక్తం చేసే రాశి క్షార వియోజన స్థిరాంకం (Kb)
ప్రశ్న 34.
వాటి జలద్రావణాలలో, క్షార స్వభావం చూపే రెండు లవణాలను తెలపండి.
జవాబు:
CH3COONa, Na2CO3 ల జల ద్రావణాలు క్షార స్వభావాన్ని కలిగి ఉంటాయి.
![]()
ప్రశ్న 35.
వాటి జలద్రావణాలలో, ఆమ్ల స్వభావం చూపే రెండు లవణాలను తెలపండి.
జవాబు:
NH4Cl, (NH4)2SO4 ల జల ద్రావణాలు ఆమ్ల స్వభావాన్ని కలిగి ఉంటాయి.
ప్రశ్న 36.
ఆమ్ల బఫర్ ద్రావణం pH ను లెక్కించడానికి ఏ సమీకరణాన్ని ఉపయోగిస్తారు?
జవాబు:
ఆమ్ల బఫర్ యొక్క pH ఈ క్రింది సమీకరణం ద్వారా లెక్కిస్తాము.

ప్రశ్న 37.
ఫాస్ఫారిక్ ఆమ్లం (H,PO) కు మూడు అయనీకరణ స్థిరాంకాలు ఉన్నాయి. ఇవి Kα1, Kα2, Kα3. వీటిలో దేనికి కనిష్ట విలువ ఉంటుంది? కారణాలు తెలపండి.
జవాబు:
H3PO4 యొక్క Ka1 = 7.5 × 10-3; Ka2 = 6.2 × 10-8; Ka3 = 4.2 × 10-13
Ka3 కి తక్కువ విలువ కలదు.
HPO-24 అయాన్ నుండి ప్రోటాన్ ను తొలగించుట కష్టము.
ప్రశ్న 38.
ఎత్తు ప్రదేశాలలో ఐస్ నెమ్మదిగా కరుగుతుంది. దీనికి కారణం వివరించండి.
జవాబు:
ఎత్తైన ప్రదేశాలలో ఐస్ నెమ్మదిగా కరుగును. ఎందువలన అనగా ఒక నిర్దిష్ట ఉష్ణోగ్రత మరియు పీడనాల వద్ద మాత్రమే ఐస్ మరియు నీరు సమతాస్థితిలో ఉంటాయి. ఎత్తైన ప్రదేశాలలో ఉష్ణోగ్రత మరియు పీడనాలు మారును.
స్వల్ప సమాధాన ప్రశ్నలు
ప్రశ్న 1.
కింది చర్యలు ప్రతీదానికి సమతాస్థితి స్థిరాంకం Kకు సమీకరణాలు రాయండి.
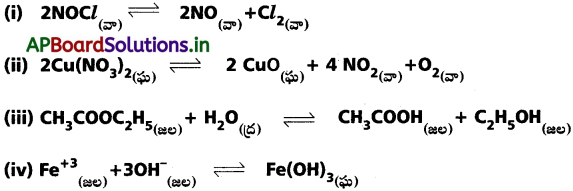
జవాబు:
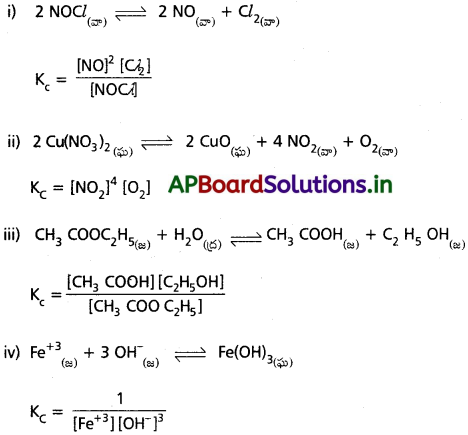
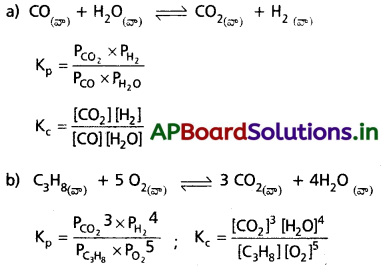
ప్రశ్న 2.
క్రింది సమతాస్థితి చర్యకు K. K. ల మధ్య గల సంబంధాన్ని ఉత్పాదించండి. [A.P. Mar.’15 Mar. ’13]
![]()
జవాబు:
Kp, KC ల మధ్య సంబంధం : Kp = KC[RT]Δn
![]()
Δn = [(వాయు క్రియాజన్యాల మోత్ల సంఖ్య) – (వాయు క్రియాజనకాల మోల్ సంఖ్య) = [(2) – (1 + 3)] = [2 – 4]
Δn = -2
∴ ‘Δ’n = ఋణ విలువ కావున అటువంటి చర్యలకు Kp < KC
ప్రశ్న 3.
సమతాస్థితి స్థిరాంకాన్ని నిర్వచించండి. కింది చర్యకు, దాని ఉత్రమణీయ చర్యకు సమతాస్థితి స్థిరాంకాన్ని రాయండి.
ఈ రెండు స్థిరాంకాలు ఏ విధంగా సంబంధం కలిగి ఉన్నాయి?
![]()
జవాబు:
క్రియాజన్యాల మోలార్ గాఢతల లబ్దానికి, క్రియాజన్యాల మోలార్ గాఢతల లబ్దానికి నిష్పత్తిని సమతాస్థితి స్థిరాంకం (KC) అంటారు.
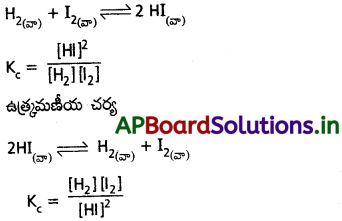
రెండు సమతాస్థితి స్థిరాంకాలు విలోమానుపాతంలో ఉంటాయి.
ప్రశ్న 4.
ఒక చర్య విస్తృతిని, సమతాస్థితి స్థిరాంకం ఏ విధంగా ఊహిస్తుంది?
జవాబు:
చర్య జరిగే విస్తృతిని ఊహించడం :
ఒక చర్య సమతాస్థితి స్థిరాంకం సంఖ్యాత్మక విలువ, ఆ చర్య విస్తృతిని తెలుపుతుంది. అయితే సమతాస్థితి స్థిరాంకం ఎంత వేగం (రేటు) తో చర్య సమతాస్థితిని చేరుకుంది అనే విషయాన్ని మాత్రం సమతాస్థితి స్థిరాంకం తెలియజేయదు. Kc లేదా Kp ల పరిమాణం క్రియాజన్యాల గాఢతలకు (సమతాస్థితి స్థిరాంక సమాసంలో లవంలో ఉండే గాఢతలు) అనులోమానుపాతంలోను, క్రియాజనకాల గాఢతలకు (సమతాస్థితి స్థిరాంక సమాసంలో హారంలో ఉండే గాఢతలు) విలోమానుపాతంలోను ఉంటాయి. దీనిని అనుసరించి K విలువ అధికంగా ఉంటే క్రియాజన్యాలు అధికంగా ఏర్పడతాయి అని తెలుపుతుంది. అదే విధంగా అల్పంగా ఉంటే క్రియాజన్యాలు అల్పంగా ఏర్పడతాయని తెలుస్తుంది.
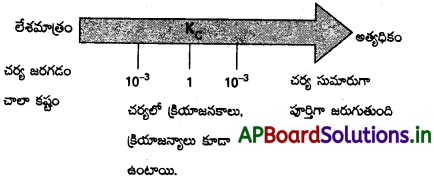
సమతాస్థితి మిశ్రమాలను గురించిన సాధారణీకరణం చేసిన విషయాలను కింది విధంగా తెలపవచ్చు.
• Kc > 10³ అయితే క్రియాజనకాల కంటే క్రియాజన్యాలు అధికంగా ఉంటాయి. అంటే Kc విలువ అత్యధికంగా ఉన్నట్లైతే చర్య సుమారుగా పూర్తిగా జరుగుతుందని ఊహించవచ్చు. కింది ఉదాహరణలను చూడండి :
a) 500 K వద్ద H2, O2 తో జరిపే చర్యకు సమతాస్థితి స్థిరాంకం విలువ అత్యధికంగా ఉంది.
Kc = 2.4 × 1047
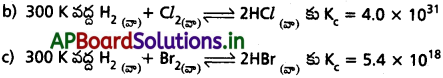
Kc < 10-3 అయితే క్రియాజనకాలు, క్రియాజన్యాల కంటే అధికంగా ఉంటాయి. Kc విలువ అతి తక్కువ అయితే, ఆ చర్య అరుదుగా జరుగుతుంది. కింది ఉదాహరణలను చూడండి.
a) 500 K వద్ద H2, O2 లుగా H2O వియోగం చెందే చర్య అత్యల్ప సమతాస్థితి స్థిరాంకం విలువను కలిగి ఉంది.
Kc = 4.1 × 10-48
![]()
K విలువ 10-3 కు 10³ కు మధ్యగా ఉండినట్లైతే చర్యలో గమనించదగిన గాఢతలలో క్రియాజన్యాలు, క్రియాజనకాలు కూడా ఉంటాయి.
కింది ఉదాహరణలను చూడండి.
a) H2, I2తో చర్య జరిపి HI ను ఏర్పరచే చర్యలో
Kc పై ఆధారపడిన చర్య విస్తృతి Kc = 570, 700 K వద్ద
(b) చర్య దిశను నిర్ణయించుట
Q మరియు K లు చర్య దిశను కనుగొనుటకు ఉపయోగిస్తారు.
a) Q = K అనగా చర్య సమతాస్థితిలో ఉండును.
b) Q < K అనగా చర్య పురోగామి దిశలో జరుగును.(అనగా క్రియాజనకాల పైన) c) Q > K అనగా చర్య తిరోగామి దిశలో జరుగును. (అనగా క్రియాజనకాల పైన)
ప్రశ్న 5.
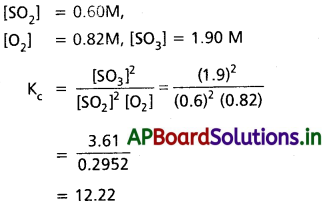
సమతాస్థితి నియమాన్ని వివరించండి. సమతాస్థితి గాఢతలు కింది విధంగా ఉండే సమతాస్థితికి Kను లెక్కించండి.
![]()
జవాబు:
క్రియాజన్యాల మోలార్ గాఢతల లబ్దంనకు, క్రియజనకాల మోలార్ గాఢతల లబ్దానికి నిష్పత్తి ఒక స్థిరమైన విలువ కలిగి ఉండును. దీనినే రసాయన సమతాస్థితి నియమం అంటారు.
![]()
ప్రశ్న 6.
సీలు చేయబడి ఉన్న సోడా నీటి సీసాను తెరచినప్పుడు ఎందుకు వాయువు బుసబుస పొంగుతూ బయటకు వస్తుంది?
జవాబు:
- సీలు చేయబడి ఉన్న సోడా నీటి సీసాను తెరచినప్పుడు వాయువు బుసబుస పొంగుతూ బయటకు వస్తుంది. ఎందువలన అనగా
- వివిధ పీడనాల వద్ద CO2 వాయువు ద్రావణీయతలో మార్పు గమనించబడుతుంది. ఇచ్చట వాయుస్థితి అణువుల, ద్రవస్థితి అణువుల మధ్య సమతాస్థితి ఏర్పడుతుంది.
ప్రశ్న 7.
కింది వాటి ప్రాముఖ్యం తెలపండి.
a) అతి ఎక్కువ K విలువ
b) అతి తక్కువ K విలువ
c) K విలువ 1.0గా ఉన్నది.
జవాబు:
a) అతి ఎక్కువ K విలువ అనగా చర్య దాదాపుగా పూర్తి అగును.
b) అతి తక్కువ K విలువ అనగా చర్య కష్టతరంగా జరుగును.
c) ‘K’ విలువ 1.0 అనగా క్రియాజన్యాలు మరియు క్రియాజనకాలు సమతాస్థితిలో ఉంటుంది.
![]()
ప్రశ్న 8.
Q, K లను సరిపోల్చడం ఎందుకు ఉపయోగపడుతుంది? కింది వాటిలో పరిస్థితులు ఏమి?
a) Q = K b) Q < K c) Q > K
జవాబు:
Q మరియు K లు చర్య దిశను కనుగొనుటకు ఉపయోగిస్తారు.
a) Q = K అనగా చర్య సమతాస్థితిలో ఉండును.
b) Q < K అనగా చర్య పురోగామి దిశలో జరుగును. (అనగా క్రియజన్యాల వైపు)
c) Q > K అనగా చర్య తిరోగామి దిశలో జరుగును. (అనగా క్రియాజనకాల వైపు)
ప్రశ్న 47.
![]()
పై చర్యలోని పదార్థాల గాఢతలు కింది విధంగా ఉంటే చర్య ఏ విధంగా జరుగుతుంది ?
[Cl2] = 0.4 mol L–; [F2] = 0.2 mol L-1, [Cl F] = 7.3 mol L-1
జవాబు:
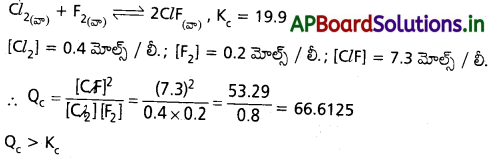
∴ కావున చర్య తిరోగామి దిశలో జరుగును. (క్రియాజనకాల వైపు)
ప్రశ్న 9.
కింది వాటిలో దేనిలో క్రియాజనకాలు, క్రియాజన్యాలు గుర్తించగలిగిన గాఢతలలో ఉంటాయి.
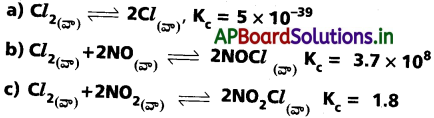
జవాబు:
పై చర్యలలో (c)కు గుర్తించగలిగిన గాఢతలలో క్రియాజనకాలు, క్రియాజన్యాలు అంటారు.
‘K’ విలువ మరీ ఎక్కువగా కాకుండా మరీ తక్కువగా కాకుండా ఉంది. (c) చర్యలో అందువలన గుర్తించగలిగిన గాఢతలు ఉంటాయి.
ప్రశ్న 10.
సమతాస్థితిలో ఉండే వ్యవస్థ పీడనం మార్పు ద్వారా ప్రభావితం అయ్యే పరిస్థితులను ఏవిధంగా తెలుసుకొంటాం?
జవాబు:
పీడనం మార్పు ప్రభావం :
ఒక చర్యలో వాయుస్థితిలో ఉండే క్రియాజనకాల మొత్తం మోల్ల సంఖ్య, వాయుస్థితిలో ఉండే క్రియాజన్యాల మొత్తం మోల్ల సంఖ్య సమానంగా లేనటువంటి వాయుస్థితి రసాయన చర్య ఘనపరిమాణం మార్చడం ద్వారా చర్య పీడనాన్ని మార్పు చెందించినట్లైతే ఈ మార్పు క్రియాజన్యాల దిగుబడిని ప్రభావితం చేస్తుంది. విజాతి సమతాస్థితులకు లీచాట్లెయర్ సూత్రాన్ని అనువర్తించినప్పుడు, చర్యలోని ఘనపదార్థాలు, ద్రవాలపై పీడనం ప్రభావాన్ని మనం విస్మరించవచ్చు. ఎందుకంటే ద్రావణం / ద్రవం ఘనపరిమాణం (గాఢత) ఇంచుమించుగా పీడనంపై ఆధారపడవు.
![]()
ఈ చర్యలో 4 మోల్ల వాయు స్థితిలో ఉండే క్రియాజనకాలు (CO + 3H2), 2 మోల్ల వాయుస్థితిలో ఉండే క్రియాజన్యాలుగా (CH4 + H2O) మారుతున్నాయి. స్థిర ఉష్ణోగ్రత వద్ద పిస్టన్ అమర్చబడిన సిలండర్లో రసాయన చర్య సమతాస్థితి చర్యా మిశ్రమాన్ని ఉంచి, పిస్టన్ సహాయంతో మిశ్రమం ఘనపరిమాణాన్ని సగానికి తగ్గించాం అనుకొందాం. అప్పుడు మొత్తం పీడనం రెట్టింపు అవుతుంది. (pV = స్థిరం అనే సమీకరణం ఆధారంగా). క్రియాజనకాల, క్రియాజన్యాల పాక్షిక పీడనాల ఫలితంగా వాటి గాఢతల విలువలు మారతాయి. కాబట్టి మిశ్రమం సమతాస్థితి ఉండదు. అయితే సమతాస్థితిని తిరిగి పునరుద్ధరించడానికి, చర్య ఏ దిశలో కొనసాగాలి అనే దానిని లీచాట్లెయర్ సూత్రం ద్వారా ఊహించవచ్చు.
పీడనం రెండు రెట్లు అవడం కారణంగా వాయువుల మోల్ల సంఖ్య తగ్గే లేదా పీడనం తగ్గే వైపుగా సమతాస్థితి పురోగామి దిశవైపుగా బదిలీ అవుతుంది. (ఎందుకంటే పీడనం, మోల్ల సంఖ్యకు అనులోమానుపాతంలో ఉంటుంది). దీనిని చర్య భాగఫల స్థిరాంకం Q ద్వారా కూడా అర్థం చేసుకోవచ్చు. మిథన్షన్ చర్యకు [CO], [H2], [CH4], [H2O]లు సమతాస్థితి వద్ద మోలార్ గాఢతలు అనుకొందాం. రసాయన చర్యా మిశ్రమం ఘనపరిమాణాన్ని సగం చేసినట్లైతే పాక్షిక పీడనం గాఢతలు రెట్టించబడతాయి. కాబట్టి సమతాస్థితి వద్ద ఉండే ప్రతీ పదార్ధం సమతాస్థితి గాఢతను రెట్టింపు చేసి వాటిని చర్య భాగఫల స్థిరాంక సమీకరణంలో ప్రతిక్షేపిస్తే భాగఫల స్థిరాంకం Qc విలువ లభిస్తుంది.

పురోగామి దిశలో జరిగే చర్యలో వాయు అణువుల సంఖ్య పెరుగుతుంది.
ప్రశ్న 11.
సమతాస్థితి స్థిరాంకం విలువ పరిమాణంపై ఉష్ణోగ్రతలో మార్పు ప్రభావాన్ని తెలుసుకొనేందుకు చర్య ఏ ధర్మం ఉపయోగపడుతుంది?
జవాబు:
సమతాస్థితి స్థిరాంకంపై ఉష్ణోగ్రత ప్రభావం :
అర్హీనియస్ సమీకరణం ప్రకారం,
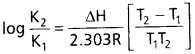
ఇక్కడ K1, K2 లు T1, T2 ఉష్ణోగ్రతల వద్ద సమతాస్థితి స్థిరాంకాలు.
∆H = చర్యా ఎంథాల్పీ, R = వాయు స్థిరాంకము.
∆H = ఋణాత్మకం అయితే, T2 < T1 అయినపుడు K2 < K1 అవుతుంది. అంటే ఉష్ణమోచక చర్యలలో ఉష్ణోగ్రత పెరిగితే, సమతాస్థితి స్థిరాంకం విలువ తగ్గుతుంది.
∆H = ధనాత్మకం అయితే, T2 > T1 అయినపుడు K2 > K1 అవుతుంది.
అంటే ఉష్ణగ్రాహక చర్యలలో, ఉష్ణోగ్రత పెరిగితే, సమతాస్థితి స్థిరాంకం విలువ పెరుగుతుంది.
ప్రశ్న 12.
ఘనపరిమాణాన్ని పెంచడం ద్వారా పీడనాన్ని తగ్గించే ప్రక్రియకు కింది సమతాస్థితులను గురిచేస్తే చర్యలోని క్రియాజనకాల, క్రియాజన్యాల మోల్ల సంఖ్య పెరుగుతుందా?
![]()
జవాబు:
![]()
పీడనాన్ని తగ్గించినపుడు, ఘనపరిమాణం పెంచినపుడు పురోగామి చర్య జరుగును. అనగా చర్యలో క్రియాజన్యాల మొత్తం సంఖ్య తగ్గును.
![]()
పీడనాన్ని తగ్గించి, ఘనపరిమాణాన్ని పెంచినపుడు చర్య ఏ దిశవైపుకు మళ్ళదు. ఎందువలన అనగా కేవలం ఒకే వాయు ఉత్పన్నం కలదు. కావున క్రియాజన్యాల సంఖ్యలో మార్పు లేదు.
ప్రశ్న 13.
పీడనం పెంపు ద్వారా కింది వాటిలో ఏ చర్యలు ప్రభావితం అవుతాయి? ఈ ప్రభావం ద్వారా చర్య పురోగామి దిశలో జరుగుతుందా? లేదా? తిరోగామి దశలో జరుగుతుందా? తెలపండి.

జవాబు:

క్రియాజనకాల సంఖ్య = క్రియాజన్యాల సంఖ్య
కావున పీడన ప్రభావం లేదు.
![]()
పీడనాన్ని పెంచినపుడు తిరోగామి చర్య జరుగును. వాయువుల యొక్క మోల్ల సంఖ్య పురోగామి దిశలో పెరుగును.
![]()
పీడనాన్ని పెంచినపుడు తిరోగామి చర్య జరుగును. వాయువుల యొక్క మోల్ల సంఖ్య పురోగామి దిశలో పెరుగును.
ప్రశ్న 14.
కింది సమతాస్థితులను పీడనం పెరుగుదల ఏ విధంగా ప్రభావితం చేస్తుంది? అదేవిధంగా ఉష్ణోగ్రతలలో పెరుగుదల ఏ విధంగా ప్రభావితం చేస్తుంది?

జవాబు:
![]()
- పీడనం పెంచినపుడు తిరోగామి చర్య జరుగును.
- ఉష్ణోగ్రత పెంచినపుడు సమతాస్థితి కుడివైపుకు మళ్ళును.
![]()
- np = nR ∴ పీడన ప్రభావం లేదు.
- ఉష్ణోగ్రత పెంచినపుడు సమతాస్థితి కుడివైపుకు మళ్ళును.
![]()
- పీడనం పెంచినపుడు తిరోగామి చర్య జరుగును.
- ఉష్ణోగ్రత పెంచినపుడు సమతాస్థితి ఎడమవైపుకు మళ్ళును.
![]()
- పీడనం పెంచినపుడు పురోగామి చర్య జరుగును.
- ఉష్ణోగ్రత పెంచినపుడు సమతాస్థితి ఎడమవైపుకు మళ్ళును.
ప్రశ్న 15.
HI విఘటనం చర్యపై అనువర్తితన పీడనం ఎటువంటి ప్రభావం చూపదు. అయితే PCl5 విఘటనంపై ప్రభావం చూపుతుంది? వివరించండి.
జవాబు:
HI విఘటన చర్య
![]()
np = nR కావున పీడన ప్రభావం లేదు.
PCl5, విఘటన చర్య
![]()
np ≠ nR కావున పీడన ప్రభావం కలదు.
ప్రశ్న 16.
కింది పదాలను వివరించండి.
(i) విద్యుద్విశ్లేష్యకం
(ii) అవిద్యుద్విశ్లేష్యకం
(iii) బలహీన బలమైన విద్యుద్విశ్లేష్యకాలు
(iv) అయానిక సమతాస్థితి
జవాబు:
(i) విద్యుద్విశ్లేష్యకం :
గలన స్థితిలో (లేదా) ద్రావణస్థితిలో విద్యుద్వాహకత గలిగి రసాయన వియోగం చెందు పదార్ధాలను విద్యుద్విశ్లేషకాలు అంటారు.
ఉదా : HCl, HNO3 etc.
(ii) అవిద్యుద్విశ్లేష్యకం :
ఏ పదార్థాలయితే ద్రావణిలో అయనీకరణం (లేదా) రసాయన వియోగం చెందినవో వాటిని అవిద్యుద్విశ్లేష్యకాలు అంటారు.
ఉదా : చక్కెర, యూరియా
(iii) a) బలమైన విద్యుద్విశ్లేష్యకం :
ఏ విద్యుద్విశ్లేష్యకాలయితే త్వరిత గతిన రసాయన వియోగం చెందవో వాటిని బలమైన విద్యుద్విశ్లేష్యకాలు అంటారు.
ఉదా : NaOH, HCl, etc.,
b) బలహీన విద్యుద్విశ్లేష్యకం :
ఏ విద్యుద్విశ్లేష్యకాలయితే నెమ్మదిగా రసాయన వియోగం చెందునో వాటిని బలహీన విద్యుద్విశ్లేష్యాలు అంటారు.
ఉదా : CH3COOH, NH4OH etc.,
(iv) అయానిక సమతాస్థితి : విఘటనం చెందే అణువులకు, విఘటనం తరువాత ఏర్పడే అయాన్లకూ మధ్య ఏర్పడే సమతాస్థితిని అయానిక సమతాస్థితి అంటారు.
![]()
ఆమ్ల, క్షార చర్యలలో ఈ అయానిక సమతాస్థితి ప్రాధాన్యత కలిగి ఉంటుంది. జీవ రసాయన శాస్త్రంలోనూ, మూలక రసాయన శాస్త్రంలోనూ ఇవి ప్రముఖ పాత్ర వహిస్తాయి.
ప్రశ్న 17.
కింది పదాలను వివరించండి :
(i) అయనీకరణం విస్తృతి, అది ఏ కారణాంశాలపై ఆధారపడుతుంది.
(ii) విఘటనం
(iii) అయనీకరణం
జవాబు:
సాధారణంగా ఆమ్లాలను HX గా మరియు క్షారాలను BOH గా సూచిస్తారు.
![]()
ఆమ్లాలు, క్షారాలు నీటిలో కరిగి, విఘటనం చెందడాన్నీ అయనీకరణం లేదా వియోజనం అంటారు. ఆమ్లాల, క్షారాల అయనీకరణ సామర్థ్యం అణువుల ధృవణతపై ఆధారపడి ఉంటుంది.
బలమైన ఆమ్లాలకు, క్షారాలకు అయనీకరణ సామర్థ్యం ఎక్కువగా ఉండును. బలహీనమైన వాటికి తక్కువగా ఉండును. అయనీకరణ సామర్థ్యం ఆ పదార్థ ద్రావణ గాఢతపై ఆధారపడి ఉండును.
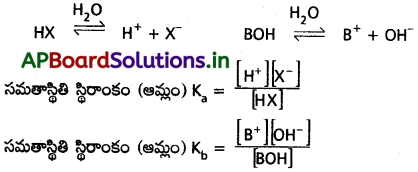
Ka = ఆమ్ల విమోచజన స్థిరాంకం
Kb = క్షార విమోచజన స్థిరాంకం
ప్రశ్న 18.
ఆర్హీనియస్ ఆమ్లాల, క్షారాల భావనలను వివరించండి.
జవాబు:
ఆర్హీనియస్ సిద్ధాంతం ప్రకారం
ఆమ్లము :
నీటిలో అయనీకరణం చెంది H+ అయాన్లను ఉత్పత్తి చేసే పదార్థాలను ఆమ్లాలు అంటారు.
ఉదా : HCl, H2SO4 etc…
Hx(జ) → H+(జ) + x–(జ)
క్షారము :
నీటిలో అయనీకరణం చెంది (OH–) అయాన్లను ఉత్పత్తి చేసే పదార్థాలను క్షారాలు అంటారు.
ఉదా : NaOH, KOH– etc.,
MOH(జ) → M+(జ) + OH–(జ)
![]()
ప్రశ్న 19.
కాంజుగేటు ఆమ్ల క్షార జంట అంటే ఏమిటి? ఒక ఉదాహరణ ఇవ్వండి. [Mar. ’14]
జవాబు:
కాంజుగేట్ ఆమ్ల క్షార జంట :
“ఒక ప్రోటాన్లో ఛేదించే ఆమ్లక్షార జంటను కాంజుగేట్ (సంయుగ్మ) ఆమ్లక్షార జంట అంటారు”.
ప్రశ్న 20.
ఎసిటిక్ ఆమ్లం బలహీన ఆమ్లం 1 M ఎసిటిక్ ఆమ్ల జలద్రావణంలో ఉండే అన్ని అయానిక అణు జాతుల గాఢతల అవరోహణ క్రమాన్ని తెలపండి.
జవాబు:
[H2O] > [CH3COOH] > [H3O+] [CH3C00] > [OH–]
ప్రశ్న 21.
తగిన సమీకరణాలతో కింది వాటిలో ప్రతీ జాతి బ్రాన్డెడ్ ఆమ్లంగా ప్రవర్తిస్తుంది అని తెలపండి?
a) H3O+
b) HCl
c) NH3
d) HSO4–
జవాబు:
a) H3O+ → H2O + H+
ప్రోటాన్ దాత కావున బ్రాన్డెడ్ ఆమ్లము
b) HCl → H+ + Cl–
ప్రోటాన్ దాత కావున బ్రాన్డెడ్ ఆమ్లము
c) NH3 అనునది బ్రాన్స్టెడ్ క్షారము కానీ ఆమ్లము కాదు.
(కొన్ని సందర్భాలలో ఆమ్లముగా NH3 → NH–2 + H+
d) HSO–4 → H+ + SO4-2
ప్రోటాన్ దాత కావున బ్రాన్డెడ్ ఆమ్లము
ప్రశ్న 22.
తగిన సమీకరణాలతో క్రింది వాటిలో ప్రతీ జాతి బ్రాన్డెడ్ క్షారంగా ప్రవర్తిస్తుంది అని తెలపండి ?
a) H2O
b) OH–
c) C2H5OH
d) HPO4-2
జవాబు:
a) H2O + H+ → H3O+
ప్రోటాన్ గ్రహీత కావున బ్రాన్డ్ క్షారము.
b) OH– + H+ → H2O
ప్రోటాన్ గ్రహీత కావున బ్రాన్స్టెడ్ క్షారము.
c) C2H5OH ఇది ప్రోటాన్ దాత కావున బ్రాన్డెడ్ ఆమ్లమే కానీ క్షారము కాదు.
d) HPO4-2 + H+ → H2PO4–
ప్రోటాన్ గ్రహీత కావున బ్రాన్డ్ క్షారము.
ప్రశ్న 23.
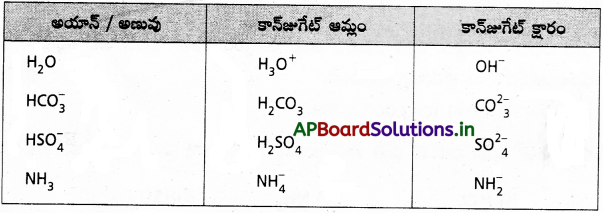
H2O, HCO3–, HSO4–, NH3, లు బ్రాన్డ్ ఆమ్లాలు, బ్రాన్స్టెడ్ క్షారాలుగా ప్రవర్తిస్తాయి. వాటికి సంబంధించిన కాంజుగేటు ఆమ్లం, క్షారం రాయండి.
జవాబు:
ప్రశ్న 24.
H2PO4– ఆమ్లంగాను, క్షారంగాను ప్రవర్తిస్తుంది అని తెలపడానికి సమీకరణం రాయండి.
జవాబు:

ప్రశ్న 25.
కింది వాటికి కాంజుగేటు ఆమ్లాన్ని, కాంజుగేటు క్షారాన్ని రాయండి.
a) OH–
b) H2O
c) HCO3–
d) H2O2
జవాబు:
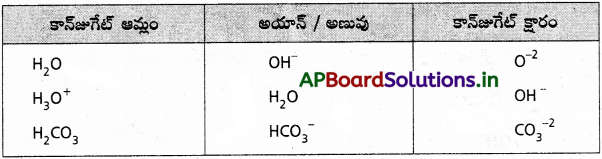
ప్రశ్న 26.
బ్రాన్డెడ్ ఆమ్లం, దాని కాంజుగేటు క్షారం, అదేవిధంగా బ్రాన్స్టెడ్ క్షారం, దాని కాంజుగేటు ఆమ్లం, వీటిని కింది సమీకరణాలలో గుర్తించండి.
a) H2SO4 + Cl– → HCl + HSO4–
b) H2S + NH2 → HS– + NH3
c) CN– + H2O → HCN + OH–
d) O-2 + H2O → 2OH–
జవాబు:

ప్రశ్న 27.
AlCl3, NH3, Mg+2, H2O లను లూయీ ఆమ్లాలు, లూయీ క్షారాలుగా వర్గీకరించండి. జవాబును సమర్థించండి.
జవాబు:
- AlCl3, Mg+2 ఎలక్ట్రాన్ జంట గ్రహీతలు. కావున లూయీ ఆమ్లాలు.
- NH3, H2O ఎలక్ట్రాన్ జంట దాతలు. కావున లూయీ క్షారాలు.
ప్రశ్న 28.
బలమైన ఆమ్లం, బలహీన ఆమ్లం, వీటి కాంజుగేటు క్షారాల బలాలను వివరించండి.
జవాబు:
బలమైన ఆమ్లము, బలహీన కాంజుగేట్ క్షారాన్ని కలిగి ఉండును.
ఉదా : HCl–, Cl–
బలహీన ఆమ్లము, బలమైన కాంజుగేట్ క్షారాన్ని కలిగి ఉండును.
ఉదా : CH3COOH, CH3COO–
ప్రశ్న 29.
బలమైన క్షారం, బలహీన క్షారం, వీటి కాంజుగేటు ఆమ్లాల బలాలను వివరించండి.
జవాబు:
బలమైన క్షారము, బలహీన కాంజుగేట్ ఆమ్లాన్ని కలిగి ఉండును.
ఉదా : HS–, H2S
బలహీన క్షారము, బలమైన కాంజుగేట్ ఆమ్లాన్ని కలిగి ఉండును.
ఉదా : ClO–4, HClO4
ప్రశ్న 30.
“నీటి అయానిక లబ్దం”, దీనిని వివరించండి. గది ఉష్ణోగ్రత వద్ద దీని విలువ ఎంత ?
జవాబు:
నీటి అయానిక లబ్దం (Kw) :
“స్థిర ఉష్ణోగ్రత వద్ద శుద్ధ జలంలో (లేదా) జల ద్రావణాలలో హైడ్రోజన్ (H+), హైడ్రాక్సైడ్ [OH–] అయాన్ల గాఢతల లబ్దాన్ని “నీటి అయానిక లబ్దం (Kw)” అంటారు.
Kw = [H+] [OH–] = 1.008 × 10-14 మోల్స్² /లీ² (25°C వద్ద)
ప్రశ్న 31.
pHను నిర్వచించండి. బలహీన ఆమ్లం, బలహీన క్షారం వీటి మోలార్ గాఢతల నుంచి pHను లెక్కించలేం. ఎందువల్ల? బలహీన ఆమ్లం pHకు సమీకరణం ఉత్పాదించండి.
జవాబు:
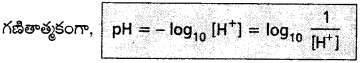
pH :
“ఒక ద్రావణంలో ఉన్న హైడ్రోజన్ అయాన్, H+ గాఢత, మోల్లు/లీటర్లలో చెప్పి, దాని సంవర్గమానం ఋణాత్మక
విలువను ఆ ద్రావణం pH అంటారు”.
గణితాత్మకంగా pH -= log [H+]
బలహీనమైన ఆమ్లాల, క్షారాలు pH మోలార్ గాఢతలను బట్టి లెక్కించలేము. ఎందువలన అనగా అయనీకరణ సామర్థ్యం తక్కువగా ఉంటుంది. ఒక బలహీన విద్యుత్ విశ్లేష్యక ద్రావణం pH విలువను లెక్కించడానికి క్రింద పేర్కొన్న అంచెల వారీ పద్ధతిని అవలంబిస్తారు.
అంచె 1.
వియోజనం జరగకముందు ద్రావణంలో ఉండే బ్రాడ్-లౌరీ ఆమ్లాలు/క్షారాలను గుర్తించాలి.
అంచె 2.
సాధ్యపడే అన్ని చర్యలకు సమతుల్యం చేయబడిన సమీకరణాలను రాయాలి అంటే ఆమ్లం క్షారంగా ప్రవర్తించే జాతిని పరిగణనలోకి తీసుకొని వీటిని రాయాలి.
అంచె 3.
K విలువ అధికంగా గల చర్యను ప్రధాన చర్యగా గుర్తించాలి. మిగిలిన చర్యలను సహాయక చర్యలుగా రాయాలి.
అంచె 4.
ప్రధాన చర్యలోని ప్రతీ జాతికి కింద ఇచ్చిన వాటి విలువలను పట్టిక రూపంలో రాయాలి.
a) ఆరంభగాఢత c.
b) సమతాస్థితిని చేరుకొనే ప్రక్రియలో గాఢతలలో మార్పు α, అయనీకరణ అవధి పరంగా రాయాలి.
c) సమతాస్థితి గాఢత.
అంచె 5.
ప్రధాన చర్య సమతాస్థితి స్థిరాంకాన్ని రాబట్టే సమీకరణంలో సమతాస్థితి గాఢతలను ప్రతిక్షేపించి సమీకరణాన్ని α విలువ కోసం సాధించాలి.
అంచె 6.
ప్రధాన చర్యలోని జాతుల గాఢతలను లెక్కించాలి.
అంచె 7.
pH = – log [H3O+] సమీకరణం ద్వారా pHను లెక్కించాలి. కింది ఉదాహరణలలో పైన వివరించిన విధాన పద్ధతిని ఉపయోగించడం జరిగింది.
![]()
ప్రశ్న 32.
పాలిప్రోటిక్ ఆమ్లాలు H2SO4, H3PO4ల అంచెలవారీ అయనీకరణాలను తెలిపే సమీకరణాలు రాయండి.
జవాబు:
H2SO4 దశల వారీగా అయనీకరణం

ప్రశ్న 33.
కింది వానిలో ఆమ్ల బలం ఏ విధంగా మారుతుంది? వివరించండి. ఆవర్తన పట్టికలో
(i) గ్రూపులోని మూలకాల హైడ్రైడ్లు
(ii) పీరియడ్లోని మూలకాల హైడ్రైడ్లు
జవాబు:
i) గ్రూపులలోని మూలకాల హైడ్రైడ్లు యొక్క ఆమ్ల బలంపై నుండి క్రిందకు తగ్గుతుంది.
ii) పీరియడ్లోని మూలకాల హైడ్రైడ్లు ఆమ్ల బలం ఎడమ నుండి కుడికి తగ్గును.
ప్రశ్న 34.
ప్రోటోనిక్ భావన ఆధారంగా నీరు ఆమ్లంగాను, క్షారంగాను కూడా ప్రవర్తిస్తుంది అని తెలపండి.
జవాబు:
నీటికి ఆమ్లంగా మరియు క్షారంగా పని చేయు స్వభావం కలదు. అనగా ఇది ద్విస్వభావ సమ్మేళనం.
→ నీటి యొక్క ద్విస్వభావాన్ని ఈ క్రింది చర్యలు దృఢపరుస్తాయి.
ఆమ్లంగా :
![]()
→ H2O ప్రోటాన్త (బ్రాన్డెడ్ ప్రకారం)
క్షారంగా :
![]()
→ H2O ప్రోటాన్ గ్రహీత (బ్రాన్డ్ ప్రకారం)
ప్రశ్న 35.
ఉభయ సామాన్య అయాన్ ఫలితం అంటే ఏమిటి ? వివరించండి.
జవాబు:
ఉభయ సామాన్య అయాన్ ప్రభావము :
“ఉమ్మడి అయాన్ ఉన్నా బలమైన విద్యుత్ విశ్లేష్య పదార్ధ సమక్షంలో బలహీన విద్యుత్ విశ్లేష్య పదార్ధము యొక్క అయనీకరణ తగ్గుటను ఉమ్మడి అయాన్ ప్రభావమంటారు”.
(లేక)
“ఒక విద్యుద్విశ్లేష్యకం నీటిలో ద్రావణీయత, దానికి విద్యుద్విశ్లేష్యకంలోని కాటయాన్ (లేదా) ఆనయాన్ ఉభయ సామాన్యంగా ఉండే వేరొక విద్యుద్విశ్లేష్యకం చేర్చినప్పుడు మొదటి విద్యుద్విశ్లేష్యకం ద్రావణీయత తగ్గిపోతుంది”.
ఉదా : i) NH4OH అయనీకరణం, NH4Cl ను చేర్చినప్పుడు తగ్గిపోతుంది దీనిలో NH4+ ఉభయ సామాన్య అయాన్.
ii) NaCl ద్రావణీయత, NaCl ద్రావణానికి HCL ద్రావణం చేర్చినపుడు తగ్గిపోతుంది.
ప్రశ్న 36.
“ద్రావణీయతా లబ్దం” దీనిని నిర్వచించండి. కింది వాటికి ద్రావణీయతా లబ్దం సమీకరణాలను రాయండి.
(i) Ag2Cr2O7
(ii) Zr3(PO4)4
జవాబు:
ద్రావణీయతా లబ్ధం (KSP):
“గది ఉష్ణోగ్రత వద్ద ఒక లవణం సంతృప్త ద్రావణంలో కాటయాన్ల గాఢతకు మరియు ఆనయాన్ గాఢతకు మధ్యగల లబ్దమును ఆ లవణం యొక్క ద్రావణీయతా లబ్ధం (KSP) అంటారు’
i) ద్రావణీయత లబ్ద సమీకరణం Ag2Cr2O7 కు

ప్రశ్న 37.
లవణాలను ఎలా వర్గీకరిస్తారు ? ఏ వర్గం లవణాలు జలవిశ్లేషణం చెందుతాయి ?
జవాబు:
లవణాలను ఈ కింది విధంగా వర్గీకరించవచ్చు.
- బలమైన ఆమ్లం, బలమైన క్షారం నుండి ఏర్పడు లవణాలు.
ఉదా : NaCl - బలమైన ఆమ్లం, బలహీన క్షారం నుండి ఏర్పడు లవణాలు.
ఉదా : NH C - బలహీన ఆమ్లం, బలమైన క్షారం నుండి ఏర్పడు లవణాలు.
ఉదా : CH4COONa - బలహీన ఆమ్లం, బలహీన క్షారం నుండి ఏర్పడు లవణాలు.
ఉదా : CH3COONH4
→ 2, 3, 4 రకాల లవణాలు జలవిశ్లేషణ జరుపుతాయి.
ప్రశ్న 38.
ఒక చర్యకు ∆G° విలువ కింది వాటిలో ఏ విధంగా ఉంటుంది?
a) K > 1
b) K = 1
c) K < 1 జవాబు: a) K > 1 అయిన ∆ G° < 0
b) K = 1 అయిన ∆ G° = 0
c) K < 1 అయిన ∆ G° > 0
ప్రశ్న 39.
NH4Cl జలద్రావణం ఆమ్ల గుణం చూపిస్తుంది. వివరించండి.
జవాబు:
NH4Cl లవణం బలమైన ఆమ్ల (HCl) మరియు బలహీన క్షారం (NH4OH) నుండి ఏర్పడినది.
![]()
పై లవణం కాటయానిక్ జలవిశ్లేషణ జరుగును.
![]()
ఇచ్చట [H+] > [OH–] కావున NH4Cl జలద్రావణం ఆమ్ల స్వభావం కలిగి ఉంటుంది. కావున pH < 7
ప్రశ్న 40.
CH3COON జలద్రావణం క్షార గుణం చూపిస్తుంది. వివరించండి.
జవాబు:
CH3COONa అయనీకరణం;
ఇపుడు CH3COONa జలద్రావణంలో CH3COO–, Na+, H+, OH– అనే అయాన్లు ఉంటాయి. CH3COO– మరియు H+ అయాన్లు కలిసిపోయి బలహీనమైన CH3COOHను ఇస్తాయి.
![]()
మరియు OH– అయాన్లు కలిసిపోయి బలమైన NaOHను ఇస్తాయి. అట్లేర్పడ్డ ఆమ్లం, క్షారాలలో ఆమ్లం బలహీనమైనది, క్షారం బలమైనది అవడం వలన ద్రావణానికి క్షార స్వభావం ఏర్పడుతుంది.
pH > 7 ఉంటుంది.
ప్రశ్న 41.
సోడియం ఎసిటేట్ ద్రావణంలో కరిగి ఉండి ఎసిటిక్ ఆమ్లం, సోడియం క్లోరైడు ద్రావణంలో కరిగి ఉండే దానికంటే బలహీనంగా ఉంటుంది. కారణం తెలపండి.
జవాబు:
సోడియం ఎసిటేట్ ద్రావణంలో కరిగియుండే ఎసిటిక్ ఆమ్లం తక్కువ ఆమ్ల స్వభావం కలదు.
వివరణ :
- ఉభయ సామాన్య అయాన్ ఫలితం వలన అయనీకరణం తగ్గును.
- CH3COONa బలహీన ఆమ్లం, బలమైన క్షారం నుండి ఏర్పడినది.
NaCl ద్రావణంలో CH3COOH ఎక్కువ ఆమ్ల స్వభావం కలిగి ఉండును.
వివరణ :
- ఉభయ సామాన్య అయాన్ ఫలితం ఇచ్చట లేదు.
- NaCl బలమైన ఆమ్లం, బలమైన క్షారం నుండి ఏర్పడినది.
ప్రశ్న 42.
శుద్ధ నీటిలో కంటే, AgNO3, AgCl తక్కువగా కరుగుతుంది. దీనిని వివరించండి.
జవాబు:
- AgNO3, ద్రావణంలో AgCl తక్కువగా కరుగుతుంది. ఎందువలన అనగా ఉభయ సామాన్య ఫలితం వలన.
- నీటిలో AgCl ఎక్కువగా కరుగుతుంది. కారణం ఇచ్చట ఉభయ సామాన్య ఫలితం లేదు.
ప్రశ్న 43.
CH3COOH(జల) + Cl–(జల) → చర్య ఎడమవైపు నుంచి కుడివైపుకు పురోగమిస్తుందా ? తెలపండి.
జవాబు:
CH3COOH(జల) + Cl–(జల) → చర్య ఎడమవైపు నుండి కుడివైపుకు పురోగ మించదు. ఎందువలన అనగా Cl– అయాన్ బలమైన ఆమ్లం నుండి ఏర్పడినది. కావున ఇది జలవిశ్లేషణ జరుపదు. మరియు CH3COOHకు తక్కువ అయనీకరణ సామర్థ్యం కలిగి ఉండును.
![]()
ప్రశ్న 44.
H2S జలద్రావణంలో H2S, HS–, S-2, H3O+, OH–, H2O భిన్న గాఢతలలో ఉంటాయి. వీటిలో ఏ జాతి క్షారంగా పనిచేస్తుంది? ఏది ఆమ్లంగా పనిచేస్తుంది? ఏది ఆమ్లం, క్షారం రెండింటిగా పనిచేస్తుంది?
జవాబు:
- H2S, H3O+ రెండు కేవలం ఆమ్లాలు.
- HS–, OH–, H2Oలు ఆమ్లాలు, క్షారాలుగా పని చేస్తాయి.
- S-2 కేవలం క్షారం మాత్రమే.
దీర్ఘ సమాధాన ప్రశ్నలు
ప్రశ్న 1.
సమతాస్థితి ప్రక్రియలు అంటే ఏమిటి ? భౌతిక, రసాయన ప్రక్రియలలో ఈ సమతాస్థితిని సోదాహరణంగా వివరించండి.
జవాబు:
సమతాస్థితి ప్రక్రియ :
“ఉత్రమణీయ చర్యలో పురోగామి చర్యారేటు, తిరోగామి చర్యారేటు విలువల్లో సమానం అయ్యే దశ లేదా స్థానాన్ని “సమతాస్థితి దశ” అంటారు.
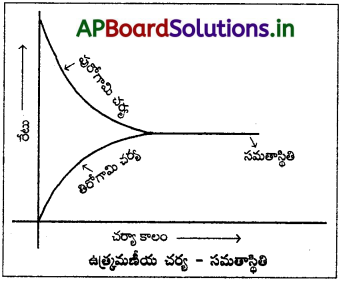
వివరణ :
A + B ![]() C + D
C + D
అనునది మూసి ఉన్న పాత్రలో జరుగుతున్నది. చర్య ప్రారంభంలో కేవలం క్రియాజనకాలు A మరియు B మాత్రమే ఉన్నాయి. వాటి గాఢతలు గరిష్ఠంగా ఉంటాయి. చర్య జరుగుతూ ఉంటే క్రియాజనకాలు A మరియు B, క్రియాజన్యాలు C మరియు Dగా మారతాయి. క్రియాజన్యాల గాఢత క్రమంగా పెరుగుతుంది.
పురోగామి చర్యారేటు తగ్గుతూ తిరోగామి చర్యారేటు పెరుగుతుంది. ఈ రెండు చర్యల రేటులు సమానం అయిన స్థానాన్ని సమతాస్థితి స్థానం అంటారు. పురోగామి చర్యరేటు Vf = తిరోగామి చర్యరేటు (Vb) అయితే ఆ వ్యవస్థ సమతాస్థితి స్థానాన్ని చేరినది అని చెప్పవచ్చు.
ఉదా : (i) భౌతిక ప్రక్రియలలో సమతాస్థితి :
(ఎ) ఒక పదార్థానికి చెందిన రెండు ప్రావస్థల మధ్య సమతాస్థితి.

(బి) ఒక పదార్థానికి చెందిన రెండు స్ఫటిక రూపాల మధ్య సమతాస్థితి.

ప్రశ్న 2.
గతిక సమతాస్థితి అంటే ఏమిటి? సరైన ఉదాహరణలతో వివరించండి.
జవాబు:
గతిక సమతాస్థితి :
“ఉత్రమణీయ చర్య సమతాస్థితి వద్ద కూడా పురోగామి, తిరోగామి చర్యలు రెండూ సమానమైన రేటుతో కొనసాగుతూనే ఉంటాయి. ఈ సమతాస్థితిని “గతిక సమతాస్థితి” అంటారు.
వివరణ :
సమతాస్థితి స్థానం వద్ద కూడా చర్యలు నిలిచిపోవు. ఈ స్థితి వద్ద కూడా పురోగామి, తిరోగామి చర్యలు రెండూ కొనసాగుతూనే ఉంటాయి. కాని క్రియాజనకాలు, ఉత్పన్నాల సమతాస్థితి గాఢతలు మాత్రం కాలంతో మార్పు చెందకుండా ఉంటాయి.
![]()
ఉదాహరణ :
సమతాస్థితి యొక్క గతిక స్వభావాన్ని అర్థం చేసుకోవటానికి, H2 బదులుగా D2 (ట్యుటీరియం)ని తీసికొని అదే పరిస్థితుల వద్ద NH3 సంశ్లేషణ చర్య జరపాలి. చర్యా మిశ్రమాలను H2 లేదా D లతో ప్రారంభించవచ్చు. సమతాస్థితి వద్ద ఘటన మిశ్రమంలో H2, NH3లకు బదులుగా D2, ND3లు ఉంటాయి. చర్య సమతాస్థితికి వచ్చిన తరువాత, ఈ రెండు మిశ్రమాలను అనగా H2, N2, NH3 మరియు D2, N2, ND3లను కొద్దిసేపు కలిపివుంచాలి.
తరువాత ఈ మిశ్రమాన్ని విశ్లేషణ చేస్తే ముందువలెనే NH, ఏర్పడింది. అనగా దాని గాఢతలో మార్పు లేదు. మాస్ స్పెక్ట్రోమీటరు ద్వారా ఈ మిశ్రమాన్ని విశ్లేషణ చేస్తే అవగతమైనదేమనగా అమ్మోనియా మరియు ట్యుటీరియంను కలిగివున్న అమ్మోనియా రూపాలు (NH3, NH2D, NHD2 మరియు ND3) మరియు డైహైడ్రోజన్ మరియు దాని డ్యుటిరేటడ్ రూపాలు (H2, HD మరియు D2) వున్నవని తెలిసింది.
పై అణువులలో H మరియు D పరమాణువులు ఉండటం కేవలం పురోగామి మరియు తిరోగామి చర్యలు జరుగుతూ ఉంటేనే సాధ్యమవుతుందనేది సారాంశము. సమతాస్థితి వద్ద చర్య జరగకపోతే అనగా చర్య ఆగిపోతే ఈ విధమైన ఐసోటోపుల మిశ్రమం జరగదు.
అమ్మోనియా సంశ్లేషణలో ఐసోటోప్ (ట్యుటీరియం) ను ఉపయోగించడమనేది సమతాస్థితి యొక్క గతిక స్వభావాన్ని జువుచేసినది. అనగా సమతాస్థితి వద్ద చర్య యొక్క పురోగామి మరియు తిరోగామి చర్యారేటులు సమానంగా ఉంటాయి మరియు సమతాస్థితి వద్ద సంఘటనల్లో మార్పు ఉండదు.
ప్రశ్న 3.
భౌతిక ప్రక్రియలలోని సమతాస్థితుల సాధారణ అభిలాక్షణిక ధర్మాలను తెలపండి.
జవాబు:
సమతాస్థితి అభిలక్షణాలు :
- పురోగామి, తిరోగామి చర్యలు రెండూ జరుగుతూనే ఉంటాయి.
- పురోగామి చర్యరేటు, తిరోగామి చర్యరేటుకు సమానంగా ఉంటుంది.
- పీడనం, గాఢత, సాంద్రత, రంగు మొదలైన ధర్మాలు. కాలంతోపాటు మార్పు చెందక స్థిరంగా నిలిచి ఉంటాయి.
- చర్యకు ఉత్ప్రేరకాన్ని చేర్చినా సమతాస్థితి స్థానం మారదు. అయితే అది సమతాస్థితిని తొందరగా చేరుకోడానికి సహాయపడుతుంది.
- చర్యను క్రియాజనకాలతో ఆరంభించినా లేదా చర్యను క్రియాజన్యాలతో ఆరంభించినా అదే రసాయన సమతాస్థితిని చేరుకోవచ్చు.
- క్రియాజనకాల లేదా క్రియాజన్యాల పీడనాలను లేదా గాఢతలను మార్చినట్లయితే సమతాస్థితి స్థానం మారవచ్చు.
ప్రశ్న 4.
సమతాస్థితి స్థిరాంకం ముఖ్య లక్షణాలను తెలపండి.
సమతాస్థితి స్థిరాంకం అనువర్తనాలు రెండింటిని తెలపండి.
జవాబు:
క్రియాజన్యాల మోలార్ గాఢతల లబ్దానికి, క్రియాజన్యాల మోలార్ గాఢతల లబ్దానికి నిష్పత్తిని సమతాస్థితి స్థిరాంకం (Kc) అంటారు.
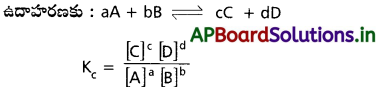
పై చర్య తిరోగామి చర్యకు K విలువ విలోమంగా ఉండును.
KP = Kc (RT)∆n ; ∆n = np – nR
Kc వ్రాసేటపుడు శుద్ధ ద్రవాలు, శుద్ధ ఘన పదార్థాలు గాఢతలు లెక్కలోనికి తీసుకోకూడడు.
అనువర్తనాలు :
(a) చర్య విస్తృతిని కనుగొనుట :
ఒక చర్య సమతాస్థితి స్థిరాంకం సంఖ్యాత్మక విలువ, ఆ చర్య విస్తృతిని తెలుపుతుంది. అయితే సమతాస్థితి స్థిరాంకం ఎంత వేగం (రేటు) తో చర్య సమతాస్థితిని చేరుకుంది అనే విషయాన్ని మాత్రం సమతాస్థితి స్థిరాంకం తెలియజేయదు. Kc లేదా Kp ల పరిమాణం క్రియాజన్యాల గాఢతలకు (సమతాస్థితి స్థిరాంక సమాసంలో లవంలో ఉండే గాఢతలు) అనులోమానుపాతంలోను, క్రియాజనకాల గాఢతలకు (సమతాస్థితి స్థిరాంక సమాసంలో హారంలో ఉండే గాఢతలు) విలోమానుపాతంలోను ఉంటాయి.
దీనిని అనుసరించి K విలువ అధికంగా ఉంటే క్రియాజన్యాలు అధికంగా ఏర్పడతాయి అని తెలుపుతుంది. అదే విధంగా అల్పంగా ఉంటే క్రియాజన్యాలు అల్పంగా ఏర్పడతాయని తెలుస్తుంది.
సమతాస్థితి మిశ్రమాలను గురించిన సాధారణీకరణం చేసిన విషయాలను కింది విధంగా తెలపవచ్చు.
Kc > 10³ అయితే క్రియాజనకాల కంటే క్రియాజన్యాలు అధికంగా ఉంటాయి. అంటే Kc విలువ అత్యధికంగా ఉన్నట్లైతే చర్య సుమారుగా పూర్తిగా జరుగుతుందని ఊహించవచ్చు. కింది ఉదాహరణలను చూడండి :
a) 500 K వద్ద H2, O2 తో జరిపే చర్యకు సమతాస్థితి స్థిరాంకం విలువ అత్యధికంగా ఉంది.
Kc = 2.4 × 1047
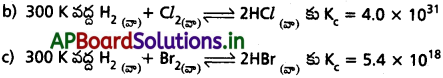
Kc < 10-3 అయితే క్రియాజనకాలు, క్రియాజన్యాల కంటే అధికంగా ఉంటాయి. Kc విలువ అతి తక్కువ అయితే, ఆ చర్య అరుదుగా జరుగుతుంది. కింది ఉదాహరణలను చూడండి.
a) 500 K వద్ద Hz, O లుగా H2O వియోగం చెందే చర్య అత్యల్ప సమతాస్థితి స్థిరాంకం విలువను కలిగి ఉంది.
Kc = 4.1 × 10-48
![]()
Kc విలువ 10-3 కు 10³ కు మధ్యగా ఉండినట్లైతే చర్యలో గమనించదగిన గాఢతలలో క్రియాజన్యాలు, క్రియాజనకాలు కూడా ఉంటాయి.
కింది ఉదాహరణలను చూడండి.
a) H2, I2తో చర్య జరిపి HI ను ఏర్పరచే చర్యలో

Kc పై ఆధారపడిన చర్య విస్తృతి K=570, 700 K వద్ద
(b) చర్య దిశను నిర్ణయించుట
Q మరియు K లు చర్య దిశను కనుగొనుటకు ఉపయోగిస్తారు.
a) Q = K అనగా చర్య సమతాస్థితిలో ఉండును.
b) Q < K అనగా చర్య పురోగామి దిశలో జరుగును. (అనగా క్రియాజన్యాల పైన)
c) Q > K అనగా చర్య తిరోగామి దిశలో జరుగును. (అనగా క్రియాజనకాల వైపు)
![]()
ప్రశ్న 5.
లీచాట్లియర్ సూత్రం వివరించండి. సమతాస్థితిని ప్రభావితం చేసే అంశాలను వివరించండి.
జవాబు:
లీచాట్లియర్ సూత్రం :
“సమతాస్థితి వద్ద ఉండే ఒక ఉత్రమణీయ రసాయన చర్యను సమతాస్థితిని ప్రభావితం చేసే ‘ ఉష్ణోగ్రత, పీడనం లేదా గాఢతల మార్పుకు గురిచేస్తే ఈ మార్పు ప్రభావాన్ని తగ్గించే లేదా రద్దు చేసే వైపుకు సమతాస్థితి మారుతుంది”.
వివరణ :
1. పీడన ప్రభావం :
(a) సమతాస్థితి వద్ద ఉండే వ్యవస్థపై పీడనాన్ని పెంచితే దాని ప్రభావం రద్దయ్యే దిశవైపుకు అనగా ఘనపరిమాణం తగ్గే దిశవైపుకు వ్యవస్థ జరుగుతుంది.

పురోగామి చర్య (4 ఘ॥ → 2 ఘ||)లో ఘనపరిమాణం తగ్గుతుంది కాబట్టి లీచాట్లియర్ సూత్రం ప్రకారం అధిక పీడనాలు NH3 ఏర్పడే చర్యను ప్రోత్సహిస్తాయి.
(b) ఇదేవిధంగా సమతాస్థితి వద్ద ఉండే వ్యవస్థపై పీడనాన్ని తగ్గిస్తే దాని ప్రభావం రద్దయ్యే దిశవైపుకు అనగా ఘనపరిమాణం పెరిగే దిశ వైపుకు వ్యవస్థ జరుగుతుంది.
ఉదా : పై చర్యలో సమతాస్థితి వద్ద పీడనాన్ని పెంచితే తిరోగామి చర్య (2NH3 → N2 + 3H2) ప్రోత్సహించబడుతుంది.
2. ఉష్ణోగ్రత ప్రభావం :
(a) ఉష్ణోగ్రతను పెంచితే ఆ మార్పు రద్దయ్యే దిశవైపుకు అనగా ఉష్ణగ్రాహక చర్య ప్రోత్సహించబడుతుంది.
(b) అదేవిధంగా ఉష్ణోగ్రతను తగ్గిస్తే ఆ మార్పు రద్దయ్యే దిశ వైపుకు అనగా ఉష్ణమోచక చర్య ప్రోత్సహించబడుతుంది.
![]()
పై చర్యలో సమతాస్థితి వద్ద ఉష్ణోగ్రతను పెంచితే ఉష్ణగ్రాహక చర్య అయిన తిరోగామి చర్య ప్రోత్సహించబడుతుంది. అదేవిధంగా సమతాస్థితి వద్ద ఉష్ణోగ్రతను తగ్గిస్తే ఉష్ణమోచక చర్య అయిన పురోగామి చర్య ప్రోత్సహించబడుతుంది.
∴ అల్ప ఉష్ణోగ్రతలు NH3 ఏర్పడుటను ప్రోత్సహిస్తాయి.
3. గాఢత ప్రభావం :
క్రియాజనకాలు గాఢతను పెంచినా, ఉత్పన్నాల గాఢతను తగ్గించినా పురోగామి చర్య ప్రోత్సహించబడుతుంది.
![]()
సమతాస్థితి వద్ద N2 గాఢతను గాని (లేదా) H2 గాఢతను గాని (లేదా) రెండింటి గాఢతను పెంచినా పురోగామి చర్య ప్రోత్సహించబడి అధిక NH3 ఏర్పడుతుంది. పురోగామి చర్యలో ఏర్పడిన NH3 గాఢతను ఎప్పటికప్పుడు తొలగిస్తూవున్నా అంటే ఉత్పన్న గాఢతను తగ్గిస్తూ వున్నా పురోగామి చర్య ప్రోత్సహింపబడుతుంది.
ప్రశ్న 6.
అమ్మోనియా, సల్ఫర్ ట్రై ఆక్సైడ్ పారిశ్రామిక తయారీలలో, లీచాట్లియర్ సూత్రం ఉపయోగాన్ని వివరించండి. [T.S. Mar. ’15]
జవాబు:
లీచాట్లియర్ సూత్రము :
“సమతాస్థితి వద్ద ఉండే ఒక ఉత్రమణీయ రసాయన చర్యను సమతాస్థితిని ప్రభావితం చేసే ఉష్ణోగ్రత, పీడనం (లేదా) గాఢతల మార్పుకు గురిచేస్తే ఈ మార్పు ప్రభావాన్ని తగ్గించే లేదా రద్దు చేసే వైపుకు సమతాస్థితి మారుతుంది.”
వివరణ :
(i) పీడనం ప్రభావము :
సమతాస్థితి వద్ద ఉన్న వ్యవస్థపై పీడనాన్ని పెంచితే, సమతాస్థితి ఘనపరిమాణాల సంఖ్య తగ్గే వైపుకు ప్రభావితం అవుతుంది. అదేవిధంగా పీడనాన్ని తగ్గిస్తే సమతాస్థితి ఘ.ప.ల సంఖ్య పెరిగేవైపుకు ప్రభావితం అవుతుంది.
(ii) ఉష్ణోగ్రత ప్రభావము :
సమతాస్థితి వద్ద ఉన్న వ్యవస్థపై ఉష్ణోగ్రతను పెంచితే ఆ ప్రభావం రద్దు అయ్యేవైపుకు అంటే ఉష్ణం గ్రహించే వైపుకు (ఉష్ణగ్రాహక చర్య) సమతాస్థితి ప్రభావితం అవుతుంది. అదేవిధంగా ఉష్ణోగ్రతను తగ్గిస్తే ఆ ప్రభావం రద్దు అయ్యే వైపుకు అంటే ఉష్ణం విడుదలయ్యే వైపుకు (ఉష్ణమోచక చర్య) సమతాస్థితి ప్రభావితం అవుతుంది.
(iii) గాఢత ప్రభావము :
క్రియాజనకాల గాఢతను పెంచితే సమతాస్థితి క్రియాజన్యాలు ఏర్పడేవైపుకు జరుగుతుంది. అలాగే క్రియాజన్యాల గాఢత తగ్గిస్తే అపుడు కూడా సమతాస్థితి క్రియాజన్యాలు ఏర్పడేవైపుకు జరుగుతుంది.
అనువర్తనము :
![]()
(i) ఉష్ణోగ్రతా ప్రభావము :
పురోగామి చర్య N2(వా) + 3H2(వా) → 2NH3(వా) ఉష్ణమోచక చర్య. అందువల్ల లీచాట్లియర్ సూత్రం ప్రకారము, అల్ప ఉష్ణోగ్రతలు, NH3 ఏర్పడే చర్యను ప్రోత్సహిస్తాయి.
కాని అల్ప ఉష్ణోగ్రతల వద్ద చర్య నెమ్మదిగా జరుగుతుంది. కాబట్టి ఇందుకు తగిన ఉష్ణోగ్రతను ఎన్నుకొంటారు. (725 – 775 K).
(ii) పీడన ప్రభావము :
పురోగామి చర్యలో N2(వా) + 3H2(వా) → 2NH3(వా) అణువుల సంఖ్య (4 → 2) తగ్గుతుంది. అంటే ఘనపరిమాణం తగ్గుతుంది. కాబట్టి లీచాట్లియర్ సూత్రం ప్రకారం, అధిక పీడనాలు NH3 ఏర్పడే చర్యను ప్రోత్సహిస్తాయి. కాబట్టి 200 అట్మాస్పియర్ల పీడనాన్ని ఉపయోగిస్తారు.
(iii) ఉత్ప్రేరకము :
చర్యా వేగాన్ని పెంచడానికి ‘Fe’ను ఉత్ప్రేరకం వాడతారు. ‘Mo’ను ప్రవర్ధకంగా వాడతారు.
∴ NH3 సంశ్లేషణలో అధిక దిగుబడికి లీచాట్లియర్ సూత్రం ప్రకారం అనుకూల అంశాలు :
| పీడనం | 200 అట్మా |
| ఉష్ణోగ్రత | 725 – 775 K |
| ఉత్ప్రేరకం | Fe (చూర్ణ స్థితిలో) |
| ప్రవర్ధకం | Mo |
![]()
(i) ఉష్ణోగ్రతా ప్రభావము :
SO3 ఏర్పడటాన్ని తెలిపే పురోగామి చర్య ఉష్ణమోచక చర్య. కాబట్టి లీచాట్లియర్ సూత్రం ప్రకారం, అల్ప ఉష్ణోగ్రతలు ఈ పురోగామి చర్యను ప్రోత్సహిస్తాయి.
కాని అల్ప ఉష్ణోగ్రతల వద్ద చర్య నెమ్మదిగా జరుగుతుంది. కాబట్టి తగిన ఉష్ణోగ్రతను (673 K) ఎన్నుకొంటారు.
(ii) పీడన ప్రభావము :
SO3 ఏర్పడటానికి దారితీసే చర్య, అణువుల సంఖ్య తగ్గే (3 → 2) చర్య లేదా ఘనపరిమాణం తగ్గే చర్య. కాబట్టి లీచాట్లియర్ సూత్రం ప్రకారం, అధిక పీడనాలు SO3 ఏర్పడటాన్ని ప్రోత్సహిస్తాయి.
కాని ఈ అధిక పీడనాల వద్ద సంశ్లేషణంలో ఉపయోగించే టవర్లు క్షయానికి గురి అవుతాయి. కాబట్టి తగిన పీడనాలను మాత్రమే ఉపయోగిస్తారు.
(iii) ఉత్ప్రేరకము :
చర్యా వేగాన్ని పెంచడానికి V2O5 లేదా ప్లాటినైజెడ్ ఏస్బెస్టాస్ ను ఉత్ప్రేరకంగా ఉపయోగిస్తారు.
SO3 సంశ్లేషణలో అధిక దిగుబడికి లీచాట్లియర్ సూత్రం ప్రకారం అనుకూల అంశాలు :
| పీడనం | సాధారణం |
| ఉష్ణోగ్రత | 673 K |
| ఉత్ప్రేరకం | V2O5 (లేదా) ప్లాటినైజ్డ్ ఎస్బెస్టాస్ |
![]()
ప్రశ్న 7.
కింద పేర్కొన్న ఉష్ణగ్రాహక చర్య ఆధారంగా సహజ వాయువును, నీటి ఆవిరి ద్వారా పాక్షిక ఆక్సీకరణం చర్యకు గురిచేసి డైహైడ్రోజన్ వాయువును తయారుచేస్తారు.
![]()
a) పై చర్యకు Kp కు సమీకరణం రాయండి.
b) Kp విలువ సమతాస్థితి మిశ్రమం సంఘటనం ఏ విధంగా కింది వాటి ద్వారా ప్రభావితం అవుతాయి ?
i) పీడనం పెరుగుదల
ii) ఉష్ణోగ్రత పెరుగుదల
iii) ఉత్ప్రేరకం ఉపయోగం
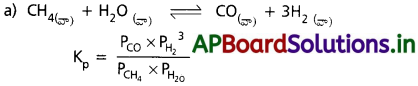
b) i) పురోగామి దిశలో వాయువుల మోల్ ల సంఖ్య పెరిగినది. కావున పీడనం పెంచినపుడు చర్య తిరోగామి దిశగా మళ్లును.
ii) ఉష్ణోగ్రత పెంచినపుడు చర్య ఉష్ణం శోషించుకొను వైపుకు మళ్లును. ఉష్ణోగ్రత పెరిగితే Kp కూడా పెరుగును.
iii) సమతాస్థితిపై ఉత్ప్రేరక ప్రభావం ఉండదు. ఇది కేవలం చర్యలోని సమతాస్థితి త్వరిత గతిన ఏర్పడేట్లు చేయును.
ప్రశ్న 91.
![]() చర్య సమతాస్థితిపై కింది వాటి ప్రభావాన్ని తెలపండి.
చర్య సమతాస్థితిపై కింది వాటి ప్రభావాన్ని తెలపండి.
CH4(వా) + H2O CO(వా) + 3H2(వా)
a) H2 సంకలనం
b) CH3OH సంకలనం
c) CO తొలగింపు
d) CH3OH తొలగింపు
జవాబు:
![]()
a) H2 సంకలనం :
క్రియా జనకాల గాఢతను పెంచినపుడు పురోగామి చర్య జరుగును.
b) CH3OH సంకలనం :
క్రియా జన్యాల గాఢతను పెంచినపుడు తిరోగామిచర్య జరుగును.
c) CO తొలగింపు
క్రియా జనకాల గాఢతను తగ్గించినపుడు తిరోగామి చర్య జరుగును.
d) CH3OH తొలగింపు
క్రియా జనకాల గాఢతను తగ్గించినపుడు పురోగామి చర్య జరుగును.
ప్రశ్న 8.
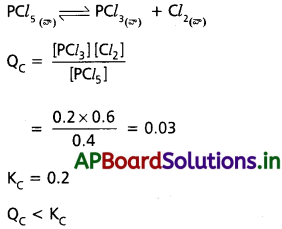
473K వద్ద ఫాస్ఫరస్ డెంటాక్లోరైడ్ PCl5 విఘటనం చర్యకు సమతాస్థితి స్థిరాంకం విలువ 8.3 × 10-3 ఈ విఘటన చర్యను కింది విధంగా వ్యక్తం చేస్తే
![]()
a) చర్యకు Kcను వ్యక్తం చేసే సమాసం రాయండి.
b) అదే ఉష్ణోగ్రత వద్ద, ఉత్రమణీయ చర్యకు Kc విలువను తెలపండి?
c) Kc పై కింది వాని ప్రభావం తెలపండి
(i) PCl5 అధిక సంకలనం
(ii) పీడనం పెంచడం
(ii) ఉష్ణోగ్రత పెంచడం
జవాబు:

c) i) PCl5 ఎక్కువగా కలుపగా Kc విలువ తగ్గును.
ii) పీడనం పెంచగా Kc విలువ పెరుగును.
iii) ఇవ్వబడిన చర్య ఉష్ణగ్రాహక చర్య కావున ఉష్ణోగ్రత పెరిగితే Kc విలువ పెరుగును.
ప్రశ్న 9.
బ్రాన్డెడ్ ఆమ్లాలు, బ్రాన్స్టెడ్ క్షారాలు భావనలను సోదాహరణంగా వివరించండి.
జవాబు:
బ్రాస్లైడ్ సిద్ధాంతము :
ఆమ్లం :
“ప్రొటానన్ను దానం చేసే ప్రవృత్తి గల పదార్థాన్ని ఆమ్లం అంటారు”.
ఉదా : HCl, H2SO4 మొ||వి.
క్షారం :
“ప్రొటాను స్వీకరించే ప్రవృత్తి గల పదార్థాన్ని క్షారం అంటారు”.
ఉదా : NH3, H2O మొ||వి.
ఈ సిద్ధాంతం ప్రకారం ఆమ్లాల, క్షారాల మధ్య చర్యలు ద్విగత చర్యలు.
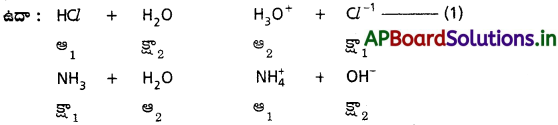
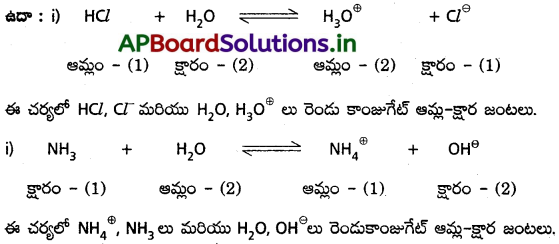
(1) వ చర్యలో (HCl, Cl-1), (H3O+, H2O) లు ఆమ్ల – క్షార జంటలు.
(2) వ చర్యలో (NH4+, NH3), (H2O), OH– లు ఆమ్ల – క్షార జంటలు.
ఈ ఆమ్ల – క్షార జంటలన్నింటిలో ఒక ప్రోటాన్ తేడా ఉంటుంది. ఈ విధంగా ప్రోటాన్ తేడాతో ఉండే ఆమ్ల – క్షార జంటను కాంజుగేట్ ఆమ్ల – క్షార జంట అంటారు.
ప్రశ్న 10.
తగిన ఉదాహరణలతో లూయీ ఆమ్ల క్షార సిద్ధాంతం వివరించండి. కింది జాతులను లూయీ అమ్లాలు, లూయీ క్షారాలుగా వర్గీకరించండి. ఇవి లూయీ ఆమ్లం/క్షారంగా ఏ విధంగా పనిచేస్తాయి ?
a) OH–
b) F–
c) H+
d) BCl3
జవాబు:
లూయీస్ ఆమ్ల – క్షార సిద్ధాంతం :
i) లూయీ ఆమ్లము :
ఒక దాతనుంచి ఎలక్ట్రాన్ జంటను స్వీకరించి, దానితో సమన్వయ సమయోజనీయ బంధాన్ని ఏర్పరచగలిగే పదార్థం లేదా రసాయన జాతి”.
ఉదా : H+, BF3, SnCl4 మొ||వి.
ii) లూయీ క్షారము :
“ఒక స్వీకర్తకు ఎలక్ట్రాన్ జంటను దానం చేసి ఆ పదార్థంతో సమన్వయ సమయోజనీయ బంధాన్ని ఏర్పరచగలిగే పదార్థం (లేదా) రసాయన జాతి”.
![]()
iii) లూయీ ఆమ్లాలలో రకాలు :
- అన్నిరకాల కాటయాన్లు
ఉదా : Ag+, CO+3, CO+2, Fe+3 మొ|| - కేంద్ర పరమాణువుపై అసంపూర్ణ అష్టకాలున్న ఖాళీ ఆర్బిటాల్లున్న సమ్మేళనాలు. ఉదా : BF3, BCl3, AlCl3, మొ||.
- కేంద్ర పరమాణువుపై అందుబాటులో d – ఆర్బిటాల్లు ఉండి, దాని ఎలక్ట్రాన్ అష్టకాన్ని విస్తృతి చేయగలిగినవై ఉన్న సమ్మేళనాలు.
ఉదా : SiF4, SnCl4, SF4 మొ|| - విభిన్న ఋణవిద్యుదాత్మకతలు గల పరమాణువుల మధ్య బహుబంధాలున్న అణువులు.
ఉదా : CO2, SO2, SO3 మొ|| - ఎలక్ట్రాన్ షష్టకాలు గల మూలకాలు.
ఉదా : S, O మొ||.
iv) లూయీ క్షారాలలో రకాలు :
అన్ని ఆనయాన్లు. ఉదా : Cl–, OH–, CN–, F– మొ||
మధ్యస్థ పరమాణువుపై ఒకటి లేదా రెండు ఒంటరి జంటలున్న అణువులు.
![]()
బహు బంధాలున్న అణువులు. ఉదా : CO, NO, CH ≡ CH (C2H2) మొ||.
v) ఆమ్ల క్షార చర్యలకు ఉదాహరణ :
హైడ్రోనియం అయాన్ (H3O+) ఏర్పడుట :
H+ నీటితో సంయోగం చెందుతుంది. నీటి అణువులోని ఆక్సిజన్ తన ఎలక్ట్రాన్ జంటను H⊕ అయాన్కు దానం చేస్తుంది.
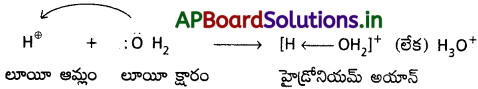
a) హైడ్రాక్సిల్ అయాన్, తాను ఒక ఎలక్ట్రాన్ జంటను దానం చేయగలగడం చేత లూయీ క్షారంగా పనిచేస్తుంది.
b) F–, దానిపై ఉండే నాలుగు ఒంటరి ఎలక్ట్రాన్ జంటలలో ఒకదానిని దానం చేసి లూయీ క్షారంగా ప్రవర్తిస్తుంది.
c) హైడ్రాక్సిల్ అయాన్, ఫ్లోరైడ్ అయాన్ వంటి క్షారాలు నుంచి, ఒక ఒంటరి ఎలక్ట్రాన్ జంటను స్వీకరించగలిగి ఉండటం కారణంగా, ప్రోటాన్ ఒక లూయీ ఆమ్లంగా పనిచేస్తుంది.
d) అమ్మోనియా, లేదా ఏమీన్ అణువులు నుంచి ఒక జంట ఒంటరి ఎలక్ట్రాన్లను BCl3 స్వీకరించి లూయీ ఆమ్లంగా పనిచేస్తుంది.
ప్రశ్న 11.
బలహీన ఆమ్లాలు, బలహీన క్షారాలు, వీటికి సంబంధించినంతవరకు అయనీకరణ అవధి ఏమిటి? HX, బలహీన ఆమ్లం విషయంలో సమతాస్థితి స్థిరాంకం విలువ Ka కు అయనీకరణం అవధికి మధ్య గల సంబంధం ఏమిటి?
జవాబు:
అయనీకరణం అవధి (α) :
దుర్భల ఆమ్లం (లేదా) క్షారం అయనీకరణం పరిమితిని అయనీకరణ అవధి (α) ద్వారా తెలుపుతారు. ‘α’ విలువ ‘ఒకటి’ కంటే తక్కువగా ఉంటుంది. ద్రావణంగాఢత ‘C’ మోల్/లీటరు అనుకొందాము.

ప్రశ్న 12.
pH ను నిర్వచించండి. బఫర్ ద్రావణం అంటే ఏమిటి ? ఆమ్ల బఫర్ ద్రావణం pH విలువను లెక్కించడానికి ఉపయోగపడే హేండర్సన్ హేజల్బాక్ సమీకరణాన్ని ఉత్పాదించండి.
జవాబు:
pH నిర్వచనము :
” ఒక ద్రావణంలో ఉన్న హైడ్రోజన్ అయాన్, H+ గాఢత మోల్ / లీటర్ల లో చెప్పి, దాని సంవర్గమాన ఋణాత్మక విలువను ఆ ద్రావణ pH అంటారు”.
బఫర్ ద్రావణం – నిర్వచనము :
“ద్రావణాన్ని విలీనం చేసినప్పుడు (లేదా) కొద్దిగా బలమైన ఆమ్లాన్ని (లేదా) బలమైన క్షారాన్ని కలిపినప్పుడు pH లో మార్పును నిరోధించే ద్రావణాలను బఫర్ ద్రావణాలు అంటారు”.
ఉదా : CH3COOH + CH3COONa (ఆమ్ల బఫర్ ద్రావణము)
NH4OH + NH4Cl (క్షార బఫర్ ద్రావణము)
బఫర్ ద్రావణాలు – తయారీ :
i) ఆమ్ల బఫర్ ద్రావణాలు :
బలహీన ఆమ్లం + దాని లవణం (బలమైన క్షారంతో) = ఆమ్ల బఫర్
“వీటిని సాధారణంగా సమమోలార్ గాఢతలున్న బలహీన ఆమ్లం, దాని లవణం ద్రావణాలను సమాన లేదా భిన్న ఘనపరిమాణాలలో కలిపి తయారు చేస్తారు.”
ఉదా : CH3COOH + CH3COONa.
ii) క్షార బఫర్ ద్రావణాలు :
బలహీన క్షారం + దాని లవణం (బలమైన ఆమ్లంతో) = క్షార బఫర్
“వీటిని సాధారణంగా సమమోలార్ గాఢతలున్న బలహీనక్షారం, దాని లవణం ద్రావణాలను సమాన లేదా భిన్న ఘనపరిమాణాలలో కలిపి తయారు చేస్తారు.”
ఉదా : NH4OH + NH4Cl
ఆమ్ల బఫర్ pH హేండర్సన్ సమీకరణ ఉత్పాదన
ఆమ్ల బఫర్ HA + NaA తీసుకొనవలెను.
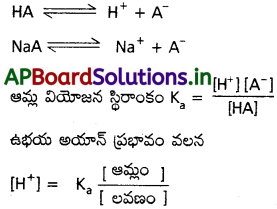
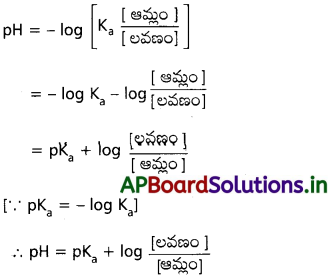
ప్రశ్న 13.
“లవణాల జలవిశ్లేషణం” పదాన్ని ఉదాహరణలతో వివరించండి. కింది లవణ ద్రావణాల pH విలువలను గురించి చర్చించండి.
(i) బలహీన ఆమ్లం, బలమైన క్షారం ఏర్పరచిన లవణాలు
(ii) బలమైన ఆమ్లం, బలహీన క్షారం ఏర్పరచిన లవణాలు
జవాబు:
లవణ జలవిశ్లేషణ :
“లవణం యొక్క ఏనయాన్ (లేదా) కాటయాన్ (లేదా) రెండూ జలద్రావణంలో నీటితో చర్యజరిపి OHΘ అయాన్లను (లేదా) H+ అయాన్లను (లేదా) రెండింటిని అదనంగా ఏర్పరిచే దృగ్విషయాన్ని లవణ జలవిశ్లేషణ అంటారు”.
i) CH3COONa లవణ జలవిశ్లేషణ :
CH3COONa అయనీకరణం; CH3COONa ![]() CH3 COO– + Na+
CH3 COO– + Na+
అదే విధంగా నీరు అయనీకరణం; H2O ![]() H+ + OH– ఇపుడు CH3COONa జలద్రావణంలో CH3COO–, Na+ H+ + OH– అనే అయాన్లు ఉంటాయి. CH3COO– మరియు H+ అయాన్లు కలిసిపోయి బలహీనమైన CH3COOH ను యిస్తాయి. CH3COO– + H2O
H+ + OH– ఇపుడు CH3COONa జలద్రావణంలో CH3COO–, Na+ H+ + OH– అనే అయాన్లు ఉంటాయి. CH3COO– మరియు H+ అయాన్లు కలిసిపోయి బలహీనమైన CH3COOH ను యిస్తాయి. CH3COO– + H2O ![]() CH3COOH + OHΘ. Na+ మరియు OH అయాన్లు కలిసిపోయి బలమైన NaOH ను యిస్తాయి. అట్లేర్పడ్డ ఆమ్లం, క్షారాలలో ఆమ్లం బలహీనమైనది, క్షారం బలమైనది అవడం వలన ద్రావణానికి క్షార స్వభావం ఏర్పడుతుంది. pH >7 ఉంటుంది.
CH3COOH + OHΘ. Na+ మరియు OH అయాన్లు కలిసిపోయి బలమైన NaOH ను యిస్తాయి. అట్లేర్పడ్డ ఆమ్లం, క్షారాలలో ఆమ్లం బలహీనమైనది, క్షారం బలమైనది అవడం వలన ద్రావణానికి క్షార స్వభావం ఏర్పడుతుంది. pH >7 ఉంటుంది.
ii) NH4Cl లవణ జలవిశ్లేషణ :

ఇపుడు NH4Cl జలద్రావణంలో NH4+, Cl–, H+, OH– అనే అయాన్లు ఉంటాయి. NH4+ అయాన్లు OH– అయాన్లతో కలిసిపోయి బలహీనమైన NH OH ను యిస్తాయి. H + మరియు C అయాన్లు కలసిపోయి బలహీనమైన HCl ను యిస్తాయి. NH4+ + H2O ![]() NH4OH + H⊕. ఇట్లేర్పడ్డ ఆమ్లం, క్షారాలలో ఆమ్లం బలమైనది అవడం వలన ద్రావణానికి ఆమ్ల స్వభావం ఏర్పడుతుంది. pH < 7 ఉంటుంది.
NH4OH + H⊕. ఇట్లేర్పడ్డ ఆమ్లం, క్షారాలలో ఆమ్లం బలమైనది అవడం వలన ద్రావణానికి ఆమ్ల స్వభావం ఏర్పడుతుంది. pH < 7 ఉంటుంది.
![]()
ప్రశ్న 14.
ద్రావణీయతా లబ్దం అంటే ఏమిటి? అయానిక లవణాల ద్రావణీయతపై ఉభయ సామాన్య అయాన్ ప్రభావం వివరించండి.
జవాబు:
ద్రావణీయతా లబ్దం (KSP) :
“గది ఉష్ణోగ్రత వద్ద ఒక లవణం సంతృప్త ద్రావణంలో కాటయాన్ల గాఢతకు మరియు ఆనయాన్ గాఢతకు మధ్యగల లబ్దమును ఆ లవణం యొక్క ద్రావణీయతా లబ్దం (KSP) అంటారు”
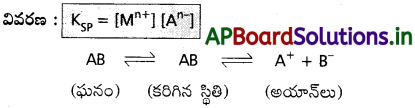
పై చర్యకు ద్రావణీయత లబ్దం (Kn+) = [A+] [B–]
ఉభయ సామాన్య అయాన్ ప్రభావము :
“ఉమ్మడి అయాన్ ఉన్నా బలమైన విద్యుత్ విశ్లేష్య పదార్థ సమక్షంలో బలహీన విద్యుత్ విశ్లేష్య పదార్ధము యొక్క అయనీకరణ తగ్గుటను ఉమ్మడి అయాన్ ప్రభావమంటారు”.
(లేక)
“ఒక విద్యుద్విశ్లేష్యకం నీటిలో ద్రావణీయత, దానికి విద్యుద్విశ్లేష్యకంలోని కాటయాన్ (లేదా) ఆనయాన్ ఉభయ సామాన్యంగా ఉండే వేరొక విద్యుద్విశ్లేష్యకం చేర్చినప్పుడు మొదటి విద్యుద్విశ్లేష్యకం ద్రావణీయత తగ్గిపోతుంది”.
లీచాట్లెయర్ సూత్రం అనుసరించి ఒక అయాన్ గాఢతను మనం పెంచినట్లైతే అది దాని ఆవేశానికి వ్యతిరేక ఆవేశం గల అయాన్తో సంయోగం చెంది KSP = QSP అయ్యే విధంగా కొంత లవణాన్ని అవక్షేపణం చెందిస్తుంది. ఇదే విధంగా ఒక అయాన్ గాఢతను తగ్గిస్తే, KSP = QSP అయ్యే విధంగా రెండు అయాన్ల గాఢతలు పెరిగే విధంగా లవణం అధిక పరిమాణంలో కరుగుతుంది. ఈ విషయం అధిక ద్రావణీయతను ప్రదర్శించే సోడియం క్లోరైడ్ వంటి లవణాలకు కూడా వర్తిస్తుంది. అయితే వీటి గాఢతలు అధిక పరిమాణంలో ఉండటం కారణంగా, QSP ను లెక్కించే సమాసంలో గాఢతలకు బదులుగా ఏక్టివిటీలను (క్రియాశీలతలను) ఉపయోగిస్తాం.
సోడియం క్లోరైడ్ సంతృప్త ద్రావణం తీసుకొని దానిలోకి HCl వాయువును పంపినట్లైతే HCl విఘటనం చర్య ద్వారా ఏర్పడిన క్లోరైడు అయాన్ల గాఢత (ఏక్టివిటీ) పెరగడం కారణంగా సోడియం క్లోరైడ్ అవక్షేపణం చెందుతుంది. ఈ విధంగా లభ్యం అయిన సోడియం క్లోరైడు చాలా శుద్ధంగా ఉంటుంది. దీనిలోని సోడియం సల్ఫేటు, మెగ్నీషియం సల్ఫేటు మలినాలు తొలగిపోతాయి. భారాత్మక విశ్లేషణ నిర్ణయ పద్ధతులలో అతిస్వల్ప ద్రావణీయత గల లవణంగా నిర్దిష్ట అయానన్ను సంపూర్ణంగా అవక్షేపణం చెందించడానికి ఈ ఉభయ సామాన్య అయాన్ సూత్రాన్ని ఉపయోగిస్తారు. ఈ విధంగా సిల్వర్ అయాను, సిల్వర్ క్లోరైడ్గాను, ఫెర్రిక్ అయాన్ను, ఫెర్రిక్ హైడ్రాక్సైడ్గాను (లేదా ఆర్ద్రీకరణం చెందిన ఫెర్రిక్ ఆక్సైడు), బేరియం అయాను దాని సల్ఫేటుగాను, భారాత్మక నిర్ణయ పద్ధతులలో అవక్షేపణం చెందిస్తారు.
ప్రశ్న 15.
కింది వాటి గురించి లఘు వ్యాఖ్యలు రాయండి.
i) ఉభయ సామన్య అయాన్ ఫలితం
ii) అల్ప ద్రావణీయత లవణం BaSO4 కు సంబంధించి Ksp కు ద్రావణీయత (S) కు గల సంబంధం జ. “ఒక విద్యుద్విశ్లేష్యకం నీటిలో ద్రావణీయత, దానికి విద్యుద్విశ్లేష్యకంలోని కాటయాన్ లేదా ఏనయాన్ ఉభయ సామాన్యంగా ఉండే వేరొక విద్యుద్విశ్లేష్యకం చేర్చినప్పుడు మొదటి విద్యుద్విశ్లేష్యకం ద్రావణీయత తగ్గిపోతుంది”. దీనినే ఉభయ సామాన్య అయాన్ ప్రభావం అంటారు.
ఉదా : NH4OH యొక్క అయనీకరణం దానికి NH4Cl ను చేర్చినప్పుడు తగ్గిపోతుంది. దీనిలో NH4+ ఉభయ సామాన్య అయాన్

i) ఉభయ సామాన్య అయాన్ ఫలితం :
“ఉమ్మడి అయాన్ ఉన్నా బలమైన విద్యుత్ విశ్లేష్య పదార్థ సమక్షంలో బలహీన విద్యుత్ విశ్లేష్య పదార్ధము యొక్క అయనీకరణ తగ్గుటను ఉమ్మడి అయాన్ ఫలితమంటారు”.
(లేక)
“ఒక విద్యుద్విశ్లేష్యకం నీటిలో ద్రావణీయత, దానికి విద్యుద్విశ్లేష్యకంలోని కాటయాన్ (లేదా) ఆనయాన్ ఉభయ సామాన్యంగా ఉండే వేరొక విద్యుద్విశ్లేష్యకం చేర్చినప్పుడు మొదటి విద్యుద్విశ్లేష్యకం ద్రావణీయత తగ్గిపోతుంది”.
ఉదా : i) NH4OH అయనీకరణం, NH4Cl ను చేర్చినప్పుడు తగ్గిపోతుంది దీనిలో NH4+ ఉభయ సామాన్య అయాన్.
ii) NaCl ద్రావణీయత, NaCl ద్రావణానికి HCl ద్రావణం చేర్చినపుడు తగ్గిపోతుంది.
అనువర్తనాలు :
- లవణ రసాయన కాటయాన్ల గుణాత్మక విశ్లేషణలో ఈ ప్రభావము ఒక ప్రాథమిక అంశము.
- రసాయన విశ్లేషణలో II గ్రూపులో S2- గాఢతనూ, III గ్రూపులో OHᎾ గాఢతనూ HCl, NH4OH లతో నియంత్రిస్తారు. దీనికి కారణం ఉభయ సామాన్య అయాన్ ప్రభావం.
H+ అయాన్ H2S కు ఉభయసామాన్యం (II గ్రూపు)
NH4+ అయాన్ NH4OH ఉభయసామాన్యం (IV గ్రూపు) - బఫర్ ద్రావణాలలో H+ అయాన్ గాఢతను నియంత్రించడానికి కూడా ఉభయ సామాన్య అయాన్ సూత్రం వర్తిస్తుంది.
- సామాన్య లవణం NaCl, శుద్ధి ప్రక్రియలో HCl వాయువును మలిన NaCl లవణ ద్రావణంలోకి పంపిస్తారు. దీనిలో ClᎾ ఉభయసామాన్య అయాన్. ఈ ప్రక్రియలో ఇమిడివున్న అంశము ఉభయ సామాన్య అయాన్ ప్రభావం.
ii) BaSO4 కు KSP కు ద్రావణీయత ‘S’కు గల సంబంధం
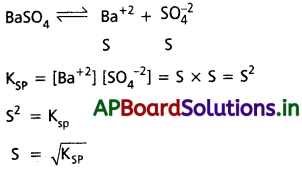
సమస్యలు (Problems)
ప్రశ్న 1.
1 లీటరు ఘనపరిమాణం గల మూసిన పాత్రలో 1 మోల్ PCl5ను వేడిచేస్తే సమతాస్థితి వద్ద 0.4 మోల్లు క్లోరిన్ ఏర్పడింది. సమతాస్థితి స్థిరాంకాన్ని లెక్కించండి.
సాధన:
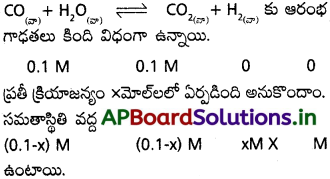
![]()
ఆరంభ [PCl5] = 1 మోల్/లీ
సమతాస్థితి వద్ద (Cl2] = 0.4 మోల్/లీ
సమతాస్థితి వద్ద [PCl3] = 0.4 మోల్/లీ
సమతాస్థితి వద్ద[PCl5] = 0.6 మోల్/లీ

ప్రశ్న 2.
2NO2(వా) ![]() N2O4(వా) అనే సమీకరణం (వా) అనుసరించి నైట్రోజన్ డై ఆక్సైడు, డై నైట్రోజన్ టెట్రాక్సైడును ఏర్పరుస్తుంది. 0.1 mole NO, ను 1 లీటరు ఘనపరిమాణం గల ప్లాస్కు 25°C కలిపినప్పుడు గాఢత మార్పు చెంది సమతాస్థితి వద్ద [NO2] = 0.016M, [N2O4] = 0.042M గాను ఉన్నాయి. (a) ఏ చర్యా జరగక ముందు చర్య భాగఫలం Q విలువ ఎంత?
N2O4(వా) అనే సమీకరణం (వా) అనుసరించి నైట్రోజన్ డై ఆక్సైడు, డై నైట్రోజన్ టెట్రాక్సైడును ఏర్పరుస్తుంది. 0.1 mole NO, ను 1 లీటరు ఘనపరిమాణం గల ప్లాస్కు 25°C కలిపినప్పుడు గాఢత మార్పు చెంది సమతాస్థితి వద్ద [NO2] = 0.016M, [N2O4] = 0.042M గాను ఉన్నాయి. (a) ఏ చర్యా జరగక ముందు చర్య భాగఫలం Q విలువ ఎంత?
(b) చర్య సమతాస్థితి స్థిరాంకం విలువ ఎంత?
సాధన:
ఇవ్వబడిన సమీకరణం
2NO2(వా) ![]() N2O4(వా)
N2O4(వా)
a) చర్య జరగక ముందు ఏ చర్యలో అయినా చర్య భాగఫలం విలువ = 0

ప్రశ్న 3.
725K వద్ద N2(వా) + 3H2(వా) ![]() 2NH3(వా) చర్యా సమతాస్థితి స్థిరాంకం విలువ 6.0 × 10-2. సమతాస్థితి వద్ద [H2] = 0.25 mol L-1, [NO3]= 0.06 mol L-1. N2 సమతాస్థితి గాఢతను లెక్కించండి.
2NH3(వా) చర్యా సమతాస్థితి స్థిరాంకం విలువ 6.0 × 10-2. సమతాస్థితి వద్ద [H2] = 0.25 mol L-1, [NO3]= 0.06 mol L-1. N2 సమతాస్థితి గాఢతను లెక్కించండి.
సాధన:

ప్రశ్న 4.
![]()
చర్యకు Kc విలువ నిర్దిష్ట ఉష్ణోగ్రత వద్ద 16. ఒక లీటరు పాత్రలో ఆరంభంలో నాలుగు వాయువులను ఒక్కొక్క మోల్ పరిమాణంలో తీసుకొన్నాం. NO, NO2ల సమతాస్థితి గాఢతలు ఏమిటి?
సాధన:


ప్రశ్న 5.
నిర్దిష్ట ప్రయోగ పరిస్థితులలో PCl5(వా), PCl3(వా), Cl2(వా)గా విఘటనం చెందే చర్య సమతాస్థితి స్థిరాంకం విలువ 0.0211 mol L-1. PCl5 ఆరంభ గాఢత 1.00 M అయితే సమతాస్థితి వద్ద PCl5, PCl3, Cl2ల సమతాస్థితి గాఢతలను లెక్కించండి.
సాధన:

![]()
ప్రశ్న 6.
A + B ![]() 3C చర్యకు సంబంధించి, 25°C వద్ద 3 లీటర్ల పాత్రలో A, B, C లు వరసగా 1, 2, 4 మోల్లలో ఉన్నాయి. కింది పరిస్థితులలో చర్య జరిగే దిశను ఊహించండి.
3C చర్యకు సంబంధించి, 25°C వద్ద 3 లీటర్ల పాత్రలో A, B, C లు వరసగా 1, 2, 4 మోల్లలో ఉన్నాయి. కింది పరిస్థితులలో చర్య జరిగే దిశను ఊహించండి.
(a) చర్యకు Kc విలువ 10
(b) చర్యకు Kc విలువ 15
(c) చర్యకు Kc విలువ 10.66
సాధన:
ఇవ్వబడిన సమీకరణం

a) ఇవ్వబడినది Kc = 10
Kc < Qc
∴ తిరోగామి చర్య జరుగును.
b) ఇవ్వబడినది Kc = 15
Kc > Qc
∴ పురోగామి చర్య జరుగును.
c) ఇవ్వబడినది Kc = 10.66
Q = Kc
∴ సమతాస్థితిని సూచిస్తుంది.
ప్రశ్న 7.
5.0 × 10-3 mol L-1, 4.0 × 10-3 mol L-1, 2.0 × 10-3 mol L-1 గాఢతలో వరసగా గల H2, N2, NH3 మిశ్రమాన్ని తయారుచేసి, 500K ఉష్ణోగ్రతకు వేడిచేస్తారు. 3H2(వా) + N2(వా) → 2NH3 చర్యకు ఈ ఉష్ణోగ్రత వద్ద సమతాస్థితి స్థిరాంకం 60. ఈ గాఢత వద్ద అమ్మోనియా ఏర్పడుతుందా? లేదా? ఏర్పడిన అమ్మోనియా విఘటనం చెందుతుందా? ఊహించండి.
సాధన:
ఇవ్వబడిన సమీకరణం
![]()

∴ తిరోగామి చర్య జరుగును. NH3 విఘటనం జరుగును.
ప్రశ్న 8.
![]()
500K వద్ద Kp విలువ 2.5 × 1010 అదే ఉష్ణోగ్రత వద్ద కింది చర్యలకు Kp విలువలను లెక్కించండి.
సాధన:


ప్రశ్న 9.
![]()
Kc విలువ 4.63 × 10-3
(a) ఇదే ఉష్ణోగ్రత వద్ద Kc విలువ ఎంత?
(b)25°C వద్ద ఉండే సమతాస్థితిలో N2O4(వా) పాక్షిక పీడనం 0.2 atm. NO2(వా) సమతాస్థితి పీడనం లెక్కించండి.
సాధన:
a) ఇవ్వబడిన సమీకరణం NGO ( 2NO ()
kC = 4.63 × 10-3
kp = kC(RT)∆n
= 4.63 × 10-3 × 0.0821 × 298 [∆n = 1]
= 113.27 × 10-3
= 0.1132
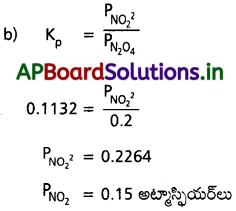
ప్రశ్న 10.
![]()
ద్విగత చర్యకు Kp విలువ 0.65 Kcను లెక్కించండి.
సాధన:
![]()

ప్రశ్న 11.
![]()
కు 400K వద్ద Kc విలువ 0.5 అయిన Kp విలువ ఎంత?
సాధన:
![]()
KC = 0.5
T = 400 K
kP = kC (RT)∆n
kP = 0.5 × (0.0821 × 400)-2 ∆n = − 2
kP = 0.5 × (8.21 × 4)-2
= 0.5 × (32.84)-2
\(\frac{0.5}{1078.46}\) = 4.63 × 10-4
ప్రశ్న 12.
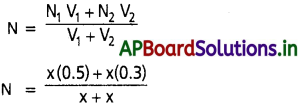
A + B ![]() C + D సమతాస్థితి చర్యలో ఆరంభంలో 1 మోల్ A ను, 1 మోల్ B ను 5 లీటర్ల ప్లాస్కులో తీసుకొన్నాం. సమతాస్థితి వద్ద 0.5 మోల్ C ఏర్పడింది. ఇదే చర్యను 2 మోల్ల ల A, 1 మోల్ B తో 5 లీటర్ల ఫ్లాస్క్ లో అదే ఉష్ణోగ్రత వద్ద జరిపించినట్లైతే చర్యలో ప్రతిజాతి మోలార్ గాఢతలను లెక్కించండి.
C + D సమతాస్థితి చర్యలో ఆరంభంలో 1 మోల్ A ను, 1 మోల్ B ను 5 లీటర్ల ప్లాస్కులో తీసుకొన్నాం. సమతాస్థితి వద్ద 0.5 మోల్ C ఏర్పడింది. ఇదే చర్యను 2 మోల్ల ల A, 1 మోల్ B తో 5 లీటర్ల ఫ్లాస్క్ లో అదే ఉష్ణోగ్రత వద్ద జరిపించినట్లైతే చర్యలో ప్రతిజాతి మోలార్ గాఢతలను లెక్కించండి.
సాధన:
ఇవ్వబడిన సమీకరణం

ప్రశ్న 13.
![]()
మోల్లు 0.6 మోల్ CI, తీసుకొన్నాం. K విలువ 0.2 అయితే చర్య ఏ దిశలో జరుగుతుంది. ఊహించండి.
సాధన:
ఇవ్వబడిన సమీకరణం
∴ పురోగామి దిశగా చర్య జరుగును.
![]()
ప్రశ్న 14.
A + B ![]() C + D సమతాస్థితిలో, T ఉష్ణోగ్రత వద్ద A,B లను ఒక పాత్రలో తీసుకొన్నారు. A ఆరంభ గాఢత, B ఆరంభ గాఢతకు రెండు రెట్లు సమతాస్థితిని చేరుకొన్న తరువాత ‘C’ గాఢత B గాఢతకు మూడురెట్లు kP విలువను లెక్కించండి.
C + D సమతాస్థితిలో, T ఉష్ణోగ్రత వద్ద A,B లను ఒక పాత్రలో తీసుకొన్నారు. A ఆరంభ గాఢత, B ఆరంభ గాఢతకు రెండు రెట్లు సమతాస్థితిని చేరుకొన్న తరువాత ‘C’ గాఢత B గాఢతకు మూడురెట్లు kP విలువను లెక్కించండి.
సాధన:
A + B ![]() C + D
C + D
A ఆరంభ గాఢత, B ఆరంభ గాఢతకు రెండురెట్లు సమతాస్థితిని చేరుకొన్న తరువాత ‘C గాఢత B గాఢతకు మూడురెట్లు అని ఇవ్వబడినది.

ప్రశ్న 15.
![]()
విలువ 100గ్రా. ఉండే ఉష్ణోగ్రత వద్ద SO2, SO3, O2 వాయువులను 10 లీటర్ల ఫ్లాస్క్ లో తీసుకొన్నారు. సమతాస్థితి వద్ద
(a) SO3, SO2 వాయువుల మోల్ల సంఖ్య ప్లాస్కులో సమానంగా ఉన్నాయి. O2 మోల్ల సంఖ్య ఎంత?
(b) ఫ్లాస్క్ SO3 మోల్ల సంఖ్య, SO2 మోల్ల సంఖ్యకు రెట్టింపు అయితే, O2 ఎన్ని మోల్లు ఉంది?
సాధన:
a) ఇవ్వబడిన సమీకరణం


∴ O2 యొక్క మోల్ల సంఖ్య 0.4
ప్రశ్న 16.
ఒక ఉష్ణోగ్రత వద్ద A + B ![]() C సమతాస్థితి చర్యలో A, B ల సమతాస్థితి గాఢతలు 15 మోల్ L-1గా ఉన్నాయి. ఘనపరిమాణాన్ని రెండు రెట్లు గావించినపుడు A సమతాస్థితి గాఢత 10 మోల్ L-1గా కింది వాటిని లెక్కించండి. (a) Kc (b) మూల సమతాస్థితిలో C గాఢత
C సమతాస్థితి చర్యలో A, B ల సమతాస్థితి గాఢతలు 15 మోల్ L-1గా ఉన్నాయి. ఘనపరిమాణాన్ని రెండు రెట్లు గావించినపుడు A సమతాస్థితి గాఢత 10 మోల్ L-1గా కింది వాటిని లెక్కించండి. (a) Kc (b) మూల సమతాస్థితిలో C గాఢత
సాధన:
ఇవ్వబడిన సమీకరణం

ప్రశ్న 17.
100K వద్ద ఒక పాత్రలో CO2 వాయువు 0.5 atm పీడనం వద్ద ఉంది. గ్రాఫైటును కలిపినప్పుడు CO2 లో కొంత భాగం Coగా మారింది. సమతాస్థితి వద్ద పీడనం 0.8 atm అయితే k విలువ లెక్కించండి.
సాధన:

ప్రశ్న 18.
![]()
చర్యకు Kpవిలువ 49. H2, I2, ల ఆరంభ గాఢతలు వరసగా 0.5 atm అయితే సమతా స్థితి వద్ద ప్రతీ వాయువు పాక్షిక పీడనాన్ని లెక్కించండి.
సాధన:
ఇవ్వబడిన సమీకరణం
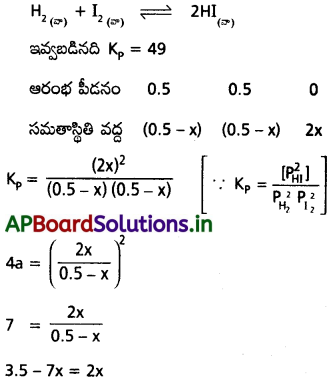
9x = 3.5
x = \(\frac{3.5}{9}\) = 0.38888
∴ PHI = 2 × 0.3888 8
= 0.778 atm
PH2 = 0.5 – 0.388
= 0.111 atm
PI2 = 0.5 – 0.388
= 0.111 atm
ప్రశ్న 19.
448°C వద్ద 10 లీటర్ల ఫ్లాస్లో 0.5 మోల్ H2, 0.5 మోల్ I2 చర్య జరిపాయి. H2(వా) + I2(వా) ![]() 2HI(వా) చర్యకు సమతాస్థితి స్థిరాంకం Kc విలువ 50.
2HI(వా) చర్యకు సమతాస్థితి స్థిరాంకం Kc విలువ 50.
(a) Kp విలువ ఎంత?
(b) సమతాస్థితి వద్ద I2 మోల్ల సంఖ్య ఎంత?
సాధన:
ఇవ్వబడిన సమీకరణం

ప్రశ్న 20.
సమతాస్థితి వద్ద 0.1 మోల్ Cl2 రాబట్టాలి అంటే 250°C వద్ద ఒక లీటరు పాత్రలో ఎంత తీసుకోవాలి?
![]()
చర్యకు Kc 0.414 M
సాధన:
ఇవ్వబడిన సమీకరణం

ప్రశ్న 21.
![]()
చర్యకు Kp విలువ 1.64 × 10-4
(a) Kcను లెక్కించండి.
(b) Kc విలువ ఉపయోగించి ∆G° విలువ లెక్కించండి.
సాధన:
ఇవ్వబడిన సమీకరణం
![]()
a) Kp = Kc (RT)∆n
∆n = 2 – 4 = – 2
1.64 × 10-4 = Kc (0.0821 × 673)-2
Kc = 1.64 × (55.2533)² × 10-4
Kc = 0.5006
b) ∆G° = -2.303 RT log K
= -2.303 × 0.0821 × 673 × log 0.5005
= 3874 జౌల్
ప్రశ్న 22.
కింది ద్రావణాల pH విలువను లెక్కించండి.
(a) 10-3 M HCl
(b) 10-3 MH2HO4
(c) 10-6 MHNO3
(d) 0.02 MH2HO4
సాధన:
a) 10-3 M HCl
pH = – log (H+) = – log 10-3 = 3
b) 10-3MH2HO4
c) 10-6 MHNO3
pH = -log [H+]
= – log 10-6
= – 6 log 10
= 6
d) 0.02MH2HO4
pH = – log10 (H+)
[H+] = 0.02 × 2= 0.04N
pH = -log 0.04
= -log 4 × 10-2
= – log4 – log 10-2
= 2 – log4
= 1.3010
ప్రశ్న 23.
క్రింది ద్రావణాల pH విలువలు లెక్కించండి.
(a) 0.001M NaOH
(b) 0.01 M Ca (OH)2
(c) 0.0008M Ba(OH)2
(d) 0.004 M NaOH
సాధన:
a) 0.001M NaOH
рOH = – log [OH]
рOH = – log (0.001)
= – log 10-3
= 3
pH = 14 – pOH = 14 – 3 = 11
b) 0.01 M Ca(OH)2
рOH = -log [OH–]
[OH–] = 0.01 × 2 = 0.02 N
∴ pOH = -log 0.02
pOH = – log 2 × 10-2
pOH = – log2 + 2log 10
= 2 – 0.3010 = 1.699
∴ pH = 14 – 1.699
= 12.301
c) 0.0008M Ba(OH)2
pOH = – log [OH–]
[OH–] = 0.0008 × 2 = 0.0016N
∴ pOH = – log 0.0016
= – log × 10-4
= – log 16 × 4 log 10
= – log24 + 4
= – 4 log 2 + 4 = 2.796
pH + pOH = 14
pH = 14 – 2.796
= 11.204
d) 0.004M NaOH
pOH = – log[OH–]
= -log 0.004
= – log 4 × 10-3
= 3 – log2²
= 3 – 0.6020
= 2.398
pH = 14 – pOH
= 14 – 2.398
= 11.602
ప్రశ్న 24.
ఒక ద్రావణం pH 3.6. దీని H3O+ అయాన్ గాఢత లెక్కించండి.
సాధన:
pH = – log [H+]
log [H+] = -3.6 (or) 4.4000
[H+] = anti log of 4.4 = 2.512 × 10-4.
ప్రశ్న 25.
ఒక ద్రావణం pH విలువలు గల ద్రావణాలలో OH– గాఢత ఎంత?
సాధన:
pH = 8.6
∴ pОН = 14
– PH = 14 – 8.6
= 5.4
∴ POH = – log [OH–]
log [OH–] = -5.4 (or) 6.6000
[OH–] anti log of 6.6000
= 3.981 × 10-6 మోల్స్ / లీ
![]()
ప్రశ్న 26.
కింది pH విలువలు గల ద్రావణాలలో [H+] గాఢత ఎంత?
a) pH = 3
b) pH = 4.75
c) pH = 4.4
సాధన:
a) pH 3
∴ pH = – log [H+]
log [H+] = -3
∴ [H+] = 10-3 M
b) pH = 4.75
pH = log [H+]
log [H+] = -4.75 (or) 5.2500
[H+] = anti log of 5. 2500
= 1.77 × 10-5 M
c) pH = 4.4
pH = – log [H+]
log [H+] = -4.4 (or) 5.6
[H+] = anti log of 5.6
= 2.512 × 10-6 M
ప్రశ్న 27.
0.005 MH,SO ద్రావణాన్ని 100 రెట్లు విలీనం చేసినప్పుడు విలీన ద్రావణం pH లెక్కించండి.
సాధన:
0.005 M H2SO4
[H+] = 0.005 × 2
= 0.01
100 రెట్ల విలీనం చేయబడినది.
[H+] = \(\frac{0.01}{100}\) = 0.0001
pH = -log [H+]
= – log 0.0001
= – log 10-4 = 4
ప్రశ్న 28.
HCl ద్రావణం pH = 3. ఈ ద్రావణం 1 ml ను లీటరుకు విలీనం చేస్తే ఫలిత ద్రావణం pH విలువ ఎంత?
సాధన:
HCl ద్రావణం యొక్క – pH = 3.
∴ [H+] = 10-3 M
ఒక లీటరు ద్రావణానికి విలీనం చేయబడినది

ప్రశ్న 29.
10-8M HCl pH విలువ ఎంత?
సాధన:
ఇవ్వబడిన ఆమ్ల ద్రావణం అతిగా విలీనం చేయబడినది.
కావున నీటి నుండి ఆమ్లం నుండి (రెండింటి నుండి)
H+ గాఢత లెక్కలోనికి తీసుకొనవలెను.
[H+] = 1.1 × 10-7 or 1.1 × 10-7 M
∴ pH = – log 1.1 × 10-7
= 7 – log 1.1
= 7 – 0.0414
= 6.995
ప్రశ్న 30.
కింది క్షార ద్రావణాలు pH విలువలను లెక్కించండి.
a) [OH–]=0.05M
b) [OH –] = 2 × 10-4
సాధన:
a) [OH–] = 0.05 M
pОН = – log (0.05)
= – log 5 × 10-2
= – log 5 + 2 log 10
= 2 – log 5
= 1.3010
pH = 14 – pOH
= 14 – 1.3010
= 12.699
b) [OH–] = 2 × 10-4
pOH = – log 2 × 10-4
= – log 2 + log 10
= 4 – log 2
= 4 – 0.3010 = 3.699
pH = 14 – 3.699 = 10.301
ప్రశ్న 31.
నీటిలో 2 గ్రా. NaOH ను కరిగించి ద్రావణాన్ని 1 లీటరుకు విలీనంచేస్తే, ద్రావణం pH విలువ ఎంత?
సాధన:

= 0.05 N = [OH–]
∴ pOH =- log 0.05
= – log 5 × 10-2
= 2 – log 5
= 1.3010
pH = 14 – pOH
= 13 – 1.3010
= 12.699
ప్రశ్న 32.
క్రింది ద్రావణాల pH విలువలు లెక్కించండి.
a) 500 ml ద్రావణంలో 0.37 g Ca(OH)2 కరిగి ఉంది.
b) 200 ml ద్రావణంలో 0.3 g NaOH కరిగి ఉంది.
c) 0.1825% HCl జల ద్రావణం.
d) ఒక లీటరు ద్రావణానికి 1 ml 13.6 M HCl విలీనం చేసి ఏర్పరచిన ద్రావణం
సాధన:
a) 0.37 గ్రా. Ca(OH)2 in 500 మి.లీ ద్రావణం ఇవ్వడినది
N = \(\frac{w t}{G \times w} \times \frac{1}{1}\)
N = \(\frac{0.37}{37} \times \frac{1000}{500}\)
= 0.01 × 2
= 0.02 = pOH
pOH = – log 0.02
= 1.699
pH = 14 – pOH = 12.301
b) 0.3 గ్రా. NaOH in 200 మి.లీ ద్రావణం ఇవ్వబడినది.

pOH = -log [OH–]
= -log0.375
= 1.426
pH = 14 – pOH
= 14 – 1.426
= 12.574
c) 0.1825% HCZ ద్రావణం అనగా 100 మి.లీ ద్రావణంలో 0.1825 గ్రా. HCl కలదు.

d) ∴ [H+] = 13.6
ఒక లీటరు ద్రావణానికి నీటితో విలీనం చేయవలెను.

ప్రశ్న 33.
10 pH e 100 mL NaOH ఎన్ని గ్రాములు NaOH కరిగి ఉంది?
సాధన:
ఇవ్వబడినది
pH = 10
pОН = 14 – 10 = 4
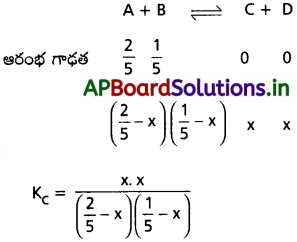
∴ నార్మాలిటీ = 10-4 N

∴ wt = 4 × 10-4 గ్రాములు
![]()
ప్రశ్న 34.
ఒక ఉష్ణోగ్రత వద్ద నీటి Kw విలువ 9.55 × 10-14 గా ఉంది. ఈ ఉష్ణోగ్రత వద్ద నీటి pH విలువ ఎంత?
సాధన:
Kw = [H+] [OH–]
Ew = 9.55 × 10-14 మోల్² లీ²
[H+] [OH–] = 9.55 × 10-14 మోల్² లీ²
∴ [H+] = \(\sqrt{9.55 \times 10^{-14}}\)
= 3.09 × 1-7
= – log[H+]
– log [3.09 × 10-7]
= – [log 3.09 + log 10-7]
= – [0.49 – 7]
pH = 7 – 0.49 = 6.51
ప్రశ్న 35.
10-8M NaOH pH విలువ లెక్కించండి?
సాధన:
ఇవ్వబడిన క్షార ద్రావణం అతిగా విలీనం చేయబడినది కావున OH– గాఢతను నీటి నుండి క్షారం నుండి లెక్కలోనికి తీసుకొనవలెను.
∴ [OH+] = 1.1 × 10-7
= 1.1 × 10-7
pОН = – log 1.1 × 10-7
pОН = 6.995
∴ pH = 14 – 6.996
= 7.005
ప్రశ్న 36.
150 mL 0.5 M HCl, 100 mL of 0.2 M HCl ద్రావణాలను కలిపి మిశ్రమం చేశారు. ఫలిత ద్రావణం pH ను లెక్కించండి.
సాధన:

ప్రశ్న 37.
100 mL 0.1 M HCl, 40 mL 0.2 M H2SO4 కలిపి మిశ్రమ ద్రావణం చేశారు. దీని pH విలువ లెక్కించండి.
సాధన:

ప్రశ్న 38.
100 ml pH = 4 ద్రావణం 100 mL pH = 6 ద్రావణం కలిపిన మిశ్రమ ద్రావణం pH ఎంత?
సాధన:

ప్రశ్న 39.
0.5 M NaOH ద్రావణాన్ని, 0.3 M KOH ద్రావణాన్ని సమ ఘనపరిమాణాలలో కలిపారు. ఫలిత ద్రావణం pOH. pH విలువలను లెక్కించండి.
సాధన:
(ఘనపరిమాణం సమానం కావున V1 = V2 = x)
= \(\frac{0.8}{2}\)
= 0.4
= [OH–]
pОН = – log [OH–]
= -log (0.4)
= 0.3979
pH = 14 – 0.3979
= 13.6021.
ప్రశ్న 40.
60 mL M HCl ద్రావణాన్ని, 40 mL 1M NaOH ద్రావణాన్ని కలిపారు. ఫలిత ద్రావణం pH విలువ ఎంత?
సాధన:
ప్రశ్న 41.
100 ml 0.1 M HCl, 9.9 ml 1.0M NaOH గల ద్రావణం pH విలువ మిశ్రమం లెక్కించండి.
సాధన:

ప్రశ్న 42.
200 mL pH = 2 గల HCl ద్రావణాన్ని, 300 mL pH = 12 గల NaOH జల ద్రావణాన్ని కలిపినప్పుడు ఏర్పడిన మిశ్రమ ద్రావణం pH ఎంత?
సాధన:
VA = 200 ml,
VB = 300 ml
NA = 10-2
NB = 10-2
[∵ pH = 2] [∵ pOH = 2]
∴ VB NB > VA NA
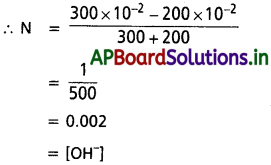
pOH = – log [OH–]
= – log [0.002]
= -log 2 × 10-3
= -log 2 + 3 log 10
= 3 – log 2
= 2.699
∴ pH = 14 – pОН
= 14 – 2.699
= 11.3010
![]()
ప్రశ్న 43.
0.2 M HCl ద్రావణం, 50 ml, OJM KOH ద్రావణం 30 mL కలిపి తయారుచేసిన మిశ్రమ ద్రావణం pH విలువ ఎంత?
సాధన:
VA = 50 మి. లీ
VB = 30 మి. లీ
NA = 0.2 N
NB = 0.1 K M
VANA > VB NB

ప్రశ్న 44.
40 ml 0.2 M HNO3, 60 ml 0.3 M NaOH ద్రావణంతో చర్య జరిపి మిశ్రమ ద్రావణాన్ని ఏర్పరచింది. ఫలిత ద్రావణం pH విలువ ఎంత?
సాధన:
VB NB > VANA

pОН = – log [OH–]
= -log 0.1
= 1
pH = 14 – pOH
= 14 – 1 = 13
ప్రశ్న 45.
100 mL 0.2 M HNO 3 ద్రావణానికి, 50ml 0.1 M H2SO4 ద్రావణం కలపబడింది. మిశ్రమ ద్రావణాన్ని 300 లకు mL విలీనం చేశారు. ఫలిత ద్రావణం pH విలువ ఎంత?
సాధన:

ప్రశ్న 46.
pKw 13.725g Kw విలువ ఎంత?
సాధన:
pKw = 13.725
pKw = – log Kw
Kw = antilog of 13.725
= 1.884 × 10-14
ప్రశ్న 47.
80° C వద్ద నీటి అయానిక లబ్దం విలువ 2.44 × 10-13. 80° C వద్ద హైడ్రోనియం అయాన్, హైడ్రాక్సైడ్ అయాన్ల గాఢతలు శుద్ధ నీటిలో ఎంత?
సాధన:
Kw = [H+] [OH–]
Kw = 2.44 × 10-13
[H+] = [OH–]
∴ [H+] = Kw
[H+] = \(\sqrt{2.44 \times 10^{-13}}\)
= 4.94 × 10-7మోల్/లీ
∴ [OH–] = 4.94 × 10-7మోల్/లీ
ప్రశ్న 48.
40°C వద్ద నీటి అయనీకరణ స్థిరాంకం విలువ 2.9 × 10-14. 40° C వద్ద శుద్ధ నీటికి [H3O+], [OH] pH, pOHలను లెక్కించండి.
సాధన:
23. Kw = [H-1] [OH–]
2.9 × 10-14 = [H+] [OH–]
[H+] = [OH–]
∴ [H+]² = 2.9 × 10-14
[H+] = 1.7 × 10-14 = [H3O+]
∴ [OH–] = 1.7 × 10-7
pH = – log [H+]
= -log [1.7 × 10-7]
= 7 – log 1.7 = 6.7689
рOH = -log [OH–]
= – log [1.7 × 10-7]
= 7 – log1.7
= 6.7689
ప్రశ్న 49.
కింది వాటి pH విలువలు లెక్కించండి.
a) 0.002 M ఎసిటిక్ ఆమ్ల ద్రావణం విఘటన శాతం 2.3%
b) 0.002 M NH OH ద్రావణం విఘటన శాతం 2.3%.
సాధన:
a) [H+] = Cα
= 0.002 × 2.3
= 0.0046
pH = – log [H+]
= -log 0.0046
= 4.3372
b) [OH–] = cα
= 0.002 x 2.3
= 0.0046
pОН = – log [OH]
= – log 0.0046
= 4.3372
pH = 14 – pOH
= 14 – 4.3372
= 9.6628
![]()
ప్రశ్న 50.
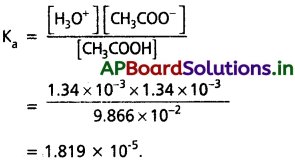
కింది ఇచ్చిన సమతాస్థితి గాఢతల ఆధారంగా ఎసిటిక్ ఆమ్లం Ka ను లెక్కించండి.
[H3O+] = [CH3COO–] = 1.34 × 10-3M, [CH3COOH] = 9.866 × 10-2M
= [CH3COO ̄] = 1.34 × 103M
సాధన:
[H3O+] = [CH3COO–] = 1.34 × 10-3M
[CH3COOH] = 9.866 × 10-2M
ప్రశ్న 51.
Ka విలువ 1.8 × 10-5 గల ఎసిటిక్ 0.1 M ఆమ్లం pH విలువ లెక్కించండి.
సాధన:
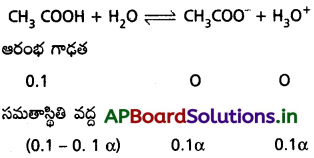
ka = C.α²
1.8 × 10-5 = 0.1 × α²
1.8 × 10-5 = α²
α = 8.4 × 10-4
[H3O+] = 0.1 × 10-4 × 8.4
pH = -log[H3O+]
= -log[8.4 × 10-5]
= 2.9
ప్రశ్న 52.
0.1 M గాఢత గల ఒక మోనో ప్రోటిక్ ఆమ్లం pH విలువ 4.0 [H+], Ka లను లెక్కించండి.
సాధన:
pH = 4.0 W ఇవ్వబడినది.
∴ [H+]= ?
pH = – log[H+]
∴ [H+] = 10-pH
= 10-4
∴ [H+] = C × α

ప్రశ్న 53.
0.02 M ఎసిటిక్ ఆమ్లం K విలువ 1.8 × 10-5 అయిన కింది వాటిని లెక్కించండి.
a) [H3O+]
b) అయనీకరణం %
c) pH
సాధన:
(a), (b)

α² = 9 × 10-4
α = 3 × 10-2
∴ α = 3%
[H3O+] = C × α
= 0.02 × 3 × 10-4
6 × 10-4 [H3O+]
= – log(6 × 10-4)
= 3.24
ప్రశ్న 54.
298 K వద్ద CH3COOH Ka విలువ 1.8 × 10-5 అయిన 0.01 M ఎసిటిక్ ఆమ్ల ద్రావణం pH విలువ ఎంత?
సాధన:

α = 4.1 × 10-2
∴ [H3O+] = 0.01 × 4.1 × 10-2
= 4.1 × 10-4
pH = – log [H3O+]
= – log(4.1 × 10-4)
= 3.38
ప్రశ్న 55.
ఒక కర్బన పదార్థ ఆమ్లం 0.1 M ద్రావణం pH విలువ 4.0 ఆమ్లం విఘటన స్థిరాంకం విలువ లెక్కించండి.
సాధన:
pH = 4.0
∴ [H+] = ?
pH = – log[H+]
∴ [H+] = 10-pH
= 10-4
∴ [H+] = C × α
α = \(\frac{10^{-4}}{0.1}\)
= 10-3
Ka = C × α²
= 0.1 × (10-3)²
= 0.1 × 10-6
= 10-6.
ప్రశ్న 56.
298 K వద్ద HF, H COON, HCN ల అయనీకరణ స్థిరాంకాల విలువలు వరసగా 6.8 × 10-4, 1.8 × 10-4, 4.8 × 10-9 వాటి కాంజుగేటు క్షారాల అయనీకరణ స్థిరాంకాల విలువలను లెక్కించండి.
సాధన:
ఈ లెక్క తప్పుగా ఇవ్వడమైనది.
ప్రశ్న 57.
బలహీన క్షారమైన ట్రైమిథైల్ ఏమీన్ 0.25 M ద్రావణంలో హైడ్రాక్సిల్ అయాన్ గాఢత లెక్కించండి.
(CH3)3N + H2O (CH3)3N+H + OH;
Kb = 7.4 × 10-5.
సాధన:
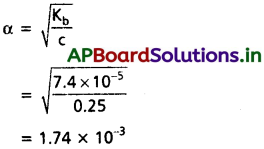
[OH–] = c × α
= 0.25 × 1.74 × 10-3
= 4.32 × 10-3 M
ప్రశ్న 58.
ఒక మోల్ క్షారిత ఆమ్ల 0.005 M ద్రావణం pH = 5. దీని అయనీకరణ అవధి ఎంత?
సాధన:
pH = 5
∴ [H+] = 10-5
గాఢత (C) = 0.005 M
= 5 × 10-3 M
[H+] = Cα

ప్రశ్న 59.
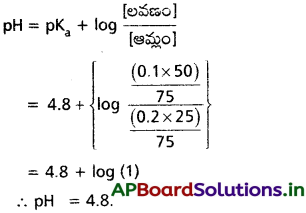
50 mL 0.1 M NH4OH, 25 ml 2M NH4Cl లను కలిపి బఫర్ ద్రావణం తయారుచేశారు. దీని pH ఎంత? pKa = 4.8.
సాధన:

ప్రశ్న 60.
50 ml 0.2M ఎసిటిక్ ఆమ్లం ద్రావణం, 25 mL సోడియం ఎసిటేట్ కలిపి తయారు చేసిన బఫర్ ద్రావణం pH 4.8 దీని pKa విలువ 4.8 CH3 COONa ద్రావణం గాఢత ఎంత?
సాధన:
ఆమ్ల బఫర్ ద్రావణం ఇవ్వబడినది
బఫర్ యొక్క pH ఈ క్రింది సమీకరణంతో లెక్కించెదము.

i.e., CH3COONa యొక్క గాఢత = 0.4 M
ప్రశ్న 61.
mL 0.1M సోడియం ఎసిటేట్ను 25mL 0.1 M సోడియం ఎసిటేట్ను 25 mL 0.2 M ఎసిటిక్ ఆమ్లాన్ని కలిపి బఫర్ ద్రావణం చేశారు. CH3, COOH, p Ka విలువ 4.8, బఫర్ ద్రావణం pH విలువ ఎంత?
సాధన:
ఆమ్ల బఫర్ ద్రావణం ఇవ్వబడినది కావున
ప్రశ్న 62.
20 ml 0.1M NH4OH ద్రావణాన్ని 20ml 1M NH4 C ద్రావణానికి కలిపారు. బఫర్ ద్రావణం pH = 8.2. NH4OH, pKa ఎంత?
సాధన:
pH = 14.0 – pOH మరియు pOH

ప్రశ్న 63.
1 లీటరు బఫర్ ద్రావణంలో 0.1 మోల్ ఎసిటిక్ ఆమ్లం, 1 మోల్ సోడియం ఎసిటేట్ ఉన్నాయి. CH3COOH, pKa విలువ 4.8. అయిన బఫర్ ద్రావణం pH ఎంత?
సాధన:
ఆమ్ల బఫర్కు
pH = pka + log
pH = 4.8 + log \(\frac{1}{0.1}\)
= 4.8 + log 10
pH = 4.8 + 1
⇒ pH = 5.8
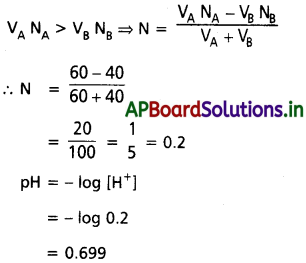
ప్రశ్న 64.
40 ml 1M CH3 COOH ద్రావణం, 50 ml 0.5 M NaOH ద్రావణం కలిపి తయారుచేసిన మిశ్రమ ద్రావణం pH విలువ ‘X’ ఎసిటిక్ ఆమ్లం pka అయితే ‘X’ విలువ ఎంత?
సాధన:
CH3COOH, NaOH తో చర్య జరిపి ఏర్పరచును
CH3COOH + NaOH → CH3COONa + H2O
CH3 COOH యొక్క మిల్లీ మోల సంఖ్య
50 × 1 = 50
NaOH యొక్క మిల్లీ మోల సంఖ్య 50 × 0.5 = 25 చర్య జరపకుండా మిగిలిన CH3 COOH మిల్లీ మోల్స్ సంఖ్య = 50 – 25 = 25

![]()
ప్రశ్న 65.
AgCI ద్రావణీయతా mol</L2 దీని ద్రావణీయత ఎంత ?
సాధన:

ప్రశ్న 66.
Zr (OH)2 యొక్క ద్రావణీయతా లబ్దం విలువ 4.5 × 10-17 mol³L-3 దీని ద్రావణీయత ఎంత?
సాధన:

ప్రశ్న 67.
Ag2 CrO4 ద్రావణీయత 1.3 × 10-4 మోల్ L-1. దీని ద్రావణీయతా లబ్దం విలువ ఎంత?
సాధన:
![]()
KSP = 4S² × S = 4S³
∴ KSP = 4 × S³
= 4 × (1.3 × 10-4)³
KSP = 9 × 10-12
ప్రశ్న 68.
A2B = 2 × 10-3 mol L-1. దీని ద్రావణీయతా లబ్ధం విలువ ఎంత?
సాధన:

ప్రశ్న 69.
AB = 10:10 mol’ L’. దీని ద్రావణీయత ఎంత?
సాధన:
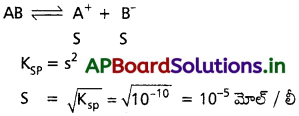
ప్రశ్న 70.
PQ, RS్కలు అల్ప ద్రావణీయతా లవణాలు. వీటి ద్రావణీయతా లబ్దం విలువలు సమానం. ప్రతీ దాని విలువ 4.0 × 10-18 ఏ లవణం వీటిలో అధిక ద్రావణీయత కలిగి ఉంది ?
సాధన:
PQ మరియు RS2 లవణాల Ksp = 4 × 10-18

∴ RS2 ల లవణం ఎక్కువ ద్రావణీయత కలిగి ఉండును
ప్రశ్న 71.
0.1 M ఎసిటిక్ ఆమ్ల ద్రావణంలో ఆమ్లం 1.34% అయనీకరణం చెందింది. అయిన [H+], [CH3COO–] [CH3 COOH] లను లెక్కించండి. ఎసిటిక్ ఆమ్లం Ka విలువ లెక్కించండి.
సాధన:
1.34 % అయనీకరణం చెందిన 0.1 M [CH3COOH] ఇవ్వబడినది.
[H+] = C × α
= 0.1 × 1.34 × 10-2
= 1.34 × 10-3
∴ [CH3COOH] =1.34 × 10-3 M
[H+] = Cα
= 1.34 × 10-3]
α = \(\frac{1.34 \times 10^{-3}}{0.1}\)
= 1.34 × 10-2
[CH3COO] (1 – α) = 0.1 (1 – 0.0134)
= 0.09866M
K = α² × C
= (1.34 × 10-2) × 0.1
= 1.79 × 10-5
సాధించిన సమస్యలు (Solved Problems)
ప్రశ్న 1.
500K వద్ద సమతాస్థితి ఉన్న N2, H2 ద్వారా NH3 ను ఏర్పరిచే చర్యకు కింద సూచించిన గాఢతలున్నాయి.
[N2] = 1.5 × 10-2. [H2] = 3.0 × 10-2 M, [NH3] = 1.2 × 10-2 M. దీని సమతాస్థితి స్థిరాంకాన్ని లెక్కించండి.
సాధన:

ప్రశ్న 2.
800K వద్ద సీలు చేసిన పాత్రలో సమతాస్థితి వద్ద గాఢతలు కింది విధంగా ఉన్నాయి.
![]()
N2 = 3.0 × 10-3M O2 = 4.2 × 10-3 M, NO = 2.8 × 10-3M. కింది చర్యకు Kc విలువ ఎంత?
సాధన:
చర్యకు సమతాస్థితి స్థిరాంకాన్ని కింది విధంగా రాయవచ్చు.

ప్రశ్న 3.
500K వద్ద PCl5, PCl2 సమతాస్థితిలో ఉన్నాయి. వీటి గాఢతలు వరుసగా 1.59M PCl3,1.59 M Cl2, 1.41 M PCl3 చర్య.
![]()
Kc ను లెక్కించండి.
సాధన:
పై చర్యకు సమతాస్థితి స్థిరాంకం Kcను కింది విధంగా రాస్తాం.
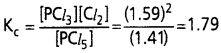
ప్రశ్న 4.
![]()
800K వద్ద Kc = 4.24. 800K వద్ద CO2, H2, CO, H2Oలకు సమతాస్థితి గాఢతలను లెక్కించండి. ఆరంభంలో CO, H2O లు మాత్రమే 0.10 M గాఢతలలో ఉన్నాయి.
సాధన:
× సమతాస్థితి వద్ద CO2, H2ల పరిమాణాన్ని సూచిస్తుంది.
కాబట్టి సమతాస్థితి స్థిరాంకాన్ని కింది విధంగా రాయవచ్చు :
Kc = x²/(0.1-x)² = 4.24
x² = 4.24(0.01 + x² – 0.2x)
x² = 0.0424 + 4.24x² – 0.848x
3.24x² – 0.848x + 0.0424 = 0
a = 3.24, b = -0.848, c = 0.0424
(వర్గ సమీకరణం ax² + bx + c = 0కు, xవిలువ కింది సమీకరణం సూచిస్తుంది
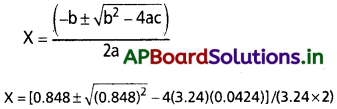
x = (0.848±0.4118)/6.48
x1 = (0.848 -0.4118)/6.48 = 0.067
x2 = (0.848 +0.4118)/6.48 0.194
0.194 విలువను మనం విస్మరించాలి. ఎందుకంటే ఈ విలువ క్రియాజనకం ఆరంభ గాఢత విలువ కంటే అధికంగా ఉంది. ఇది అసాధ్యం.
కాబట్టి సమతాస్థితి గాఢతలు
[CO2] = [H2] = x = 0.067 M
[CO] = [H2O] = 0.1 – 0.067
= 0.033M
ప్రశ్న 5.
![]()
సమతా స్థితి చర్యకు, సమతాస్థితి స్థిరాంకం Kc విలువ 1069 K వద్ద 3.75 × 10-6 అయిన ఈ ఉష్ణోగ్రత వద్ద ఈ చర్యకు Kp విలువ లెక్కించండి.
సాధన:
Kp = Kc(RT)∆n
అని మనకు తెలుసు,
∆n = (2 + 1) -2 = 1
Kp = 3.75 × 10-6 (0.0831 × 1069)
Kp = 0.033
ప్రశ్న 6.
![]()
చర్యకు, Kp విలువ 1000K వద్ద 3.0. ఆరంభంలో πXO2 = 0.48 బార్, πXO = 0 బార్, శుద్ధ గ్రాఫైటు ఉన్నట్లైతే సమతాస్థితి CO, CO2ల పాక్షిక పీడనాలను లెక్కించండి.
సాధన:
ఈ చర్యకు CO2 పీడనంలో మార్పు ‘x’ అనుకొందాం.

(x విలువ రుణ విలువ కావడానికి వీలులేదు. కాబట్టి రుణ విలువలో ఉండే రెండో విలువ విస్మరించడం జరిగింది)
x = 2.66/8 = 0.33
సమతాస్థితి పీడనాలు కింది విధంగా ఉన్నాయి.
PCO = 2x
= 2 × 0.33 = 0.66 బార్
PCO2 = 0.48 – x
= 0.48 – 0.33 = 0.15 బార్
ప్రశ్న 7.
2A ![]() B + C చర్యకు Kc విలువ is 2 × 10-3 ఒక నిర్దేశిత కాలం వద్ద చర్యా మిశ్రమంలో [A] = [B] = [C] = 3 × 10-4 M. ఏ దిశలో చర్య పురోగమిస్తుంది?
B + C చర్యకు Kc విలువ is 2 × 10-3 ఒక నిర్దేశిత కాలం వద్ద చర్యా మిశ్రమంలో [A] = [B] = [C] = 3 × 10-4 M. ఏ దిశలో చర్య పురోగమిస్తుంది?
సాధన:
చర్యకు భాగఫలం Qc విలువను కింది సమీకరణం తెలుపుతుంది.
Qc = [B] [C] / [A]²
కాని [A] [B] ] [C] = 3 × 10-4 M కాబట్టి
Qc = (3 × 10-4) (3 × 10-4)/ (3 × 10-4)² = 1
అంటే Qc > Kc కాబట్టి చర్య తిరోగామి దిశగా ప్రయాణిస్తుంది.
ప్రశ్న 8.
400K వద్ద 1L ఘనపరిమాణం గల చర్యా పాత్రలో 13.8 g N2O4 ను ఉంచి కింది సమతాస్థితిని చేరుకొనేటట్లు చేయబడింది.
![]()
సమతాస్థితి వద్ద మొత్తం పీడనం 9.15 బార్లు. Kc, Kp, లను సమతాస్థితి వద్ద పాక్షిక పీడనాలను లెక్కించండి.
సాధన:
nRT అని మనకు తెలుసు.
మొత్తం ఘనపరిమాణం (V) = 1L
N2O4 మోలార్ ద్రవ్యరాశి = 92 g
వాయువు మోల్ల సంఖ్య (n)
= 13.8 g/ 92 g mol-1
= 0.15 వాయు స్థిరాంకం (R) mol-1 K-1 ఉష్ణోగ్రత (T) = 400K
pV = nRT
= 0.083 bar L
p × 1L = 0.15 × 0.083 bar L mol-1 K-1 × 400 K
p = 4.98 bar

9.15 = (4.98 – x) + 2x
9.15 = 4.98 + x
x = 9.15 – 4.98 = 4.17 bar
సమతాస్థితి వద్ద పాక్షిక పీడనాలు
PN2O4 = 4.98 – 4.17 = 0.81 bar
PNO2 = 2x = 4.17 = 8.34 bar
Kc = (PNO2)²/PN2O4
= (8.34)²/0.81 = 85.87
Kp = Kc(RT)∆n
= 85.87 = Kc (0.083 × 400)¹
Kc = 2.586 = 2.6
![]()
ప్రశ్న 9.
1L ఘన పరిమాణం గల మూసిన చర్యా పాత్రలో 3.00 మోల్ల PCl5 ను 380K వద్ద ఉంచి, అది సమతాస్థితిని చేరుకొనేటట్లు చేయబడింది. సమతాస్థితి వద్ద చర్యా మిశ్రమం సంఘటనాన్ని లెక్కించండి Kc = 1.80.
సాధన:

ప్రశ్న 10.
గ్లైకోలిసిస్ చర్యలో గ్లూకోజ్ ఫాస్ఫారిలేషన్ చర్యకు ∆GᎾ విలువ 13.8 kJ mol-1. 298 K వద్ద దీని Kc విలువ ఎంత?
సాధన:
∆GᎾ = 13.8 kJ mol-1
= 13.8 × 10³ J mol-1
∆GᎾ = Kc = -RT lnKc
కాబట్టి lnKc = -13.8 × 10³ J mol-1 / (8.314 Jmol-1 K-1 × 298 K)
lnKc = -5.569
Kc = e-5.569
Kc = 3.81 × 10-3
ప్రశ్న 11.
సుక్రోజ్ జలవిశ్లేషణాన్ని కింది సమీకరణం సూచిస్తుంది.
సుక్రోజు + H2O ![]() గ్లూకోజు + ఫ్రక్టోజు చర్యకు సమతాస్థితి స్థిరాంకం Kc విలువ 300K వద్ద 2 × 1013, 300K వద్ద ∆GᎾ విలువ ఎంత?
గ్లూకోజు + ఫ్రక్టోజు చర్యకు సమతాస్థితి స్థిరాంకం Kc విలువ 300K వద్ద 2 × 1013, 300K వద్ద ∆GᎾ విలువ ఎంత?
సాధన:
∆GᎾ = -RT lnKc
∆GᎾ = (-814 J mol-1 K-1)300K × In (2 × 1013)
∆GᎾ = -7.64 × 104 J mol-1
ప్రశ్న 12.
బ్రాన్డెడ్ ఆమ్లాలు : HF, H2SO4, HCO–3లకు కాంజుగేటు క్షారాలను రాయండి.
సాధన:
కాంజుగేటు క్షారాలు ఒక ప్రోటాను తక్కువగా కలిగి ఉండాలి. కాబట్టి ఈ ఆమ్లాల కాంజుగేటు క్షారాలు వరుసగా F–, HSO–4, CO2-3 లు.
ప్రశ్న 13.
బ్రానెడ్ క్షారాలు : NH–2, NH3, HCOO–లకు కాంజుగేటు ఆమ్లాలను రాయండి.
సాధన:
కాంజుగేటు ఆమ్లంలో ఒక ప్రోటాన్ అధికంగా ఉండాలి.
కాబట్టి కాంజుగేటు ఆమ్లాలు వరుసగా :
NH3, NH+4, HCOOH లు
ప్రశ్న 14.
H2O, HCO–3, HSO–4, NH3 జాతులు, బ్రాన్డ్ ఆమ్లాలుగాను, క్షారాలుగాను ప్రవర్తిస్తాయి. కాబట్టి ప్రతీదానికి అనురూపక కాంజుగేటు ఆమ్లాన్ని, కాంజుగేటు క్షారాన్ని ఇవ్వండి.
సాధన:
క్రింది పట్టికలో జవాబు చూడండి.
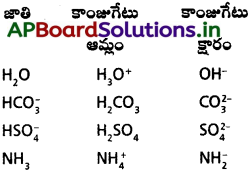
ప్రశ్న 15.
కింది వాటిని లూయీ ఆమ్లాలు, క్షారాలుగా వర్గీకరించి అవి ఆ విధంగా ఎందుకు ప్రవర్తిస్తాయి
అనే దానిని తెలపండి.
(a) HO– (b) F– (c)H+ (d) BCl3
సాధన:
(a) హైడ్రాక్సిల్ అయాన్. తాను ఒక ఎలక్ట్రాన్ జంటను దానం చేయగలగడం చేత లూయీ క్షారంగా పనిచేస్తుంది.
(b) F-దానిపై ఉండే నాలుగు ఒంటరి ఎలక్ట్రాన్ జంటలలో ఒకదానిని దానంచేసి లూయీ క్షారంగా ప్రవర్తిస్తుంది.
(C) హైడ్రాక్సిల్ అయాన్, ఫ్లోరైడ్ అయాన్ వంటి క్షారాలు నుంచి, ఒక ఒంటరి ఎలక్ట్రాన్ జంటను స్వీకరించ గలిగి ఉండటం కారణంగా, ప్రోటాన్ ఒక లూయీ ఆమ్లంగా పనిచేస్తుంది.
(d) అమ్మోనియా, లేదా ఏమీన్ అణువులు నుంచి ఒక జంట ఒంటరి ఎలక్ట్రాన్లను BCl3 స్వీకరించి లూయీ ఆమ్లంగా పనిచేస్తుంది.
ప్రశ్న 16.
ఒక మృదు పానీయం నమూనా ద్రావణంలో హైడ్రోజన్ అయాన్ గాఢత 3.8 × 10-3M. pH విలువ ఎంత?
సాధన:
pH = – log [3.8 × 10-3]
= – {[log [3.8] + log [10-3]}
= -{(0.58) + (-3.0)}
= -[-2.42] = 2.42
కాబట్టి మృదు పానీయం pH విలువ 2.42. దీనిని అనుసరించి ఇది ఆమ్ల గుణం కలిగి ఉంది అని తెలుస్తుంది.
ప్రశ్న 17.
1.0 × 10-8 M. గాఢత గల HCl ద్రావణం pH విలువ లెక్కించండి.
సాధన:
![]()
Kw = [OH–][H3O+]
= 10-14
నీటిలో x = [OH–] = [H3O+] అనుకొందాం.
H3O+ అయాన్ల గాఢత (i) ద్రావణం స్థితిలో ఉండే
HCl అయనీకరణం ప్రక్రియ మీద అంటే
![]()
(ii) H2O అయనీకరణం ప్రక్రియ మీద ఆధారపడి ఉంటుంది. అతి విలీన ద్రావణాలలో H3O+కు సంబంధించిన రెండు ఉత్పత్తి స్థానాలను పరిగణనలోకి తీసుకోవాలి.
[H3O+] = 10-8 + x
Kw = (10-8 + x) (x) = 10-14
or x² + 10-8 x – 10-14 = 0
[OH–] = x = 9.5 × 10-8
pOH = 7.02, pH = 6.98
![]()
ప్రశ్న 18.
HF అయనీకరణ స్థిరాంకం విలువ 3.2 × 10-4. దీని 0.02 M ద్రావణంలో HF అయనీకరణ అవధిని లెక్కించండి. ఈ ద్రావణం లోని అన్ని రసాయన జాతుల (H3O+, F–, HF) గాఢతలను ద్రావణం ను లెక్కించండి.
సాధన:
కింది ప్రోటాన్ బదిలీ చర్యలు జరిగే అవకాశం ఉంది.
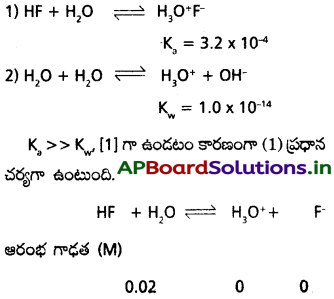

ప్రధాన చర్య సమతాస్థితి సమీకరణంలో పై సమతాస్థితి గాఢతలను ప్రతిక్షేపిస్తే
Ka = (0.02α²) / (0.02 – 0.02α)
= 0.02α²) / (1 – α) = 3.2 × 10-4
కింది వర్గ సమీకరణం లభిస్తుంది
α² + 1.6 × 10-2 α – 1.6 × 10-2 = 0
‘α’ గల వర్గ సమీకరణాన్ని ‘α’ కోసం సాధిస్తే, రెండు వర్గ మూలాలు (విలువలు) వస్తాయి. ఇవి
α = + 0.12, – 0.12
ఋణ విలువను ఆమోదించలేం. (ఎందుకంటే అయనీకరణం విలువ ఋణ విలువగా ఉండటానికి వీలులేదు) కాబట్టి
α = 0.12
దీని అర్థం α = + 0.12. మిగిలిన జాతుల అంటే HF, F–, H3O+ ల సమతాస్థితి గాఢతలు కింది విధంగా ఉంటాయి :
[H3O+] = [F–] = cα = 0.02 × 0.12
= 2.4 × 10-3 M
[HF] = c(1 – α) = 0.02 (1 – 0.12)
= 17.6 × 10-3 M
pH = – log [H+]
= -log(2.4 × 10-3 = 2.62
ప్రశ్న 19.
0.1 M మోనోక్షారిత ఆమ్లం pH విలువ 4.50. H+, A–, HA జాతుల గాఢతలను సమతాస్థితి వద్ద లెక్కించండి. మోనోక్షారిత ఆమ్లం Ka, pKa విలువలను కూడా నిర్ణయించండి.
సాధన:
pH = – log [H+]
కాబట్టి, [H+] = 10-pH = 10-4.50
= 3.16 × 10-5
[H+] = [A–] = 3.16 × 10-5
Ka = [H+][A–] / [HA]
[HA]సమతాస్థితి = 0.1 (3.16 × 10-5) = 0.1
Ka = (3.16 × 10-5)²/0.1 = 1.0 × 10-8
pKa = – log (10-8) = 8
ఇంకొక విధంగా, బలహీన ఆమ్లం బలాన్ని “వియోజన శాతం”గా ఉపయోగకరమైన పద్ధతిలో కొలుస్తారు. వియోజన శాతాన్ని కింది విధంగా రాస్తారు.
[HA]వియోజనం x × 100/[HA]ఆరంభ
ప్రశ్న 20.
0.08 M హైడ్రోక్లోరిక్ ఆమ్లం HOCl ద్రావణం pH ను లెక్కించండి. ఆమ్లం అయనీకరణ స్థిరాంకం విలువ 2.5 × 10-5. HOCl యొక్క వియోజన శాతాన్ని నిర్ణయించండి.
సాధన:
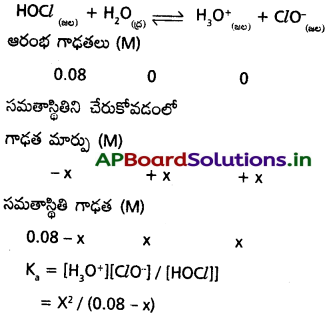
x << 0.08 (అంటే 0.08 కంటే చాలా తక్కువ), కాబట్టి
0.08 – x = 0.08
X² / 0.08 = 2.5 × 10-5
X² = 2.0 × 10-6,
x = 1.41 × 10-3
[H+] = 1.41 × 10-3 M.
కాబట్టి వియోజన శాతం
= [HOCl]వియోజనం/ [HOCI]ఆరంభ × 100
= 1.41 × 100/[HA]
“ఆరంభం
= 1.41 × 10-3/0.08
= 1.76 %.
pH = – log(1.41 × 10-3)
= 2.85.
ప్రశ్న 21.
0.004 M హైడ్రోజన్ ద్రావణం pH విలువ 9.7. దాని అయనీకరణ స్థిరాంకం Kb నుpKb ను లెక్కించండి.
సాధన:
![]()
pH విలువ నుంచి హైడ్రోజీన్ అయాన్ గాఢతను లెక్కించవచ్చు. హైడ్రోజన్ అయాన్ గాఢత, నీటి అయానిక్ లబ్దం విలువ తెలిసినట్లయితే హైడ్రాక్సిల్ అయాన్ గాఢతను లెక్కించవచ్చు. కాబట్టి
[H+] = ప్రతిసంవర్గం (−pH)
= ప్రతి సంవర్గం(-9.7) = 1.67 × 10-10
[OH–] = Kw/ [H+] = 1 × 10-14 / 1.67 × 10-10
= 5.98 × 10-5
హైడ్రాజీనీయమ్ అయాన్ గాఢత కూడా, హైడ్రాక్సిల్ అయాన్ గాఢతకు సమానంగా ఉంటుంది. ఈ రెండింటికి గాఢతలు కూడా స్వల్ప పరిమాణంలోనే ఉన్నాయి. కాబట్టి వియోజనం చెందని క్షారం గాఢత 0.004M కు సమానంగా తీసుకోవచ్చు. కాబట్టి
Kb = [NH2NH3+][OH–] / [NH2NH2]
(5.98 × 10-5)² / 0.004 8.96 × 10-7
pKb = – logKb = log(8.96 × 10-7) = 6.04.
ప్రశ్న 22.
0.2M NH4Cl 0.1M NH3 గల ద్రావణం pH విలువను లెక్కించండి. అమ్మోనియా pKb విలువ 4.75
సాధన:

సమతాస్థితి వద్ద గాఢతలు (M)
0.10 – x 0.20 + x x
Kb = [NH+4][OH–] / [NH3]
= (0.20 + x) (x) / (0.1 – x) = 1.77 × 10-5
Kb స్వల్ప పరిమాణం కలిగి ఉంది. కాబట్టి 0.1M, 0.2Mతో ‘x’ విలువను సరిపోల్చితే దీనిని విస్మరించవచ్చు.
కాబట్టి, [OH–] = x = 0.88 × 10-5
కాబట్టి, [H+] = 1.12 × 10-9
pH = -log[H+] = 8.95
ప్రశ్న 23.
0.05M అమ్మోనియా ద్రావణం అయనీకరణం అవధిని pH విలువను లెక్కించండి. అమ్మోనియా అయనీకరణ స్థిరాంకం విలువను పట్టిక 7.7 నుంచి గ్రహించండి. అమ్మోనియా కాంజుగేటు ఆమ్లం అయనీకరణ స్థిరాంకం విలువను కూడా లెక్కించండి.
సాధన:
నీటిలో అమ్మోనియా అయనీకరణాన్ని కింది సమీకరణం ద్వారా వ్యక్తం చేయవచ్చు.
NH3 + H2O ![]() H+4 + OH
H+4 + OH
సమీకరణం (7.33)ను హైడ్రాక్సిల్ అయాన్ గాఢతను లెక్కించడానికి ఉపయోగిస్తాం,
[OH–] = c α = 0.05 α
Kb = 0.05 α²x / (1 – α)
α విలువ అతిస్వల్పం, సమీకరణంలో కుడివైపున ఉండే సమాసంలో హారంలో ఉండే (1 – α) లో ‘1’తో ‘α’ ను సరిపోల్చి, ‘α’ విలువను విస్మరించవచ్చు.
కాబట్టి,

కాంజుగేటు ఆమ్ల – క్షార జంటకు ఈ సమీకరణాన్ని ఉపయోగిస్తే
Ka × Kb = Kw అవుతుంది
పట్టిక 7.7 నుంచి NH3 Kb విలువను గ్రహించి, కాంజుగేటు ఆమ్లం NH+4 గాఢతను మనం లెక్కించవచ్చు.
Ka = Kw/Kb = 10-14/ 1.77 × 10-5
= 5.64 × 10-10
ప్రశ్న 24.
0.10M అమ్మోనియా ద్రావణం pH విలువను లెక్కించండి. 50.0 mL పరిమాణం గల ఈ ద్రావణం 25.0 mL పరిమాణం గల 0.10M HCl తో చర్య జరిపినప్పుడు ఏర్పడిన ఫలిత ద్రావణం pH లెక్కించండి. అమ్మోనియా విఘటన స్థిరాంకం విలువ kb = 1.77 × 10-5
సాధన:
![]()
Kb = [NH+4][OH–]/NH3 = 1.77 × 10-5
తటస్థీకరణ చర్యకు ముందుగా
[NH+4][OH–] = x
[NH3] = 0.10 − x = 0.10
x² / 0.10 = 1.77 × 10-5
x = 1.33 × 10-3 = [OH–]
కాబట్టి [H+] = Kw/ [OH–] = 10-14
= (1.33 × 10-3) = 7.51 × 10-12
pH = – log (7.5 × 10-12) = 11.12
50mL, 0.1M అమ్మోనియా ద్రావణానికి (5 మి.మోల్ల NH3 గలది), 25mL, 0.01M HCL ద్రావణం (2.5 మోల్ల HCl గలది) కలిపితే 2.5 మి.మోల్ల అమ్మోనియా తటస్థీకరణం చెందుతుంది. ఈ రెండు ద్రావణాలను కలపగా ఏర్పడిన 75mL ద్రావణంలో మిగిలిన ఉండిన 2.5 మి.మోల్ల అమ్మోనియా తటస్థీకరణం చెందక మిగిలి ఉంటుంది. అంతేకాక 2.5 మి.మోల్ల NH+4 కూడా ఉంటుంది.

ఫలితంగా ఏర్పడిన 75ml ద్రావణంలో 2.5 మి.మోల్లు NH+4 అయాన్లు (అంటే 0.033M), 2.5 మి.మోల్ (అంటే 0.033) తటస్థీకరణం చెందని NH3 అణువులు ఉంటాయి. (NH3 + H2O → NH4OH) కింది సమతాస్థితిలో ఉంటుంది.
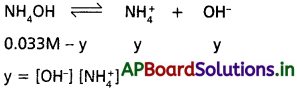
చివరి 75mL ద్రావణం తటస్థీకరణం చర్య తరువాత అప్పటికే 2.5 మి.మోల్లు. NH+4 అయాన్లను (అంటే 0.033M) కలిగి ఉంది.
కాబట్టి NH+4 అయాన్ల మొత్తం గాఢత
[NH+4] = 0.033 + y
y చాలా స్వల్పం. కాబట్టి [NH4OH] = 0.033 M
[NH+4] = 0.033M.
Kb = [NH+4][OH–] / [NH4OH]
= y(0.033) / (0.033) = 1.77 × 10-5 M
అని మనకు తెలుసు.
కాబట్టి, y =1.77 × 10-5 = [OH–]
[H+] = 10-14/ 1.77 × 10-5
= 0.56 × 10-9
కాబట్టి, pH = 9.24
![]()
ప్రశ్న 25.
ఎసిటిక్ ఆమ్లం pKa అమ్మోనియా హైడ్రాక్సైడ్ pKa విలువ వరుసగా 4.76, 4.75. అమ్మోనియం ఎసిటేట్ జలద్రావణం pH కనుక్కోండి.
సాధన:

ప్రశ్న 26.
శుద్ధ నీటిలో A2X3 ద్రావణీయతను లెక్కించండి. దీనిలో ఏర్పడిన ఏ అయాన్ నీటితో చర్య జరపదు అని ఊహించండి. A2X3 ద్రావణీయతా
విలువ Ksp = 1.1 × 10-23.
సాధన:
A2X3 ![]() 2A3+ + 3X2-
2A3+ + 3X2-
Ksp= [A3+]²[X2-]³ = 1.1 × 10-23
S = A2X3 ద్రావణీయత అయితే
[A3+] = 2S; [X2-]= 3S
Ksp = (2S)² (3S)³ = 108S5
= 1.1 × 10-23
S5 = 1 × 10-25
S = 1.0 × 10-5 mol L-1
ప్రశ్న 27.
Ni(OH)2 AgCN లవణాలు ద్రావణీయతా లబ్దం విలువలు వరసగా 2.0 × 10-15, 6 × 10-17 ఏ లవణం అధిక ద్రావణీయత కలిగి ఉంది? వివరించండి.
సాధన:
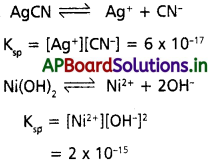
[Ag+] = S1, అయితే [CN–] = S1
[Ni2+] = S2, అయితే [OHF] = 2S2
S²1 = 6 × 10-17, S1 7.8 × 10-9
= (S2)(2S2)² = 2 × 10-15, S1 = 0.58 × 10-4
Ni(OH)2, AgCN కంటే అధిక ద్రావణీయత కలిగి ఉంది.
ప్రశ్న 28.
0.10 M NaOH ద్రావణంలో Ni(OH)2 మోలార్ ద్రావణీయతను లెక్కించండి. Ni(OH)2 ద్రావణీయతా లబ్దం విలువ 2.0 × 10-15.
సాధన:
Ni(OH)2 ద్రావణీయతను ‘5’ అనుకొందాం. S mol/L Ni(OH)2 ను నీటిలో కరిగిస్తే, S mol/L Ni2+ 2S mol/ L, OH– అయాన్లు ఏర్పడతాయి. అయితే ద్రావణంలో OH– అయాన్ల మొత్తం గాఢత (0.10 + 2S) mol/L కు సమానంగా ఉంటుంది. ఎందుకంటే ద్రావణంలో ఇదివరకే 0.10 mol/L OH– అయాన్లు NaOH ద్వారా చేరి ఉన్నాయి.
Ksp = 2.0 × 10-15 = [Ni2+][OH–]²
= (S)(0.10 + 2S)²
Ksp అల్ప విలువ గలది కాబట్టి
2S << 0.10 0.10
(0.10 +2S) ≈ 0.10
కాబట్టి,
2.0 × 10-15 = S (0.10)²
S = 2.0 × 10-13M = [Ni2+]