Andhra Pradesh BIEAP AP Inter 2nd Year Chemistry Study Material 2nd Lesson ద్రావణాలు Textbook Questions and Answers.
AP Inter 2nd Year Chemistry Study Material 2nd Lesson ద్రావణాలు
అతిస్వల్ప సమాధాన ప్రశ్నలు
ప్రశ్న 1.
ద్రావణాన్ని నిర్వచించండి.
జవాబు:
రెండు లేదా అంతకంటే ఎక్కువ అనుఘటకాల సజాతీయ మిశ్రమాన్ని ద్రావణం అంటారు. దీని సంఘటనం కొన్ని పరిధిలలో మారుతూ ఉండును.
ప్రశ్న 2.
మోలారిటీని నిర్వచించండి. [TS. Mar.’17]
జవాబు:
మోలారిటీ :
ఒక లీటరు ద్రావణంలో కరిగి ఉన్న ద్రావిత మోల్ల సంఖ్యను మోలారిటీ అంటారు.

ప్రమాణాలు : మోల్స్ / లీటర్.
ప్రశ్న 3.
మోలిలిటీని నిర్వచించండి. [AP. Mar.’15]
జవాబు:
మోలాలిటీ :
ఒక కిలోగ్రామ్ ద్రావణిలో ఉన్న ద్రావిత మోల్ల సంఖ్యను మోలాలిటీ అంటారు.
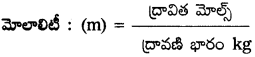
ప్రమాణాలు : మోల్స్ / kg
ప్రశ్న 4.
ఘన ద్రావితం గల ఘనపదార్థ ద్రావణానికి ఉదాహరణ ఇవ్వండి.
జవాబు:
ఘన ద్రావితం గల ఘనపదార్థ ద్రావణానికి ఉదాహరణ గోల్డ్లో కరిగిన కాపర్.
ప్రశ్న 5.
మోల్ భాగాన్ని నిర్వచించండి.
జవాబు:
మోల్ భాగం :
ఒక ద్విగుణాత్మక ద్రావణంలోని ఒక అనుఘటకం (ద్రావితం/ ద్రావణి) మోల్ల సంఖ్యకు, ద్రావణంలోని మొత్తం అనుఘటకాల మోత్ల సంఖ్యకు గల నిష్పత్తినే ఆ అనుఘటక మోల్ భాగం అంటారు.
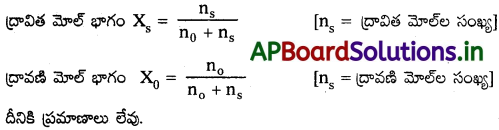
![]()
ప్రశ్న 6.
ద్రావణం ద్రవ్యరాశి శాతాన్ని నిర్వచించండి.
జవాబు:
ద్రావణం ద్రవ్యరాశి శాతాన్ని ఈ క్రింది విధంగా నిర్వచించవచ్చు.
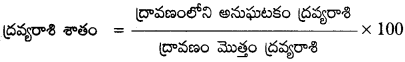
ప్రశ్న 7.
ద్రావణం ppm అంటే ఏమిటి?
జవాబు:
ద్రావితం లేశమాత్ర పరిమాణంలో ఉన్నపుడు గాఢతను ppm లలో చూపుట అనువుగా ఉంటుంది.
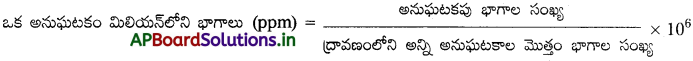
ప్రశ్న 8.
ఆల్కహాల్, నీటి ద్రావణంలో అణువుల అన్యోన్య చర్యలు ఏ పాత్ర పోషిస్తాయి?
జవాబు:
ఆల్కహాల్, నీటి ద్రావణంలో అణువుల మధ్య హైడ్రోజన్ బంధాలు కలిగి ఉంటాయి. ఈ అనుఘటకాలను కలిపినపుడు కొత్త హైడ్రోజన్ బంధాలు ఆల్కహాల్ మరియు నీటి అణువుల మధ్య ఏర్పడతాయి. ఇలా ఏర్పడిన బంధాలు బలహీనమైనవి. ఆకర్షణ బలాల తగ్గుదల వల్ల ఈ ద్రావణం రౌల్ట్ నియమం నుండి ధనాత్మక విచలనాన్ని చూపుతుంది. దీనివలన ద్రావణ బాష్పపీడనం పెరిగి బాష్పీభవనస్థానం తగ్గును.
ప్రశ్న 9.
రౌల్ నియమాన్ని వ్రాయండి. [AP & TS. Mar.’17]
జవాబు:
ఎ) రౌల్ట్ నియమం (బాష్పశీల ద్రావితం) :
బాష్పశీల ద్రవాల ద్రావణంలోని ప్రతి అనుఘటక పాక్షిక బాష్పపీడనం, అనుఘటకం మోల్ భాగానికి అనులోమానుపాతంలో ఉంటుంది.
బి) రౌల్ట్ నియమం (అబాష్పశీల ద్రావితం) :
అబాష్పశీల ద్రావితం కలిగియున్న విలీన ద్రావణంలోని సాపేక్ష బాష్పపీడన నిమ్నత, ద్రావిత మోల్భాగానికి సమానమౌతుంది.
ప్రశ్న 10.
హెన్రీ నియమాన్ని రాయండి.
జవాబు:
హెన్రీ నియమం :
స్థిర ఉష్ణోగ్రత వద్ద ద్రవంలో వాయువు ద్రావణీయత, ద్రవం లేదా ద్రావణం ఉపరితలంపై ఉన్న వాయువు పాక్షిక పీడనానికి అనులోమానుపాతంలో ఉంటుంది.
(లేదా)
బాష్పస్థితిలోని వాయువు పాక్షిక పీడనం (P) ద్రావణంలోని వాయువు మోల్భాగానికి (X) అనులోమానుపాతంలో ఉంటుంది.
P = KH × x ∵ KH = హెన్రీ నియమ స్థిరాంకం
ప్రశ్న 11.
ఎబులియోస్కోపిక్ స్థిరాంకం అంటే ఏమిటి?
జవాబు:
ఎబులియోస్కోపిక్ స్థిరాంకం :
అబాష్పశీల ద్రావితం కలిగియున్న ఒక మోలాల్ ద్రావణంలో పరిశీలించబడిన బాష్పీభవన స్థాన నిమ్నతను ఎబులియోస్కోపిక్ స్థిరాంకం (లేదా) మోలాల్ ఉన్నతి స్థిరాంకం అంటారు.
![]()
ప్రశ్న 12.
క్రయోస్కోపిక్ స్థిరాంకం అంటే ఏమిటి?
జవాబు:
క్రయోస్కోపిక్ స్థిరాంకం :
అబాష్పశీల ద్రావితం కలిగి ఉన్న ఒక మోలాల్ ద్రావణంలో పరిశీలించబడిన ఘనీభవన స్థాన నిమ్నతను క్రయోస్కోపిక్ స్థిరాంకం (లేదా) మోలాల్ నిమ్నత స్థిరాంకం అంటారు.
ప్రశ్న 13.
ద్రవాభిసరణ పీడనాన్ని నిర్వచించండి. [AP. Mar.’17]
జవాబు:
ద్రవాభిసరణ పీడనం :
ద్రావణి, ద్రావణం అర్ధ ప్రవేశ్యక పొరతో వేరుపరచినపుడు ద్రావణి ద్రావణంలోకి ప్రవేశించకుండా నివారించుటకు ఉపయోగించు పీడనాన్ని ద్రవాభిసరణ పీడనం అంటారు.
ప్రశ్న 14.
ఐసోటోనిక్ ద్రావణాలు అంటే ఏమిటి? [AP & TS. Mar.’17; AP. Mar.’15]
జవాబు:
ఐసోటోనిక్ ద్రావణాలు :
“ఒక స్థిర ఉష్ణోగ్రత వద్ద ఉన్న ద్రావణాలలో ద్రవాభిసరణ పీడనం సమానంగా ఉన్నట్లయితే వాటిని “ఐసోటోనిక్ ద్రావణాలు” అంటారు.
ఉదా : సెలైన్ [0.9% (\(\frac{W}{V}\)) NaCl ద్రావణం] తో రక్తం ఐసోటోనిక్ గా ఉండును.
ప్రశ్న 15.
క్రింది ఇచ్చిన పదార్థాలలో ఏవి నీటిలో కరగవు, పాక్షికంగా కరుగుతాయో, అత్యధికంగా కరుగుతాయో గుర్తించండి.
i) ఫినాల్ ii) టోలిన్ iii) ఫార్మిక్ ఆమ్లం iv) ఇథిలీన్ గ్లైకాల్ ) క్లోరోఫారమ్ vi) పెంటనోల్
జవాబు:
i) ఫినాల్ నీటిలో పాక్షికంగా కరుగును.
ii) టోలిన్ నీటిలో కరగదు.
iii) ఫార్మిక్ ఆమ్లం నీటిలో అధికంగా కరుగును.
iv) ఇథిలీన్ గ్లైకాల్ నీటిలో అధికంగా కరుగును.
v) క్లోరోఫారమ్ నీటిలో కరగదు.
vi) పెంటనోల్ నీటిలో పాక్షికంగా కరుగును.
ప్రశ్న 16.
6.5 gm ల C9H8O4 ను 450g లCH3CNలో కరిగించారు, ఎసిటోనైట్రైల్లో (CH3CN), ఆస్పిరిన్ (C9H8O4) ద్రవ్యరాశి శాతాన్ని లెక్కించండి.
జవాబు:
ఇవ్వబడినవి
ఆస్పిరిన్ భారం = 6.5గ్రా.
ఎసిటోనైట్రైల్ భారం = 450 గ్రా.
ద్రావణ భారం = 6.5 + 450 = 456.5గ్రా.
భారశాతం (లేదా) ద్రవ్యరాశి శాతం = \(\frac{6.5}{456.5}\) × 100 = 1.424%.
ప్రశ్న 17.
మిథనోల్లో 250 ml ల 0.15 M ద్రావణాన్ని తయారుచేయడానికి కావలసిన బెంజోయిక్ ఆమ్లం (C6H5COOH) ద్రవ్యరాశిని లెక్కించండి.
జవాబు:
ఇవ్వబడినది
మోలారిటీ = 0.15 M
ఘనపరిమాణం (V) = 250 ml
బెంజోయిక్ ఆమ్ల అణుభారం (C6H5COOH) = 122
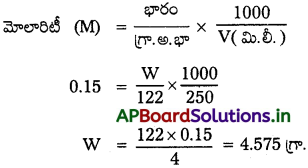
ప్రశ్న 18.
ఒకే పరిమాణం గల ఎసిటిక్ ఆమ్లం, డైక్లోరో ఎసిటిక్ ఆమ్లం, ట్రైక్లోరో ఎసిటిక్ ఆమ్లాల జలద్రావణంలో పరిశీలించిన నీటి ఘనీభవన స్థాన నిమ్నతలు పైన చూపించిన క్రమంలోనే పెరుగుతాయి. క్లుప్తంగా వివరించండి.
జవాబు:
ఇవ్వబడిన ఆమ్లాలు CH3COOH, CHCl2COOH మరియు CCl3 COOH.
- నీటిలో ఘనీభవన స్థాన నిమ్నత జల ద్రావణంలోని కణాల సంఖ్యపై ఆధారపడును.
- ఇవ్వబడిన ఆమ్లాలు వాటి ఆమ్ల స్వభావం పెరిగే క్రమంలో ఈ క్రింద ఇవ్వబడ్డాయి.
CH3COOH < CHCl2COOH < CCl3COOH
మూడు (CI) పరమాణువులు ఉండుట వలన CCI,COOH అధిక ఆమ్ల స్వభావం కలిగియుండును. CHCl2COOH తరువాత CH3COOH.
ఘనీభవన స్థాన నిమ్నత క్రమం
CH3COOH < CHCl2COOH < CCl3COOH
ప్రశ్న 19.
వాంట్ హాఫ్ గుణకం (i) అంటే ఏమిటి? దీనికి ద్విగుణాత్మక విద్యుద్విశ్లేష్య పదార్థం (1 : 1) ‘α’ కు ఏ విధమైన సంబంధం ఉన్నది?
జవాబు:
వాంట్ఫ్ అంశం (i) :
“ప్రయోగం ద్వారా నిర్ణయించిన కణాధార ధర్మం విలువ మరియు లెక్కించిన కణాధార ధర్మం విలువల యొక్క నిష్పత్తిని వాంటాఫ్ అంశం (i) అంటారు.”
ద్రావిత వియోజనం లేదా అయనీకరణ ప్రక్రియ :
ద్రావితం అయనీకరణ ప్రక్రియలో ‘n’ అయాన్లు ఏర్పరచి, ఇచ్చిన గాఢత దగ్గర ‘α’ అయనీకరణం చెందితే, [1 + (n – 1) α] అయాన్లు ఏర్పడతాయి.
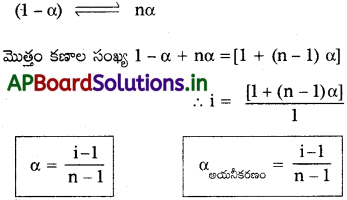
ద్రావితం సహచరిత ప్రక్రియ:
‘n’A సహచరితం అయితే An, ఏర్పడితే,
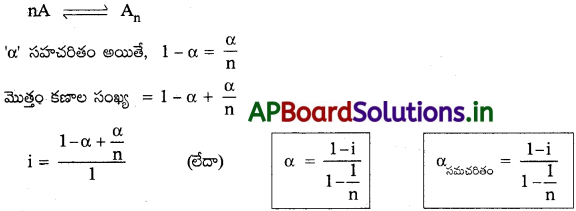
ప్రశ్న 20.
సాపేక్ష బాష్ప పీడన నిమ్నత అంటే ఏమిటి?
జవాబు:
సాపేక్ష బాష్ప పీడన నిమ్నత :
అబాష్పశీల ద్రావితం కలిగిన ఒక ద్రావణంలోని బాష్పపీడన నిమ్నతకు శుద్ధద్రావణి బాష్ప పీడనానికి గల నిష్పత్తిని సాపేక్ష బాష్పపీడన నిమ్నత అంటారు.
సాపేక్ష బాష్ప పీడన నిమ్నత = \(\frac{P_0-P_s}{P_0}\)
Po – Ps = బాష్పపీడన నిమ్నత, Po = శుద్ధ ద్రావణి బాష్పపీడనం
![]()
ప్రశ్న 21.
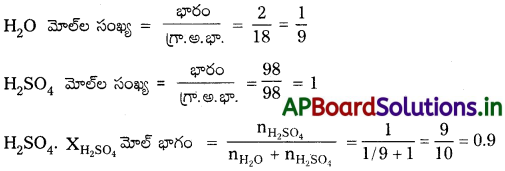
98% (w/w) H2SO4 గల ద్రావణంలోని H2SO4 మోల్ భాగం గణించండి. [AP. Mar.’17]
జవాబు:
98% (\(\frac{w}{w}\)) H2SO4 ద్రావణం ఇవ్వబడినది.
98 గ్రా. లH2SO4 మరియు 2 గ్రా. H2O కలిపి ద్రావణం ఏర్పడినది.
స్వల్ప సమాధాన ప్రశ్నలు
ప్రశ్న 1.
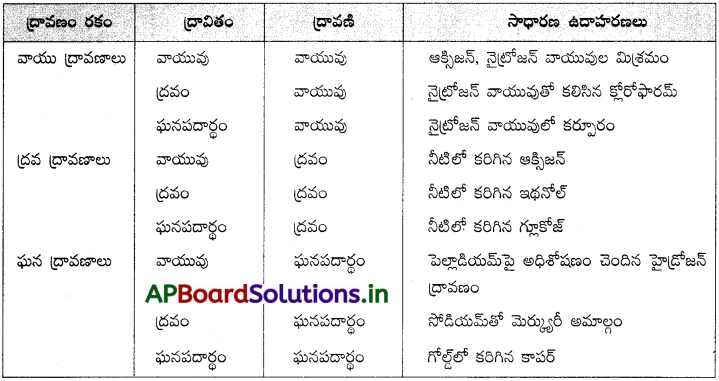
ద్రావణాలు ఎన్ని రకాలుగా ఏర్పడతాయి? ప్రతిరకం ద్రావణానికి ఒక ఉదాహరణ ఇవ్వండి.
జవాబు:
ద్రావణంలోని ద్రావణి ఆధారంగా ద్రావణాలు మూడు రకాలుగా విభజించారు.
ప్రశ్న 2.
ద్రవ్యరాశి శాతం, ఘనపరిమాణ శాతం, ద్రవ్యరాశికి ఘనపరిమాణ శాతం ద్రావణాలను లెక్కించండి.
జవాబు:
(i) ద్రావణం ద్రవ్యరాశి శాతాన్ని ఈ క్రింది విధంగా నిర్వచించవచ్చు
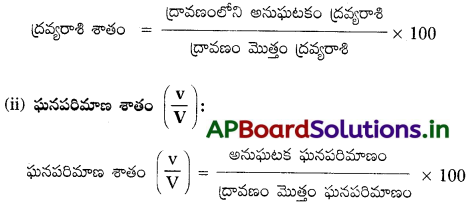
(iii) ద్రవ్యరాశికి ఘనపరిమాణ శాతం (\(\frac{w}{V}\)) :
100 మి.లీ. ల ద్రావణంలో కరిగియున్న ద్రావిత ద్రవ్యరాశిని ద్రవ్యరాశికి ఘనపరిమాణ శాతం అంటారు.
ప్రశ్న 3.
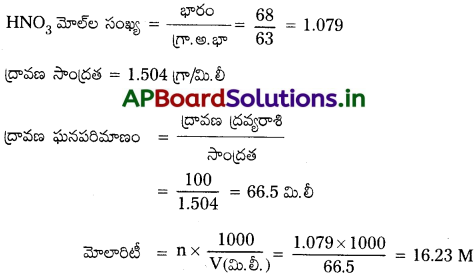
ప్రయోగశాలలో ఉపయోగించే గాఢనైట్రికామ్లం, 68% W/W జలద్రావణం. ఆ ద్రావణం సాంద్రత 1.504 g mL-1 ఉంటే అలాంటి నమూనా ఆమ్లం మోలారిటి ఎంత?
జవాబు:
68% (\(\frac{W}{w}\)) HNO3 జలద్రావణం ఇవ్వబడినది.
68% గ్రా.ల HNO3, 100 గ్రా.ల ద్రావణంలో కలదు.
HNO3 అణు భారం = 63
ప్రశ్న 4.
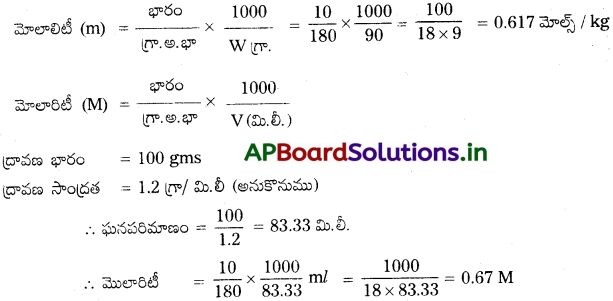
గ్లూకోజ్ నీటి ద్రావణం 10% w/w గా సూచించబడింది. ఆ ద్రావణం మోలారిటి ఎంత ఉంటుంది?
జవాబు:
10% (\(\frac{w}{w}\)) గ్లూకోజ్ జల ద్రావణం ఇవ్వబడినది.
గ్లూకోజ్ భారం = 10గ్రా.
C6H12O6 గ్రా. అణుభారం = 180
నీటి భారం = 100 – 10 = 90 గ్రా
ప్రశ్న 5.
సుక్రోజ్ నీటి ద్రావణం 20% w/w గా సూచించబడింది. ద్రావణంలో ఉన్న ప్రతిఘటకం మోల్భాగం ఎంత?
జవాబు:
20% (\(\frac{w}{w}\)) సుక్రోజ్ జల ద్రావణం ఇవ్వబడినది.
20 గ్రా. సుక్రోజ్ 80 గ్రా. నీటిలో ఉన్నది.
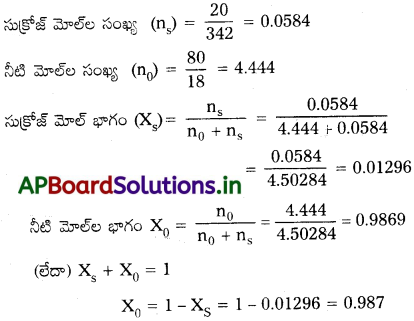
ప్రశ్న 6.
సమాన మోలార్ పరిమాణం గల Na2CO3, NaHCO3 ల 1.0g మిశ్రమంతో పూర్తిగా చర్యనొందడానికి ఎన్ని mlల 0.1M HCl అవసరమవుతుంది?
జవాబు:
Na2CO3 మరియు NaHCO3 ల 1 గ్రా. మిశ్రమం ఇవ్వబడినది.
Na2CO3 భారం = a గ్రా. అనుకొనుము
NaHCO3 = (1 – a) గ్రా.

Na2CO3, NaHCO3 లు మిశ్రమంలో సమాన మోలార్ పరిమాణం గలవు


ప్రశ్న 7.
300 గ్రా.ల 25% W/W ద్రావణం 400 గ్రా. ల 40% w/w ద్రావణం కలిపి ద్రావణం తయారుచేశారు. ఫలితంగా వచ్చిన ద్రావణం ద్రవ్యరాశి శాతం లెక్కించండి.
జవాబు:

ప్రశ్న 8.
222.6గ్రా. ల ఇథిలీన్ గ్లైకాల్ను (CHO) 200గ్రా. నీటికి (ద్రావణి) కలిపి ఘనీభవన వ్యతికరణి (antifreeze) తయారు చేశారు. ద్రావణం మోలాలిటి లెక్కించండి.
జవాబు:
ఇథిలీన్ గ్లైకాల్ భారం = 222.6 గ్రా.
గ్రా. అణు భారం = 62
ద్రావణి భారం = 200 గ్రా.
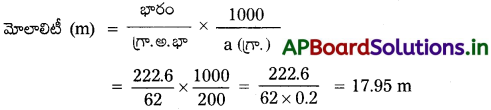
ప్రశ్న 9.
ఉష్ణోగ్రత పెరిగినకొద్దీ ద్రవాలలో వాయువులకు ఎప్పుడూ తక్కువ కరిగే ప్రవృత్తి ఉంటుంది. ఎందుకు?
జవాబు:
వాయువులు ద్రవాలలో కరుగుట ఉష్ణమోచక చర్యకు ఉదాహరణ (∆ HCO)
లీచాట్లియర్ సూత్రం ప్రకారం ఒక చర్య ఉష్ణమోచక చర్య అయినప్పుడు ఉష్ణోగ్రత పెరుగుదలతో వాయువు ద్రావణీయత తగ్గును.
కావున ఉష్ణోగ్రత పెరిగిన కొలది ద్రవాలలో వాయువులకు ఎప్పుడూ తక్కువ కరిగే ప్రవృత్తి ఉండును.
![]()
ప్రశ్న 10.
రౌల్ట్ నియమం నుంచి ధనాత్మక విచలనం అంటే ఏమిటి? రౌల్ట్ నియమం నుంచి ధనాత్మక విచలనంతో ∆mixH గుర్తు సంబంధం ఎలా ఉంటుంది?
జవాబు:
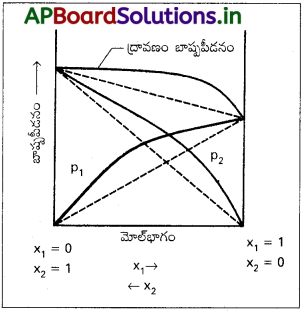
- రౌల్ట్ నియమం ప్రకారం లెక్కించే బాష్పపీడనం కంటే ఎక్కువ అయితే ఆ ద్రావణం ధనాత్మక విచలనాన్ని ప్రదర్శిస్తుంది.
- ఇచ్చట ద్రావిత మరియు ద్రావణి (1 మరియు 2) ల మధ్య ఉండు అంతర అణు ఆకర్షణ బలాలు ద్రావిత మరియు ద్రావిత (1 మరియు 1) ల మధ్య మరియు ద్రావణి మరియు ద్రావణి (2 మరియు 2) ల మధ్య కంటే బలహీనంగా ఉంటాయి.
- కావున ద్రావిత లేదా ద్రావణి అణువులు ద్రావణం ఉపరితలంపై నుండి శుద్ధ స్థితిలో తప్పించుకొంటాయి. కావున ద్రావణ బాష్ప పీడనం పెరుగును.
ఉదా : ఇథైల్ ఆల్కహాల్ మరియు నీరు, ఎసిటోన్ మరియు బెంజీన్.
ప్రశ్న 11.
రౌల్ట్ నియమం నుంచి రుణాత్మక విచలనం అంటే ఏమిటి? రౌల్ట్ నియమం నుంచి రుణాత్మక విచలనంతో ∆mixH సంబంధం ఎలా ఉంటుంది?
జవాబు:
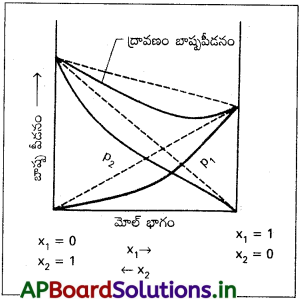
రౌల్ట్ నియమం ప్రకారం లెక్కించే బాష్పపీడనం కంటే తక్కువ అయితే ఆ ద్రావణం ఋణాత్మక విచలనాన్ని ప్రదర్శిస్తుంది.
- ఇచ్చట ద్రావణి మరియు ద్రావణి (2 మరియు 2) ల మధ్య, ద్రావిత మరియు ద్రావిత (1మరియు 1)ల మధ్య ఉండు అంతర అణు ఆకర్షణ బలాల కంటే ద్రావిత మరియు ద్రావణి(1మరియు 2) ల మధ్య కంటే బలహీనంగా ఉంటాయి.
- కావున ద్రావణ బాష్ప పీడనం తగ్గును.
ఉదా : HNO3 మరియు నీరు, HCl మరియు నీరు
ప్రశ్న 12.
300K వద్ద నీటి బాష్పపీడనం 12.3 k Pa. అబాష్పశీల ద్రావితం ఉన్న 1 మోలాల్ ద్రావణం బాష్పపీడనం లెక్కించండి.
జవాబు:
ఇవ్వబడిన ద్రావణ మోలాలిటీ = 1m
నీటి యొక్క బాష్పపీడనం (P0) = 12.3 lPa
ద్రావిత మోల్ల సంఖ్య (ns) = 1
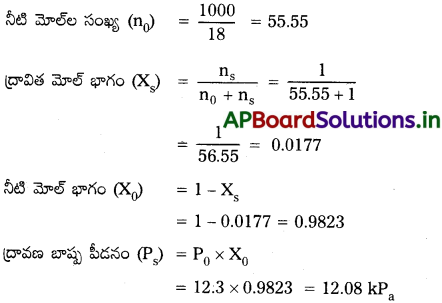
ప్రశ్న 13.
బాష్పపీడనాన్ని 80%కు తగ్గించడానికి 114g ల ఆక్టెన్లో కరిగించవలసిన అబాష్పశీల ద్రావితం (మోలార్ ద్రవ్యరాశి 40g mol-1 ద్రవ్యరాశిని లెక్కించండి. [TS. Mar.’16]
జవాబు:
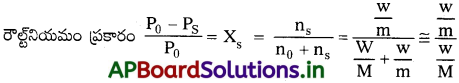
అబాష్పశీల ద్రావితం ఆక్టేన్లో కరిగినపుడు బాష్పపీడనం 80% తగ్గించబడినది.

ప్రశ్న 14.
5% W/W చక్కెర నీటి ద్రావణం ఘనీభవనస్థానం 271K. నీటి ఘనీభవనస్థానం 273.15 K అయితే 5% గ్లూకోజ్ నీటి ద్రావణం ఘనీభవనస్థానం లెక్కించండి.
జవాబు:

∴ 5% గ్లూకోజ్ ద్రావణానికి ఘనీభవన స్థానం = 273.15 – 4.085 = 269.07 K
ప్రశ్న 15.
300 K వద్ద గ్లూకోజ్ ద్రావణం ద్రవాభిసరణ పీడనం 1.52 bar అయితే, దాని గాఢత ఎంత?
R = 0.083L bar mol-1 K-1?
జవాబు:
π = CRT
R = 0.0836.bar. mol-1 K-1
T = 300 K
π = 1.52 bar
![]()
ప్రశ్న 16.
293K వద్ద నీటి బాష్ప పీడనం 17.535 mm Hg. 25g ల గ్లూకోజ్ను 450g ల నీటిలో కరిగిస్తే వచ్చిన ద్రావణం బాష్పపీడనాన్ని 293K వద్ద గణించండి.
జవాబు:
రౌల్టి నియమం ప్రకారం

ప్రశ్న 17.
మోలార్ ద్రవ్యరాశికి ద్రావణం బాష్పీభవన స్థాన ఉన్నతికి ఎలాంటి సంబంధం ఉన్నది?
జవాబు:
బాష్పీభవన స్థాన ఉన్నతి
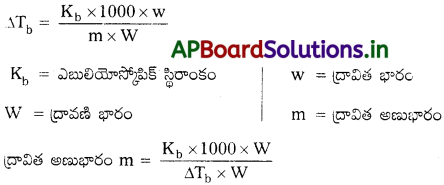
∴ మోలార్ ద్రవ్యరాశికి ద్రావణ బాష్పపీడన ఉన్నతి విలోమానుపాతంలో ఉంటాయి.
ప్రశ్న 18.
ఆదర్శ ద్రావణం అంటే ఏమిటి?
జవాబు:
ఆదర్శ ద్రావణం :
అన్ని గాఢతల అవధులలో రౌల్టనియమాన్ని పాటించే ద్రావణాలను ఆదర్శ ద్రావణాలు అంటారు. ఆదర్శ ద్రావణాలలో ద్రావిత, ద్రావణిల మధ్య రసాయన చర్యలు జరగవు.
ఉదా : ఈ క్రింది మిశ్రమాలు ఆదర్శ ద్రావణాలు ఏర్పరుస్తాయి.
- బెంజీన్ + టోలీస్
- n- హెక్సేన్ + n– హెప్టేన్
- ఇథైల్ బ్రోమైడ్ + ఇథైల్ అయోడైడ్
![]()
ప్రశ్న 19.
సాపేక్ష బాష్పపీడన నిమ్నత అంటే ఏమిటి? ఇది ద్రావితం మోలార్ ద్రవ్యరాశిని నిర్ధారించడానికి ఏవిధంగా ఉపయోగపడుతుంది? [TS. Mar.’15]
జవాబు:
సాపేక్ష బాష్పపీడన నిమ్నత :
బాష్పశీల ద్రావితం కలిగిన ఒక ద్రావణంలోని బాష్పపీడన నిమ్నతకు శుద్ధద్రావణి బాష్ప పీడనానికి గల నిష్పత్తిని సాపేక్ష బాష్పపీడన నిమ్నత అంటారు.
సాపేక్ష బాష్పపీడన నిమ్నత = \(\frac{P_0-P_s}{P_0}\)
P0 – Ps = బాష్పపీడన నిమ్నత, p0 = శుద్ధ ద్రావణి బాష్ప పీడనం
రౌల్ట్నియముం (అబాష్పశీల ద్రావితం) :
అబాష్పశీల ద్రావితం కలిగియున్న విలీన ద్రావణంలోని సాపేక్ష బాష్పపీడన నిమ్నత, ద్రావిత మోల్భాగానికి సమానమౌతుంది.

ప్రశ్న 20.
మోలార్ ద్రవ్యరాశికి ద్రావణం ఘనీభవనస్థాన నిమ్నతకి ఎలాంటి సంబంధం ఉన్నది?
జవాబు:
ఘనీభవన స్థాన నిమ్నత
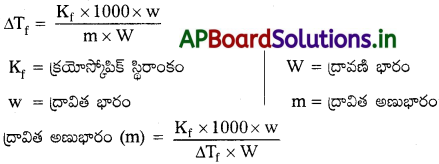
∴ మోలార్ ద్రవ్యరాశికి ద్రావణ ఘనీభవన స్థాన నిమ్నత విలోమానుపాతంలో ఉండును.
దీర్ఘసమాధాన ప్రశ్నలు
ప్రశ్న 1.
2% w/wఅబాష్పశీల ద్రావిత జలద్రావణం, ద్రావణి సాధారణ బాష్పీభవన స్థానం వద్ద 1.004bar పీడనాన్ని కలుగజేస్తుంది. ద్రావితం మోలార్ ద్రవ్యరాశి ఎంత?
జవాబు:
సాపేక్ష బాష్పపీడన నిమ్నత \(\frac{P_0-P_s}{P_0}=\frac{n_s}{n_0}\)
P0 = 1.013 bar, Ps = 1.004 bar
w = 2 గ్రా. W = 98 గ్రా.
M = 18, m = ?

ప్రశ్న 2.
హెప్టేన్, ఆక్టేన్ ఆదర్శ ద్రావణాన్ని ఏర్పరుస్తాయి. 373 K వద్ద రెండు ద్రవ ఘటకాల బాష్పపీడనాలు వరసగా 105.2 kPa, 46.8 kPa. 26.0 g హెప్టేన్, 35.0g ఆక్టేన్ కలిసిన మిశ్రమం బాష్పపీడనం ఎంత?
జవాబు:
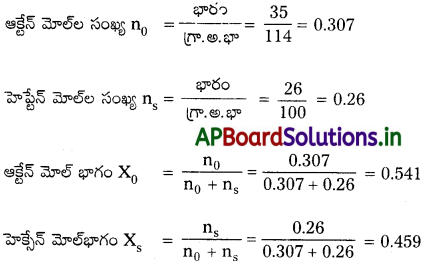
హెప్టేన్ బాష్ప పీడనం P1 = 105.2 kPa
ఆక్టేన్ బాష్ప పీడనం P2 = 46.8 kPa
26గ్రా. హెప్టేన్ మరియు 35 గ్రా. ఆక్టేన్ కలుపబడ్డాయి
ఆ మిశ్రమంలో
హెప్టేన్ బాష్పపీడనం (P11) = P1 × Xs
= 105.2 × 0.459
= 48.28 kPa
ఆక్టేన్ బాష్పపీడనం (P22) = P2 × X0
= 46.8 × 0.541
= 25.32 kPa
మిశ్రమం యొక్క మొత్తం పీడనం (P) = P11 + P22
= 25.32 + 48.28
= 73.6 kPa
ప్రశ్న 3.
298 K వద్ద 90.0 g నీటిలో ఉన్న 30.0g అబాష్పశీల ద్రావితం ఉన్న ద్రావణం బాష్పపీడనం 2.8 kPa. అంతేకాకుండా 18.0g నీటిని ఆ ద్రావణానికి కలిపితే కొత్తగా ఏర్పడిన బాష్పపీడనం 298 K వద్ద 2.9 kPa అయితే (i) ద్రావితం మోలార్ ద్రవ్యరాశిని (ii) 298 K వద్ద నీటి బాష్పపీడనాన్ని లెక్కించండి.
జవాబు:
i) ద్రావితం మోలార్ ద్రవ్యరాశిని లెక్కించుట :
Case – I :

Case – II :

ii) నీటి బాష్పపీడనం లెక్కించుట :
రౌల్ట్ నియమం ప్రకారం

ప్రశ్న 4.
A, B అనే రెండు మూలకాలు AB2, AB4 ఫార్ములాలు గల సమ్మేళనాలను ఏర్పరుస్తాయి. 20.0g ల బెంజీన్లో 1.0g AB2 కరిగిస్తే ఘనీభవనస్థాన నిమ్నత 2.3 K, 1.0g. AB4 కరిగిస్తే ఘనీభవన స్థాన నిమ్నత 1.3 K. బెంజీన్ మోలార్ నిమ్నత స్థిరాంకం 5.1 K kg mol-1. A, B ల పరమాణు ద్రవ్యరాశులను లెక్కించండి.
జవాబు:
AB2 మరియు AB4 సమ్మేళనాల అణుభారాలు లెక్కించుట :
AB2 సమ్మేళనానికి
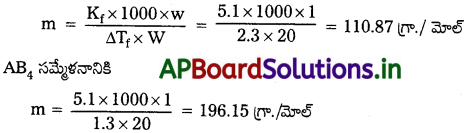
మూలకాల పరమాణు ద్రవ్యరాశులు లెక్కించుట :
A మూలక పరమాణు ద్రవ్యరాశి = x
B మూలక పరమాణు ద్రవ్యరాశి = У
AB2 అణుభారం = x + 2y
ABB4 అణుభారం = x + 4y
x + 2y = 110.87 ——— (1)
x + 4y = 196.15 ——— (2)
సమీకరణం (2) – సమీకరణం (1)
x + 4y – x – 2y = 196.15 – 110.87
2y = 85.28
y = 42.64
x + 2y = 110.87
x + 85.28 = 110.87
x = 110.87 – 85.28
X = 25.59
∴ A మూలక పరమాణు ద్రవ్యరాశి = 25.59 u
B మూలక పరమాణు ద్రవ్యరాశి = 42.64u
![]()
ప్రశ్న 5.
10.0g CH3CH2 CHClCOOH ని 250g నీటికి కలిపినప్పుడు నీటి ఘనీభవన స్థాన నిమ్నతని లెక్కించండి.
Ka = 1.4 × 10-3, Kf = 1.86 K kg mol -1.
జవాబు:
వియోజనావధి లెక్కించుట :
ద్రావిత భారం = 10 గ్రా.
ద్రావిత అణుభారం (CH3 – CH2 – CH Cl COOH) = 122.5 గ్రా/మోల్
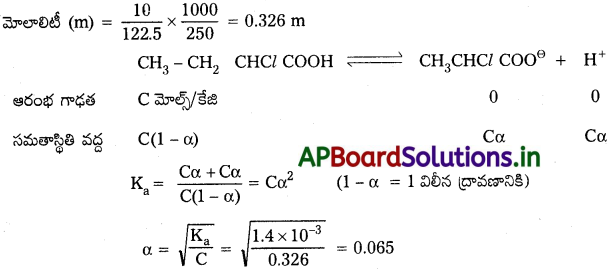
వాంట్ఫ్ గుణకం లెక్కించుట :

ఘనీభవన స్థాన నిమ్నత ∆Tf = i × Kf × m = 1.065 × 1.86 × 0.326 = 0.65 k
ప్రశ్న 6.
19.5g CH2FCOOH ని 500g ల నీటిలో కరిగించారు. పరిశీలనలో నీటి ఘనీభవన స్థాన నిమ్నత 1.0°C. ఉంది. వాంట్ఫ్ గుణకాన్ని, ఫ్లోరో ఎసిటిక్ ఆమ్లం వియోజన స్థిరాంకాన్ని లెక్కించండి.
జవాబు:
ఆమ్ల వాంట్ఫ్ గుణకం లెక్కించుట :

ఆమ్ల వియోజన అవధి లెక్కించుట :
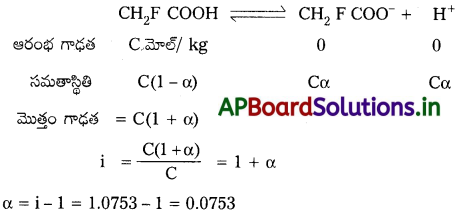
ఆమ్ల వియోజన స్థిరాంకం లెక్కించుట :

ప్రశ్న 7.
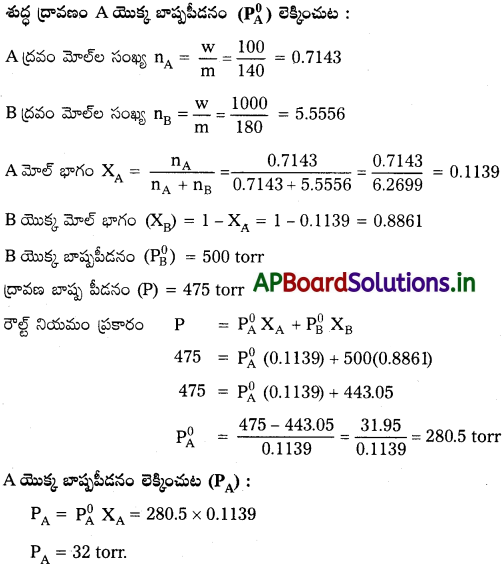
100g A ద్రవాన్ని (మోలార్ ద్రవ్యరాశి 140g mol-1) 1000g B ద్రవంలో (మోలార్ ద్రవ్యరాశి 180g mol-1). కరిగించారు. శుద్ధ ద్రవం B బాష్పపీడనం 500 torr. ద్రావణం మొత్తం బాష్పపీడనం 475 torr అయినట్లయితే శుద్ధ ద్రవం A బాష్పపీడనం, ద్రావణంలో దాని బాష్పపీడనాన్ని గణించండి.
జవాబు:
ప్రశ్న 8.
27°C వద్ద ద్రవాభిసరణ పీడనం 0.75 atm. ఉండాలంటే 2.5 లీటర్ల నీటిలో కరిగించవలసిన CaCl2 (i = 2.47) పరిమాణాన్ని నిర్ధారించండి.
జవాబు:
వాంట్ హాఫ్ సమీకరణం
ద్రవాభిసరణ పీడనం (π) = i CRT
i = 2.47
V = 2.5 lit
R = 0.0821 lit. atm.K-1. mol-1
T = 27 + 273 = 300 K
π = 0.75 atm

ప్రశ్న 9.
25°C 25 g ల K2SO4 ని రెండు లీటర్ల నీటిలో కరిగించగా వచ్చిన ద్రావణంలో K2SO4 పూర్తిగా వియోజనం చెందిందనుకొని ద్రవాభిసరణ పీడనాన్ని నిర్ధారించండి.
జవాబు:
కరిగించబడిన K2SO4 భారం = 25 mg
V = 2 lit; T = 25°C = 298 K
K2SO4 అణుభారం = 174 గ్రా/మోల్

ప్రశ్న 10.
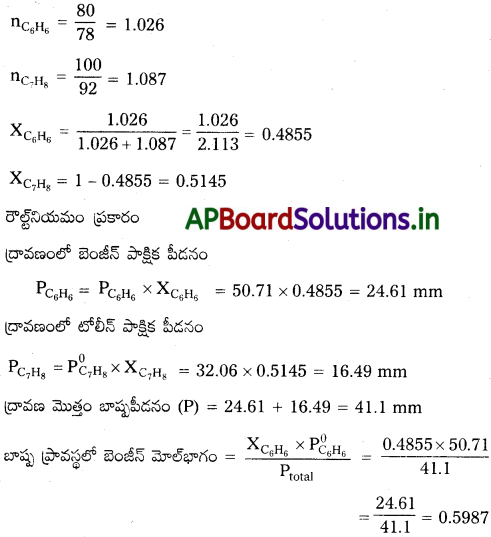
సంఘటనం పూర్తి అవధిలో బెంజీన్, టోలీన్ ఆదర్శ ద్రావణాన్ని ఏర్పరుస్తాయి. 300 K వద్ద శుద్ధ బెంజీన్, టోలీస్ బాష్పపీడనాలు వరసగా 50.71 mm Hg, 32.06 mm Hg. 80g బెంజీన్ని 100g టోలీస్ లో కలిపితే బాష్పప్రావస్థలో ఉన్న బెంజీన్ మోల్భాగాన్ని లెక్కించండి.
జవాబు:
బెంజీన్ అణుభారం (C6H6) = 78
టోలీన్ అణుభారం (C7H8) = 92
సాధించిన సమస్యలు Textual Examples
ప్రశ్న 1.
ద్రవ్యరాశిపరంగా 20% C2H6O2 గల ద్రావణంలో ఇథిలీన్ గ్లైకాల్ (C2H6O2) మోల్ భాగాన్ని లెక్కించండి.
సాధన:
100g ద్రావణం ఉందనుకొందాం (ఎంత మొత్తం ద్రావణంతోనైనా మొదలుపెట్టవచ్చు, ఫలితాలు ఒకే విధంగా ఉంటాయి).
ద్రావణంలో 20g ఇథిలీన్ గ్లైకాల్, 80 g నీరు ఉంటాయి.
C2H6O2 మోలార్ ద్రవ్యరాశి = 12 × 2 + 1 × 6 + 16 × 2 = 62 g mol-1
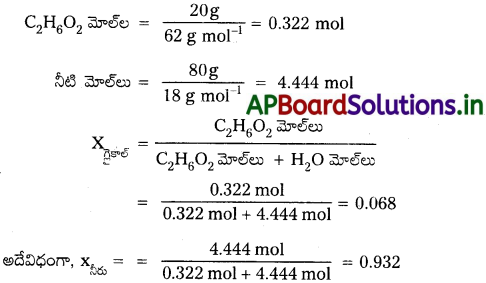
నీటి మోలాగాన్ని, గ్లైకాల్ మోల్భాగంతో ఈ విధంగా కూడా లెక్కించవచ్చు :
1 – 0.068 = 0.932
![]()
ప్రశ్న 2.
5g NaOH 450 ml ద్రావణంలో ఉంటే ఆ ద్రావణం మోలారిటీని లెక్కించండి.
సాధన:

ప్రశ్న 3.
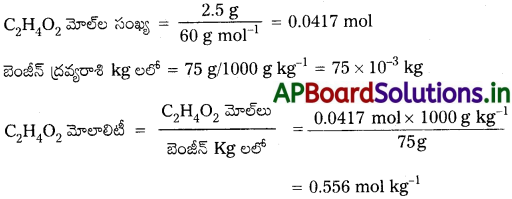
75g ల బెంజీన్లో 2.5g ఇథనోయిక్ ఆమ్లం (CH3COOH)మోలాలిటీని లెక్కించండి. [TS. Mar.’15]
సాధన:
C2H4O2 మోలార్ ద్రవ్యరాశి = 12 × 2 + 1 × 4 + 16 × 2 = 60g mol-1
ప్రశ్న 4.
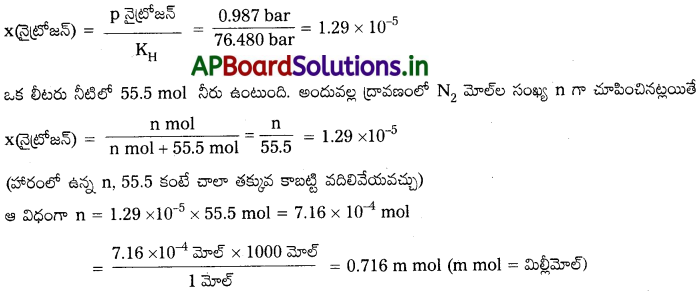
293 K వద్ద N2 వాయువును నీటి ద్వారా పంపితే ఒక లీటరు నీటిలో ఎన్ని మిల్లీ మోల్ల N2 వాయువు కరుగుతుంది? N2, కలుగజేసే పాక్షిక పీడనం 0.987 bar అనుకోండి. 293 K వద్ద హెన్రీ నియమ స్థిరాంకం 76.48 k bar. గా ఇవ్వడమైంది.
సాధన:
జలద్రావణంలో వాయువు ద్రావణీయతకు మోల్భాగానికి సంబంధం ఉన్నది. ద్రావణంలో వాయువు మోల్భాగాన్ని హెన్రీ నియమాన్ని ఉపయోగించి లెక్కించాలి. అందువల్ల,
ప్రశ్న 5.
298 K వద్ద క్లోరోఫారమ్ (CHCl3) డైక్లోరోమీథేన్ (CH2Cl2) బాష్ప పీడనాలు వరసగా 200 mm Hg, 415 mm Hg. (i) 298 K వద్ద 25.5 g ల CHCl3, 40 g CH2Cl2 కలిపి తయారుచేసిన ద్రావణం బాష్ప పీడనాన్ని, (ii) వాయు ప్రావస్థలో ప్రతి అనుఘటకం మోల్భాగాన్ని లెక్కించండి.
సాధన:
i) CH2Cl2 మోలార్ ద్రవ్యరాశి 12 × 1 + 1 × 2 + 35.5 × 2 = 85 g mol-1
CHCl3 మోలార్ ద్రవ్యరాశి = 12 × 1 + 1 × 1 + 35.5 × 3 = 119.5 g mol-1

సమీకరణంని ఉపయోగించి
pమొత్తం = p°1 + (p°2 – p°1) x2 = 200 + (415 – 200) × 0.688
= 200 + 147.9 = 347.9 mm Hg
ii) సమీకరణం, y1 = pi/pమొత్తం ఉపయోగించి వాయు ప్రావస్థలోని అనుఘటకాల మోల్భాగాలను లెక్కించవచ్చు.
pCH2Cl2 = 0.688 × 415 mm Hg = 285.5 mm Hg
pCHCl3 = 0.312 × 200 mm Hg = 62.4 mm Hg
yCH2Cl2 = 285.5 mm Hg/347.9 mm Hg = 0.82
yCHCl3 = 62.4 mm Hg/347.9 mm Hg = 0.18
గమనిక : CH2Cl2 కు CHCI, కంటే అధిక బాష్పశీలత ఉంది కాబట్టి [p°CH2Cl2 = 415 mm Hg . p°CHCl3 = 200 mm Hg] బాష్ప ప్రావస్థలో కూడా CH2Cl2 అధికంగా ఉంటుంది. [yCH2Cl2 = 0.82, yCHCl3 = 0.18], అందువల్ల ద్రావణం బాష్పంతో సమతాస్థితిలో ఉన్నప్పుడు బాప్పు ప్రావస్థలో ఎప్పుడూ కూడా బాష్పశీలత ఎక్కువగా ఉన్న అనుఘటకం అధికంగా ఉంటుందని మనం చెప్పవచ్చు.
ప్రశ్న 6.
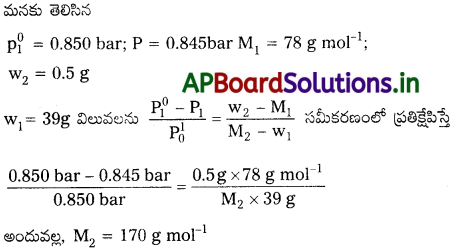
ఒక నిర్దిష్ట ఉష్ణోగ్రత వద్ద శుద్ధ బెంజీన్ బాష్పపీడనం 0.850 bar. 0.5g బరువుగల అబాష్పశీల అవిద్యుద్విశ్లేష్య పదార్థం 39.0 g బెంజీనిక్కి (78 g mol’ మోలార్ ద్రవ్యరాశి) కలిపారు. అప్పుడు ద్రావణం బాష్పపీడనం 0.845 bar. ఘనపదార్థం మోలార్ ద్రవ్యరాశి ఎంత? [AP. Mar.’16]
సాధన:
ప్రశ్న 7.
18g గ్లూకోజ్ను సాస్పన్ (saucepan) లో తీసుకొని 1 kg నీటిలో కరిగించారు. 1.013 bar వద్ద నీరు ఏ ఉష్ణోగ్రత వద్ద మరుగుతుంది? నీటి Kb 0.52 K kg mol-1.
సాధన:
గ్లూకోజ్ మోల్లు 18g/ 180 g mol-1 = 0.1 mol
ద్రావణి కిలోగ్రాముల సంఖ్య = 1 kg
అందువల్ల ద్రావణంలో గ్లూకోజ్ మోలాలిటి = 0.1 mol-1
నీటికి బాష్పీభవన స్థానంలో మార్పు
∆Tb = Kb × m = 0.52 K kg mol-1 × 0.1 mol kg-1 = 0.052.K.
1.013 bar పీడనం వద్ద నీరు 373.15 K వద్ద మరుగుతుంది, అందువల్ల ద్రావణం బాష్పీభవన స్థానం
= 373.15 + 0.052 = 373.202 K
![]()
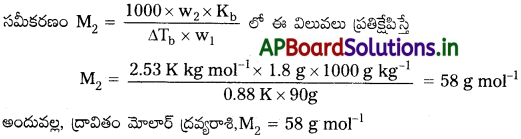
ప్రశ్న 8.
బెంజీన్ బాష్పీభవన స్థానం 353.23 K. 1.80 gల అబాష్పశీల ద్రావితం 90 gల బెంజీన్ లో కరిగిస్తే బాష్పీభవన స్థానం 354.11 K కు పెరిగింది. ద్రావితం మోలార్ ద్రవ్యరాశిని లెక్కించండి. బెంజీనికి Kb 2.53 K kg mol-1.
సాధన:
బాష్పీభవన స్థాన ఉన్నతి (∆ Tb) = 354.11 K – 353.23 K = 0.88 K
ప్రశ్న 9.
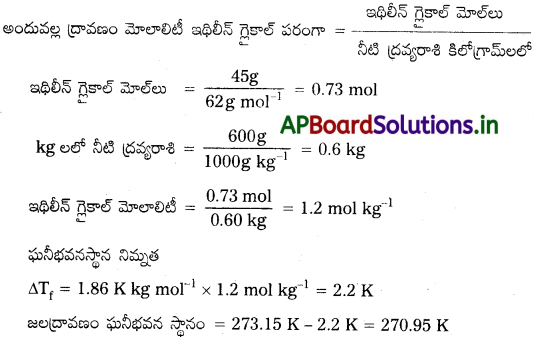
45 gల ఇథిలీన్ గ్లైకాల్ను (C2H6O2) 600 g నీటితో కలిపారు. (ఎ) ఘనీభవనస్థాన నిమ్నత (బి) ద్రావణం ఘనీభవన స్థానం లెక్కించండి.
సాధన:
ఘనీభవనస్థాన నిమ్నతకు మోలాలిటీతో సంబంధం ఉంది.
ప్రశ్న 10.
1.00 g అబాష్పశీల ద్రావితాన్ని 50g బెంజీన్లో కరిగిస్తే బెంజీన్ ఘనీభవనస్థానం 0.40 K తగ్గింది. బెంజీన్ ఘనీభవన స్థాన నిమ్నత స్థిరాంకం 5.12 K kg mol-1. ద్రావితం మోలార్ ద్రవ్యరాశి కనుక్కోండి.
సాధన:

ఆ విధంగా ద్రావితం మోలార్ ద్రవ్యరాశి = 256 g mol-1
ప్రశ్న 11.
200 cm³ ప్రోటీన్ జలద్రావణంలో 1.26gల ప్రోటీన్ ఉంది. 300K వద్ద ఆ ద్రావణం ద్రవాభిసరణ పీడనం 2.57 × 10-3 bar. ప్రోటీన్ మోలార్ ద్రవ్యరాశి గణించండి.
సాధన:
మనకు తెలిసిన రాశులు π = 2.57 × 10-3 bar.
V = 200 cm³ = 0.200 litre
T = 300 K
R = 0.083 L bar mol-1 K-1
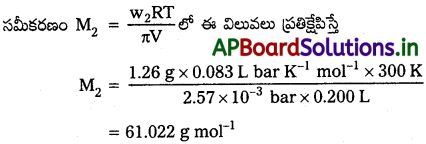
ప్రశ్న 12.
2g ల బెంజోయిక్ ఆమ్లాన్ని (C6H5COOH) 25g ల బెంజీన్లో కరిగిస్తే 1.62 K ఘనీభవన స్థాననిమ్నతని చూపిస్తుంది. బెంజీన్ మోలార్ నిమ్నత స్థిరాంకం 4.9 K kg mol-1. అది ద్రావణంలో ద్విఅణుకం ఏర్పరిస్తే, ఆమ్లం సాహచర్య శాతం ఎంత?
సాధన:
ఇచ్చిన రాశులు : w2 = 2g; Kf = 4.9 K kg mol-1; w1 = 25 g
∆Tf = 1.62 K

ఆ విధంగా బెంజీన్లో బెంజోయిక్ ఆమ్ల ప్రయోగాత్మక మోలార్ ద్రవ్యరాశి = 241.98 g mol-1
ఆమ్లానికి ఈ కింది సమతాస్థితిని చూడండి.
![]()
ద్రావితం సాహచర్య అవధి x అయితే (1 – x) మోల్ బెంజోయిక్ ఆమ్లం సాహచర్యం కాకుండా ఉంటుంది. సమతాస్థితి \(\frac{x}{2}\) mol సాహచర్యం జరిగి ఉంటుంది. అందువల్ల సమతాస్థితి వద్ద మొత్తం కణాల మోల్ల సంఖ్య.
వద్ద దీనికి అనుగుణంగా
1 – x + \(\frac{x}{2}\) = 1 – \(\frac{x}{2}\)2
అందువల్ల, సమతాస్థితి వద్ద మొత్తం కణాల మోల్ సంఖ్య వాంట్ హాఫ్ గుణకానికి (i) సమానం. కానీ
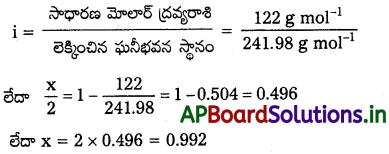
అందువల్ల బెంజీన్ బెంజోయిక్ ఆమ్లం సాహచర్య అవధి = 99.2%.
ప్రశ్న 13.
1.06 g ml-1 సాంద్రత గల 0.6 mL ఎసిటిక్ ఆమ్లాన్ని (CH3COOH) 1లీటర్ నీటిలో కరిగించారు. ఈ ఆమ్ల గాఢతకు పరిశీలించిన ఘనీభవన స్థాన నిమ్నత 0.0205°C, వాంట్ హాఫ్ గుణకాన్ని, ఆమ్లం వియోజన స్థిరాంకాన్ని గణించండి.
సాధన:
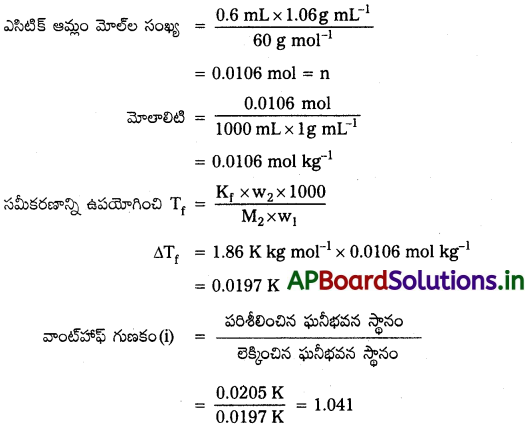
ఎసిటిక్ ఆమ్లం బలహీనమైన విద్యుద్విశ్లేష్యం, ఒక ఎసిటిక్ ఆమ్ల అణువు ఒక ఎసిటేట్ అయాన్, ఒక హైడ్రోజన్ అయాన్, రెండు అయాన్లుగా వియోజనం చెందుతుంది.
ఎసిటిక్ ఆమ్ల వియోజన అవధి x అయితే, వియోజనం చెందని ఎసిటిక్ అమ్లం మోల్లు n(1 – x), nx మోల్ల CH3COO–, nx మోల్ల H+ అయాన్లు ఉంటాయి.

పాఠ్యాంశ ప్రశ్నలు Intext Questions
ప్రశ్న 1.
22g బెంజీన్ను (C6H6) 122g కార్బన్టెట్రాక్లోరైడ్ (CCl4)లో కరిగిస్తే బెంజీన్, కార్బన్టెట్రాక్లోరైడ్ల ద్రవ్యరాశి శాతాలను లెక్కించండి.
సాధన:
బెంజీన్ ద్రవ్యరాశి = 22g
CCl4 ద్రవ్యరాశి = 122g
ద్రావణ ద్రవ్యరాశి = 22 + 122 = 22 = 144 గ్రా.
బెంజీన్ ద్రవ్యరాశి శాతం \(\frac{22}{144}\) × 100 = 15.28%
CCl4 ద్రవ్యరాశి శాతం 100 – 15.28 = 84.72%
![]()
ప్రశ్న 2.
కార్బన్ట్రాక్లోరైడ్ ద్రావణంలో 30% ద్రవ్యరాశి గల, బెంజీన్ మోల్భాగాన్ని లెక్కించండి.
సాధన:
100 గ్రా. ద్రావణంలో
బెంజీన్ ద్రవ్యరాశి = 30గ్రా.
CCl4 ద్రవ్యరాశి 100 – 30 = 70 గ్రా.
బెంజీన్ అణుభారం = 78
CCl4 అణుభారం = 154

ప్రశ్న 3.
ఈక్రింది ద్రావణాల మోలారిటీని గణించండి :
ఎ) 4.3 L ద్రావణంలో 30g CO(NO3)2.6H2O
బి) 30 mL 0.5 M H2SO4 500 mL కు విలీనం చేయబడింది.
సాధన:
ఎ) CO(NO3)2. 6H2O అణుభారం = 291 గ్రా. / మోల్
CO (NO3)2 6 H2O మోల్ల సంఖ్య = \(\frac{30}{291}\) = 0.103
ద్రావణ ఘనపరిమాణం = 4.3 లీ
మొలారిటీ M \(\frac{0.103}{4.3}\) = 0.024 M
బి) విలీనం చేయని H2SO4 ఘన పరిమాణం V1 = 30 mL
విలీనం చేయని H2SO4 మోలారిటీ M1 = 0.5 M
విలీనం చేసిన H2SO4 ఘనపరిమాణం V2 = 500 mL
M1V1 = M2V2
M2 = \(\frac{M_1V_1}{V_2}=\frac{0.5\times30}{500}\) = 0.03 M
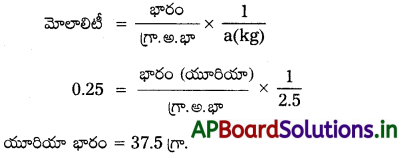
ప్రశ్న 4.
2.5 kg ల 0.25 మోలాల్ జలద్రావణం చేయడానికి కావలసిన యూరియా (NH2CONH2) ద్రవ్యరాశిని లెక్కించండి.
సాధన:
ద్రావణ మొలాలిటీ m = 0.25 m
యూరియా అణుభారం = 60 గ్రా. / మోల్
ద్రావణి (నీరు) భారం = 2.5 kg
ప్రశ్న 5.
20% (ద్రవ్యరాశి/ ద్రవ్యరాశి) KI జలద్రావణం సాంద్రత 1.202 g mL-1. అయితే KI (ఎ) మోలాలిటీ (బి) మోలారిటీ (సి)మోల్ భాగాలను లెక్కించండి.
సాధన:
ఎ) మోలాలిటీ :
100 గ్రా. నీటిలో KI భారం = 20 గ్రా.
ద్రావణంలో నీటిభారం = 80 గ్రా. = 0.08 kg
KI అణుభారం = 166 గ్రా./ మోల్-1
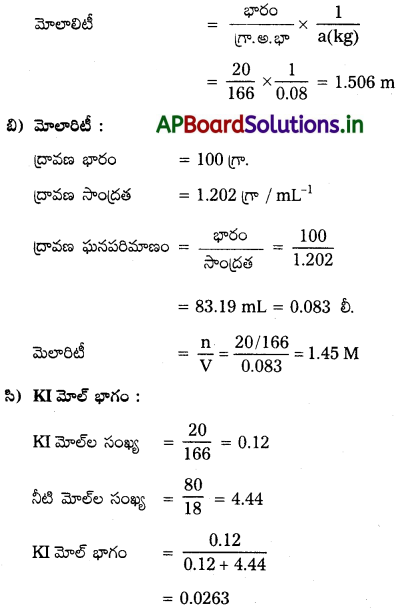
ప్రశ్న 6.
కుళ్ళిన గుడ్డులాంటి వాసనగల విషతుల్యమైన H2S వాయువును గుణాత్మక విశ్లేషణలో వాడతారు. నీటిలో STP వద్ద H2S ద్రావణీయత 0.195m అయినట్లయితే హెన్రీ నియమ స్థిరాంకం లెక్కించండి.
సాధన:
0.195 m అనగా 0.195 మోల్ల H2S 1000 గ్రా. నీటిలో కరిగినది.
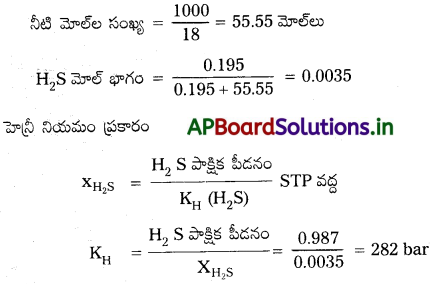
ప్రశ్న 7.
298 K వద్ద నీటిలో CO2 కు హెన్రీ నియమ స్థిరాంకం 1.67 × 108 Pa. 298 K వద్ద 2.5 atm ల CO2 పీడనంలో సీలు చేసిన 500 mL సోడా నీళ్ళలోని CO2 పరిమాణాన్ని లెక్కించండి.
సాధన:
Step I : CO2 మోల్ల సంఖ్య లెక్కించుట :
హెన్రీ నియమం ప్రకారం,

ప్రశ్న 8.
350 K వద్ద శుద్ధ A, Bల బాష్పపీడనాలు వరసగా 450, 700 mm Hg. ద్రవ మిశ్రమాల మొత్తం పీడనం 600 mm Hg అయినట్లయితే సంఘటనాన్ని కనుక్కోండి. బాష్ప ప్రావస్థ సంఘటనాన్ని కూడా కనుక్కోండి.
సాధన:
Step I :
శుద్ధ ద్రావణం A యొక్క బాష్ప పీడనం P°A = 450 mm
శుద్ధ ద్రావణం B యొక్క బాష్ప పీడనం P°B = 700 mm
ద్రావణ మొత్తం బాష్ప పీడనం (P) = 600 mm

ప్రశ్న 9.
298 K వద్ద శుద్ధజలం బాష్ప పీడనం 23.8 mm Hg. 850g నీటిలో 50 g యూరియా (NH2CONH2) కరిగి ఉన్నది. ఈ ద్రావణంలో నీటి బాష్పపీడనం దాని సాపేక్ష నిమ్నత లెక్కించండి.
సాధన:
Step I:
రౌల్ట్ నియమం ప్రకారం

ప్రశ్న 10.
750 mm Hg వద్ద నీటి బాష్పీభవన స్థానం 99. 63°C. నీరు 100°C వద్ద మరగాలంటే 500 g నీటికి ఎంత సుక్రోజ్న కలపాలి?
సాధన:
నీటి భారం (WA) = 0.5 kg = (500 గ్రా.)
బాష్పీభవనస్థాన ఉన్నతి = 100 – 99.63°C = 0.37°C
Kb = 0.52 K. kg/mole
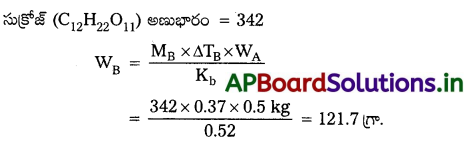
ప్రశ్న 11.
ఎసిటిక్ ఆమ్లం ఘనీభవన స్థానం 1.5°C తగ్గించటానికి 75g ఎసిటిక్ ఆమ్లంలో కరిగించవలసిన ఆస్కార్బిక్ ఆమ్లం (విటమిన్ C, C6H8O6) ద్రవ్యరాశిని లెక్కించండి. Kf = 3.9 K kg mol-1
సాధన:
ఆస్కార్బిక్ ఆమ్లభారం = 75 గ్రా. = 0.075 kg
(∆Tf) = 1.5° C = 1.5 K

![]()
ప్రశ్న 12.
1,85,000 మోలార్ ద్రవ్యరాశి గల 1.0 g ల పాలిమర్లను 450 mL నీటిలో కరిగించగా ఏర్పడిన ద్రావణం కలుగజేసే ద్రవాభిసరణ పీడనం పాస్కల్లో 37°C వద్ద లెక్కించండి.
సాధన:
పాలిమర్ ద్రవ్యరాశి WB = 1.0 గ్రా.
అణుభారం MB = 185000 g /mole
V = 450ml = 0.450 lit
T = 37°C = 310 K
