Andhra Pradesh BIEAP AP Inter 1st Year Chemistry Study Material 10th Lesson P బ్లాక్ మూలకాలు – 13వ గ్రూప్ Textbook Questions and Answers.
AP Inter 1st Year Chemistry Study Material 10th Lesson P బ్లాక్ మూలకాలు – 13వ గ్రూప్
అతిస్వల్ప సమాధాన ప్రశ్నలు
ప్రశ్న 1.
బోరాన్, థాలియం ఆక్సిడేషన్ స్థితుల మార్పు విధానాన్ని చర్చించండి.
జవాబు:
- బోరాన్ తక్కువ పరిమాణం కలిగి ఉండి అలోహస్వభావం కలిగి ఉండును. కావున – 3 ఆక్సీకరణ స్థితి ప్రదర్శిస్తుంది.
- ‘Al’ +3 స్థితిని ప్రదర్శిస్తుంది.
- Ga, In మరియు Tl లు +1 మరియు +3 స్థితులు ప్రదర్శిస్తాయి.
- Tl జడ ఎలక్ట్రాన్ జంట ప్రభావం వలన +1 స్థిరమైన స్థితిని ప్రదర్శిస్తుంది.
ప్రశ్న 2.
TlCl3 అధిక స్థిరత్వాన్ని ఎట్లా వివరిస్తారు?
జవాబు:
TlCl3 అస్థిరమైనది Tl+3 స్థిరమైనది కాదు. TlCl స్థిరమైనది. జడ ఎలక్ట్రాన్ జంట ప్రభావం వలన T+ స్థిరమైనది.
ప్రశ్న 3.
BF3 లూయీ ఆమ్లంగా ఎందుకు ప్రవర్తిస్తుంది?
జవాబు:
BF3 ఎలక్ట్రాన్ కొరత సమ్మేళనం. దీనికి ఎలక్ట్రాన్ జంటను స్వీకరించే స్వభావం కలదు. ఎలక్ట్రాన్ జంటలు స్వీకర్తలను లూయి ఆమ్లాలు అంటారు. కావున BF3 లూయి ఆమ్లం.
ప్రశ్న 4.
బోరిక్ ఆమ్లం ప్రోటాన్ ఇచ్చే ఆమ్లమా? వివరించండి.
జవాబు:
బోరిక్ ఆమ్లం ఒక బలహీన ఏకక్షార ఆమ్లం. బోరిక్ ఆమ్లంలో సమతల BO3 యూనిట్లు హైడ్రోజన్ బంధాలతో కలుపబడతాయి. కావున ఇది ప్రోటాన్ నిచ్చే ఆమ్లం కాదు. (ప్రోటిక్ ఆమ్లం కాదు)
ప్రశ్న 5.
బోరిక్ ఆమ్లాన్ని వేడిచేస్తే ఏమవుతుంది?
జవాబు:
బోరిక్ ఆమ్లాన్ని 370 K పైన వేడిచేసినపుడు మెటాబోరిక్ ఆమ్లం ఏర్పడును. దీనిని వేడిచేయగా బోరిక్ ఆక్సైడ్ ఏర్పడును.
![]()
ప్రశ్న 6.
BF3, BH4– ల ఆకారాలను వర్ణించండి. ఈ కణాలలో బోరాన్ సంకరకరణం రాయండి.
జవాబు:
→ BF3 అణువు సమతల త్రిభుజాకారం
‘B’ యొక్క సంకరీకరణం ‘sp²’.
→ BH4 అణు-టెట్రాహెడ్రల్ ఆకృతి
‘B’ యొక్క సంకరీకరణం ‘sp³’.
![]()
ప్రశ్న 7.
Ga పరమాణు వ్యాసార్థం Al కంటే ఎందుకు తక్కువ ఉంటుంది. వివరించండి.
జవాబు:
గాలియంలో ఉపాంత్యకర్పరంలో 10- ఎలక్ట్రాన్లు కలవు. ఈ ఎలక్ట్రాన్ల వల్ల పరిరక్షక ప్రభావం తక్కువగా ఉంటుంది. కావున ‘Ga’ లో కేంద్రక ఆవేశం పెరుగును. కావున Ga యొక్క పరమాణు వ్యాసార్థం ‘Al8’ కంటే తక్కువగా ఉండును.
ప్రశ్న 8.
జడజంట ప్రభావాన్ని వివరించండి.
జవాబు:
బంధ నిర్మాణంలో పాల్గొనడానికి ‘ns’ ఎలక్ట్రాన్లు వ్యతిరిక్తతను చూపడాన్ని “జడ జంట ప్రభావం” అంటారు.
ఉదా : ఈ ప్రభావం వలననే ‘థాలియం’ “+1” ఆక్సీకరణ స్థితిని ప్రదర్శిస్తుంది.
ప్రశ్న 9. ఈకింది సమీకరణాలను తుల్యంచేసి రాయండి.
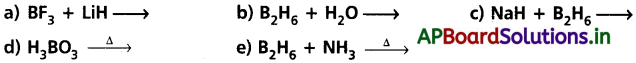
జవాబు:
a) 1) బోరాన్ ట్రైఫ్లోరైడు లిథియం హైడ్రైడ్తో క్షయకరణం చెందిస్తే డైబోరేన్ ఏర్పడుతుంది.
2BF3 + 6LiH → B2H6 + 6 LiF
b) 3) నీటితో చర్య జరిపి బోరిక్ ఆమ్లాన్ని, హైడ్రోజన్ న్ను ఇస్తుంది.
B22H6 + 6H2O → 2H3BO3 + 6H2
c) 4) సోడియం ఎమాల్గంతో చర్య జరిపి సంకలన పదార్థాన్ని ఇస్తుంది.

ప్రశ్న 10.
బోరిక్ ఆమ్లం బహ్వణుకగా ఎందుకు ఉంటుంది?
జవాబు:
బోరిక్ ఆమ్లం పొరలవంటి జాలకం కలిగియుండును. ఈ నిర్మాణంలో BO3 యూనిట్లు హైడ్రోజన్ బంధాలతో కలుపబడి పాలిమర్ (బహ్వణుక)గా ఏర్పడును.
ప్రశ్న 11.
డైబోరేన్, బోరజీన్లలో బోరాన్ సంకరకరణం ఏమిటి?
జవాబు:
- డైబోరేన్ ‘B’ సంకరీకరణం sp³
- బోరజీన్లో ‘B’ సంకరీకరణం sp²
![]()
ప్రశ్న 12.
13 గ్రూప్ మూలకాల ఎలక్ట్రాన్ విన్యాసాన్ని రాయండి.
జవాబు:
IIA గ్రూపు మూలకాలు సాధారణ ఎలక్ట్రానిక్ విన్యాసము ns²np¹.
- B – 1s²2s²2p¹
- Al – [Ne] 3s²3p¹
- Ga – [Ar] 3d1o4s²4p¹
- In − [Kr] 4d1o5s²5p¹
- Tl − [Xe] 5d1o 6s² 6p¹
ప్రశ్న 13.
బోరజీన్ సాంకేతికాన్ని రాయండి. దాని సాధారణ నామం ఏమిటి?
జవాబు:
బోరజీన్ అణు ఫార్ములా B3N3H6.
దీని సాధారణ నామం “ఇనార్గానిక్ బెంజీన్” ఎందుకనగా ఇది బెంజీన్ వంటి నిర్మాణం కలిగియుండును.
ప్రశ్న 14.
(a) బొరాక్స్ (b) కోలిమనైట్ సాంకేతికాలు ఇవ్వండి.
జవాబు:
a) బొరాక్స్ ఫార్ములా Na2BO7. 10H2O.
b) కొలేమనైట్ ఫార్ములా Ca2B6O11.5H2O.
ప్రశ్న 15.
అల్యూమినియం ఉపయోగాలు రెండు రాయండి.
జవాబు:
‘Al’ ఉపయోగాలు :
- ఎలక్ట్రికల్ కేబుల్లను చేయడానికి దీనిని ఉపయోగిస్తారు.
- ట్రేలు, పటాల ఫ్రేమ్లను చేయడానికి వాడతారు.
- విమాన విడిభాగాల తయారీలో వాడతారు.
- AI మిశ్రమలోహాలను పైపులు, తీగలు తయారుచేయుటకు ఉపయోగిస్తారు.
ప్రశ్న 16.
కింది చర్యల్లో ఏమి జరుగుతుంది?
a) LiAlH4, BCl3, మిశ్రమాన్ని అనార్థ ఈథర్లో వెచ్చబెట్టినప్పుడు
b) బోరాక్స్న H2SO4 తో వేడిచేసినప్పుడు
జవాబు:
a) LiAlH4 BCl3 లను పొడి ఈథర్లో కరిగించి, వేడిచేస్తే డైబోరేన్ (B2H6) తయారగును.

b) బోరాకన్ను H2SO4తో వేడిచేసినపుడు బోరిక్ ఆమ్లం ఏర్పడును.
Na2B4O7 + H2SO4 + 5H2O → Na2SO4 + 4H3BO3
ప్రశ్న 17.
ఆర్థోబోరిక్ ఆమ్ల నిర్మాణాన్ని గీయండి.
జవాబు:
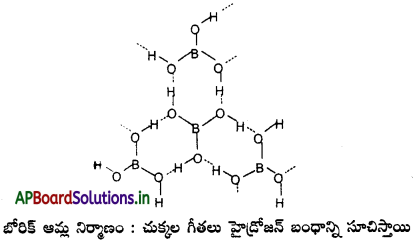
ప్రశ్న 18.
AlCl3 ద్విఅణుక నిర్మాణాన్ని రాయండి.
జవాబు:
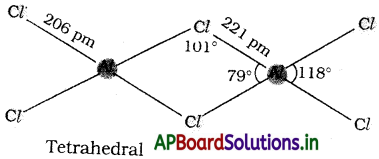
ప్రశ్న 19.
లోహ బోరైడ్లను (10B) రక్షణ కవచాలుగా వాడతారు.
జవాబు:
బోరాన్- 10 (10B) కి నూట్రాన్లను శోషించుకొనే సామర్థ్యం కలదు. కావున లోహబోరైడ్లు (10B కలిగినవై) ను న్యూక్లియర్ పరిశ్రమలలో రక్షణ కవచాలుగా ఉపయోగిస్తారు.
స్వల్ప సమాధాన ప్రశ్నలు
ప్రశ్న 1.
అల్యూమినియమ్కు ద్విస్వభావికం ఉన్నదని రుజువుచేసే చర్యలు రాయండి.
జవాబు:
1. ఆమ్లాలతో చర్య :
i) విలీన లేదా గాఢ ఆమ్లాలు Al ని కరిగించుకుని H2 నిస్తాయి.
2Al + 6HCl → 2AlCl3 + 3H2 ↑
గాఢ HNO3 తో Al క్రియారహితం అవుతుంది. ఇది లోహపు తలంపై పలుచని ఆక్సైడ్ పొర ఏర్పడటం వల్ల క్రియా రాహిత్యం వస్తుంది.
2. క్షారాలతో చర్య :
Al లోహం ద్విస్వభావ లోహం. అది క్షారాలతో H2ని ఇస్తుంది. మెటా అల్యూమినేట్ లేదా అల్యూమినేట్ ఏర్పడుతుంది.

పై చర్యలు అల్యూమినియం ద్విస్వభావాన్ని ఋజువు చేస్తున్నాయి.
![]()
ప్రశ్న 2.
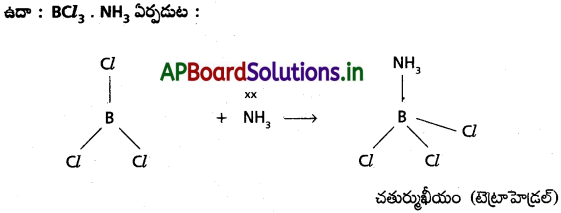
ఎలక్ట్రాన్ కొరత గల సమ్మేళనాలంటే ఏమిటి? BCl3 ఎలక్ట్రాన్ కొరత గల సమ్మేళనమా? వివరించండి.
జవాబు:
ఎలక్ట్రాన్ కొరత అణువులు :
ఈ అణువులో అన్నీ కోవలెంట్ బంధాలు ఏర్పడటానికి అవసరమయిన ఎలక్ట్రాన్లు అందుబాటులో ఉండవు. కాబట్టి ఒక వింతయిన సందర్భం ఏర్పడుతుంది.
ఉదా : డైబోరేన్ (B2H6), టెట్రా బోరేన్ (B4H10) మొదలగునవి.
- BCl3 ఎలక్ట్రాన్ కొరత సమ్మేళనం.
- BCl3 ‘B’ 8 ఎలక్ట్రాన్లకు బదులు 6 ఎలక్ట్రాన్లను కలిగి ఉండును.
- ఇది ఎలక్ట్రాన్ జంటను స్వీకరిస్తుంది. ఇవి లూయి ఆమ్లం.
ప్రశ్న 3.
BF3, BF4– లో B – F బంధ దూరాలు వరుసగా 130 pm, 143 pm ఎందుకు వేరువేరుగా ఉన్నాయో కారణాలు సూచించండి.
జవాబు:
BF3 గురించి :
- BF3లో ‘B’ వేలన్సీ కర్పరంలో మూడు బంధ ఎలక్ట్రాన్ జంటలను కలిగి ఉండును.
- ‘B’ పరమాణువు sp² సంకరీకరణం చెందును.
- అణువు ఆకృతి సమతల త్రిభుజాకారం..
BF4– గురించి :
- BF4– లో. ‘B’ వేలన్సీ కర్పరంలో నాలుగు బంధ ఎలక్ట్రాన్ జంటలను కలిగి ఉండును.
- ‘B’ పరమాణువు sp³ సంకరీకరణం చెందును.
- అణువు ఆకృతి టెట్రాహెడ్రల్.
- పైన చెప్పిన కారణాల వలన BF3 లో బంధదైర్ఘ్యం, BF4– లో బంధ దైర్ఘ్యం వేరువేరుగా ఉన్నాయి.
ప్రశ్న 4.
B – Cl బంధానికి బంధ భ్రామకం ఉంది కాని BCl3 అణువుకు ద్విధ్రువ భ్రామకం సున్నా ఉంటుంది. వివరించండి.
జవాబు:
- B – Cl బంధం ధృవణ బంధం కావున బంధభ్రామకం కలదు.
- BCl3 అణువు అధృవ అణువు కారణం ఇది సౌష్ఠవ నిర్మాణం కలిగి ఉంటుంది. (సమతల త్రిభుజాకారం)
- సౌష్టవ అణువులకు ద్విధృవ భ్రామకం సున్నా.
∴ μ (BCl3) = 0
ప్రశ్న 5.
బోరిక్ ఆమ్లం నిర్మాణాన్ని వివరించండి.
జవాబు:
ఆమ్లం పొరలవంటి జాలకం కలిగియుండును. ఈ నిర్మాణంలో BO3 యూనిట్లు హైడ్రోజన్ బంధాలతో కలుపబడి పాలిమర్ (బహ్వణుక)గా ఏర్పడును.

ప్రశ్న 6.
ఏమి జరుగుతుంది?
a) బోరాక్స్న ప్రబలంగా వేడిచేస్తే
b) బోరిక్ ఆమ్లాన్ని నీటికి కలిపితే
c) అల్యూమినియాన్ని సజల NaOH తో వేడిచేస్తే
d) అమ్మోనియాతో BF చర్య జరిపినపుడు
e) ఆర్థ అల్యూమినాను సజల NaOH ద్రావణంతో చర్య జరిపినప్పుడు
జవాబు:
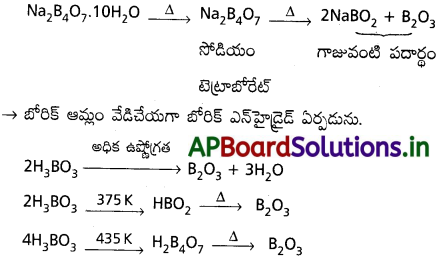
a) బోరాక్స్ను ప్రబలంగా వేడిచేస్తే చివరగా గాజువంటి పదార్థం ఏర్పడును.
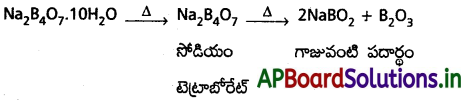
b) బోరిక్ ఆమ్లంనకు నీటిని కలిపితే బోరిక్ ఆమ్లం నీటి నుండి OH అయాన్ను స్వీకరిస్తుంది.
B(OH)3 + 2H2O → [B(OH)4]– + H3O+
c) ‘Al’ ను సజల NaOH తో చర్య జరిపితే సోడియం మెటాల్యుమినేట్ ఏర్పడి హైడ్రోజన్ వాయువు వెలువడును.
2Al + 2NaOH → 2NaAlO2 + H2↑
d) BF, ని NH3 తో చర్య జరిపినపుడు NH3. BF3 సమ్మేళనం ఏర్పడును.

లూయి ఆమ్లం, లూయి క్షారం.
e) ఆర్ద్ర అల్యూమినాను సజల NaOH ద్రావణంతో చర్య జరిపితే సోడియం మెటాల్యుమినేట్ ఏర్పడును.
Al2O3.2H2O + 2NaOH → 2NaAlO2 + 3H2O
ప్రశ్న 7.
కారణాలు తెలపండి.
a) అల్యూమినియం పాత్రలలో గాఢ HNO3 రవాణా చేయవచ్చు
b) సజల NaOH అల్యూమినియం ముక్కల మిశ్రమాన్ని మురుగు కాలువను తెరవడానికి వాడతారు. c) అల్యూమినియం మిశ్రమలోహాన్ని విమానాలను తయారుచేయడానికి వాడతారు.
d) అల్యూమినియం పాత్రలను రాత్రంతా నీళ్ళలో పెట్టకూడదు.
e) అల్యూమినియం తీగలను ప్రసార కేబుల్ తయారీకి వాడతారు.
జవాబు:
a) Al మరియు గాఢ HNO3 కి మధ్య చర్యారాహిత్యం (passivity) కలదు. అందువలన అల్యూమినియం పాత్రలలో గాఢ HNO3ని రవాణా చేయవచ్చు.
b) సజల NaOH మరియు ‘Al’ ముక్కల మిశ్రమాన్ని మురుగుకాలువను తెరవడానికి ఉపయోగిస్తారు. దీనికి కారణం ఈ మిశ్రమం మురుగుకాలువను శుభ్రపరుస్తుంది.
2A + 2NaOH – 2NaAlO2 + H2
c) Al తేలికయిన, బలమైన లోహం. గాలిలో క్షయం చెందదు. మంచి విద్యుద్వాహకం కాబట్టి దీనిని విమాన విడిభాగాలను తయారుచేయడానికి వాడతారు.
d) అల్యూమినియం పాత్రలను రాత్రంతా నీటిలో పెట్టకూడదు. ‘ ‘Al’ నీటితో చర్య జరిపి H2 ను ఉష్ణాన్ని విడుదల చేయును. దీనివలన రంగు పోతుంది. కొన్ని సందర్భాలలో Al సమ్మేళనాలు విషపూరితమైనవి.
e) అల్యూమినియం తీగలను ప్రసార కేబుల్ తయారీకి వాడతారు. దీనికి కారణం దాని యొక్క మంచి విద్యుద్వాహకత మరియు వాతావరణంలో లోహక్షమత్వం జరుగదు.
![]()
ప్రశ్న 8.
Ga, In మరియు Tl లలో ఋణవిద్యుదాత్మకత భేదం ఎందుకు ఎక్కువగా మారదో వివరించండి.
జవాబు:
- Ga, In మరియు Tl ల ఋణ విద్యుదాత్మక విలువలు 1.6, 1.7,1.8.
- Ga, In మరియుTl లో గల -ఎలక్ట్రాన్లు బాహ్య కక్ష్యలోని ఎలక్ట్రాన్లను సరిగా పరిరక్షణ చేయలేవు. (కేంద్రక ఆకర్షణ నుండి).
- దీనికి కారణం వివిధ ఆర్బిటాళ్ళ పరిరక్షణ ప్రభావం క్రమం
s > p> d > f. - Ga, In మరియు Tl లు ఒకే సంఖ్యలో ఉపాంత కర్పర ఎలక్ట్రాన్లను కలిగి ఉన్నాయి.
- కావున Ga, In మరియు Tl ల ఋణ విద్యుదాత్మక విలువల భేదం ఎక్కువగా మారదు.
ప్రశ్న 9.
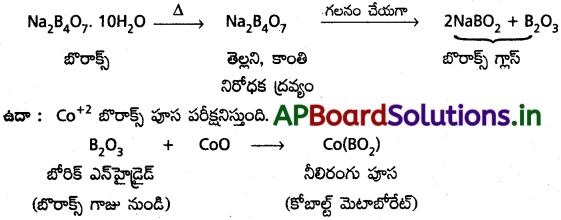
సరైన ఉదాహరణతో బోరాక్స్ పూస పరీక్షను వివరించండి. [Mar. ’13]
జవాబు:
బొరాక్స్ పూస పరీక్ష :
ఈ పరీక్షను గుణాత్మక విశ్లేషణలో కాటయాన్ల ను గుర్తించడానికి ఉపయోగిస్తారు. బొరాక్స్ను వేడి చేయడం వల్ల అది ఉబ్బి, కాంతి నిరోధక పదార్థం, అనార్ధ సోడియమ్ టెట్రా బోరేట్ అవుతుంది. దాన్ని గలనం చేస్తే బొరాక్స్ గ్లాస్ ఏర్పడుతుంది. అందులో సోడియమ్ మెటాబోరేట్, B2O3 లు ఉంటాయి. బోరిక్ ఎన్ హైడ్రైడ్, (B2O3), లోహపు ఆక్సైడ్తో కలిసి మెటాబోరేట్లను రంగుగల పూసలుగా ఏర్పడుతుంది. దీనిలో చర్యలు క్రింది విధంగా జరుగుతాయి.
ప్రశ్న 10.
డైబోరేన్ నిర్మాణాన్ని వివరించండి. [A.P. & T.S. Mar, ’15]
జవాబు:
డైబోరేన్ నిర్మాణం :
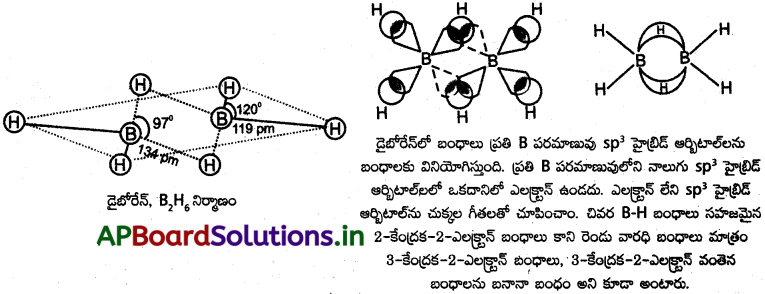
ఎలక్ట్రాన్ వివర్తన ప్రయోగాలు, రామన్ వర్ణపటం ఆధారంగా డైబోరేన్లో BH2 సమూహాలు ఉన్నాయని మిగిలిన రెండు హైడ్రోజన్లలో ఒక హైడ్రోజన్ పరమాణువు ఈ తలానికి పైన, వేరొక H పరమాణువు తలానికి క్రింద ఉన్నాయని తెలిసింది. ఈ రెండు H పరమాణువులు రెండు BH2 సమూహాలను కలుపుటకై వారధి వలె ఉంటాయి. అందువలన వాటిని వారధి హైడ్రోజన్లు అంటారు. ఈ వారధులు పైన ఒకటి క్రింద ఒకటి ఉంటాయి. ఈ వారధిలో ఒక్కొక్క దానిలో రెండు ఎలక్ట్రాన్లు మూడు పరమాణువులను కలుపుతాయి. అందువలన దీనిని మూడు కేంద్రకాలు గల ఎలక్ట్రాన్ జంట బంధం అంటారు. దీనినే బనానా బంధం అని లేక టౌ బంధం అనికూడా అంటారు.
డైబోరేన్ బోరాన్ పరమాణువు sp³ సంకరీకరణం పొందుతుంది. అపుడు ప్రతి బోరాన్ మీద నాలుగు sp³ సంకర ఆర్బిటాళ్ళు ఏర్పడతాయి. వాటిలో మూడింటిలో బంధ ఎలక్ట్రాన్లు ఉంటాయి. ఒక sp³ సంకర ఆర్బిటాల్ మాత్రం ఖాళీగా ఉంటాయి. ప్రతి బోరాన్ పరమాణువులోని బంధ ఎలక్ట్రాన్లు ఉన్న రెండు sp³ సంకర ఆర్బిటాళ్ళు రెండు H పరమాణువులలోని 1s ఆర్బిటాళ్ళతో ఆవరింపు చేసుకుని B – H బంధాలను ఇస్తాయి. ఇపుడు ఒక బోరాన్ వద్ద ఉన్న బంధ ఎలక్ట్రాన్ గల sp³ సంకర ఆర్బిటాల్ వేరొక బోరాన్ వద్ద గల ఖాళీ sp³ సంకర ఆర్బిటాల్ మరియు హైడ్రోజన్ యొక్క 1s ఆర్బిటాల్ కలిసి అస్థానీకృత ఆర్బిటాలు ఇస్తాయి. ఇందులోని జంట ఎలక్ట్రాన్లు మూడు కేంద్రకాలను ఆవరించుకుని రెండు BH2 సమూహాలున్న తలాలకు ఒకటి పైన రెండవది క్రింద ఉంటాయి. ఈ రకమైన బంధాలు డైబోరేన్లో రెండు ఉంటాయి.
దీనిలో Hb బ్రిడ్జిలో గల హైడ్రోజన్లను సూచిస్తుంది. ఒక తలంలో రెండు హైడ్రోజన్ల మధ్య కోణం 121.5°. వారధి హైడ్రోజన్ల మధ్య కోణం 97° ఉంటుంది.
దీనిలో ‘Hb‘ బ్రిడ్జిలో గల హైడ్రోజన్లను సూచిస్తుంది.
ప్రశ్న 11.
ఆమ్లాలతో అల్యూమినియం చర్యలను వివరించండి.
జవాబు:
ఆమ్లాలతో ‘Al’ చర్య :
i) విలీన లేదా గాఢ HCl, Al ని కరిగించుకుని H2 నిస్తాయి.
2 Al + 6 HCl → 2 AlCl + 3H2 ↑
ii) విలీన H2SO4 తో H2 ఉత్పన్నమవుతుంది.
2 Al + 3 H2SO4 → Al2(SO4)3 + 3 H2 ↑
గాఢ H2SO4, Al లోహాన్ని కరిగించుకుని SO2 ని ఇస్తుంది.
2 Al + 6 H2SO4 → Al2(SO4)3 + 3SO2 + 6 H2O
iii) అతివిలీన HNO3 ని NH4NO3 గా Al క్షయకరణం చేస్తుంది.
8 Al + 30 HNO3 → 8 Al(NO3)3 + 3 NH4NO3 + 9 H2O
గాఢ HNO3 తో ‘Al’ క్రియారహితం అవుతుంది. ఇది లోహపు తలంపై పలుచని ఆక్సైడ్ పొర ఏర్పడటం వల్ల క్రియారాహిత్యం వస్తుంది.
ప్రశ్న 12.
గ్రూపు 13లో బోరాన్ అసంగత ప్రవర్తనను సంక్షిప్తంగా రాయండి.
జవాబు:
బోరాన్ గ్రూపులో మిగతా మూలకాలతో చెప్పుకోతగినంత విభిన్నంగా ఉంటుంది. క్రింది అంశాలలో బోరాన్, మిగిలిన మూలకాల మధ్య తేడాలను చూడవచ్చు. పరమాణు సైజు చిన్నది కావటం, ఉపాంత కక్ష్య విన్యాసంలో తేడా ఈ భిన్న ప్రవృత్తికి కారణం కావచ్చు. బోరాన్ మొదటి అయొనైజేషన్ పొటన్షియల్ ఎక్కువగా ఉంటుంది.
- బోరాన్ ఒక అలోహం. Al ద్వంద్వ స్వభావం గల లోహం. Ga, In, Tl లు లోహాలు.
- బోరాన్ ఎప్పుడూ కోవలెంట్ సమ్మేళనాలను మాత్రమే ఏర్పరుస్తుంది. మిగిలిన మూలకాలు అయానిక సమ్మేళనాలను ఇవ్వవచ్చు.
- బోరాన్లు సిలికాన్తో కర్ణ సంబంధాలుంటాయి. ఇదే విధమయిన సంబంధాలను మిగిలిన మూలకాలు చూపించవు.
- ఆమ్లాల నుంచి హైడ్రోజను బోరాన్ స్థానభ్రంశం చేయదు. కానీ మిగతా మూలకాలు, లోహాలు కావడం వల్ల, అనుకూల పరిస్థితులలో హైడ్రోజన్ ను స్థానభ్రంశం చేస్తాయి.
- B2O3, SiO2 వలెనే ఆమ్లఆక్సైడ్, మిగతా మూలకాల ట్రై ఆక్సైడ్లు ద్విస్వభావ ఆక్సైడ్లుగానీ, క్షార ఆక్సైడ్లుగానీ అవుతాయి.
ఉదా : Al2O3 ⇒ ద్విస్వభావ ఆక్సైడ్, TlOH ⇒ బలమైన క్షారం. - B(OH)3 లేదా H3BO3 ఆమ్లం, ఇతర మూలకాల హైడ్రాక్సైడ్లు ద్విస్వభావమైనవి లేదా క్షార స్వభావం కలవి.
- సరళ బోరేట్లు, సిలికేట్లు తేలికగా పొలిమరీకరణం చెంది పాలీ ఆమ్లాలను ఇస్తాయి. మిగిలిన మూలకాలు ఆ విధమయిన పాలిమర్లను ఇవ్వవు.
- బోరాన్ అత్యధిక కోవలెన్సీ 4 మాత్రమే. కాని ఇతర మూలకాలకు అత్యధిక కోవలెన్సీ 6.
- బోరాన్ స్థిరమయిన కోవలెంట్ హైడ్రైడ్లనిస్తుంది. మిగిలిన మూలకాలతో స్థిరమయిన హైడ్రోజన్ సమ్మేళనాలు ఏర్పరచటం కష్టం.
- బోరాన్ ఎప్పుడూ కాటయాన్ గా కనబడదు. అయితే ఇతర మూలకాలు త్రి సంయోజక కాటయాన్లున్న చాలా సమ్మేళనాలను ఇస్తాయి.
- BF3 మినహా మిగిలిన బోరాన్ హాలైడ్లు జలవిశ్లేషణ తేలిగ్గా జరుపుతాయి. జల విశ్లేషణ తీవ్ర చర్య. కాని ఇతర మూలకాల హాలైడ్లు పాక్షిక జల విశ్లేషణను జరుపుతాయి లేదా అసలు జరపవు.
ప్రశ్న 13.
అల్యూమినియం సజల HNO3 చర్య జరుపుతుంది కాని గాఢ HNO3 తో చర్య జరుపదు. వివరించండి.
జవాబు:
a) అతి విలీన HNO3 ని NH4NO3 గా Al క్షయకరణం చేస్తుంది.

b) గాఢ HNO3 తో Al క్రియారహితం అవుతుంది. ఇది లోహపు తలంపై పలుచని ఆక్సైడ్ పొర ఏర్పడటం వల్ల క్రియా రాహిత్యం వస్తుంది.
ప్రశ్న 14.
డైబోరేన్ను తయారుచేసే రెండు పద్ధతులు రాయండి. [Mar. ’14]
జవాబు:
డైబోరేన్ న్ను (B2H6) తయారు చేయు విధానాలు :
1. పారిశ్రామిక పద్ధతి : బోరాన్ ట్రై ఫ్లోరైడ్ను లిథియమ్ హైడ్రైడ్తో 450° K వద్ద క్షయీకరించడం.
2 BF3 + 6 LiH → B2H6 + 6 LiF
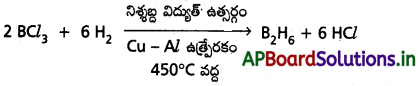
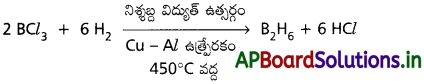
2. ప్రయోగశాల పద్ధతి :
a) బోరాన్ ట్రైక్లోరైడ్ను లిథియమ్ అల్యూమినియమ్ హైడ్రైడ్తో పొడి ఈథర్లో క్షయకరణం చేయడం. దీనిలో దిగుబడి 99.4% B2H6
![]()
b) బోరాన్ ట్రై క్లోరైడ్, హైడ్రోజన్ మిశ్రమంలో నిశ్శబ్ద విద్యుత్ ఉత్సర్గం జరిపితే B2H6 తయారవుతుంది.
ప్రశ్న 15.
డైబోరేన్ ఈ కిందివాటితో ఏ విధంగా చర్య జరుపుతుంది?
a) H2O b) CO c) N(CH3)3
జవాబు:
a) H2O తో చర్య :
B2H6 నీటితో చర్యజరిపి బోరికామ్లాన్ని ఇస్తుంది. హైడ్రోజన్ వెలువడుతుంది.
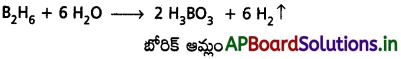
b) డైబోరేన్ (B2H6) ఈ క్రింది పరిస్థితులలో ‘CO’ తో చర్యనొందుతుంది.
i) 1000°C ఉష్ణోగ్రత
మరియు ii) 2 అట్మా.
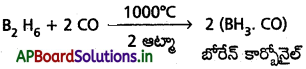
c) డైబోరేన్ N(CH3)3 తో చర్య జరిపి అడక్ట్ (సంకలన సమ్మేళనం) ను ఏర్పరచును.
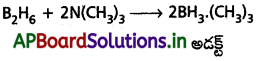
ప్రశ్న 16.
Al2O3 ద్విస్వభావం కలదని సరైన చర్యలతో వివరించండి.
జవాబు:
- ద్విస్వభావ ఆక్సైడ్లు ఆమ్ల మరియు క్షార రెండు స్వభావాలను కలిగి ఉంటాయి.
- Al2O3 ద్విస్వభావ ఆక్సైడ్ ఆమ్ల మరియు క్షార రెండు స్వభావాలను కలిగి ఉంటుంది.
- A2O3 ఆమ్లాలతో క్షారాలతో రెండింటితో చర్య జరిపి లవణాలను, నీటిని ఏర్పరుస్తుంది.
చర్యలు :
ఆమ్లాలతో
Al2O3 + 6HCl → 2AlCl3 + H2O
క్షారాలతో :
Al2O3 + 2NaOH → 2NaAlO2 + H2O
ప్రశ్న 36.
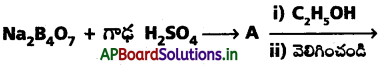
B (ఆకుపచ్చని అంచుజ్వాల) A, B లను గుర్తించండి.
(సూచన : A = H3BO3 B = (C2H5)3 BO3. )
జవాబు:
దీర్ఘ సమాధాన ప్రశ్నలు
ప్రశ్న 1.
బోరాక్స్న, బోరిక్ ఆమ్లాన్ని ఎలా తయారుచేస్తారు ? వాటిమీద ఉష్ణం చర్యను వివరించండి.
జవాబు:
బోరాక్స్ తయారీ :
బోరిక్ ఆమ్లంను వేడిచేయగా టెట్రాబోరిక్ ఆమ్లం ఏర్పడును. దీనిని NaOH తో చర్య జరుపగా బోరాక్స్ ఏర్పడును.
![]()
బోరిక్ ఆమ్లం తయారీ :
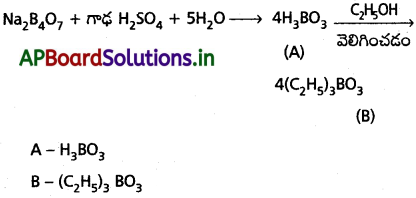
బోరాక్స్న గాఢ H2SO4 తో చర్య జరిపినపుడు బోరిక్ ఆమ్లం ఏర్పడును.
Na2B4O7 + H2SO4 + 5H2O → 4H3BO3 + Na2SO4
బోరాక్స్న వేడిచేయగా :
బోరాక్సన్న ప్రబలంగా వేడిచేస్తే చివరగా గాజువంటి పదార్థం ఏర్పడును.
ప్రశ్న 2.
డైబోరేన్ ను ఎలా తయారుచేస్తారు ? దాని నిర్మాణాన్ని వివరించండి.
జవాబు:
డైబోరేన్ న్ను (B2H6) తయారు చేయు విధానాలు :
1. పారిశ్రామిక పద్ధతి : బోరాన్ ట్రై ఫ్లోరైడ్ను లిథియమ్ హైడ్రైడ్తో 450° K వద్ద క్షయీకరించడం.
2 BF3 + 6 LiH → B2H6 + 6 LiF
2. ప్రయోగశాల పద్ధతి :
a) బోరాన్ ట్రైక్లోరైడ్ను లిథియమ్ అల్యూమినియమ్ హైడ్రైడ్తో పొడి ఈథర్లో క్షయకరణం చేయడం. దీనిలో దిగుబడి 99.4% B2H6
![]()
b) బోరాన్ ట్రై క్లోరైడ్, హైడ్రోజన్ మిశ్రమంలో నిశ్శబ్ద విద్యుత్ ఉత్సర్గం జరిపితే B2H6 తయారవుతుంది.
డైబోరేన్ నిర్మాణం :
ఎలక్ట్రాన్ వివర్తన ప్రయోగాలు, రామన్ వర్ణపటం ఆధారంగా డైబోరేన్లో ఒకే తలంలో ఉండే రెండు BH2 సమూహాలు ఉన్నాయని మిగిలిన రెండు హైడ్రోజన్లలో ఒక హైడ్రోజన్ పరమాణువు ఈ తలానికి పైన, వేరొక H పరమాణువు తలానికి క్రింద ఉన్నాయని తెలిసింది. ఈ రెండు H పరమాణువులు రెండు BH2 సమూహాలను కలుపుటకై వారధి వలె ఉంటాయి. అందువలన వాటిని వారధి హైడ్రోజన్ లు అంటారు. ఈ వారధులు పైన ఒకటి క్రింద ఒకటి ఉంటాయి. ఈ వారధిలో ఒక్కొక్క దానిలో రెండు ఎలక్ట్రాన్లు మూడు పరమాణువులను కలుపుతాయి. అందువలన దీనిని మూడు కేంద్రకాలు గల ఎలక్ట్రాన్ జంట బంధం అంటారు. దీనినే బనానా బంధం అని లేక టౌ బంధం అనికూడా అంటారు.
డైబోరేన్ బోరాన్ పరమాణువు sp³ సంకరీకరణం పొందుతుంది. అపుడు ప్రతి బోరాన్ మీద నాలుగు sp³ సంకర ఆర్బిటాళ్ళు ఏర్పడతాయి. వాటిలో మూడింటిలో బంధ ఎలక్ట్రాన్లు ఉంటాయి. ఒక sp³ సంకర ఆర్బిటాల్ మాత్రం ఖాళీగా ఉంటాయి. ప్రతి బోరాన్ పరమాణువులోని బంధ ఎలక్ట్రాన్లు ఉన్న రెండు sp³ సంకర ఆర్బిటాళ్ళు రెండు H పరమాణువులలోని 1s ఆర్బిటాళ్ళతో ఆవరింపు చేసుకుని B – H బంధాలను ఇస్తాయి. ఇపుడు ఒక బోరాన్ వద్ద ఉన్న బంధ ఎలక్ట్రాన్ గల sp³ సంకర ఆర్బిటాల్ వేరొక బోరాన్ వద్ద గల ఖాళీ sp³ సంకర ఆర్బిటాల్ మరియు హైడ్రోజన్ యొక్క 1s ఆర్బిటాల్ కలిసి అస్థానీకృత ఆర్బిటాల్ను ఇస్తాయి. ఇందులోని జంట ఎలక్ట్రాన్లు మూడు కేంద్రకాలను ఆవరించుకుని రెండు BH2 సమూహాలున్న తలాలకు ఒకటి పైన రెండవది క్రింద ఉంటాయి. ఈ రకమైన బంధాలు డైబోరేన్లో రెండు ఉంటాయి.

దీనిలో Hb బ్రిడ్జిలో గల హైడ్రోజన్లను సూచిస్తుంది. ఒక తలంలో రెండు హైడ్రోజన్ల మధ్య కోణం 121.5°. వారధి హైడ్రోజన్ల మధ్య కోణం 97° ఉంటుంది.
దీనిలో ‘Hb‘ బ్రిడ్జిలో గల హైడ్రోజన్లను సూచిస్తుంది.
![]()
ప్రశ్న 3.
డైబోరేన న్ను తయారుచేసే ఏవైనా రెండు పద్ధతులు రాయండి. అది ఈ కింది వాటితో ఏ విధంగా చర్య జరుపుతుంది?
a) కార్బన్ మోనాక్సైడ్ b) అమ్మోనియా
జవాబు:
డైబోరేన్ను (B2H6) తయారు చేయు విధానాలు :
1. పారిశ్రామిక పద్ధతి : బోరాన్ ట్రై ఫ్లోరైడ్ను లిథియమ్ హైడ్రైడ్తో 450° K వద్ద క్షయీకరించడం.
2 BF3 + 6 LiH → B2H6 + 6 LiF
2. ప్రయోగశాల పద్ధతి :
a) బోరాన్ ట్రైక్లోరైడ్ను లిథియమ్ అల్యూమినియమ్ హైడ్రైడ్తో పొడి ఈథర్లో క్షయకరణం చేయడం. దీనిలో దిగుబడి 99.4% B2H6.
![]()
b) బోరాన్ ట్రై క్లోరైడ్, హైడ్రోజన్ మిశ్రమంలో నిశ్శబ్ద విద్యుత్ ఉత్సర్గం జరిపితే B2H6 తయారవుతుంది.

c) డైబోరేన్ (B2H6) ఈ క్రింది పరిస్థితులలో ‘CO’ తో చర్యనొందుతుంది.
i) 1000°C ఉష్ణోగ్రత మరియు ii) 2 అట్మా పీడనం
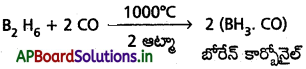
d) బోరాన్ హైడ్రైడ్ (డైబోరేన్, B2H6) మరియు NH3 ల మిశ్రమాన్ని వేడిగొట్టం ద్వారా పంపినపుడు బోరజోల్ ఏర్పడును.
120°C వద్ద అమ్మోనియాతో చర్య జరిపి డై అమ్మోనియేట్ ఆఫ్ డైబోరేన్ను ఇస్తుంది. దీనిని వేడిచేస్తే బోరజోల్ అనే సమ్మేళనం ఏర్పడుతుంది. బోరజోల్కు బెంజీన్ ను పోలిన చక్రీయ నిర్మాణం, ధర్మాలు ఉంటాయి. అందువలన బోరజోల్ను ఇనార్గినిక్ బెంజీన్ అంటారు.
![]()
సాధించిన సమస్యలు (Solved Problems)
ప్రశ్న 1.
Al3+, Al, Tl3+/Tl ల ప్రమాణ ఎలక్ట్రోడ్ శక్మాల EΘ విలువలు వరుసగా -1.66 V, + 1.26 V, ద్రావణంలో M3+ అయాన్ ఏర్పాటు గురించి ఊహించి రెండు లోహాల ధన విద్యుదాత్మక స్వభావాన్ని పోల్చండి.
సాధన:
రెండు అర్ధఘటచర్యల ప్రమాణ ఎలక్ట్రోడ్ శక్మాల విలువలు అల్యూమినియంకు Al3+(జల) అయాన్లుగా మారే ప్రవృత్తి ఎక్కువని సూచిస్తుంది. ద్రావణంలో Tl3+ అస్థిరమైనదే కాకుండా అది బలమైన ఆక్సీకరణి కూడా. అందువల్ల Tl+ ద్రావణంలో Tl3+ కంటే ఎక్కువ స్థిరమైనది. అల్యూమినియమ్ తేలికగా Al3+ అయాన్లను ఏర్పరుస్తుంది కనుక థాలియమ్ కంటే ఎక్కువ ధన విద్యుదాత్మక స్వభావం ఉంటుంది.
ప్రశ్న 2.
అనార్ద్ర అల్యూమినియం క్లోరైడ్ సీసా చుట్టూ తెల్లటి పొగలు కనబడతాయి. కారణం తెలపండి.
సాధన:
ఆర్ద్ర వాతావరణంలో అనార్ద్ర అల్యూమినియం క్లోరైడ్ పాక్షికంగా జలవిశ్లేషన చెంది HCl వాయువును విడుదల చేస్తుంది. ఆర్ద్ర HCl తెల్లని రంగులో కనబడుతుంది.
ప్రశ్న 3.
బోరాన్కు BF63- అయాన్ను ఏర్పరిచే సమర్ధత లేదు. వివరించండి.
సాధన:
బోరాన్లో d ఆర్బిటాల్ల లభ్యత లేదు కనక బోరాన్కు దాని అష్టకాన్ని విస్తరింపజేసే సామర్థ్యం లేదు. అందువల్ల బోరాన్ గరిష్ఠ సమయోజనీయత 4 కంటే మించదు.
![]()
ప్రశ్న 4.
బోరికామ్లం బలహీన ఆమ్లం. ఎందుకు?
సాధన:
ఎందుకంటే ఇది స్వతహాగా H+ అయాన్లను విడుదల చేయలేదు. ఇది అష్టక ప్రాప్తి పొందడానికి నీటి నుంచి OH అయాన్లను గ్రహించడం ద్వారా H+ అయాన్లను విడుదల చేస్తుంది.