Andhra Pradesh BIEAP AP Inter 1st Year Chemistry Study Material 13th Lesson కర్బన రసాయన శాస్త్రం – సామాన్య సూత్రాలు, విధానాలు Textbook Questions and Answers.
AP Inter 1st Year Chemistry Study Material 13th Lesson కర్బన రసాయన శాస్త్రం – సామాన్య సూత్రాలు, విధానాలు
అతిస్వల్ప సమాధాన ప్రశ్నలు
ప్రశ్న 1.
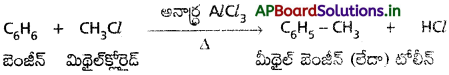
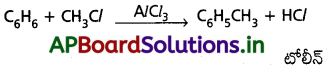
బెంజీన్ ను మిథైల్ బెంజీన్ గా మార్చడానికి అవసరమైన కారకాలు రాయండి.
జవాబు:
“ఫ్రీడల్ క్రాఫ్ట్ మిథైలేషన్” విధానంలో బెంజీన్ ను మిథైల్ బెంజీన్ గా మారుస్తారు.
ఈ చర్యకు అవసరమైన కారకాలు :
బెంజీన్, మిథైల్ క్లోరైడ్ మరియు అనార్ద్ర AlCl3.
చర్యా సమీకరణం :
ప్రశ్న 2.
నైట్రో బెంజీన్ ను ఎలా తయారు చేస్తారు?
జవాబు:
బెంజీన్ ను నైట్రేషన్ మిశ్రమం (గాఢ HNO3 + గాఢ H2SO4) తో 60°C కన్న తక్కువ ఉష్ణోగ్రత వద్ద చర్య జరుపగా నైట్రోబెంజీన్ ఏర్పడుతుంది.

ప్రశ్న 3.
ఈథేన్ అనురూపకాలను రాయండి.
జవాబు:
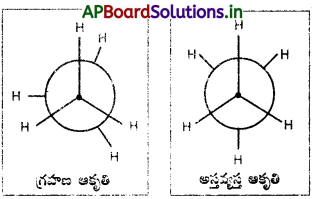
ఈథేన్ – అనురూపాత్మక సాదృశ్యములు :
ఈథేన్ అణువులో ఒక కర్బన పరమాణువు స్థానమును స్థిరీకరించి, రెండవ కర్బన పరమాణువును ‘C – C’ బంధ అక్షముపై చక్ర భ్రమణము చేయుటవలన అనేక ప్రాదేశిక అమరికలు గల రూపములు లభించును. ఈ రూపములను అనురూపాత్మక సాదృశ్యములందురు.
ఈథేన్ ప్రధాన అనురూపాత్మక సాదృశ్యములు :
i) గ్రహణ ఆకృతి (eclipsed form)
ii) అస్తవ్యస్త ఆకృతి (staggered form)
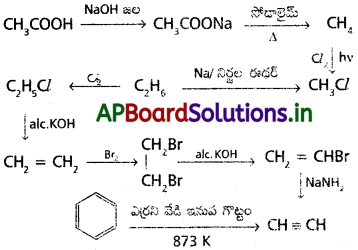
ప్రశ్న 4.
ఇథిలీన్ నుంచి ఈథైల్ క్లోరైడ్ను ఎలా తయారుచేస్తారు?
జవాబు:
ఇథిలీన్ ను హైడ్రోజన్ క్లోరైడ్తో సంకలనం చేయగా ఈథైల్ క్లోరైడ్ ఏర్పడుతుంది.

ప్రశ్న 5.
కింది నిర్మాణాల IUPAC నామాలు రాయండి.
a) CH3 – CH2 – CH2 – CH = CH2
జవాబు:
a) CH3 – CH2 – CH2 – CH = CH2
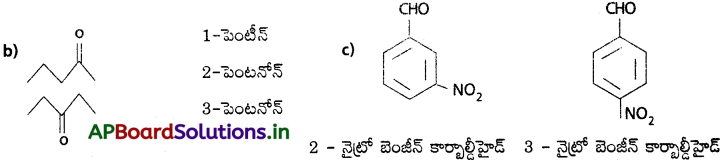
ప్రశ్న 6.
కింది వాటి నిర్మాణాలను రాయండి.
i) ట్రైక్లోరో ఇథనాయిక్ ఆమ్లం,
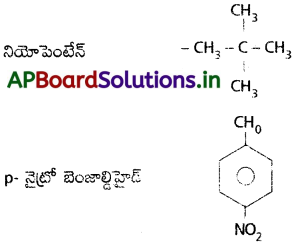
ii) నియోపెంటేన్
iii) p-నైట్రో బెంజాల్డిహైడ్
జవాబు:
ట్రైక్లోరో ఇధనాయిక్ ఆమ్లం – CCl3 – COOH
ప్రశ్న 7.
లాసజీన్ చర్యను వివరించండి.
జవాబు:
- పొడిగా ఉన్న చిన్న Na లోహాన్ని గలన స్థితిలో మారే వరకు గలన నాళికలో వేడి చేయవలెను.
- ఈ గలన Na కు కర్బన సమ్మేళనం కలిసి ఎర్రగా మారేవరకు వేడి చేయవలెను.
- చైనా పాత్రలో ఈ ఎర్రగా కాలిన నాళికను వేసి నీటిని కలిపి మరిగించి చల్లబరచి వడపోయవలెను.
- ఈ వడపోత ద్రావణాన్ని లాసైన్ కషాయం అంటారు.
- ఈ పరీక్ష N, S, హలోజన్లను గుర్తించుటకు ఉపయోగపడను.
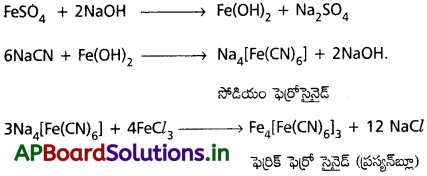
నైట్రోజన్ న్ను గుర్తించుట :
లాసైన్ కషాయానికి సజల NaOH, అపుడే తయారు చేసిన FeSO4, కలిపి వేడిచేసి కొద్ది చుక్కల FeCl3, కలపవలెను మరియు ఆమ్లీకృతం చేయుటకు HCL (లేదా) H2SO4 కలుపవలెను. ప్రశ్యన్ బ్లూ రంగు ఏర్పడినది.
Na + C + N → NaCN
2NaCN + FeSO4 → Na2SO4 + Fe(CN)2
Fe(CN)2 + 4NaCN → Na4[Fe(N)6]
3Na4[Fe(CN)6] + 4FeCl3 → Fe4[Fe(CN)6]3 + 12NaCl
ప్రశ్యన్ బ్లూ
![]()
ప్రశ్న 8.
క్రొమటోగ్రఫీ సిద్ధాంతాన్ని వివరించండి.
జవాబు:
క్రోమటోగ్రఫీ :
స్వెట్ (Tswett 1906) ఒక వృక్ష శాస్త్రవేత్త. ఈయన వృక్షాల నుంచి నిష్కరించిన క్లోరోఫిల్, క్సాంతోఫిల్ ఇతర సమ్మేళనాలను కాల్షియం కార్బొనేట్ కాలమ్ ద్వారా ప్రసరింపచేసి (Percolate) వేరు పరచాడు. ఇక్కడ కాల్షియం కార్బొనేట్ కాలమ్ అధిశోషకంగా (adsorbent) గా పనిచేస్తుంది. విభిన్న సమ్మేళనాలు విభిన్న పరిమితుల్లో అధిశోషణం చెందడం వల్ల కాలమ్లో విభిన్న స్థానాల్లో విభిన్న రంగుల పట్టీలు వచ్చాయి. స్వెట్ ఈ రంగుల పట్టీలకు క్రోమటోగ్రామ్ అని పేరు పెట్టాడు. ఈ పద్ధతిని క్రోమటోగ్రఫీ అన్నాడు. కాల్షియం కార్బొనేట్ కాలమ్ కదలిక లేనిది కాబట్టి దీనిని స్థిర (Stationary) ప్రావస్థ అంటారు. వృక్ష సంబంధ నిష్కర్ష పదార్థాల ద్రావణాన్ని చలనశీల (Mobile) ప్రావస్థ అంటారు. క్రోమటోగ్రఫీని ఒక మిశ్రమంలోని అనుఘటకాలను స్థిరప్రావస్థ, చలనశీల ప్రావస్థ అనే రెండు ప్రావస్థతి మధ్య వేరు పరచే విధానంగా అభివృద్ధి చేశారు.
ప్రశ్న 9.
జలభాష్ప స్వేదనంలో కర్బన ద్రవం దాని బాష్పీభవన స్థానం కంటే తక్కువ ఉష్ణోగ్రత వద్ద ఎందుకు ఆవిరిగా మారుతుంది?
జవాబు:
జల బాష్ప స్వేదనం (Steam distillation) :
ఈ పద్ధతిలో నీటిలో కరగని, బాష్పీభవన స్థానం ఎక్కువగా ఉన్న, జల బాష్పంతో బాష్పశీలత పొందే ద్రవాల్ని శుద్ధి చేస్తారు. ఈ విధానంలో వేడి మలిన ద్రవంలోకి నీటి ఆవిరిని పంపుతారు. నీటి ఆవిరి, ద్రవపు బాష్పం కలిసి బయటకొస్తాయి. దీనికి కారణం నీటి బాష్పం, ద్రవ బాష్పం రెండింటి మొత్తం పీడనం బాహ్య వాతావరణ పీడనానికి సమానమవడమే. ఈ నీటి ఆవిరి ద్రవ బాష్పం రెండూ కండెన్సర్ ద్వారా ప్రయాణించి ద్రవ మిశ్రమమై సంగ్రహణ పాత్రలో చేరతాయి. అవి ఒకదానితో ఒకటి కలిసిపోవు కాబట్టి వేర్పాటు గరాటుతో వేరు చేయవచ్చు.
ప్రశ్న 10.
కింది వాటిని వివరించండి.
(a) స్ఫటికీకరణం (b) స్వేదనం
జవాబు:
a) స్ఫటికీకరణం (Crystalisation) :
ఇందులో ఉన్న సూత్రం ఇచ్చిన ద్రావణిలో మలినాలు అసలు కరగకపోవడం లేదా ఏ ఉష్ణోగ్రత దగ్గరైనా పూర్తిగా కరగడం గాలితం (filtrate) లోకి రావడం కర్బన రసాయన పదార్ధం మాత్రం గది ఉష్ణోగ్రత వద్ద ఆ ద్రావణిలో దాదాపు కరగకుండా ఎక్కువ ఉష్ణోగ్రత వద్ద అంటే ద్రావణి బాష్పీభవన ఉష్ణోగ్రత దగ్గర కరిగిపోవడం.
b) ఉత్పతనం (Sublimation) :
కొన్ని ఘన పదార్థాలు వేడి చేసినప్పుడు కరిగి ద్రవస్థితికి రాకుండా నేరుగా బాష్పస్థితికి వెళ్ళడం మనకు తెలుసు. ఆ బాష్పాలు తిరిగి చల్లబరచినప్పుడు ద్రవంగా ద్రవీకరణం చెందకుండా నేరుగా ఘనపదార్థాన్నిస్తాయి. ఈ విధానాన్నే ఉత్పతనం అంటారు.
స్వల్ప సమాధాన ప్రశ్నలు
ప్రశ్న 1.
కింది చర్యలను పూరించి A,B,C ఉత్పన్నాల నామాలు రాయండి. [T.S. Mar. ’15]
![]()
జవాబు:
ప్రశ్న 2.
కింది చర్యలో ఏర్పడిన A,B,C ఉత్పన్నాల పేర్లను రాసి, చర్యా సమీకరణాన్ని రాయండి. [T.S. Mar. ’15.]
![]()
జవాబు:

ప్రశ్న 3.
ఎసిటిలీన్ a. బ్రోమిన్ b. హైడ్రోజన్తో ఎట్లా చర్య జరుపుతుంది? పై చర్యలకు సమీకరణాలు రాసి ఉత్పన్నాల పేర్లను తెలపండి.
జవాబు:
a. బ్రోమిన్తో చర్య :
ఎసిటిలీన్ను బ్రోమిన్ సంకలనం చేయగా మొదట ఎసిటిలీన్ డైబ్రోమైడ్ పిదప ఎసిటిలీన్ టెట్రాబ్రోమైడ్ ఏర్పడుతుంది.
b. హైడ్రోజన్తో చర్య :
ఎసిటిలీన్ ను నికెల్ ఉత్ప్రేరకం సమక్షంలో హైడ్రోజన్తో వేడిచేయగా సంకలనం చెంది మొదట ఇథిలిన్ పిదప ఈథేన్ ఏర్పడుతుంది.
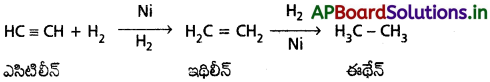
ప్రశ్న 4.
ప్రతిక్షేపణ చర్య అంటే ఏమిటి? ఏవైనా రెండు బెంజీన్ ప్రతిక్షేపక చర్యలను తెలపండి.
జవాబు:
ఎలక్ట్రోఫిలిక్ ప్రతిక్షేపణ చర్య :
కర్బన సమ్మేళనంలోని ఏదేని పరమాణువు లేక పరమాణువుల సమూహాన్ని ధనావేశిత ఆయాన్ (ఎలక్ట్రోఫైల్)తో ప్రతిక్షేపించుటను ఎలక్ట్రోఫిలిక్ ప్రతిక్షేపణ చర్య అంటారు.
బెంజీన్ ప్రతిక్షేపణ చర్యలు :
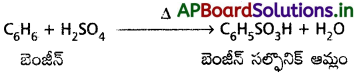
1. సల్ఫోనీకరణం :
బెంజీన్, సధూమ సల్ఫ్యూరిక్ ఆమ్లంతో చర్య జరుపగా బెంజీన్ సల్ఫోనిక్ ఆమ్లం ఏర్పడుతుంది.
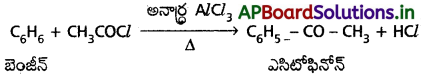
2. ఎసిటైలేషన్:
బెంజీన్ అనార్ద్ర అల్యూమినియం క్లోరైడ్ ఉత్ప్రేరకం సమక్షంలో ఎసిటైల్ క్లోరైడ్ (CH3 COCI) తో చర్య జరుపగా ఎసిటోఫినోస్ (మిథైల్ ఫినైల్ కీటోన్) ఏర్పడుతుంది.
ప్రశ్న 5.
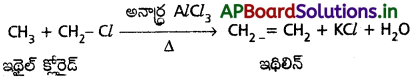
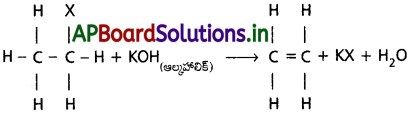
డీహైడ్రోహాలోజినేషన్ చర్య అంటే ఏమిటి? ఆల్కైల్ హాలైడ్ నుంచి ఆల్కీన్ ఏర్పడే చర్యను రాయండి.
జవాబు:
డీహైడ్రోహాలోజనీకరణం :
ఒక సమ్మేళనంలో ప్రక్కప్రక్కన గల కార్బన్ పరమాణువుల నుండి హైడ్రోజన్ మరియు హేలోజన్ పరమాణువులను హైడ్రోజన్ హేలైడ్ అణువుగా తొలగించు చర్యను డీహైడ్రో హేలోజనీకరణం అంటారు.
ఆల్కైల్ హాలైడ్ నుండి ఆల్కీన్ ఏర్పడు చర్య :
ఆల్కైల్ హేలైడ్ను ఆల్కహాలిక్ పోటాషియం హైడ్రాక్సైడ్తో వేడిచేయగా డీహైడ్రో హేలోజనీకరణం చెంది ఆల్కీన్ (ఇథిలిన్) ఏర్పడుతుంది.
ప్రశ్న 6.
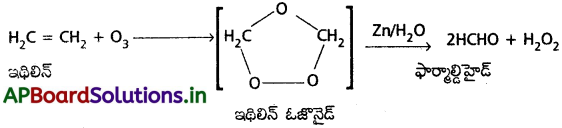
ఓజోన్ తో ఎటువంటి సమ్మేళనాలు చర్యనొందుతాయి? ఏదైనా ఒక ఉదాహరణతో వివరించండి.
జవాబు:
ఓజొనోలిసిస్ :
అసంతృప్త హైడ్రోకార్బన్లు ఓజోన్ తో చర్య జరుపగా అస్థిరమైన ఓజోనైడ్లు ఏర్పడతాయి. ఇవి జలవిశ్లేషణ చెంది కార్బోనైల్ సమ్మేళనాలను ఏర్పరుస్తాయి. ఈ చర్యను ఓజోనీకరణం (ఓజొనోలిసిస్) అంటారు.
అసంతృప్త హైడ్రోకార్బన్లు ఓజొనీకరణంలో పాల్గొంటాయి. ఉదా : ఇథిలిన్, ఓజోన్తో చర్య జరుపగా అస్థిరమైన ఇథిలిన్ ఓజోనైడ్ ఏర్పడుతుంది. ఇది జలవిశ్లేషణ చెంది ఫార్మాల్డిహైడ్ ఏర్పడుతుంది.
ప్రశ్న 7.
స్థాన సాదృశ్యానికీ, ప్రమేయ సాదృశ్యానికీ క్రమంగా రెండు ఉదాహరణలు ఇవ్వండి. [Mar. ’14]
జవాబు:
ప్రమేయ సమూహ సాదృశ్యం :
“ఒకే అణుఫార్ములా కలిగి వాటి ప్రమేయ సమూహంలో భేదాన్ని ప్రదర్శించు కర్బన సమ్మేళనాలను ప్రమేయ సమూహ సాదృశ్యాలు అని, ఆ ధర్మాన్ని ప్రమేయ సమూహ సాదృశ్యం అని అంటారు”.
ఉదా : C2H6O కు రెండు ప్రమేయ సాదృశ్యాలు కలవు.

స్థానసాదృశ్యం :
“ఒకే అణుఫార్ములా కలిగి వాటి ప్రమేయ సమూహం లేక ప్రతిక్షేపకం యొక్క స్థానంలో భేదాన్ని ప్రదర్శించు కర్బన సమ్మేళనాలను స్థాన సాదృశ్యాలు అని, ఆ ధర్మాన్ని స్థాన సాదృశ్యం అని అంటారు”.

ప్రశ్న 8.
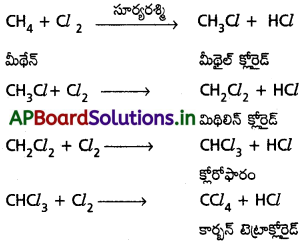
మీథేన్ హాలోజనీకరణం చర్యాగతిని రాయండి.
జవాబు:
మీథేన్ సూర్యకాంతి సమక్షంలో క్లోరిన్తో చర్య జరుపగా అనేక ప్రతిక్షేపణ ఉత్పన్నాలు ఏర్పడతాయి. ఈ చర్యలలో ప్రతి దశలోనూ మీథేన్లోని ఒక హైడ్రోజన్, క్లోరిన్ పరమాణువుచే ప్రతిక్షేపించబడుతుంది.
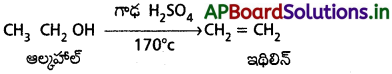
ప్రశ్న 9.
ఈథైల్ ఆల్కహాల్ నుంచి ఇథిలీన్ ను ఎట్లా తయారుచేస్తారు?
జవాబు:
ఇథైల్ ఆల్కహాల్ 170°C వద్ద H2SO4 తో చర్యనొంది నిర్జలీకరణమునకు లోనై ఇథిలీన్ ఏర్పరుస్తుంది.
ప్రశ్న 10.
కింది వాటితో ఎసిటిలీన్ చర్యలను వివరించండి.
a) Na/NH, b) క్రోమిక్ ఆమ్లం సమీకరణాలను, ఉత్పన్నాల పేర్లను రాయండి.
జవాబు:
a) అమ్మోనియాలో సోడియం లోహంతో చర్య :
ఎసిటిలీన్ పై కారకంతో చర్యనొంది మోనోసోడియం ఎసిటిలైడ్ మరియు డైసోడియం ఎసిటిలైట్లనిస్తుంది.
H – C ≡ C – H + Na → H – C ≡ C – Na + \(\frac{1}{2}\)H2
H – C ≡ C -Na → Na – C ≡ C – Na + \(\frac{1}{2}\)H2
b) క్రోమిక్ ఆమ్లంతో చర్య :
క్రోమిక్ ఆమ్లంతో ఎసిటిలీన్ ఆక్సీకరణానికి లోనై ఎసిటిక్ ఆమ్లమునిచ్చును.
![]()
ప్రశ్న 11.
కర్బన ద్రవాలను శుద్ధిచేసే ప్రక్రియలు – స్ఫటికీకరణం, ఉత్పతనాలను వివరించండి.
జవాబు:
స్ఫటికీకరణం (Crystalisation) :
ఇందులో ఉన్న సూత్రం ఇచ్చిన ద్రావణిలో మలినాలు అసలు కరగకపోవడం లేదా ఏ ఉష్ణోగ్రత దగ్గరైనా పూర్తిగా కరగడం గాలితం (filtrate) లోకి రావడం కర్బన రసాయన పదార్ధం మాత్రం గది ఉష్ణోగ్రత వద్ద ఆ ద్రావణిలో దాదాపు కరగకుండా ఎక్కువ ఉష్ణోగ్రత వద్ద అంటే ద్రావణి బాష్పీభవన ఉష్ణోగ్రత దగ్గర కరిగిపోవడం.
పద్ధతి :
మలిన సమ్మేళనాన్ని సరయిన ద్రావణిలో ఉంచాలి. కొన్ని మలినాలు కరిగితే మరికొన్ని కరగకపోవచ్చు. వేడి చేస్తుంటే సమ్మేళనం కరగడం మొదలవుతుంది. ఉష్ణోగ్రత పెరిగే కొద్దీ సమ్మేళనం కరుగుదల పెరుగుతుంది. ఈ విధంగా సమ్మేళనాన్ని సాధ్యమయినంత తక్కువ ద్రావణిలో దాని బాష్పీభవన స్థానం దగ్గరలో కరిగించి ద్రావణాన్ని దాదాపు సంతృప్త ద్రావణం వచ్చే వరకు మరిగించి గాఢత పెంచాలి. వెంటనే ఆ వేడి ద్రావణాన్ని వడపోయాలి. ద్రావణాన్ని నెమ్మదిగా చల్లారనిస్తే సమ్మేళనం స్ఫటికీకరణం చెందుతుంది. స్ఫటికాలను బక నర్ గరాటు ఉపయోగించి తక్కువ పీడనంలో వడపోసి వేరు చేయాలి. కరిగిన మలినాలు ద్రావణంలో మిగిలిపోతాయి. స్ఫటికీకరణం అనేకమార్లు చేయాలి. ఏవైనా రంగు మలినాలుంటే వాటిని ఉత్తేజిత బొగ్గుపై అధిశోషణం చెందించాలి. ఈ పద్దతి ఘన సమ్మేళనాలను శుద్ధి చేయడానికి ఉపయోగిస్తారు.
ఉత్పతనం (Sublimation) :
కొన్ని ఘన పదార్థాలు వేడి చేసినప్పుడు కరిగి ద్రవస్థితికి రాకుండా నేరుగా బాష్పస్థితికి వెళ్ళడం మనకు తెలుసు. ఆ బాష్పాలు తిరిగి చల్లబరచినప్పుడు ద్రవంగా ద్రవీకరణం చెందకుండా నేరుగా ఘనపదార్థాన్నిస్తాయి. ఈ విధానాన్నే ఉత్పతనం అంటారు.
పద్ధతి:
సమ్మేళనానికి దాని ద్రవీభవన స్థానం కంటే తక్కువ ఉష్ణోగ్రతలోనే అధిక బాష్పపీడనం ఉండి వేడి చేసినప్పుడు ఉత్పతనం చెందితే మలినాలు ఉత్పతనం చెందకపోతే అలాంటి అపరిశుద్ధ సమ్మేళనాన్ని ఒక వాచ్గాసుతో మూసి ఉన్న బీకరులో తీసుకొని ఒక ఎలక్ట్రిక్ ప్లేటు మీద పెట్టి వేడి చేయాలి. సమ్మేళనం ఉత్పతనం చెంది వాచ్స్ అడుగు భాగాన ఘనీభవిస్తుంది. మలినాలు బీకర్లో ఉంటాయి. శుద్ధ సమ్మేళనాన్ని గీరి వాచ్స్ నుంచి వేరు చేస్తారు. ఉత్పతనం చెందవలసిన పదార్థాలు బాష్పపీడనం తక్కువ గలపై వేడి చేసినప్పుడు ఉత్పతనం చెందే మండే వియోగం చెందుతుంటే వాటిని అల్పపీడనాల్లో ఉత్పతనం చెందించాలి. ఉత్పతనం కూడా ఘన పదార్థాలను శుద్ధి చేయడానికి ఉపయోగపడుతుంది.
![]()
ప్రశ్న 12.
సమ్మేళనాన్ని శుద్ధిచేసే ద్రావణ నిష్కర్షణాన్ని తెలపండి.
జవాబు:
ద్రావణి నిష్కర్షణ :
ఒక కర్బన పదార్థం ‘A’ నీటిలో కరగని కర్బన ద్రావణిలో నీటిలో కంటే అధికంగా కరుగుతుంది. కాని నీటిలో కరిగివున్నదనుకొంటే అప్పుడు ఆ జలద్రావణాన్ని కర్బన ద్రావణితో కలిపి కుదిపితే ‘A’ కర్బన ద్రావణిలోకి అధికంగా వెళ్ళిపోతుంది. కర్బన ద్రావణాన్ని వేరు చేసి స్వేదనం చేస్తే కర్బన ద్రావణి బాష్పరూపంలో కర్బన సమ్మేళనం నుంచి వేరవుతుంది. సమ్మేళనం స్వేదన కుప్పెలో ఉంటుంది.
ప్రశ్న 13.
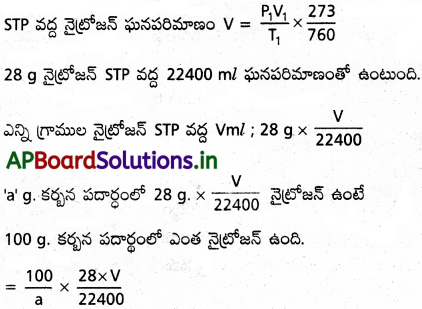
కర్బన సమ్మేళనంలోని ఫాస్ఫరస్, సల్ఫర్ల భారశాతాన్ని కనుక్కొనే విధానాలు తెలపండి.
జవాబు:
ఫాస్ఫరస్ భార శాతం: ఫాస్పరస్ భారశాతాన్ని కనుక్కోడానికి తెలిసిన ద్రవ్యరాశి గల కర్బన పదార్థాన్ని కేరియస్ నాళికలో సధూమ నైట్రిక్లామంతో వేడి చేయాలి. ఫాస్ఫరస్ ఫాస్ఫారిక్ ఆమ్లంగా ఆక్సీకరణం చెందుతుంది. ఈ ఆమ్లాన్ని అమోనియా, అమోనియం మోలిబ్దేట్ ద్రావణాలు కలిపి అమోనియం ఫాస్ఫోమోలిబ్రేటి (NH4)3PO4 12M0O3 గా అవక్షేపించాలి. కొన్ని సమయాల్లో ఆమ్లాన్ని మెగ్నీషియం మిశ్రమం కలిపి అవక్షేపిస్తారు. (మెగ్నీషియం మిశ్రమమంటే 100.0g. ల MgCl2, 6H2O. 100.0g. ల NH4Cl లను నీటిలో కరిగించి ఆ ద్రావణాన్ని 1000 ml లకు విలీనం చేస్తే వచ్చే ద్రావణం) అప్పుడు మెగ్నీషియం అమోనియం ఫాస్ఫేట్ అవక్షేపమేర్పడుతుంది. (Mg NH PO ) దీనిని జ్వలనం చేస్తే మెగ్నీషియం పైరో ఫాస్ఫేట్ (Mg2P2O7) వస్తుంది.
పరిశీలనలు, గణనలు :
‘a’ g ల కర్బన సమ్మేళనం తీసికొంటే ‘b’ g ల అమోనియం ఫాస్ఫో మోలిప్డేట్ ఏర్పడిందనుకొందాం.
అమోనియం ఫాస్ఫోమోలిబ్రేట్ అణు ద్రవ్యరాశి (NH4)3 PO4 12M0O3 = 1877
1877 gల (NH4)3PO4 12MoO3లో 31.0g ల ‘P’ ఉంటే ‘b’g ల (NH4)3PO4 12M0O3 లో ‘P’ ఎంత ఉంటుంది?

సల్ఫర్ భార శాతం
కర్బన్ సమ్మేళనంలోని సల్ఫర్ భారశాతం కనుక్కోవడానికి తెలిసిన భారం గల కర్బన సమ్మేళనాన్ని సోడియం పెరాక్సైడ్ లేదా సధూమనైట్రికామ్లంతో కేరియస్ నాళికలో వేడిచేస్తారు. సల్ఫర్ గనుక సమ్మేళనంలో ఉంటే అది సల్ఫ్యూరిక్ ఆమ్లంగా ఆక్సీకరణం చెందుతుంది. ఈ ఆమ్లాన్ని అధికంగా బేరియం క్లోరైడ్ ద్రావణం కలిపి బేరియం సల్ఫేట్గా అవక్షేపిస్తారు. ఈ అవక్షేపాన్ని వడపోత ద్వారా వేరు చేసి కడిగి, పొడి (dry) బేసి (నిర్జలీకరణం) భారాన్ని కనుగొంటారు.
పరిశీలనలు, గణనలు :
కర్బన సమ్మేళనం భారం a g అనుకొందాం.
ఏర్పడిన బేరియం సల్ఫేట్ భారం bg అనుకొందాం.
బేరియం సల్ఫేట్ అణు ద్రవ్యరాశి = 233
1 మోల్ BaSO4 లో లేదా 233.0 g ల BaSO4 లో 32.0 gల సల్ఫర్ ఉంటుంది.
‘b’ g ల BaSO4 లో ఎంత సల్ఫర్ ఉంటుంది? ⇒ \(\frac{b}{233}\) × 32 g
‘a’ g ల కర్బన సమ్మేళనంలో \(\frac{b}{233}\) × 32 g సల్ఫర్ ఉంది.
100 g ల సమ్మేళనంలో ఎంత సల్ఫర్ ఉంటుంది?
\(\frac{100g}{a}\times\frac{b\times32}{233}\)
ప్రశ్న 14.
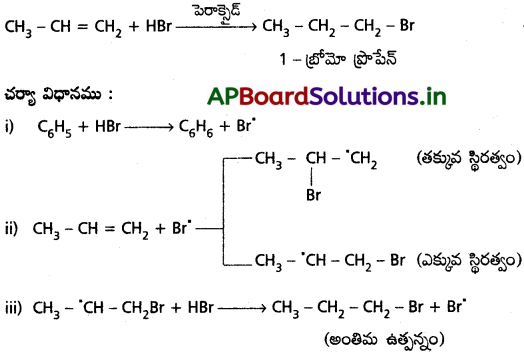
ప్రోపీన్తో HBr సంకలన చర్యను అయానిక చర్యాగతితో వివరించండి.
జవాబు:
i) CH2 – CH = CH2 కు HBr సంకలనానికి ఎలక్ట్రోఫిలిక్ చర్యా విధానము మార్కొనికాఫ్ నియమమును అనుసరిస్తుంది.
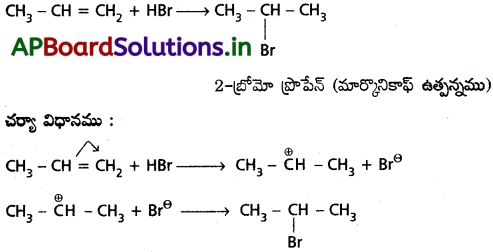
ii) CH2 − CH = CH2 కు HBr సంకలనానికి స్వేచ్ఛా ప్రాతిపదిక సంకలన చర్యా విధానము యాంటి మార్కొనికాఫ్ నియమమును అనుసరిస్తుంది.
ప్రశ్న 15.
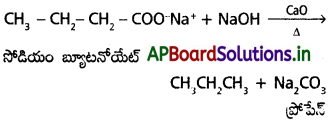
సోడియం ప్రోపనోయేట్ను సోడాలైమ్తో వేడిచేస్తే ఏ ఉత్పన్నం ఏర్పడుతుంది.?
జవాబు:
ఈథేన్ ఏర్పడుతుంది.

దీర్ఘ సమాధాన ప్రశ్నలు
ప్రశ్న 1.
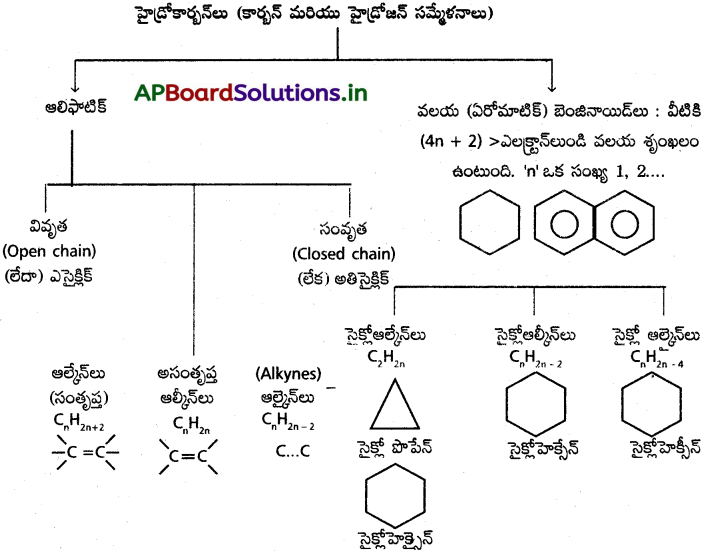
హైడ్రోకార్బన్ల వర్గీకరణను వివరించండి.
జవాబు:
హైడ్రోకార్బన్ల వర్గీకరణ:-
ప్రశ్న 2.
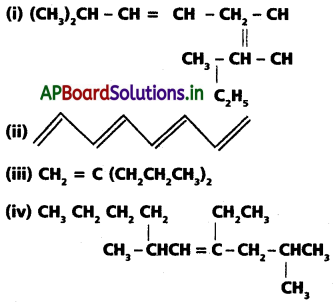
కింది సమ్మేళనాల IUPAC నామాలు రాయండి.
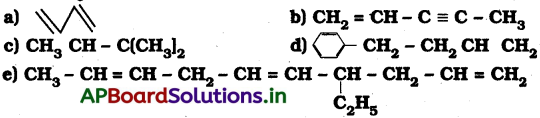
జవాబు:
a) 1, 3 బ్యుటాడయీన్
b) పెంట్, 1-ఈన్, 3 – అయిన్
c) 2 – మిథైల్ 2 – బ్యుటీన్
d) 4 – ఫినైల్ 1 – బ్యుటీన్
e) 4 – ఇథైల్ డెక్ 1, 5, 8 ట్రయీన్
ప్రశ్న 3.
ఈథేనన్ను తయారుచేసే రెండు పద్ధతులను, ఏవైనా ఈథేన్ మూడు చర్యలను రాయండి.
జవాబు:
ఈథేనన్ను (1) సబటీర్ – శాండరన్స్ క్షయకరణం (2) ఉర్జ్ చర్య పద్ధతుల ద్వారా తయారు చేయవచ్చు.
1. సబటీర్ – శాండరన్స్ చర్య (Sabatier – Sanderence Reaction) :
ఇథిలీన్ ను 200°C వద్ద చూర్ణస్థితిలోని Ni ఉత్ప్రేరకం సమక్షంలో హైడ్రోజనీకరణం చేయగా ఈథేన్ ఏర్పడుతుంది.

2. ఉర్ట్ చర్య (Wurtz Reaction) :
మీథైల్ అయొడైడ్ పొడి ఈథర్ సమక్షంలో సోడియం లోహముతో చర్య జరుపగా ఈథేన్ ఏర్పడుతుంది.

ఈథేన్ యొక్క మూడు రసాయన ధర్మాలు :
1. హేలోజనీకరణం (Halogenation) :
ఈథేన్ సూర్యకాంతి సమక్షంలో క్లోరిన్ తో చర్య జరుపగా ఈథేన్ లో గల హైడ్రోజన్ పరమాణువులన్నీ ఒకదాని తరువాత ఒకటి క్లోరిన్ పరమాణువుల చేత ప్రతిక్షేపించబడి హెక్సాక్లోరో ఈథేన్ అంతిమ ఉత్పన్నంగా ఏర్పడుతుంది.

2. నైట్రోకరణం (Nitration) :
ఈథేన్ ను సధూమ నత్రికామ్లంతో 400°C వద్ద వేడిచేయగా నైట్రో ఈథేన్ ఏర్పడుతుంది.

3. దహనము (Combustion) :
ఈథేన్ను గాలిలో మండించగా కార్బన్ డై ఆక్సైడ్ మరియు నీటి ఆవిరి ఏర్పడతాయి. ఈ చర్యలో ఉష్ణం విడుదలవుతుంది.
2C2H6 + 7O2 → 4CO2 + 6H2O + 3116.6 కి. జౌ .
ప్రశ్న 4.
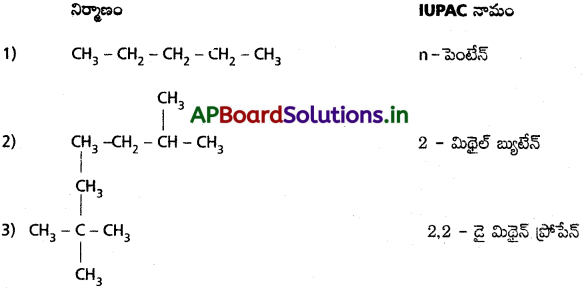
కింద ఇచ్చిన ఫార్ములాలు ఏర్పరచగలిగిన సాదృశ్యాలను రాసి వాటి నిర్మాణాలు, IUPAC పేర్లు రాయండి :
a) C4H8 (ఒక ద్విబంధం)
b) C5H8 (ఒక త్రిబంధం)
c) C5H12 (బహుబంధాలు లేవు)
జవాబు:
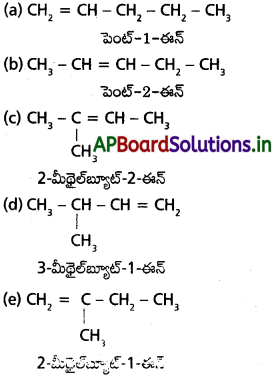
a) C4H8 (ఒక ద్విబంధం): సాదృశ్యాలు

b) C5H8 (ఒక త్రిబంధం) సాదృశ్యాలు :

c) C5H12 (బహు బంధాలు లేవు) సాదృశ్యాలు :
ప్రశ్న 5.
కింది హైడ్రోకార్బన్లు దహనచర్యలో జరిపే చర్యలను సమీకరణ రూపంలో రాయండి.
a) బ్యూటేన్
b) పెంటీన్
c) హెక్సెన్
జవాబు:
a) బ్యూటేన్ దహనచర్య
C4H10 + \(\frac{13}{2}\)O2 → 4CO2 + 5 H2O + శక్తి
b) పెంటీన్ దహనచర్య
C5H10 + \(\frac{15}{2}\)O2 → 5CO2 + 5 H2O + శక్తి
c) హెక్సెన్ దహన చర్య
C6H10 + \(\frac{17}{2}\)O2 → 6CO2 + 5H2O + శక్తి
![]()
ప్రశ్న 6.
ప్రోపీన్తో HBr సంకలనం చెంది 2-బ్రోమో ప్రోపేనన్ను ఇస్తుంది. అదే బెంజాయిల్ పెరాక్సైడ్ సమక్షంలో 1-బ్రోమోప్రోపేన్ ఏర్పడుతుంది. చర్యాగతిని రాసి తేడాను వివరించండి.
జవాబు:
i) CH3 – CH = CH2 కు HBr సంకలనానికి ఎలక్ట్రోఫిలిక్ చర్యా విధానము మార్కొనికాఫ్ నియమమును అనుసరిస్తుంది.
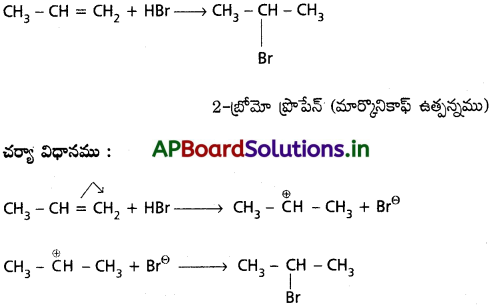
ii) CH3 – CH CH2కు HBr సంకలనానికి స్వేచ్ఛా ప్రాతిపదిక సంకలన చర్యా విధానము యాంటి మార్కొనికాఫ్ నియమమును అనుసరిస్తుంది.
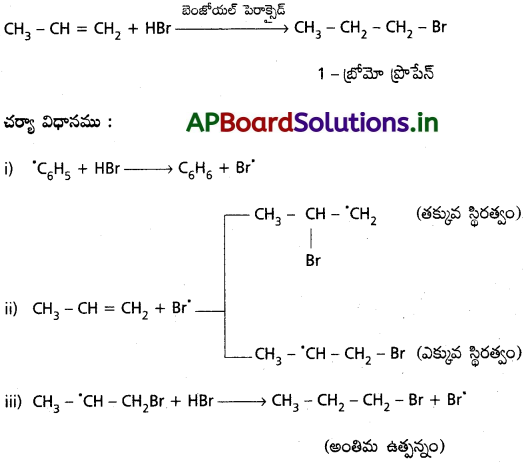
ప్రశ్న 7.
ఇథిలీన్ తయారుచేయడానికి రెండు విధానాలు తెలపండి. ఇథిలీన్ కింది వాటితో ఏర్పరిచే ఉత్పన్నాల చర్యలను తెలపండి. [Mar. ’14]
1) ఓజోన్
2) హైపోహాలస్ ఆమ్లం
3) చల్లని విలీన క్షార KMnO
4) అధిక పీడనం వద్ద తో వేడిచేయుట
జవాబు:
ఇథిలీన్ న్ను (1) డీ హైడ్రోహేలోజనీకరణం (2) డీహేలోజనీకరణం పద్ధతుల ద్వారా తయారుచేయవచ్చు.
1. డీహైడ్రోహేలోజనీకరణం :
ఇథైల్ క్లోరైడ్ లేక ఇథైల్ బ్రోమైడ్ లేక ఇథైల్ అయొడైడ్లను ఆల్కహాలిక్ పొటాషియం హైడ్రాక్సైడ్తో వేడిచేయగా ఆసన్న కార్బన్ పరమాణువుల నుండి హైడ్రోజన్ హేలైడ్ తొలగింపబడి ఇథిలీన్ ఏర్పడుతుంది.
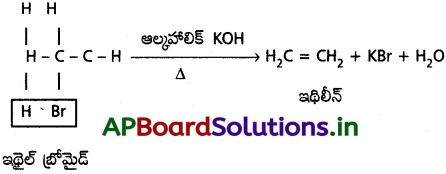
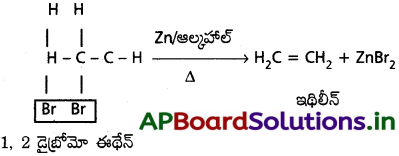
2. డీ హేలోజనీకరణం :
1, 2 డైబ్రోమో ఈథేన్ ఆల్కహాల్ సమక్షంలో జింక్ పొడితో వేడిచేయగా ఆసన్న కార్బన్ పరమాణువుల నుండి బ్రోమిన్ అణువు తొలగించబడి ఇథిలీన్ ఏర్పడుతుంది.
ఇథిలీన్ చర్యలు :
a) ఓజోన్తో చర్య :
ఇథిలీన్, ఓజోన్తో చర్య జరుపగా అస్థిరమైన ఇథిలీన్ ఓజోనైడ్ ఏర్పడుతుంది. ఇది zn/H2O నీరు సమక్షంలో వియోగం చెంది ఫార్మాల్డిహైడ్ను ఏర్పరుస్తుంది.
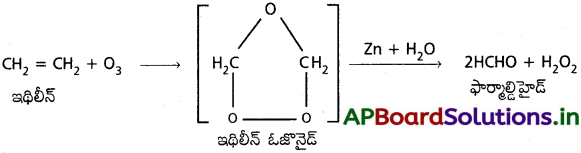
b) హైపోహాలస్ ఆమ్లం (HOCl) తో చర్య :
ఇథిలీన్, HOCl తో సంకలన చర్య జరిపి ఇథిలీన్ క్లోరోహైడ్రిన్ను ఏర్పరుస్తుంది.

c) చల్లని విలీన, క్షార KMnO తో :
పై కారకంతో ఇథిలీన్ చర్య జరిపి ఇథిలీన్ గ్లైకాల్నిస్తుంది.

d) అధిక పీడనాల వద్ద ‘O2‘ తో చర్య :
అధిక పీడనాల వద్ద మరియు 200° C వద్ద ఇథిలీన్ ను O2 తో చర్య జరిపిస్తే పాలిమరీకరణానికిలోనై పాలిథీన్ ను ఏర్పరుస్తుంది.
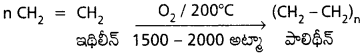
ప్రశ్న 8.
కింది వాటితో ఇథిలీన్ చర్యలు రాయండి. సమీకరణాలు రాసి ఉత్పన్నాల పేర్లు రాయండి.
a) హైడ్రోజన్ హాలైడ్ b) హైడ్రోజన్ c) బ్రోమీన్ d) నీరు e) సిల్వర్ సమక్షంలో 200°C దగ్గర ఆక్సిజన్ చర్య
జవాబు:
ఇథిలీన్ – చర్యలు :
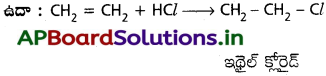
a) హైడ్రోజన్ హాలైడ్ (H – X) తో చర్య :
ఇథిలీన్, H – X తో చర్య జరిపి ఇథైల్ హాలైడ్లనిస్తుంది.
CH2 = CH2 + HX → CH3 – CH2 – X
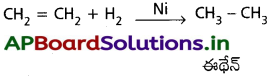
b) హైడ్రోజన్తో చర్య :
Ni సమక్షంలో హైడ్రోజన్ ఇథిలీన్ చర్య జరిపి ఈథేన్ నన్ను ఇస్తుంది.
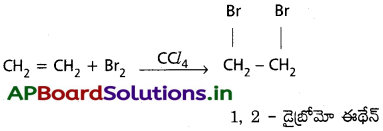
c) బ్రోమిన్తో చర్య :
ఇథిలీన్, బ్రోమిన్తో సంకలన చర్య జరిపి 1, 2 – డైబ్రోమో ఈథేన్ ను ఏర్పరుస్తుంది.
d) నీటితో చర్య :
ఆమ్లీకృత నీటితో చర్య జరిపి ఇథిలీన్, ఆల్కహాల్నిస్తుంది.

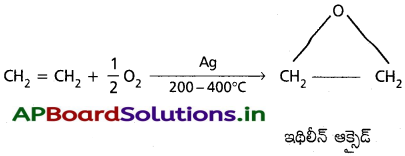
e) సిల్వర్ సమక్షంలో ‘O2‘ తో చర్య :
200 -400°C వద్ద సిల్వర్ సమక్షంలో ఇథిలీన్ ఆక్సిజన్తో చర్య జరిపి ఇథిలీన్ ఆక్సైడినిస్తుంది.
ప్రశ్న 9.
‘A’ అను ఆల్కీన్ ఓజోనాలిసిస్ చర్యలో పాల్గొని ఇథనాల్, పెంటేన్-3-ఓన్ల మిశ్రమాన్ని ఏర్పరుస్తుంది. చర్యను రాసి, ఉత్పన్నాల, ఆల్కీన్-A ల నిర్మాణాలు రాసి వాటి IUPAC పేరును తెల్పండి.
జవాబు:
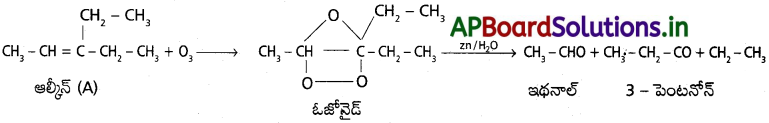
‘A’ యొక్క IUPAC నామం
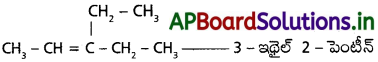
ప్రశ్న 10.
‘A’ అనే ఆల్కీన్ లో మూడు C – C, ఎనిమిది C – H బంధాలు, ఒక C = C ద్విబంధం ఉన్నాయి. ఓజోనాలిసిస్ చర్యలో ‘A’ ఆల్కీన్ రెండు అణువుల ఆల్డిహైడ్ (అణుభారం 44)ను ఏర్పరుస్తుంది. ‘A’ యొక్క IUPAC పేరును రాయండి.
జవాబు:
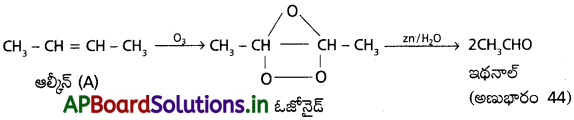
A లో 3 (C – C), 8 (C – H), 1 (C = C) బంధాలు కలవు.
→ A యొక్క IUPAC నామం : – 2 – బ్యుటీన్
ప్రశ్న 11.
ఎసిటిలీన్ తయారుచేయడానికి రెండు పద్ధతులను తెలపండి. ఎసిటిలీన్ నీటితో, ఓజోన్తో జరుపు చర్యలు రాయండి.
జవాబు:
ఎసిటిలీన్ ను తయారుచేయు పద్ధతులు :
1. కాల్షియం కార్బైడ్ నుండి :
కాల్షియం కార్బైడు జలవిశ్లేషణ చేయుట ద్వారా పారిశ్రామికంగా ఎసిటిలీన్ ను తయారుచేస్తారు.

2. క్లోరోఫారం నుండి :
క్లోరోఫారంను సిల్వర్ పొడితో వేడిచేయగా ఎసిటిలీన్ ఏర్పడుతుంది.

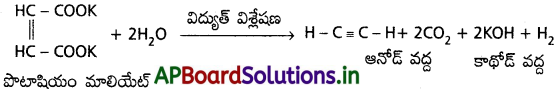
3. కోల్బే విద్యుత్ విశ్లేషణ :
పొటాషియం మాలియేట్ జలద్రావణాన్ని విద్యుత్ విశ్లేషణ చేయగా ఆనోడ్ వద్ద ఎసిటిలీన్ ఏర్పడుతుంది.
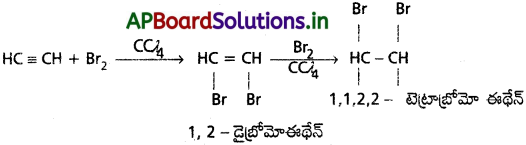
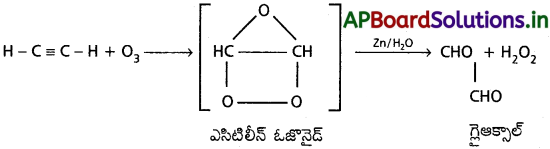
ఎసిటిలీన్ రసాయన చర్యలు :
1. ఓజోన్ చర్య :
ఎసిటిలీన్, ఓజోన్ తో సంకలనం చెందగా అస్థిరమైన ఎసిటిలీన్ ఓజొనైడ్ ఏర్పడుతుంది. ఇది zn/ H2O సమక్షంలో వియోగం చెంది గ్లైఆక్సాల్ మరియు హైడ్రోజన్ పెరాక్సైడ్లు ఏర్పడతాయి.
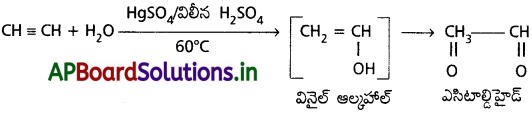
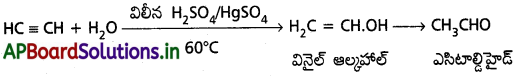
2. నీటితో చర్య :
ఎసిటిలీన్, మెర్క్యురిక్ సల్ఫేట్ మరియు విలీన సల్ఫ్యూరిక్ ఆమ్లం సమక్షంలో 60°C వద్ద నీటితో సంకలనం చెంది అస్థిరమైన వినైల్ ఆల్కహాల్ను ఏర్పరుస్తుంది. ఇది పునర్వ్యవస్థీకరణం (Tautomerism) చెంది అసిటాల్డిహైడ్న ఏర్పరుస్తుంది.
ప్రశ్న 12.
ఎసిటిలీన్ కిందివానితో ఏవిధంగా చర్య జరుపుతుంది? ఉత్పన్నాల పేర్లు రాసి చర్యలు రాయండి. a) ఎసిటిక్ ఆమ్లం b) నీరు c) హైడ్రోజన్ d) హాలోజన్లు e) హైడ్రోజన్ హాలైడ్ f) అమ్మోనికల్ సిల్వర్ నైట్రేట్, Cu2Cl2.
జవాబు:
a) ఎసిటిక్ ఆమ్లంతో చర్య :
ఎసిటిలీన్, Hg2+ అయానుల సమక్షంలో ఎసిటిక్ ఆమ్లముతో సంకలనం చెంది మొదట వినైల్ ఎసిటేట్ పిదప ఇథిలిడిన్ ఎసిటేట్ ఏర్పడుతుంది.
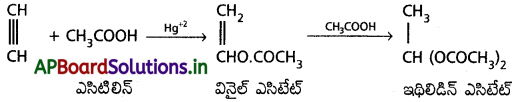
b) నీటితో చర్య :
ఎసిటిలిన్, విలీన సల్ఫ్యూరిక్ ఆమ్లం, మెర్క్యురిక్ సల్ఫేట్ల సమక్షంలో 60°C ఉష్ణోగ్రత వద్ద నీటితో సంకలనం చెంది మొదట అస్థిరమైన వినైల్ ఆల్కహాల్ ఏర్పడి పిదప అది ఎసిటాల్డిహైడ్గా పునర్వ్యవస్థీకరణ చెందుతుంది.
c) హైడ్రోజన్ చర్య :
ఎసిటిలీన్ ను నికెల్ ఉత్ప్రేరకం సమక్షంలో హైడ్రోజన్తో వేడిచేయగా సంకలనం చెంది మొదట ఇథిలీన్ పిదప ఈథేన్ ఏర్పడతాయి. ఈ చర్యను సెబాటియర్ – సెండరెన్స్ చర్య అంటారు.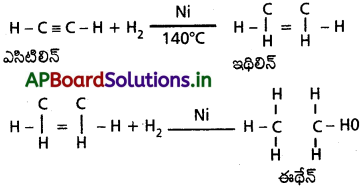
d) హాలోజన్లతో :
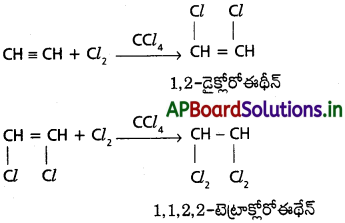
ఎసిటిలీన్ హాలోజన్లతో సంకలన చర్య జరిపి 1, 1, 2, 2 – టెట్రా హాలో ఈథేన్ను ఏర్పరచును.
e) హైడ్రోజన్ హాలైడ్లో :
ఎసిటిలీన్, హైడ్రోజన్ హాలైడ్ (HCl) తో చర్యనొంది ఇథిలిడిన్ క్లోరైడ్ నిస్తుంది.
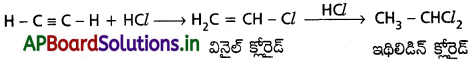
f) అమ్మోనికల్ AgNO3 మరియు Cu2Cl2 తో చర్యలు :
ఎసిటిలీన్ వాయువును అమ్మోనికల్ AgNO3 ద్రావణం గుండా పంపినపుడు, సిల్వర్ ఎసిటిలైడ్ అవక్షేపం ఏర్పడుతుంది.
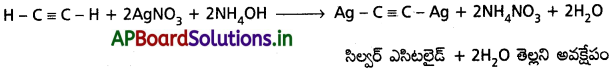
ఎసిటిలీన్ వాయువును అమ్మోనికల్ Cu2Cl2 ద్రావణం గుండా పంపినపుడు, క్యూప్రస్ ఎసిటిలైడ్ అవక్షేపం ఏర్పడుతుంది.

ప్రశ్న 13.
బెంజీన్ ను తయారుచేసే ఏవైనా రెండు పద్ధతులను రాసి వాటి సమీకరణాలు రాయండి. బెంజీన్ ఆల్కీన్ లక్షణాలను చూపించదు –ఎందుకని? బెంజీన్ నుంచి మీథైల్ బెంజీన్ ను ఎలా తయారుచేస్తారు? [A.P. Mar. ’15]
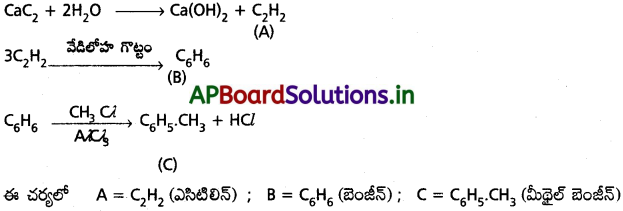
జవాబు:
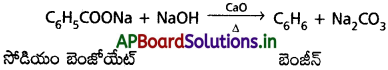
i) బెంజీన్ను తయారుచేయు పద్ధతులు :
a) డీకార్బాక్సిలీకరణం :
సోడియం బెంజోయేట్ను సోడాలైమ్ (NaOH + CaO) తో వేడిచేయగా బెంజీన్ ఏర్పడుతుంది.
b) ఫినోల్ క్షయకరణం :
ఫినోల్ను జింక్ పొడితో వేడిచేయగా అది క్షయకరణం చెంది బెంజీన్ ఏర్పడుతుంది.
![]()
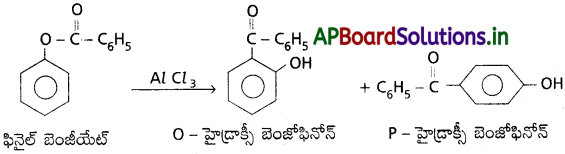
ii) బెంజీన్ నుండి టోలిన్ ఏర్పడుట :
బెంజీన్, అనార్ద్ర AlCl3 ఉత్ప్రేరకం సమక్షంలో మీథైల్ క్లోరైడ్తో చర్య జరుపగా మిథైల్ బెంజీన్ లేక టోలిన్ ఏర్పడుతుంది. దీనినే ఫ్రీడెల్ క్రాఫ్ట్ ఆల్కైలేషన్ చర్య అంటారు.

iii) బెంజీన్ అణు ఫార్ములా అసంతృప్తతను (ఆల్కీన్వలె) తెలియజేసినప్పటికీ, ఇది అత్యంత స్థిరంగావుంటూ సంకలన చర్యలలో కన్నా ప్రతిక్షేపణ చర్యలవైపు మొగ్గు చూపుతుంది. దీనికి కారణం బెంజీన్లోని π – ఎలక్ట్రాన్లు అస్థానీకృతం చెందుతాయి. దీనివలన బెంజీన్కు రెజొనెన్స్ నిర్మాణం వస్తుంది. బెంజీన్ కున్న అధిక రెజొనెన్స్ శక్తి వలన దానికి అధిక స్థిరత్వం వస్తుంది. ఈ కారణాల వలన బెంజీన్ అసంతృప్త సమ్మేళమయినప్పటికి ఆల్కీన్ వలె ప్రవర్తించదు.
![]()
ప్రశ్న 14.
ఎసిటిలీన్ నుంచి బెంజీన్ ఎట్లా ఏర్పడుతుంది ? సమీకరణం రాయండి. బెంజీన్ యొక్క హాలోజినేషన్, ఆల్కైలేషన్, ఎసైలేషన్, నైట్రేషన్, సల్ఫోనేషన్ చర్యలను వివరించండి. [A.P. Mar. ’15 Mar. ’14]
జవాబు:
ఎసిటిలీన్ నుండి బెంజీన్ నన్ను తయారుచేయుట:
ఎసిటిలీన్ వాయువును ఎర్రగా కాలుచున్న కాపర్ గొట్టాల గుండా పంపినపుడు మూడు అణువులు ఎసిటిలీన్ పొలిమరీకరణం చెంది బెంజీన్ ఏర్పడుతుంది.

ఎలక్ట్రోఫిలిక్ ప్రతిక్షేపణ చర్య :
కర్బన సమ్మేళనంలోని ఏదేని పరమాణువు లేక పరమాణువుల సమూహాన్ని ధనావేశిత అయాన్ (ఎలక్ట్రోఫైల్) తో ప్రతిక్షేపించుటను ఎలక్ట్రోఫిలిక్ ప్రతిక్షేపణ చర్య అంటారు.
బెంజీన్ అణువులో ఆరు π ఎలక్ట్రాన్లతో ఏర్పడిన మేఘం కలదు. కనుక బెంజీన్ అణువు ధనావేశిత అయాన్ (ఎలక్ట్రోఫైల్) లను ఆకర్షిస్తుంది. ఈ ధనావేశిత అయాన్లు బెంజీన్లోని ఏదేని ఒక హైడ్రోజన్ ను స్థానభ్రంశం చేయుట ద్వారా ప్రతిక్షేపణ ఉత్పన్నం ఏర్పడుతుంది. ఈ చర్యను ఎలక్ట్రోఫిలిక్ ప్రతిక్షేపణ చర్య అంటారు.
బెంజీన్ యొక్క ప్రతిక్షేపణ చర్యలు :
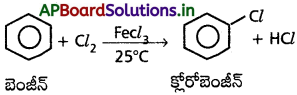
1. హాలోజనీకరణం :
బెంజీన్ ను FeCl3 ఉత్ప్రేరకం సమక్షంలో క్లోరిన్తో చర్య జరుపగా క్లోరో బెంజీన్ ఏర్పడుతుంది.
2. నైట్రోకరణం :
బెంజీన్ ను నైట్రోషన్ మిశ్రమం (గాఢ HNO3 + గాఢ H2SO4) తో 60°C కన్న తక్కువ ఉష్ణోగ్రత వద్ద చర్య జరుపగా నైట్రోబెంజీన్ ఏర్పడుతుంది.
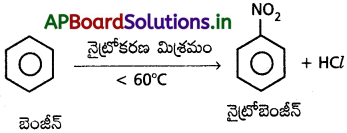
3. సల్ఫోనీకరణం :
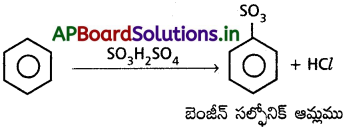
బెంజీన్ సుథూమ సల్ఫ్యూరిక్ ఆమ్లంతో చర్య జరిపి బెంజీన్ సల్ఫోనిక్ ఆమ్లమునిస్తుంది.
4. ఆల్కైనీకరణం :
బెంజీన్ AlCl3 సమక్షంలో ఆల్కైల్ హాలైడ్లతో చర్య జరిపి ఆల్కైల్ బెంజీన్ ఇస్తుంది.

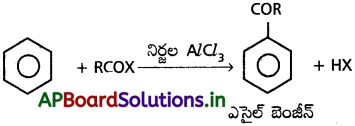
5. ఎసైలేషన్ :
బెంజీన్, AlCl3 సమక్షంలో ఎసైల్ క్లోరైడ్తో చర్య జరిపి ఎసైల్ బెంజీన్ ఇస్తుంది.
ప్రశ్న 15.
నిర్మాణ సాదృశ్యాలు, త్రిమితీయ సాదృశ్యాల మధ్య తేడాలు వివరించండి.
జవాబు:
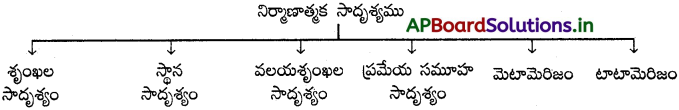
నిర్మాణాత్మక సాదృశ్యము :
అణువులోని పరమాణువులు లేదా సమూహాల అమరికలో తేడా వలన సాదృశ్యం ఏర్పడును. ఈ సాదృశ్యములను నిర్మాణాత్మక సాదృశ్యాలు అంటారు. ఈ సాదృశ్యములకు ఒకే అణుఫార్ములా వుండి వేరు వేరు నిర్మాణాత్మక ఫార్ములాలు ఉంటాయి.
త్రిమితీయ సాదృశ్యము :
ఒకే అణుఫార్ములా మరియు నిర్మాణాత్మక ఫార్ములా కలిగివుండి, త్రిమితీయంగా పరమాణువుల (లేదా) గ్రూపుల, ప్రాదేశిక అమరికలో భేదంవల్ల వచ్చు సాదృశ్యమును త్రిమితీయ సాదృశ్యము అంటారు. పరమాణువుల (లేదా) గ్రూపుల త్రిమితీయ అమరికనే అణువు యొక్క కానిఫిగరేషన్ అంటారు.
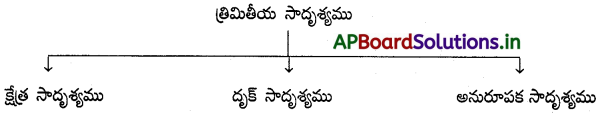
| నిర్మాణాత్మక సాదృశ్యాలు | త్రిమితీయ సాదృశ్యాలు |
| 1. ఈ ఐసోమర్లు ఒకే అణుఫార్ములా కలిగివుండి, ప్రాదేశికతో ఎట్టి సంబంధం లేకుండా పరమాణువుల (లేక) సమూహాల అమరికలో తేడా కలిగివుంటాయి. | 1. ఈ ఐసోమర్లు ఒకే అణుఫార్ములా ఒకే నిర్మాణం కలిగి వుండి పరమాణువుల లేక సమూహాల అమరికలో తేడా కలిగివుంటాయి. |
| 2. శృంఖల, స్థాన, ప్రమేయ మరియు మెటామెరిజం అనే సాదృశ్యాలు – నిర్మాణాత్మక రకానికి చెందినవి. | 2. క్షేత్ర, దృక్ సాదృశ్యాలు త్రిమితీయ సాదృశ్యాల రకానికి చెందినవి. |
| 3. ఇవి ద్విమితీయంగా ఉంటాయి. | 3. ఇవి త్రిమితీయంగా ఉంటాయి. |
ప్రశ్న 16.
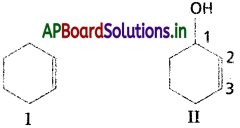
సరళ శృంఖలాలు అనురూపత, విన్యాసంలందు తేడా ఏమిటి?
జవాబు:
అనురూపత (లేదా) అనురూపక సాదృశ్యాలు :
- ఇవి త్రిమితీయ సాదృశ్యాలు. ఒక రూపం నుండి మరొక రూపంలోనికి C – C బంధాల భ్రమణం వల్ల మార్పు.. చెందుతాయి. ఇవి ఒకదానికొకటి గతిక సమతాస్థితిలో ఉంటాయి.
- సాధారణ పరిస్థితులలో వీటిని వేరుచేయలేము.
విన్యాసం (లేదా) విన్యాస సాదృశ్యాలు :
- ఇవి కూడా త్రిమితీయ సాదృశ్యాలు. ఇవి స్థిరమైనవి. ఇవి ఒక రూపం నుండి మరొక రూపంలోకి మార్పు చెందవు.
- ఒక రూపం నుండి వేరొక రూపంలోనికి మార్పు చెందుటకు బంధాలు విడిపోయి కలుపవలెను.
- ఇవి అధ్యారోహితాలు కావు.
- వీటిని ఎనాన్షియోమర్లు, డయాస్టీరియోమర్లు, క్షేత్ర సాదృశ్యాలుగా వర్గీకరించారు.
ప్రశ్న 17.
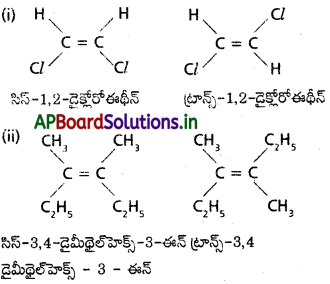
క్షేత్ర సాదృశ్యం అంటే ఏమిటి? 2 – బ్యూటీన్ క్షేత్ర సాదృశ్యాలను రాయండి.
జవాబు:
జ్యామితీయ సాదృశ్యము :
“ఒకే నిర్మాణాత్మక ఫార్ములాను కలిగివుండి అణువులో ద్విబంధం మీద కార్బన్లపైవున్న ప్రతిక్షేపకాల ప్రాదేశిక అమరికలో భేదంవలన వచ్చు సాదృశ్యమును జ్యామితీయ (లేక) క్షేత్ర సాదృశ్యము అంటారు.”
ఒకే రకమైన సమూహాలు ద్విబంధానికి ఒకేవైపున బంధాలేర్పరచివుంటే ఆ సాదృశ్యమును సిస్ సాదృశ్యమని, ఒకే రకమైన సమూహాలు ద్విబంధానికి వ్యతిరేక దిశలో బంధాలేర్పరచివుంటే ఆ సాదృశ్యమును ట్రాన్స్ సాదృశ్యమని అంటారు.
అందువలన ఈ సాదృశ్యమును సిస్ ట్రాన్స్ సాదృశ్యమంటారు. ద్విబంధం ఏర్పరచే కార్బన్లలో ఏ ఒక్కదాని మీదనైనా రెండు సమానమైన ప్రతిక్షేపకాలుంటే జ్యామితీయ సాదృశ్యం వీలుకాదు.
ఉదా : 1 – బ్యూటీన్కు జ్యామితీయ సాదృశ్యాలు వీలుకావు.
2 – బ్యూటీన్ కు జ్యామితీయ సాదృశ్యానికి మంచి ఉదాహరణ
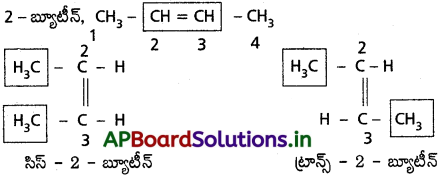
ప్రశ్న 18.
E – Z విన్యాసాలను గుర్తించే పద్దతిని తెలిపి, CHCl = CFBr అణువుకు క్షేత్ర సాద్యశాలను రాయండి.
జవాబు:
ద్విబంధం మీద కార్బన్లపై ఉన్న ప్రతిక్షేపకాలు ఒకే విధమయినచో (లేదా) నిర్మాణాత్మకంగా సారూప్యం (లేదా) ఏక రూపం కలిగినవో అయితే వాటి విన్యాసాల్ని సిస్ – ట్రాన్స్ విన్యాసాలుగా చెప్పవచ్చు.
అయితే ఒక కార్బన్ మీద గ్రూపులు మరియు రెండో కార్బన్ మీద ఏ నిర్దేశ గ్రూపులకు సమరూపకంగా ఉన్నాయో స్పష్టంగా తెలియకపోతే సిస్ ట్రాన్స్ సాదృశ్యాలు సంశయాత్మకమవుతాయి. ఈ సమస్యను తొలగించడానికి ప్రవేశపెట్టిన పద్ధతి
E – Z పద్ధతి :
ఇది పరమాణు సంఖ్యలపై ఆధారపడి వుంటుంది. “ద్విబంధ కార్బన్ల మీద గ్రూపులు అధిక పరమాణు సంఖ్యగల పరమాణువుల ద్వారా ద్విబంధ కార్బన్లకు ఒకే వైపున బంధాలేర్పరచివుంటే దానికి ‘Z’ విన్యాసమని, అదే అధిక పరమాణు సంఖ్యగల పరమాణువులు ద్విబంధానికి వ్యతిరేక దిశలలో బంధించబడి ఉంటే దానిని ”E’ విన్యాసమని అంటారు.” అధిక పరమాణు సంఖ్య
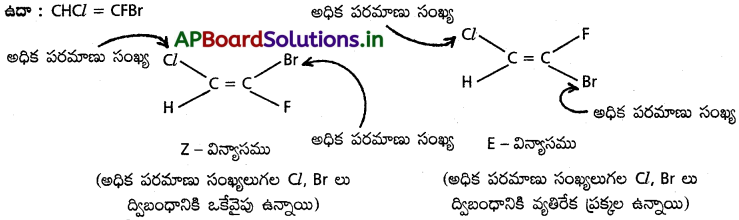
ప్రశ్న 19.
ఒక ఆల్కీన్లో ద్విబంధం వద్ద ఉన్న కార్బన్లపై Cl, Br – CH2 – CH2 OH, CH(CH3)2 సమూహాలుంటే దాని E, Z విన్యాసాలు రాయండి.
జవాబు:

ప్రశ్న 20.
కింది వాటిని వివరించండి:
a) స్వేదనం b) అంశిక స్వేదనం c) తక్కువ పీడనంలో స్వేదనం d) జలబాష్ప స్వేదనం.
జవాబు:
a) స్వేదనం :
ఈ పద్ధతి అబాష్పశీల పదార్థాలు మలినాలుగా ఉన్న ద్రవాలను శుద్ధి చేయడానికి ఉపయోగపడుతుంది. స్వేదన కుప్పెలో మలిన ద్రవాన్ని తీసికొని మరిగించితే దాని బాష్పం వస్తుంది. ఆ బాష్పాన్ని కండెన్సర్ ద్వారా పంపి ద్రవీకరించి సంగ్రహణ పాత్రలో గ్రహించవచ్చు. ఈ పద్ధతిని ద్రవాల మిశ్రమాన్ని వేరు చేయడానికి కూడా వాడవచ్చు. ఐతే ఆ ద్రవాల బాష్పీభవన స్థానాలలో భేదం 40° C కంటే ఎక్కువ ఉండాలి. 40° C తక్కువ బాష్పీభవన స్థానాల భేదం ఉన్న ద్రవాలను పాక్షిక అంశిక స్వేదనం ద్వారా వేరు చేయవచ్చు.
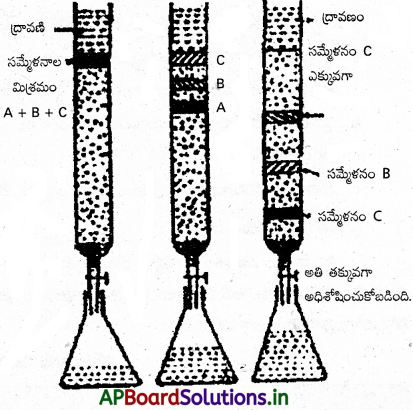
b) పాక్షిక అంశిక స్వేదనం (Fractional distillation) :
రకరకాల డిజైన్లు, ఆకారాలతో పొడవైన గాజు నాళికలుంటాయి. వీటిని అంశిక నాళికలంటారు. ద్రవ మిశ్రమాన్ని స్వేదన కుప్పెలో తీసికొని దాని మూతికి అంశిక నాళికను బిగిస్తారు. నాళిక పై భాగాన్ని నీటి కండెన్సర్కు కలిపే వీలుంటుంది. మిశ్రమంలో రెండు ద్రవాలు A, B లు ఉన్నాయనుకొందాం. అందులో Aకు B కంటే ఎక్కువ బాష్పీభవన స్థానం ఉంటుందనుకొందాం. మిశ్రమాన్ని వేడి చేస్తే A, B లు రెండింటికీ చాలా దగ్గర బాష్పీభవన స్థానాలుండటం వల్ల అంశిక నాళిక ద్వారా రెండింటి బాష్పాలు పైకి ప్రయాణిస్తాయి. ఐతే ‘B’ బాష్పం అధికంగా ఉంటుంది. అంశికనాళిక ద్వారా ప్రయాణించేప్పుడు బాష్పాలు అనేక అడుగు ఉపరితలాలనెదుర్కొంటాయి. ఆ సమయంలో కింది నుంచి పైకి పై నుంచి కిందికి వచ్చే బాష్పాల మధ్య ఉష్ణ వినిమయం జరిగి బాష్పాల ఉష్ణోగ్రత తగ్గుతుంది.
ఆ ఉష్ణోగ్రత ‘A’ బాష్పీభవన స్థానం కంటే తక్కువయితే ‘A’ ద్రవీకరణం చెంది తిరిగి స్వేదన కుప్పెలోకి చేరుకుంటుంది. ద్రవీకరణం ఉష్ణమోచక చర్య అందువల్ల ‘A’ ద్రవీకరణం చెందగా వచ్చిన ఉష్ణశక్తి ‘B’ బాష్పాన్ని వేడిచేసి బాష్పస్థితిలోనే అంశిక నాళిక నుంచి బయటకు శుద్ధమైన ‘B’ బాష్పంగా వచ్చేందుకు ఉపయోగపడుతుంది. ఈ ‘B’ బాష్పం కండెన్సర్ ద్వారా ప్రయాణించి ద్రవీకరణం చెందుతుంది. ఆ విధంగా వచ్చిన ద్రవం సంగ్రహణ పాత్రలోకి వస్తుంది.
c) నిర్వాత (లేదా) తక్కువ పీడనంలో స్వేదనం (Distillation under reduced pressure) :
ఈ విధానం అధిక బాష్పీభవన స్థానాలున్న ద్రవాల్ని లేదా బాష్పీభవన స్థానాలకంటే తక్కువ ఉష్ణోగ్రతల వద్దనే వియోగం చెందే ద్రవాల్ని శుద్ధి చేయడానికి ఉపయోగపడుతుంది. బాహ్య పీడనం తగ్గిస్తే ద్రవం తక్కువ ఉష్ణోగ్రత వద్దే ఎలాంటి వియోగం చెందకుండా బాష్పీభవనం చెందుతోంది. వచ్చిన బాష్పాల్ని చల్లబరచి పరిశుద్ధ ద్రవాన్ని పొందవచ్చు. మలినాలు స్వేదన కుప్పెలో మిగిలిపోతాయి.
d) జల బాష్ప స్వేదనం (Steam distillation) :
ఈ పద్ధతిలో నీటిలో కరగని, బాష్పీభవన స్థానం ఎక్కువగా ఉన్న, జల బాష్పంతో బాష్పశీలత పొందే ద్రవాల్ని శుద్ధి చేస్తారు. ఈ విధానంలో వేడి మలిన ద్రవంలోకి నీటి ఆవిరిని పంపుతారు. నీటి ఆవిరి, ద్రవపు బాష్పం కలిసి బయటకొస్తాయి. దీనికి కారణం నీటి బాష్పం, ద్రవ బాష్పం రెండింటి మొత్తం పీడనం బాహ్య వాతావరణ పీడనానికి సమానమవడమే. ఈ నీటి ఆవిరి ద్రవ బాష్పం రెండూ కండెన్సర్ ద్వారా ప్రయాణించి ద్రవ మిశ్రమమై సంగ్రహణ పాత్రలో చేరతాయి. అవి ఒక దానితో ఒకటి కలిసిపోవు కాబట్టి వేర్పాటు గరాటుతో వేరు చేయవచ్చు.
![]()
ప్రశ్న 21.
క్రోమటోగ్రఫీని విశదీకరించండి.
జవాబు:
క్రోమటోగ్రఫీ :
స్వెట్ (Tswett 1906) ఒక వృక్ష శాస్త్రవేత్త. ఈయన వృక్షాల నుంచి నిష్కరించిన క్లోరోఫిల్, క్సాంతోఫిల్ ఇతర సమ్మేళనాలను కాల్షియం కార్బొనేట్ కాలమ్ ద్వారా ప్రసరింపచేసి (Percolate) వేరు పరచాడు. ఇక్కడ కాల్షియం కార్బొనేట్ కాలమ్ అధిశోషకంగా (adsorbent) గా పనిచేస్తుంది. విభిన్న సమ్మేళనాలు విభిన్న పరిమితుల్లో అధిశోషణం చెందడం వల్ల కాలమ్ విభిన్న స్థానాల్లో విభిన్న రంగుల పట్టీలు వచ్చాయి. స్వెట్ ఈ రంగుల పట్టీలకు క్రోమటోగ్రామ్ అని పేరు పెట్టాడు. ఈ పద్ధతిని క్రోమటోగ్రఫీ అన్నాడు. కాల్షియం కార్బొనేట్ కాలమ్ కదలిక లేనిది కాబట్టి దీనిని స్థిర (Stationary) ప్రావస్థ అంటారు. వృక్ష సంబంధ నిష్కర్ష పదార్థాల ద్రావణాన్ని చలనశీల (Mobile) ప్రావస్థ అంటారు. క్రోమటోగ్రఫీని ఒక మిశ్రమంలోని అనుఘటకాలను స్థిరప్రావస్థ, చలనశీల ప్రావస్థ అనే రెండు ప్రావస్థతి మధ్య వేరు పరచే విధానంగా అభివృద్ధి చేశారు.
క్రోమటోగ్రఫీలో కింద పేర్కొన్న మూడు దశలు ఇమిడి ఉంటాయి.
a. స్థిరప్రావస్థ మిశ్రమంలోని అనుఘటకాలను అధిశోషించుకొని స్థిరంగా పట్టి ఉంచుతుంది. చలన శీల ప్రావస్థ అధిశోషించుకోబడిన అనుఘటకాలను వేరు పరచి స్థిరప్రావస్థపై విభిన్న దూరాలకు తీసికొనిపోతుంది.
b. పైవిధంగా వేరుపర్చబడిన అనుఘటకాలను చలనశీల ప్రావస్థను ఆపకుండా పంపి తిరిగి పొందడం దీనినే నిక్షాలన పద్ధతి (elution) అంటారు.
c. గుణాత్మక, పరిమాణాత్మక విశ్లేషణల ద్వారా నిక్షాలన చేసి, సాధించిన సమ్మేళనాలను తెలుసుకోవడం.
క్రోమటోగ్రఫీ పద్ధతుల వర్గీకరణ :
స్థిరప్రావస్థ, చలనశీల ప్రావస్థల భౌతిక స్థితులపై ఆధారపడి కాని, స్థిరప్రావస్థపై పదార్థాలు అధిశోషించుకోబడిన సూత్రంపై ఆధారపడికాని, అనుఘటకాలు స్థిరప్రావస్థ, చలనశీల ప్రావస్థల మధ్య వితరణం (Partition) మీద ఆధారపడి గానీ క్రోమటోగ్రఫీని రకరకాలుగా వర్గీకరిస్తారు.
కోమటోగ్రఫీ పద్ధతి వర్గీకరణ
| కోమటోగ్రఫీ పద్దతి | స్థిరప్రావస్థ | చలనశీల ప్రావస్థ |
| 1. కాలమ్ (అధిశోషణ) క్రోమటోగ్రఫీ | ఘన పదార్థం | ద్రవం |
| 2. ద్రవ – ద్రవ వితరణ క్రోమటోగ్రఫీ ద్రవం | ద్రవం | ద్రవం |
| 3. పేపర్ క్రోమటోగ్రఫీ | ద్రవం | ద్రవం |
| 4. పలుచని పొర క్రోమటోగ్రఫీ ద్రవం లేదా (Thin layer chromatography) |
ద్రవం లేదా ఘన పదార్థం | ద్రవం |
| 5. వాయువు – ద్రవం క్రోమటోగ్రఫీ | ద్రవం | వాయువు |
| 6. వాయువు – ఘనపదార్థం క్రోమటోగ్రఫీ | ఘనపదార్థం | వాయువు |
| 7. అయాన్ వినిమయ క్రోమటోగ్రఫీ ఘనపదార్థం | ఘనపదార్థం | ద్రవం |
స్థిరప్రావస్థ మీదుగా పదార్థాల మిశ్రమాన్ని పంపాలి. స్థిరప్రావస్థ ఘనపదార్థం లేదా ద్రవం ఉంటుంది. ఒక శుద్ధ ద్రావణి లేదా ద్రావణుల మిశ్రమం లేదా వాయువును నెమ్మదిగా స్థిరప్రావస్థ పైకి పంపాలి. అప్పుడు మిశ్రమంలోని అనుఘటకాలు క్రమంగా ఒకదాని నుంచి ఒకటి విడిపోతాయి. ఈ కదిలే ప్రావస్థనే చలనశీల ప్రావస్థ అంటారు.
కింది సాధారణ క్రోమటోగ్రఫీలో ఉండే రెండు సాంకేతిక సూత్రాలను గూర్చి తెలుసుకొంటాం. అవి :
- అధిశోషణ క్రోమటోగ్రఫీ
- వితరణ క్రోమటోగ్రఫీ
అధిశోషణ క్రోమటోగ్రఫీలో అధిశోషణిపై వివిధ సమ్మేళనాలు వివిధ అవధుల్లో అధిశోషణం చెందుతాయి. సాధారణంగా వాడే అధిశోషణులు సిలికాజెల్ లేదా అల్యూమినా, చలన శీల ప్రావస్థను స్థిరప్రావస్థపై పంపినప్పుడు చలనశీల ప్రావస్థలోని వివిధ అనుఘటకాలు స్థిరప్రావస్థపై వివిధ దూరాలలో అధిశోషితం చెందుతాయి.
భేదాత్మక అధిశోషణం సూత్రాన్ని ఎ. కాలమ్ క్రోమటోగ్రఫీలోనూ బి. పలుచటి పొర క్రోమటోగ్రఫీలోనూ, వాడతారు.
ప్రశ్న 22.
కింది వాటిని వివరించండి.
a) కాలమ్ క్రోమటోగ్రఫి b) పలుచని పొర క్రోమటోగ్రఫీ c) వితరణ క్రోమటోగ్రఫి.
జవాబు:
a) కాలమ్ క్రోమటోగ్రఫి :
కాలమ్ క్రోమటోగ్రఫిలో మిశ్రమంలోని అనుఘటకాలను ఒక గాజుగొట్టంలో నింపి ఉన్న అధిశోషకం (స్థిరప్రావస్థ)పై భాగాన ఉంచాలి. గాజు గొట్టానికి కింద ఒక స్టాప్ కాక ఉంటుంది. ఒక సరియైన నిక్షాలకాన్ని అది ఒకే ద్రావణి కావచ్చు లేదా కొన్ని ద్రావణుల మిశ్రమం కావచ్చు, తీసికొని కాలమ్ పైనుంచి కిందికి నెమ్మదిగా ప్రవహింప జేయాలి. అప్పుడు మిశ్రమంలోని అనుఘటకాలు విభిన్న అవధుల్లో అధిశోషణం చెంది వేరవుతాయి.
b) పలుచని పొర క్రోమటోగ్రఫీ :
ఇది కూడా అధిశోషణాల్లో భేదం వల్లనే ఇక్కడ అధిశోషకం సితికాజెల్ లేదా అల్యూమినాను ఒక గాజు ప్లేటుపై పలుచనిపొర (0.2 mm మందం) గా పూత పూస్తారు. ఈ ప్లేటును టిఎల్సి ప్లేటు లేదా క్రోమెప్లేటు అంటారు. అనుఘటకాలను కలిగి ఉన్న మిశ్రమ ద్రావణాన్ని ప్లేట్ కింది నుంచి రెండు సెంటీ మీటర్ల (2 cm) దూరంలో ఒక చిన్న చుక్క లేదా బొట్టుగా ఉంచుతారు. ఇప్పుడు ప్లేటును నిక్షాలకం ఉన్న ఒక మూసిన పాత్రలో ఉంచుతారు. నిక్షాలకం ప్లేటు పైకి ప్రవహిస్తూ తనతోపాటు మిశ్రమంలోని అనుఘటకాలను తీసికొని పోతుంది కాని అనుఘటకాల అధిశోషణ అవధులపై ఆధారపడి అవి వివిధ దూరాలు ప్రయాణించి వేరు వేరు దూరాల్లో అధిశోషితమవుతాయి.
ఒక అనుఘటకం సాపేక్ష అధిశోషణం దాని మందనం గుణకం (Retardation factor) Rf విలువతో తెలుపుతారు.
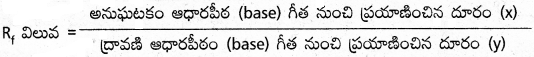
రంగులున్న అనుఘటకాల్ని తేలికగా గుర్తించవచ్చు. రంగులేని వాటిని వాటి ప్రతిదీప్తి ధర్మం ఆధారంగా చేసుకొని అతినీలలోహిత (UV) కిరణాలను ఉపయోగించి గుర్తిస్తారు. కొన్ని సమయాల్లో అనుఘటకాల స్థానాలను అయోడిన్ను అధిశోషింపజేసి గుర్తిస్తారు. ఆ స్థానాలు వాటిపై అయోడిన్ ఆవిర్లు ఊదినప్పుడు గోధుమ రంగుకు మారతాయి. కొన్ని సమయాల్లో ఒక కారకాన్ని చల్లి (Spray) అనుఘటకాల్ని గుర్తిస్తారు. ఎమినో ఆమ్లాల గుర్తింపుకు నిన్ హైడ్రిన్ను వాడతారు.
d) వితరణ క్రోమటోగ్రఫీ :
ఇది మిశ్రమంలోని అనుఘటకాలు ఆగకుండా స్థిరప్రావస్థ, చలనశీల ప్రావస్థల మధ్య భేదాత్మకంగా వితరణం చెందుతాయి. పేపర్ క్రోమటోగ్రఫీలో ఒక ప్రత్యేకమయిన క్రోమాటోగ్రఫీ పేపరు తీసికొని నీటిని దానిలో ఉంచుతారు (Trap). ఈ నీరు స్థిర ప్రావస్థగా పనిచేస్తుంది. ఈ క్రోమటోగ్రఫీ పేపర్ ఆధారపీఠ గీతపై అనుఘటకాల మిశ్రమ ద్రావణాన్ని చుక్కగా పెట్టి పేపర్ను ఒక సరియైన ద్రావణి (అది ఒకటే ద్రావణి లేదా కొన్ని ద్రావణుల మిశ్రమం కావచ్చు) దీనిలో వేలాడదీస్తారు. ఇక్కడ ద్రావణి చలన శీలప్రావస్థగా పనిచేస్తుంది. ద్రావణి పేపర్పై కాపిలరీ యాక్షన్ (Capillary action) ద్వారా పైకి ప్రయాణించి మిశ్రమపు బొట్టు పైగా పోతుంది.
అప్పుడు పేపర్ విభిన్న అనుఘటకాల్ని ప్రత్యేకంగా తనపై నిలుపుకొంటుంది. అనుఘటకాలు వాటి అభిలాక్షిణిక ధర్మాలపై ఆధారపడి స్థిరప్రావస్థ, చలనశీల ప్రావస్థల మధ్య వేర్వేరుగా వితరణ (Partition) చెందుతాయి. డెవలప్ చేసిన పేపరు క్రోమెటోగ్రాం అంటారు. విడగొట్టబడిన రంగుల అనుఘటకాల చుక్కలను పేపరుపై గుర్తించవచ్చు. రంగులేని అనుఘటకాలను ఇతర కారకాలను చల్లడం వంటి ప్రయత్నాల ద్వారా గుర్తించవచ్చు.
ప్రశ్న 23.
కర్బన సమ్మేళనంలో ఉన్న నైట్రోజన్ భార శాతాన్ని కింది విధానాలలో కనుక్కొనే పద్ధతిని రాయండి. a) డ్యూమాస్ పద్ధతి b) జెల్దాల్ పద్ధతి.
జవాబు:
నైట్రోజన్ భారశాతం : దీనికి రెండు పద్ధతులున్నాయి. అవి :
a) డ్యూమా పద్ధతి (Duma’s method)
b) జెల్దాల్ పద్ధతి (Kjeldahl’s method)
a) డ్యూమా పద్ధతి :
ఈ పద్ధతిలో తెలిసిన భారమున్న కర్బన పదార్థాన్ని ముతక క్యూప్రిక్ ఆక్సైడ్తో కలిపి తీసికొని ప్రబలంగా వేడి చేస్తారు. కార్బన్, హైడ్రోజన్లు కార్బన్ డయాక్సైడ్, నీటి ఆవిర్లుగా ఆక్సీకరణం చెందుతాయి. నైట్రోజన్ ఉంటే అది నైట్రోజన్ వాయువుగా మారుతుంది. కొంత నైట్రోజన్ ఆక్సైడ్లుగా మారినా, ఆక్సైడ్లను వేడి కాపర్ జాలకం (Gauze) తో నైట్రోజన్గా క్షయకరణం చెందుతాయి. ఉత్పన్న వాయువులను KOH ద్రావణం ద్వారా పంపి సంగ్రహిస్తారు. CO2 వాయువు KOH ద్రావణంలో శోషణం చెందుతుంది. నైట్రోజన్ KOH ద్రావణంపై చేరుతుంది. దాని ఘనపరిమాణాన్ని కొలుస్తారు.
![]()
‘a’ g కర్బన పదార్థం V1 ml నైట్రోజన్ ను TK, ‘P’ mm వాతావరణ పీడనం వద్ద ఇచ్చిందనుకొందాం. ‘p’ mm ని T, K వద్ద నీటి బాష్పపీడనంగా తీసికొంటే నైట్రోజన్ వాయువు పీడనం (P – p) = P1. నైట్రోజన్ ఘనపరిమాణాన్ని 273, 760 mm కు గణించాలంటే (ప్రమాణ ఉష్ణోగ్రత, పీడనాల వద్ద)
b) జెల్దాల్ (Kjeldah’s) పద్ధతి :
నైట్రోజన్ భార శాతం కనుక్కోవడానికి ఇది ఇంకో పద్ధతి. దీనిలో తెలిపిన భారం గల కర్బన సమ్మేళనం CuSO4 సమక్షంలో గాఢ సల్ఫ్యూరిక్ ఆమ్లంతో వేడి చేస్తారు. కర్బన పదార్థంలోని నైట్రోజన్ అంతా పరిమాణాత్మకంగా అమ్మోనియం సల్ఫేట్గా మారుతుంది. ప్రయోగ పాత్రలోని అనుఘటకాలన్నీ వేరే పాత్రలోకి మార్చి అధిక సోడియం హైడ్రాక్సైడ్ ద్రావణంతో వేడిచేస్తే అమ్మోనియా వాయువు విడుదల అవుతుంది. ఈ అమ్మోనియా వాయువును గాఢత, ఘనపరిమాణం తెలిసిన, అమ్మోనియా వాయువు మొత్తాన్ని తటస్థీకరణం చేయడానికి కావలసిన దానికన్నా ఎక్కువ పరిమాణంలో ఉన్న గాఢ సల్ఫ్యూరిక్ ఆమ్లంలోకి పంపి తటస్థీకరణం చెందించగా మిగిలిన ఆమ్లాన్ని ప్రమాణక్షారంతో అంశమాపనం చేస్తారు. దీని నుంచి అమ్మోనియాను తటస్థీకరించడానికి పట్టిన ఆమ్ల ప్రమాణాన్ని గణిస్తారు. దీని నుంచి ఎంత అమ్మోనియా ఏర్పడిందో గణించి దాని నుంచి నైట్రోజన్ భార శాతం లెక్కిస్తారు.
కర్బన పదార్థం + H2SO4 → (NH4)2SO4
(NH4)2SO4 + 2 NaOH → Na2SO4 + 2H2O + 2NH3
2NH3 + H2SO4 → (NH4)2SO4
గణన : కర్బన పదార్ధం ‘a’ g. అనుకొందాం.
మొదటగా తీసికొన్న సల్ఫ్యూరిక్ ఆమ్లం గాఢత ‘M’ ఘన పరిమాణం ‘Vml‘ అనుకొంటే
అమ్మోనియా వాయువును పంపిన తరువాత మిగిలిన ఆమ్లాన్ని ‘M’ మోలార్ NaOH ద్రావణంతో తటస్థీకరించడానికి V1 ml. ల NaOH పట్టిందనుకొంటే
= \(\frac{MV_1}{n_1}\)(NaOH) = \(\frac{MV_2}{n_2}\)(H2SO4)
స్థాయికియోమెట్రిక్ సమీకరణం ప్రకారం
2NaOH + H2SO4 → Na2SO4 + 2H2O
n1 = NaOH మోల్ల సంఖ్య
n2 = H2SO4 మోల్ల సంఖ్య

ప్రశ్న 24.
ప్రేరేపక ప్రభావాన్ని ఒక ఉదాహరణ ఇచ్చి వివరించండి.
జవాబు:
“కర్బన సమ్మేళనపు అణువులో ఒక బంధమునకు ఒక దిశలో ధృవాత్మకత ఉన్నప్పుడు, అణువులోని కార్బన్ శృంఖలము వెంట అదే దిశలో ధృవాత్మకతను కలుగజేయుటను ప్రేరేపక ప్రభావము అందురు”.
ధృవాత్మక సమూహము నుండి దూరము పెరిగే కొలది ప్రేరేపక ప్రభావము తగ్గిపోవును. ఈ ప్రభావము కార్బన్ శృంఖలములో నాల్గవ కార్బన్ తరువాత ఉండదు.
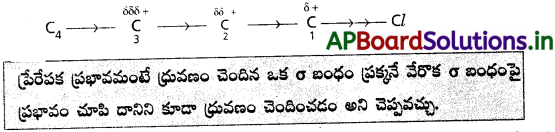
ప్రేరేపక ప్రభావమంటే ధ్రువణం చెందిన ఒక బంధం ప్రక్కనే వేరొక σ బంధంపై ప్రభావం చూపి దానిని కూడా ధ్రువణం చెందించడం అని చెప్పవచ్చు.
ప్రేరేపక ప్రభావం కార్బన్పై ఉన్న ప్రతిక్షేపకాల ఎలక్ట్రాన్ సాంద్రతను దానం చేసే లేదా ఆకర్షించే స్వభావంపై ఆధారపడి ఉంటుంది. ఈ స్వభావం ఆధారంగా ప్రతిక్షేపకాలను హైడ్రోజన్తో పోల్చి హైడ్రోజన్ కంటే ఎక్కువగా ఎలక్ట్రాన్ సాంద్రతను ఆకర్షించే వాటిని ఎలక్ట్రాన్ ఆకర్షక లేదా ఎలక్ట్రాన్ సాంద్రత తగ్గించే గ్రూపులనీ హైడ్రోజన్తో పోల్చినప్పుడు ఎలక్ట్రాన్లు ఎక్కువగా విడుదల చేసే గ్రూపులను ఎలక్ట్రాన్ దాన గ్రూపులనీ చెబుతారు.
హాలోజన్లు – NO2, – CN, – COOH, – COOR, – OArలు ఎలక్ట్రాన్ సాంద్రత ఆకర్షించే గ్రూపులు. వీటి ప్రేరేపక ప్రభావాన్ని (- I) గా చూపుతారు. ఆల్కైల్ గ్రూపులు ఎలక్ట్రాన్ దాతలు. వీటి ప్రేరేపక ప్రభావాన్ని (+ I) గా చూపుతారు.
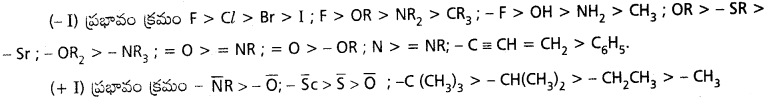
ప్రేరేపక ప్రభావం ముఖ్య లక్షణాలు :
ఇది శాశ్వత ప్రభావం, ప్రేరేపక ఎలక్ట్రాన్ స్థానభ్రంశాల వల్ల బంధంలో జరుగుతుంది. ప్రభావం శృంఖలం పెరిగే కొద్దీ తగ్గుతుంది. మూడో కార్బన్ తరువాత ప్రభావం లేనట్లే భావించవచ్చు. రసాయన చర్యాశీలతపై ప్రభావం చూపుతుంది. భౌతిక ధర్మాలపై ప్రభావం చూపుతుంది.
ప్రశ్న 25.
మీసోమరిక్ ప్రభావాన్ని వివరించండి.
జవాబు:
మీసోమరిక్ ప్రభావం (Mesomeric effect (M)) :
అణువులోని ఎలక్ట్రాన్లు వీలైనంత వరకు అస్థానీకృతం చెంది అణువుకు స్థిరత్వం తెస్తాయి. ఒంటరి జంటలు, సంయుగ్మతా వ్యవస్థలు ఈ అస్థానీకృతాన్ని ఎక్కువగా చూపుతాయి.
ఒక శృంఖలంలో సంయుగ్మ విధానంలో ఒక పరమాణువు లేదా గ్రూపు ఎలక్ట్రాన్ జంటలను స్థాన భ్రంశం చేసే విధానాన్ని మీసోమరిక్ ప్రభావం అంటారు.
మీసోమరిక్ ప్రభావం ప్రధాన లక్షణాలు :
- ఇది స్థిరమైన ప్రభావం. అణువు భూస్థితిలో ఉన్నప్పుడు జరుగుతుంది.
- ఒంటరి జతలు, π ఎలక్ట్రాన్లతో సంయుగ్మ విధానంలో ఎలక్ట్రాన్ స్థానభ్రంశం జరుగుతుంది.
- ఇది భౌతిక ధర్మాల్ని, చర్యావేగాల్ని ప్రభావితం చేస్తుంది.
ఏ గ్రూపులయితే మిగిలిన అణుభారంతో ఎలక్ట్రాన్ సాంద్రతను పెంచుతాయో వాటికి (+M) ప్రభావముంది అంటారు.
ఉదాహరణకు : -NH2 గ్రూపుకు + M ప్రభావం ఉన్నట్లుగా భావించాలి. ఏ గ్రూపులయితే ఎలక్ట్రాన్లను తమవైపుకు ఆకర్షించి మిగిలిన అణుభాగంపై ఎలక్ట్రాన్ సాంద్రతను తగ్గిస్తాయో వాటికి (- M) ప్రభావం ఉన్నట్లుగా భావించాలి.
ఉదాహరణకు :
ఇక్కడ > C = O గ్రూపు మిగిలిన అణుభాగంపై ఎలక్ట్రాన్ సాంద్రతను తగ్గిస్తుంది. దీనికి – M ప్రభావం ఉంటుంది.
+ M ప్రభావం చూపే గ్రూపులు – F > – Cl > – Br > – I – NR2 > OR > F – NH2 > – OH > – F; – OR > – SR > SeR; – O > – OR
– M ప్రభావం చూపే గ్రూపులు = O > – NR > = CR2, = R2 < = NR; N > CR.
– O, – OH, – H, – OH, – CH3 – NH్క లకు కూడా (- M) ప్రభావం ఉంటుంది.
హాలోజన్లకు – I ప్రభావం ఉంటుంది. కాని వాటి ఒంటరి జతలతో (+ M) ఉంటుంది. ఈ రెండూ వ్యతిరేక దిశల్లో పని చేస్తాయి.
![]()
ప్రశ్న 26.
రెజోనెన్స్ ప్రభావాన్ని ఒక ఉదాహరణతో వివరించండి.
జవాబు:
రెజోనెన్స్ ఫలితం :
పక్క పక్క పరమాణువుల మధ్య రెండు T బంధాల లేదా ఒక T బంధం ఒక ఒంటరి జంటల మధ్య జరిగే అంతర్ చర్యల వల్ల ఉత్పన్నమయిన ధ్రువణాన్ని రెజోనెన్స్ ఫలితం అంటారు.
ఈ ఫలితం శృంఖలం ద్వారా ప్రసారమవుతుంది.
ఎలక్ట్రాన్ల బదలాయింపు ప్రతిక్షేపక పరమాణువు లేదా గ్రూపు నుంచి అణువుపైకి సంయుగ్మ వ్యవస్థ ద్వారా జరిగితే దానిని (+ R) తో చూపుతారు. దీని వల్ల అణువులోని కొన్ని స్థానాల్లో ఎక్కువ ఎలక్ట్రాన్ సాంద్రత వస్తుంది. ఎనిలిన్ అణువు ఉదాహరణగా చూడవచ్చు. అదే ఎలక్ట్రాన్ బదలాయింపు ప్రతిక్షేపక పరమాణువులే గ్రూపు వైపుకయితే దానిని (- R) తో చూపుతారు. నైట్రోబెంజీన్ దీనికి ఉదాహరణ.
ఒక అణువు అసలు శక్తికి అత్యంత స్థిరమైన కనోనికల్ (Canonical) నిర్మాణం శక్తికి మధ్య భేదమే రెజొనెన్స్ శక్తి అంటారు.
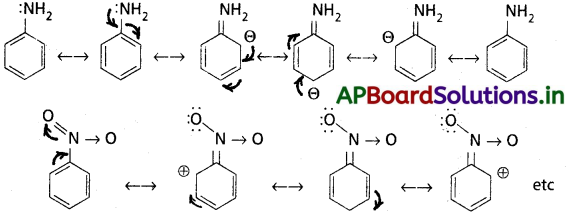
(+ R) ప్రభావం చూపే గ్రూపులు : X, – OH, – OR, – COOR, – NH2, -NHR, – NR2, – NHCOR మొదలైనవి.
(- R) ప్రభావం చూపే గ్రూపులు : -COOH, CHO, > C = O, – CN, – NO2 మొదలయినవి.
ఒక వివృత లేదా వలయ శృంఖలంలో ఏకబంధాలు, ద్విబంధాలు ఒకటి తర్వాత ఒకటి ఏకాంతరంగా ఉన్న వ్యవస్థను సంయుగ్మ (conjugated) వ్యవస్థ అంటారు.
రెజొనెన్స్ శక్తి :
అసలైన నిర్మాణం (రెజొనెన్స్ సంకర రూపం) శక్తికి అత్యంత స్థిరమైన రెజొనెన్స్ నిర్మాణం శక్తికి మధ్య భేదమే రెజొనెన్స్ శక్తి (+ R) ఫలితం.
ప్రశ్న 27.
కర్బన రసాయన చర్యలు ఎన్ని రకాలో వివరించండి.
జవాబు:
సాధారణ కర్బన రసాయన చర్యలు :
i) ప్రతిక్షేపణ (Substitution) చర్యలు,
ii) సంకలనాత్మక (Addition) చర్యలు,
iii) విలోపన (Elimination) చర్యలు,
iv) అణుపునరమరికలు (Molecular rearrangements) అని నాలుగు వర్గాలుగా విభజించవచ్చు.
i) సంకలనాత్మక చర్యలు : ఈ చర్యల్లో క్రియాధారం, కారకం రెండూ కలిసి ఒక ఉత్పన్నాన్ని ఇస్తాయి.

నెమ్మదిగా జరిగే చర్యావేగ నిర్ధారణదశలో సంకలనం చెందే కారకాన్ని బట్టి సంకలనాత్మక చర్యలను a) ఎలక్ట్రోఫిలిక్ సంకలనాత్మక చర్య, b) న్యూక్లియోలిక్ సంకలనాత్మక చర్య, c) స్వేచ్ఛా ప్రాతిపదిక సంకలనాత్మక చర్య అని వర్గీకరించవచ్చు.
ii) ప్రతిక్షేపణ చర్యలు :
ఈ చర్యల్లో ఒక పరమాణువు లేదా గ్రూపు క్రియాధారంలోని వేరే పరమాణువు లేదా గ్రూపును స్థానభ్రంశం చేసి క్రియాధారంతో బంధమేర్పరుస్తుంది.
![]()
iii) విలోపన చర్యలు :
ఇక్కడ రెండు లేక అంతకంటే ఎక్కువ పరమాణువులు లేదా గ్రూపులు క్రియాధారం నుంచి విలోపనం చెందుతాయి. దీని వల్ల ద్విబంధం లేదా త్రికబంధం ఉత్పన్నంలో ఏర్పడతాయి.
iv) అణుపునరమరికలు :
ఇక్కడ ఒక కర్బన పదార్ధం (సాధారణంగా తక్కువ స్థిరత్వం గలది), వేరే కర్బన పదార్ధంగా (ఎక్కువ స్థిరత్వం గలది) పునరమరిక చెందుతుంది.
ఉదా : ఫ్రీస్ పునరమరిక చర్య :
0 ఎసైలేటెడ్ ఫినాల్ గతిక నియంత్రిత ఉత్పన్నం. ఫినాల్ను సల్ఫ్యూరిక్ ఆమ్ల సమక్షంలో కార్బాక్సిలిక్ ఆమ్ల ఎన్హెడ్రేడ్లతో చర్య జరిపితే ఎక్టర్ వస్తుంది. అది తిరిగి AlCl3 ఉత్ప్రేరకం సమక్షంలో పునరమరిక చెంది ఎక్కువ స్థిరత్వం గల C-acyl సాదృశ్యాన్నిస్తుంది.
ప్రశ్న 28.
ఈథేన్ అనురూపకాలను రాసి వాటిలో దేనికి స్థిరత్వం ఎక్కువో తెలపండి.
జవాబు:
అనురూపాత్మక సాదృశ్యకములు (Conformers) :
అనురూపాత్మక సాదృశ్యములు ఒక రకమయిన ప్రాదేశిక సాదృశ్యములు. ఏక బంధంచే కలుపబడిన రెండు పరమాణువులు వాటిపై ఉండే సమూహలతో సహా బంధపు అక్షంపై చక్ర భ్రమణం చేయుట వలన భిన్న ప్రాదేశిక అమరికలు గల రూపములు లభించును. ఈ రూపములను అనురూపాత్మక సాదృశ్యకములు (లేక) చక్ర భ్రమణ సాదృశ్యకము అందురు.
ఈథేన్ – అనురూపాత్మక సాదృశ్యములు :
ఈథేన్ అణువులో ఒక కర్బన పరమాణువు స్థానమును స్థిరీకరించి, రెండవ కర్బన పరమాణువును ‘C – C’ బంధ అక్షముపై చక్ర భ్రమణము చేయుటవలన అనేక ప్రాదేశిక అమరికలు గల రూపములు లభించును. ఈ రూపములను అనురూపాత్మక సాదృశ్యములందురు.
ఈథేన్ ప్రధాన అనురూపాత్మక సాదృశ్యములు :
- గ్రహణ ఆకృతి (eclipsed form)
- అస్తవ్యస్త ఆకృతి (staggered form)
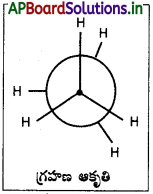
గ్రహణ ఆకృతిలో రెండు కర్బన పరమాణవులపై గల హైడ్రోజన్ పరమాణువులు అతిసన్నిహితంగా ఉండుట వలన వీటిమధ్య వికర్షణ బలములు అధికము. శక్తి అధికము. కనుక ఈ రూపమునకు స్థిరత్వము తక్కువ.
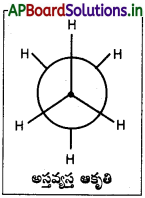
అస్తవ్యస్త ఆకృతిలో రెండు కర్బన పరమాణువులపై గల హైడ్రోజన్ పరమాణువులు వీలయినంత దూరంగా ఉండుటవలన, ఈ రూపములో వికర్షణ బలములు అతి స్వల్పము. కనుక శక్తి తక్కువ. అందువలన దీనికి స్థిరత్వము అధికము.
ఈథేన్ అణువులు నిరంతరము ఒకదానితో ఒకటి తాడనము చెందుటవలన వాటి శక్తి మారుతూ ఉండును. కనుక ఈ రూపములు కూడా నిరంతరము ఒకదాని నుండి ఇంకొకటి మారుతూవుండును. ఈ రూపముల మధ్య శక్తి తేడా చాలా తక్కువ కావున, ఈ రూపములను వేరుచేయుట సాధ్యం కాదు.
ప్రశ్న 29.
బెంజీన్ యొక్క ఏరోమాటిక్ ఎలక్ట్రోఫిల్లిక్ ప్రతిక్షేపణ చర్యలను వివరించండి.
జవాబు:
బెంజీన్ ఎలక్ట్రోఫిలిక్ ఏరోమాటిక్ ప్రతిక్షేపణ చర్యల చర్యా విధానం :
బెంజీన్ ఎలక్ట్రోఫిలిక్ ప్రతిక్షేపణ చర్యలు రెండు దశలలో జరుగుతాయి.
- ఎలక్ట్రోఫైల్ ఏర్పడటం.
- ఎ. కార్బొకాటియాన్ మధ్యస్థం ఏర్పడటం.
బి. కార్బొనేటియాన్ మధ్యస్థం నుంచి ప్రోటీన్ తొలగించడం.
1. బెంజీన్ హాలోజనీకరణం, ఆల్కైలేషన్, ఎసైలేషన్ చర్యల్లో నిర్జన AlCl3, అనే లూయీ ఆమ్లం క్లోరిన్ లేదా హాలోజన్తో, (X2) ఆల్కైల్ హాలైడ్తో లేదా ఎసైల్ హాలైడ్ తో చర్య జరిపి X+ క్లోరిన్ అయితే C+, R+, RCO+ లను వరుసగా ఇస్తుంది.
II) a) కార్బొకాటియాన్ ఏర్పడటం :
పైన ఉత్పన్నమయిన ఎలక్ట్రోఫైల్ ఒక బెంజీన్ అణువులోని కార్బన్పై చర్య జరిపి దానిని sp³ కార్బన్ మారుస్తుంది. ఆ విధంగా ఏర్పడిన (అర్రీనియం అయాన్) కార్బొకాటియాన్ రెజొనెన్స్ ద్వారా స్థిరత్వం పొందుతుంది.
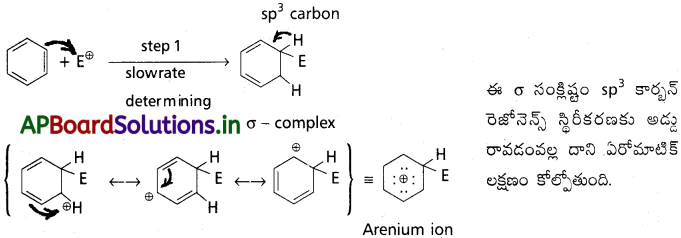
b) ప్రోటాన్ వదులుకోవడం :
తిరిగి ఏరోమాటిక్ లక్షణం పొందడానికి అరీనియం అయాన్ sp³ కార్బన్ నుంచి ఒక ప్రోటాను కోల్పోతుంది. ఇది హాలోజనీకరణం, ఆల్కైలేషన్, ఎసైలేషన్లలో (AlCl4)– తో చర్య జరపడం ద్వారా, నైట్రేషన్లో చర్య ద్వారా.
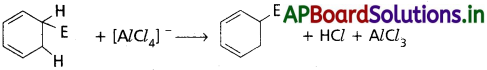
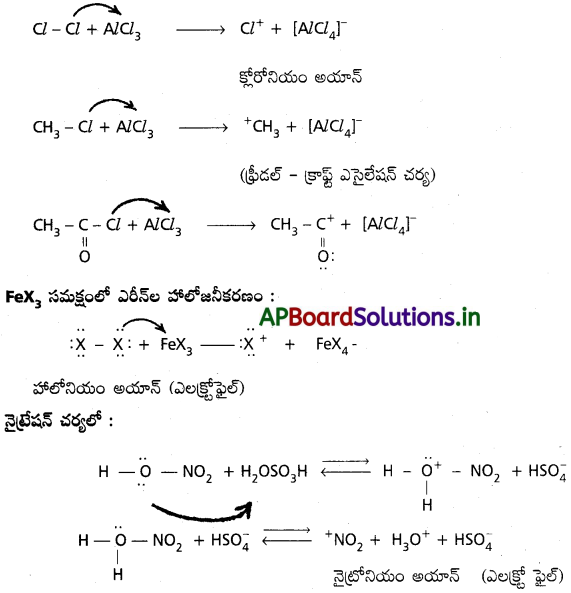
బెంజీన్ యొక్క ప్రతిక్షేపణ చర్యలు :
1. హాలోజనీకరణం :
బెంజీన్ ను FeCl3 ఉత్ప్రేరకం సమక్షంలో క్లోరిన్ తో చర్య జరుపగా క్లోరో బెంజీన్ ఏర్పడుతుంది.

2. నైట్రోకరణం :
బెంజీన్ ను నైట్రోషన్ మిశ్రమం (గాఢ HNO3 + గాఢ H2SO4) తో 60°C కన్న తక్కువ ఉష్ణోగ్రత వద్ద చర్య జరుపగా నైట్రోబెంజీన్ ఏర్పడుతుంది.

3. సల్ఫోనీకరణం :
బెంజీన్ సుథూమ సల్ఫ్యూరిక్ ఆమ్లంతో చర్య జరిపి బెంజీన్ సల్ఫోనిక్ ఆమ్లమునిస్తుంది.

4. ఆల్కైనీకరణం :
బెంజీన్ AlCl3 సమక్షంలో ఆల్కైల్ హాలైడ్లతో చర్య జరిపి ఆల్కైల్ బెంజీన్ ఇస్తుంది.

5. ఎసైలేషన్ :
బెంజీన్, AlCl3 సమక్షంలో ఎసైలోరైడ్తో చర్య జరిపి ఎసైల్ బెంజీన్ ఇస్తుంది.

ప్రశ్న 30.
ఇథిలీన్ సంకలన చర్యలను (ఎలక్ట్రోఫిల్లిక్) చర్యాగతిని వివరించండి.
జవాబు:
ఇథిలీన్ ఎలక్ట్రోఫిల్లిక్ సంకలన చర్యా విధానము :
ఇథిలీన్ కార్బన్ – కార్బన్ మధ్యవున్న ద్విబంధంలోని π – ఎలక్ట్రాన్లు ఎలక్ట్రోఫైల్కు అందుబాటులో ఉంటాయి. ద్విబంధంపై ఎలక్ట్రోఫైల్ సంకలన చర్యలో రెండు క్రొత్త σ – బంధాలు ఏర్పడతాయి. ద్విబంధంలోని π – బంధవిచ్ఛేదన వల్ల ఈ క్రొత్త σ – బంధాలేర్పడతాయి.
మొదటిదశ :
ఇథిలీన్ పై ఎలక్ట్రోఫైల్ (E+) చర్యలో కార్బోనియం అయాన్ ఏర్పడుతుంది.

రెండవ దశ :
పైదశలో ఏర్పడిన కార్బోనియం అయాన్ పై న్యూక్లియోఫైల్ (Nu–) చర్యలలో అంతిమ ఉత్పన్నమేర్పడుతుంది.
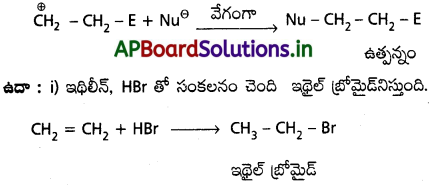
చర్యా విధానము :
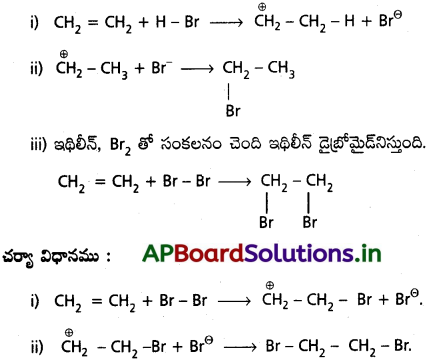
ప్రశ్న 31.
చర్యా సంవిధానం (mechansim of the reaction) ద్వారా ఆల్కేన్ స్వేచ్ఛా ప్రాతిపదిక హాలేజినేషన్ చర్యను వివరించండి.
జవాబు:
హాలోజనేషన్ లేదా హాలోజనీకరణం : ఈథేన్ హాలోజన్లతో వ్యాపన సూర్యరశ్మి లేదా UV కిరణాలతో లేదా 700 K కంటే పై ఉష్ణోగ్రత వద్ద చర్య జరుపుతుంది.
![]()
చర్య ఇక్కడితో ఆగదు. హైడ్రోజన్ల స్థానభ్రంశం అన్ని హైడ్రోజన్లతో జరగవచ్చు. ఈ విధంగా C2H4Cl2, C2H3Cl3 C2Cl6 వరకు వస్తాయి. అందుకే ఈథేన్తో క్లోరిన్ చర్యలో అనేక క్లోరో ఉత్పన్నాల మిశ్రమం వస్తుంది. దీనికి కారణం ఈథేన్లలో ఒక హైడ్రోజన్ పరమాణువు నుంచి ఆరు హైడ్రోజన్ పరమాణువుల వరకు మొత్తం హైడ్రోజన్లు క్లోరిన్ పరమాణువులతో ప్రతిక్షేపింపబడే అవకాశం ఉండడమే.
హాలోజనీకరణం స్వేచ్ఛా ప్రాతిపదికా విధానంలో జరుగుతుంది.
చర్యా విధానం :
క్లోరినీకరణ చర్య తీసుకొంటే ఈ చర్య మూడు దశల్లో జరుగుతుంది. ఆ దశలు i) శృంఖల చర్యల ప్రారంభం (Initiation), ii) శృంఖల చర్యల వ్యాప్తి (Propagation), iii) శృంఖల చర్యల ముగింపు (Termination)
1. అయితే శృంఖల సాదృశ్యాల్లో పక్క శృంఖలాలు పెరిగే కొద్దీ బాష్పీభవన స్థానాలు తగ్గుతాయి.
i) శృంఖల చర్య ప్రారంభ చర్య :
ఇక్కడ క్లోరిన్ అణువు శక్తిని గ్రహించి క్లోరిన్ స్వేచ్ఛా ప్రాతిపదికలుగా విడిపోతుంది. C – C, C – H బంధాలు సాపేక్షంగా బలమైనవి కావడం వల్ల ఈ దశలో అవి విచ్ఛిన్నం కావు.

ii) శృంఖల చర్య వ్యాప్తి :
పైన ఏర్పడిన క్లోరిన్ స్వేచ్ఛా ప్రాతిపదికలు ఈథేన్ అణువుతో చర్య జరుపుతాయి. ఇది రెండో దశ.
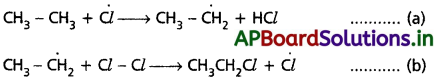
(a), (b) చర్యలు అనేక మార్లు పునరావృతమై చర్యను శృంఖల చర్యగా మారుస్తాయి. అందుకే (a), (b) లను చర్యావ్యాప్తి చర్యలు అంటారు. ఈ దశలోనే ప్రధాన ఉత్పన్నాలు ఏర్పడతాయి.
(a), (b) తో పాటు ఇంకా ఇతర హైడ్రోజన్లను కూడా ప్రతిక్షేపించే ఇతర చర్యలు జరుగుతాయి.
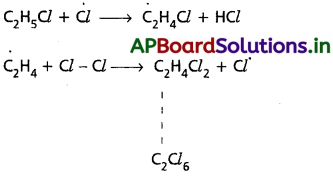
iii) శృంఖల చర్యల ముగింపు :
స్వేచ్ఛాప్రాతిపదికలు నేరుగా కలిసిపోయి శృంఖల చర్యలు అంతమవుతాయి. ఇది సాధారణంగా ఒక క్రియాజనకం పూర్తిగా చర్యలో పాల్గొని ఇంకా చర్య జరిపేందుకు ఏమీ మిగలకపోవడం లేదా ఇతర ప్రక్క చర్యలు జరగడం వంటి కారణాల వల్ల జరుగుతుంది.
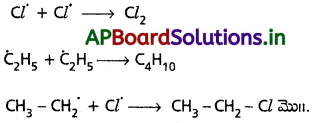
ప్రశ్న 32.
మార్కొనికాఫ్ నియమం, ఖరాష్ ప్రభావాల్ని వివరించండి.
జవాబు:
i) మార్కొనికాఫ్ నియమం నిర్వచనం :
ఈ నియమం ప్రకారం ఒక అసమ కారకం (unsymmetrical reagent) (C = C) ద్విబంధం దగ్గర సంకలనం చెందేప్పుడు దాని ధనావేశ భాగం ఎక్కువ స్థిరత్వముండే కార్బొకాటియాన్ మధ్యస్థం ఏర్పడేందుకు వీలుగా ఉన్న ద్విబంధ కార్బన్పై సంకలనం చెందుతుంది.
చర్యా విధానం :
ద్విబంధంలోని II ఎలక్ట్రాన్ జంట ఎలక్ట్రోఫైల్ అయిన HX పై చర్య జరిపి ఎకైరల్ ట్రై గొనల్ సమతల కార్బొకాటియాను ఇస్తుంది. అప్పుడు హాలైడ్ అయాన్ (X–) ధన విద్యుదావేశ కార్బన్పై ముందు, వెనుక ఏ వైపు నుంచైనా చర్య జరిపి ఆల్కైల్ హాలెడ్ ఉత్పన్నం ఇస్తుంది.
స్థిరత్వంలో టెర్షియరీ C+ > సెకండరీ C+ > ప్రైమరీ C+ గా ఉంటుంది.
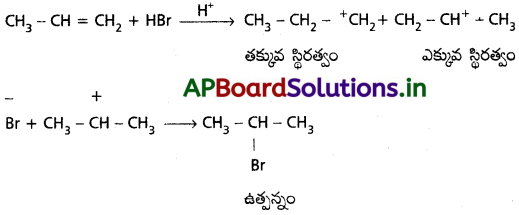
ii) యాంటి మార్కొనికాఫ్ సంకలనం, పెరాక్సైడ్ ప్రభావం లేదా ఖరాష్ ప్రభావం ఉత్సనం :
(Anti Markownikoff’s addition or peroxide effect or Kharasch effect)
పెరాక్సైడ్ సమక్షంలో (R – O – O – R) HBr ను ప్రొపీన్ లాంటి ఒక అసమ ఆల్కీను కలిపినపుడు సంకలనం మార్కోనీకాఫ్ నియమానికి వ్యతిరేకంగా జరుగుతుంది. నియమం ప్రకారం ప్రొపీన్ లాంటి అసౌష్ఠవ ఆల్కీన్కు HBr ను పెరాక్సైడ్ సమక్షంలో జరిపినపుడు కారకంలోని H ద్విబంధం వద్ద ఏ కార్బన్పై తక్కువ హైడ్రోజన్లు ఉంటాయో దానితో బంధమేర్పరుస్తుంది.
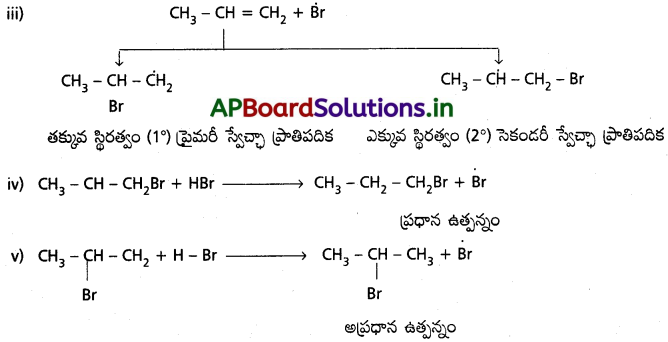
2° స్వేచ్ఛా ప్రాతిపదిక కంటే 1° స్వేచ్ఛా ప్రాతిపదిక ఎక్కువ స్థిరత్వం గలది. అందువల్ల 1-బ్రోమోప్రొపేన్ ప్రధాన ఉత్పన్నం.
![]()
ప్రశ్న 33.
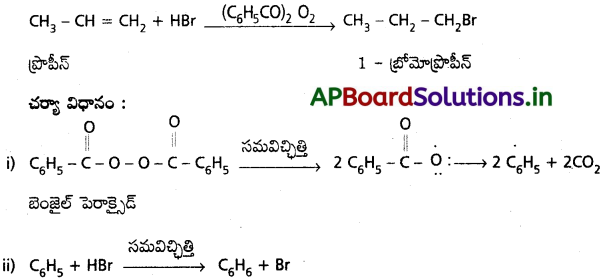
బెంజీన్ నుండి ఈ క్రింది వాటిని ఏ విధంగా పొందవచ్చు?
a) క్లోరో బెంజీన్ b) టోలీస్ c) p- నైట్రో టోలీన్
జవాబు:
a) బెంజీన్ క్లోరిన్తో FeCl3 సమక్షంలో చర్య జరిపి క్లోరో బెంజీన్ ను ఏర్పరచును.

b) బెంజీన్ CH3Cl తో AlCl3 సమక్షంలో చర్య జరిపి టోలీన్ ను ఏర్పరచును. (ఫ్రీడల్ క్రాఫ్ట్ చర్య)
c) బెంజీన్ నుండి p- నైట్రోటోలీన్ ఈ క్రింది విధంగా ఏర్పడును.
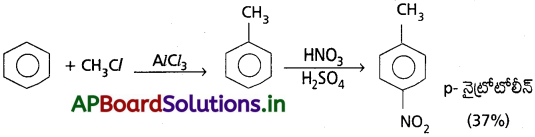
ప్రశ్న 34.
బేసి సంఖ్యలో కార్బన్లున్న ఆల్కేన్లను ఉర్ట్ చర్య ద్వారా ఎందుకు తయారుచేయలేరు? ఏదైనా ఉదాహరణతో వివరించండి.
జవాబు:
ఉర్జ్ చర్య :
ఆల్కైల్ హేలైడ్లు సోడియం లోహంతో పొడి ఈథర్ సమక్షంలో చర్య జరిపి ఆల్కేన్లను ఏర్పరచును.
![]()
- ఉర్ట్జ్ చర్యను బేసి సంఖ్యలో కార్బన్లు ఉన్న ఆల్కేన్లను తయారుచేయుటకు ఎక్కువగా ఉపయోగించరు.
- బేసి సంఖ్యలో కార్బన్లు ఉన్న ఆల్కేన్లను తయారుచేయుటకు రెండు విభిన్నమైన ఆల్కైల్ హాలైడ్లను తీసుకొనవలెను.
- ఏర్పడే ఉత్పన్నం తక్కువ మొత్తంలో ఏర్పడును. ఎందువలన అనగా ఉత్పన్నం మిశ్రమ రూపంలో ఏర్పడును.
- మీథేన్ ను ఈ చర్య ద్వారా తయారుచేయలేము.
ప్రశ్న 35.
కర్బన సమ్మేళనాలలో నైట్రోజన్, సల్ఫర్, హాలోజన్లను గుణాత్మకంగా విశ్లేషించే సమీకరణాలను రాయండి.
జవాబు:
హాలోజన్లు, నైట్రోజన్, సల్ఫర్లను గుర్తించడం :
(లాసైన్ పరీక్ష లేదా సోడియం నిష్కర్షణ పరీక్ష) :
లాసైన్ పరీక్షలో సమ్మేళనాన్ని ఒక జ్వలన నాళిక (Ignition tube) లో సోడియం లోహంతోపాటు తీసికొని నాళిక ఎర్రగా మారే వరకు వేడిచేస్తే సమ్మేళనం, సోడియం కరుగుతాయి. అప్పుడు క్రింది చర్యలు జరుగుతాయి.
నైట్రోజన్ కనుక కర్బన పదార్థంలో ఉంటే NaCN వస్తుంది.

కర్బన పదార్థంలో సల్ఫర్ ఉంటే (Nazs) ఏర్పడుతుంది.
2 Na + S → Na2S
కర్బన పదార్థంలో హాలోజన్లు ఉంటే
2 Na + X2 → 2NaX(X = Cl, Br, I)
ఎర్రని వేడి జ్వలన నాళికను స్వేదన జలంలో ముంచి పైన వచ్చిన కరిగిన ద్రవ్యరాశిని నీటితో నిష్కర్షణ చేసి ద్రావణాన్ని పది నిముషాల పాటు మరిగించి వడపోయాలి. గాలిత ద్రవాన్ని సోడియం నిష్కర్షణ (Sodium extract) అంటారు.
i) నైట్రోజన్ పరీక్ష :
ఒక భాగం సోడియం నిష్కర్షణను తీసికొని అది క్షార ద్రావణం కాకపోతే కొంత NaOH ద్రావణాన్ని కలిపి అప్పుడే తయారు చేసిన ఫెర్రస్ సల్ఫేట్ ద్రావణాన్ని కలపాలి. దీనికి 2 లేదా 3 చుక్కల FeCl3 ద్రావణం కలిపి, చల్లబరచి గాఢ HCl ద్రావణంతో ఆమ్లీకృతం చేయాలి. ప్రసన్ బ్లూ (Prhssian blue) లేదా ఆకుపచ్చని రంగు లేదా అవక్షేపం వస్తే నైట్రోజన్ ఉన్నట్లు.
ii) సల్ఫర్ పరీక్ష :
ఒక భాగం సోడియం నిష్కర్షణ తీసుకొని దానికి తాజాగా తయారుచేసిన సోడియం నైట్రోప్రసైడ్ ద్రావణం కలపాలి. ముదురు ఉదారంగు వస్తుంది.
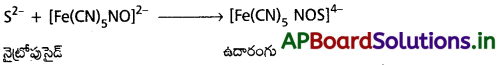
N, S రెండూ ఉంటే Na + C + N + S → NaSCN సోడియం ఢయోసైనేట్.
దీనికి FeCl3 ద్రావణాన్ని కలిపితే Fe3+ + SCN– → [Fe(SCN)]2+ రక్తపు రంగు.
రక్తపు రంగు రాకుంటే N లేదా SS లేవని అర్థం. సోడియం ఎక్కువగా తీసికొని సోడియం నిష్కర్షణ తయారు చేస్తే ధయోసయనేటి వియోగం చెంది CN, S2- వస్తాయి.
Na SCN + 2Na → NaCN + Na2S
సోడియం ప్యూజిన్ ఎక్స్ట్రాక్ట్ లేదా సోడియం ద్రవ నిష్కర్షణను ఎసిటిక్ ఆమ్లంతో ఆమ్లీకృతం చేసి లెడ్ ఎసిటేట్ ద్రావణాన్ని కలిపితే నల్లని అవక్షేపం వస్తుంది.
Pb² + S2- → PbS
iii) హాలోజన్ల పరీక్ష :
సోడియం ఎక్స్ట్రాక్ట్ను నైట్రికామ్లంతో ఆమ్లీకృతం చేసి AgNO, ద్రావణాన్ని కలపాలి.
Ag+ + X– → AgX
తెల్లని అవక్షేపం ఏర్పడి, అది NH4OH ద్రావణంలో కరిగితే ఆ హాలైడ్ Cl–. అంటే క్లోరిన్ ఉన్నట్లు లేత పసుపు పచ్చ అవక్షేపం ఏర్పడి, అది NH4OH ద్రావణంలో అతి తక్కువగా కరిగితే అది Br–. అంటే బ్రోమిన్ ఉన్నట్లు, పసుపు పచ్చని అవక్షేపం ఏర్పడి, అది NH4OH ద్రావణంలో దాదాపు కరగకపోతే అది అయోడైడ్ (I–). అంటే అయోడిన్ ఉన్నట్లు.
c) ఫాస్ఫరస్ ను గుర్తించడం: సమ్మేళనాన్ని సోడియం పెరాక్సైడ్ వంటి ఆక్సీకరణితో వేడి చేసినప్పుడు సమ్మేళనంలోని ఫాస్ఫరస్ ఆక్సీకరణం చెంది PO 3 ద్రావణాన్ని HNO తో మరిగించి అమ్మోనియం మోలిబ్రేట్ తో చర్య జరపాలి. అప్పుడు కానరీపక్షి రంగును పోలిన పసుపు పచ్చని అవక్షేపం వస్తే ఫాస్ఫరస్ ఉన్నట్లు.
Na3PO4 + 3HNO3 → H3PO4 + 3NaNO3.
H3PO4 + 12(NH4)2M0O4 + 21HNO3 → (NH4)3 PO4. 12M0O3 + 12H2O అమ్మోనియం ఫాస్ఫోమోలిబేట్.
d) ఆక్సిజన్ను గుర్తించడం ఆక్సిజన్కు ప్రత్యక్ష పరీక్ష లేదు. అయితే కర్బన పదార్థాన్ని నైట్రోజన్ వాతావరణంలో వేడిచేస్తే పరీక్షనాళిక గోడలపై నీటిబిందువులు కనబడితే ఆక్సిజన్ ఉన్నట్లు. OH, CHO, COOH, NO వంటి ప్రమేయ సమూహాలను గుర్తిస్తే ఆక్సిజన్ ఉన్నట్లుగా గ్రహించవచ్చు. ఈ విధంగా కాకుండా సమ్మేళనం సంఘటన శాతం కనుగొన్న తరువాత మొత్తం 100% కు రాకుంటే ఆ భేదం ఆక్సిజన్ వలన అనుకోవచ్చు.
ప్రశ్న 36.
కర్బన సమ్మేళనంలో కార్బన్, హైడ్రోజన్ల భారశాతాన్ని కనుక్కోవడానికి అనువైన సమీకరణాలను రాయండి.
జవాబు:
కార్బన్, హైడ్రోజన్ల భార శాతం కనుక్కోవడం: ఒకే ప్రయోగంలో ఒకేసారిగా రెండు మూలకాల భారశాతం కనుక్కోవచ్చు. తెలిసిన భారం గల కర్బన పదార్థాన్ని తీసికొని దానిని కాపర్ (II) ఆక్సైడ్ సమక్షంలో అధిక గాలి సమక్షంలో పూర్తిగా దహనం చెందించాలి. ( దహనం చెంది CO్క గాను H దహనం చెంది H2O గాను మారతాయి.
Cx Hy + x + \(\frac{y}{2}\)O2 → x CO2 + \(\frac{y}{2}\) H2O.
ఆ విధంగా లభించిన CO2.H2O లను ముందుగానే తూచి వరుసగా ఉంచిన నిర్జల కాల్షియం క్లోరైడ్, కాస్టిక్ పొటాష్లతో ఉన్న విడి విడి U గొట్టాలలోకి పంపుతారు. కాల్షియం క్లోరైడ్ ఏ గొట్టంలో పెరిగిన బరువు వెలువడిన నీటి ఆవిరి బరువుగాను కాస్టిక్ పొటాష్ U గొట్టంలో పెరిగిన బరువు విడుదలయిన CO2 భారంగాను ఉంటాయి.
‘a’ గ్రాముల కర్బన పదార్థం దహనం చెంది ‘b’ గ్రాముల నీటి ఆవిరి, ‘C’ గ్రాముల CO2 ల, నిచ్చాయని అనుకొందాం. ఇప్పుడు CO2 భారశాతం గణించే విధానం చూద్దాం.
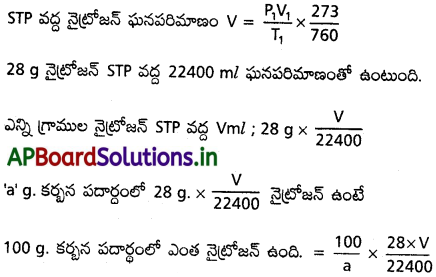
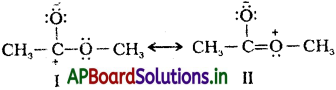
కార్బన్ భార శాతం (%): 12g. కార్బన్ 44g. CO2 లో ఉంది.
? ← + ‘C’ g. of CO2
⇒ \(\frac{22}{44}\) × C g ల కార్బన్
‘a’ గ్రాముల కర్బన పదార్థంలో \(\frac{22}{44}\) × C g కార్బన్ ఉంటే
100 గ్రాముల కర్బన పదార్థంలో ఎంత కార్బన్ ఉంది ? = \(\frac{100}{a}\times\frac{2}{18}\) × c g.
హైడ్రోజన్ భారశాతం (%) :
18 గ్రాముల నీటిలో 2 గ్రా.ల హైడ్రోజన్ ఉన్నది.
‘b’ గ్రాముల నీటిలో ఎన్ని గ్రా. హైడ్రోజన్ ఉన్నది?
⇒ \(\frac{b}{18}\) × 2g
‘a’ g కర్బన పదార్ధంలో \(\frac{b}{18}\) × 2g హైడ్రోజన్ ఉన్నది
100 గ్రాముల కర్బన పదార్ధంలో ఎన్ని (?) గ్రాముల హైడ్రోజన్ ఉన్నది.
\(\frac{b\times2}{18}\times\frac{100}{a}\)
ప్రశ్న 37.
నైట్రోజన్ భారశాతాన్ని డ్యూమాస్, జెల్దాల్ పద్ధతిలో కనుక్కొనే విధానాన్ని వివరించండి.
జవాబు:
నైట్రోజన్ భారశాతం : దీనికి రెండు పద్ధతులున్నాయి. అవి :
i) డ్యూమా పద్ధతి (Duma’s method)
ii) జెల్దాల్ పద్ధతి (Kjeldahl’s method)
i) డ్యూమా పద్ధతి :
ఈ పద్ధతిలో తెలిసిన భారమున్న కర్బన పదార్థాన్ని ముతక క్యూప్రిక్ ఆక్సైడ్తో కలిపి తీసికొని ప్రబలంగా వేడి చేస్తారు. కార్బన్, హైడ్రోజన్లు కార్బన్ డయాక్సైడ్, నీటి ఆవిర్లుగా ఆక్సీకరణం చెందుతాయి. నైట్రోజన్ ఉంటే అది నైట్రోజన్ వాయువుగా మారుతుంది. కొంత నైట్రోజన్ ఆక్సైడ్లుగా మారినా, ఆక్సైడ్లను వేడి కాపర్ జాలకం (Gauze) తో నైట్రోజన్గా క్షయకరణం చెందుతాయి. ఉత్పన్న వాయువులను KOH ద్రావణం ద్వారా పంపి సంగ్రహిస్తారు. CO2 వాయువు KOH ద్రావణంలో శోషణం చెందుతుంది. నైట్రోజన్ KOH ద్రావణంపై చేరుతుంది. దాని ఘనపరిమాణాన్ని కొలుస్తారు.
![]()
‘a’ g కర్బన పదార్థం V1 ml నైట్రోజన్ ను TK, ‘P’ mm వాతావరణ పీడనం వద్ద ఇచ్చిందనుకొందాం. ‘p’ mm ని T, K వద్ద నీటి బాష్పపీడనంగా తీసికొంటే నైట్రోజన్ వాయువు పీడనం (P – p) = P1. నైట్రోజన్ ఘనపరిమాణాన్ని 273, 760 mm కు గణించాలంటే (ప్రమాణ ఉష్ణోగ్రత, పీడనాల వద్ద)
ii) జెల్దాల్ (Kjeldahl’s) పద్ధతి :
నైట్రోజన్ భార శాతం కనుక్కోవడానికి ఇది ఇంకో పద్ధతి. దీనిలో తెలిపిన భారం గల కర్బన సమ్మేళనం CuSO4 సమక్షంలో గాఢ సల్ఫ్యూరిక్ ఆమ్లంతో వేడి చేస్తారు. కర్బన పదార్థంలోని నైట్రోజన్ అంతా పరిమాణాత్మకంగా అమ్మోనియం సల్ఫేట్గా మారుతుంది. ప్రయోగ పాత్రలోని అనుఘటకాలన్నీ వేరే పాత్రలోకి మార్చి అధిక సోడియం హైడ్రాక్సైడ్ ద్రావణంతో వేడిచేస్తే అమ్మోనియా వాయువు విడుదల అవుతుంది. ఈ అమ్మోనియా వాయువును గాఢత, ఘనపరిమాణం తెలిసిన, అమ్మోనియా వాయువు మొత్తాన్ని తటస్థీకరణం చేయడానికి కావలసిన దానికన్నా ఎక్కువ పరిమాణంలో ఉన్న గాఢ సల్ఫ్యూరిక్ ఆమ్లంలోకి పంపి తటస్థీకరణం చెందించగా మిగిలిన ఆమ్లాన్ని ప్రమాణక్షారంతో అంశమాపనం చేస్తారు. దీని నుంచి అమ్మోనియాను తటస్థీకరించడానికి పట్టిన ఆమ్ల ప్రమాణాన్ని గణిస్తారు. దీని నుంచి ఎంత అమ్మోనియా ఏర్పడిందో గణించి దాని నుంచి నైట్రోజన్ భార శాతం లెక్కిస్తారు.
కర్బన పదార్థం + H2SO4 → (NH4)2SO4
(NH4)2SO4 + 2 NaOH → Na2SO4 + 2H2O + 2NH3
2NH3 + H2SO4 → (NH4)2SO4
గణన : కర్బన పదార్ధం ‘a’ g. అనుకొందాం.
మొదటగా తీసికొన్న సల్ఫ్యూరిక్ ఆమ్లం గాఢత ‘M’ ఘన పరిమాణం ‘Vml‘ అనుకొంటే
అమ్మోనియా వాయువును పంపిన తరువాత మిగిలిన ఆమ్లాన్ని ‘M’ మోలార్ NaOH ద్రావణంతో తటస్థీకరించడానికి V1 ml. ల NaOH పట్టిందనుకొంటే


ప్రశ్న 38.
కర్బన సమ్మేళనంలోని సల్ఫర్, ఫాస్ఫరస్, ఆక్సిజన్ల పరిమాణాత్మక విశ్లేషణను వివరించండి.
జవాబు:
1) ఫాస్ఫరస్ భార శాతం :
ఫాస్పరస్ భారశాతాన్ని కనుక్కోడానికి తెలిసిన ద్రవ్యరాశి గల కర్బన పదార్థాన్ని కేరియస్ నాళికలో సధూమ నైట్రిక్లామంతో వేడి చేయాలి. ఫాస్ఫరస్ ఫాస్ఫారిక్ ఆమ్లంగా ఆక్సీకరణం చెందుతుంది. ఈ ఆమ్లాన్ని అమ్మోనియా, అమ్మోనియం మోలిబేట్ ద్రావణాలు కలిపి అమ్మోనియం ఫాస్ఫోమోలిబ్దేటి (NH4)3 PO4 12M0O3 గా అవక్షేపించాలి. కొన్ని సమయాల్లో ఆమ్లాన్ని మెగ్నీషియం మిశ్రమం కలిపి అవక్షేపిస్తారు. (మెగ్నీషియం మిశ్రమమంటే 100.0g. ల MgCl2, 6H2O. 100.0g. ల NH4Cl లను నీటిలో కరిగించి ఆ ద్రావణాన్ని 1000 ml లకు విలీనం చేస్తే వచ్చే ద్రావణం) అప్పుడు మెగ్నీషియం అమ్మోనియం ఫాస్ఫేట్ అవక్షేపమేర్పడుతుంది. (Mg NH4 PO4) దీనిని జ్వలనం చేస్తే మెగ్నీషియం పైరో ఫాస్ఫేట్ (Mg2P2O7) వస్తుంది.
పరిశీలనలు, గణనలు :
‘a’ y’ ల కర్బన సమ్మేళనం తీసుకుంటే ‘b’ g ల అమ్మోనియం ఫాస్ఫో మోలిబ్రేట్ ఏర్పడిందనుకొందాం.
అమ్మోనియం ఫాస్ఫోమోలిబ్రేట్ అణు ద్రవ్యరాశి (NH4)3PO4 12MoO3 = 1877
1877 ge) (NH4)3PO4 12MoO3లో 31.0g ల ‘P’ ఉంటే ‘b’g ల (NH4)3 PO4 12M0O3 లో ‘P’ ఎంత ఉంటుంది?
\(\frac{b}{1877}\) × 31.0 g
‘a’ g ల కర్బన పదార్థంలో
\(\frac{b}{1877}\) × 31.0 g ల ‘p’ ఉంటే 100g. కర్బన పదార్థంలలో ఎన్ని g ల ‘p’ ఉంటుంది.

2) సల్ఫర్ భార శాతం :
కర్బన్ సమ్మేళనంలోని సల్ఫర్ భారశాతం కనుక్కోవవడానికి తెలిసిన భారం గల కర్బన సమ్మేళనాన్ని సోడియం పెరాక్సైడ్ లేదా సధూమనైట్రికామ్లంతో కేరియస్ నాళికలో వేడిచేస్తారు. సల్ఫర్ గనుక సమ్మేళనంలో ఉంటే అది సల్ఫ్యూరిక్ ఆమ్లంగా ఆక్సీకరణం చెందుతుంది. ఈ ఆమ్లాన్ని అధికంగా బేరియం క్లోరైడ్ ద్రావణం కలిపి బేరియం సల్ఫేట్గా అవక్షేపిస్తారు. ఈ అవక్షేపాన్ని వడపోత ద్వారా వేరు చేసి కడిగి, పొడి (dry) బేసి (నిర్జలీకరణం) భారాన్ని కనుగొంటారు.
పరిశీలనలు, గణనలు :
కర్బన సమ్మేళనం భారం a g అనుకొందాం.
ఏర్పడిన బేరియం సల్ఫేట్ భారం bg అనుకొందాం.
బేరియం సల్ఫేట్ అణుద్రవ్యరాశి = 233
1మోల్ BaSO4 లో లేదా 233.0 g ల BaSO4 లో 32.0 g ల సల్ఫర్ ఉంటుంది.
‘b’ g ల BaSO4 లో ఎంత సల్ఫర్ ఉంటుంది ?

3) ఆక్సిజన్ భారశాతము :
తెలిసిన ద్రవ్యరాశి గల కర్బన సమ్మేళనాన్ని నైట్రోజన్ వాయువు సమక్షంలో వేడి చేసి వియోగం చెందిస్తారు. వెలువడిన ఉత్పన్న ఆక్సైడ్ వాయువుల మిశ్రమాన్ని ఎర్రటి వేడి బొగ్గుపైకి పంపి మొత్తం ఆక్సైడ్లలో ఉన్న ఆక్సిజన్ను CO గా మార్చుతారు. ఆ తర్వాత మిశ్రమ వాయువులను వేడి I2O5 పైకి పంపితే CO తిరిగి CO2 గా ఆక్సీకరణం చెందుతుంది. అయోడిన్ వెలువడుతుంది.

గణనలు :
కర్బన సమ్మేళనం భారం ‘a’ g అనుకొంటే, వచ్చిన CO2 ద్రవ్యరాశి ‘b’ g అనుకొంటే 44g ల CO2లో 32 g ల ఆక్సిజన్ ఉన్నది ‘b’ g ల CO2 లో ఎంత ఆక్సిజన్ ఉన్నది?

గమనిక :
ఆక్సిజన్ భారశాతాన్ని పరోక్ష పద్ధతిలో ఈ విధంగా కనుగొంటారు.
ఆక్సిజన్ భారశాతం= (100 – మిగిలిన మూలకాల మొత్తం భారాల శాతం)
![]()
ప్రశ్న 39.
కేరియస్ పద్ధతిలో జరిపే కర్బన సమ్మేళనంలోని హాలోజన్ను పరిమాణాత్మక విశ్లేషణ వివరించండి.
జవాబు:
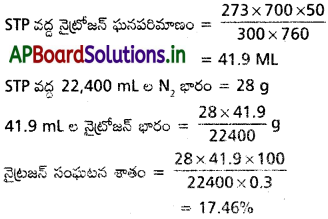
హాలోజన్ భారశాతం:
హాలోజన్ భారశాతాలను కేరియస్ (Carius) పద్ధతిలో తెలిసిన ద్రవ్యరాశి గల కర్బన రసాయన పదార్ధాన్ని సధూమ నైట్రికామ్లం (Fuming nitric acid) తో సిల్వర్ నైట్రేట్ సమక్షంలో ఒక ప్రత్యేకమయిన బలమయిన గాజు నాళికలో వేడి చేస్తారు. ఈ గాజునాళికలను కేరియస్ నాళిక అంటారు. సమ్మేళనంలోని కార్బన్, హైడ్రోజన్లు CO2, H2O లుగా ఆక్సీకరణం చెందుతాయి. హాలోజన్ సిల్వర్ హాలైడ్గా మారుతుంది. ఈ విధంగా వచ్చిన సిల్వర్ హాలైడ్ను (AgX) వడపోత ద్వారా వేరు చేసి కడిగి పొడిగా చేసి భారం కనుక్కొంటారు.
పరిశీలనలు, గణనలు :
కర్బన సమ్మేళనం ద్రవ్యరాశి ‘a’ g అనుకొందాం.
ఏర్పడిన AgX ద్రవ్యరాశీ

మూడు హాలోజన్లు (Cl, Br, I) కు గణనాలు
i) క్లోరిన్ :
పరమాణు ద్రవ్యరాశులు క్లోరిన్, సిల్వర్లకు వరుసగా 35.5, 108 సిల్వర్ క్లోరైడ్ ఆణుద్రవ్యరాశి = 35.5 + 108 = 143.5
ii) బ్రోమిన్ :
బ్రోమిన్ పరమాణు ద్రవ్యరాశి = 80 ; AgBr = అణు ద్రవ్యరాశి = 188
iii) అయోడిన్ :
అయోడిన్ పరమాణు ద్రవ్యరాశి 127 ; AgI అణురాశి = 235
ప్రశ్న 40.
కార్సినోజెనిసిటీ అంటే ఏమిటి? రెండు ఉదాహరణలతో వివరించండి.
జవాబు:
- బెంజీన్, ఇంకా అనేక బహు కేంద్రక వలయాల హైడ్రోకార్బన్లు విషపదార్థాలే కాక క్యాన్సర్ కారకాలు.
- వాటిలో ఎక్కువ పదార్థాలు పొగాకు, పెట్రోలియం, బొగ్గు వంటి కర్బన పదార్థాలు పూర్తిగా దహనం చెందకుంటే ఏర్పడతాయి.
- ఇవి మానవ శరీరాల్లో అనేక రసాయన చర్యలకు లోనై DNA ను నాశనం చేసి క్యాన్సర్ను కలుగజేస్తాయి.
సాధించిన సమస్యలు (Solved Problems)
ప్రశ్న 1.
కింద ఇచ్చిన పరమాణువులలో ఎన్ని σ, π బంధాలు ఉన్నాయి?
(a) HC ≡ CCH = CHCH3
(b) CH2 = C = CHCH3
సాధన:
(a) σC-C : 4; σC-H: 6; πC-C : 1, π C ≡ C : 2
(b) σC-C : 3; σC-H: 6; πC-C : 2.
ప్రశ్న 2.
ఈ కింది సమ్మేళనాలలోని ప్రతి కార్బన్ యొక్క సంకర కరణాన్ని గుర్తించండి.
(a) CH3Cl, (b) (CH3)2CO, (c) CH3, (d)HCONH2, (e) CH3CH = CHCN
సాధన:
(a) sp³,
(b) sp³, sp³,
(c) sp³, sp,
(d) sp²,
(e) sp³, sp², sp², sp
ప్రశ్న 3.
ఈ కింది సమ్మేళనాలలోని కార్బన్ల సంకరకరణస్థితి, నిర్మాణాకృతిని రాయండి.
(a)H2C = 0, (b) CH3F, (c) HC ≡ N.
సాధన:
(a) sp² సంకరకరణ కార్బన్, సమతల త్రిభుజాకారం
(b) sp³ సంకరకరణ కార్బన్, టెట్రాహెడ్రల్
(c) sp సంకరకరణ కార్బన్, రేఖీయ సౌష్ఠవం
ప్రశ్న 4.
కింద ఇచ్చిన సంక్షిప్త ఫార్ములాలను సంపూర్ణ సాంకేతిక నిర్మాణాలుగా రాయండి.
(a) CH3 CH2COCH2 CH3
(b) CH3CH = CH(CH2)3 CH3
సాధన:
ప్రశ్న 5.
ఈ కింది సమ్మేళనాలకు సంక్షిప్త, బంధగీత ఫార్ములాలను రాయండి.

సాధన:
సంక్షిప్త ఫార్ములా :
(a) HO(CH2)3CH(CH3)CH(CH3)2
(b) HOCH(CN)2
బంధ-గీత ఫార్ములాలు :
ప్రశ్న 6.
కింద ఇచ్చిన బంధగీత ఫార్ములాలను విశదీకరించి కార్బన్, హైడ్రోజన్తో సహా అన్ని పరమాణువులను చూపించండి.
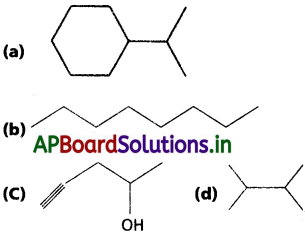
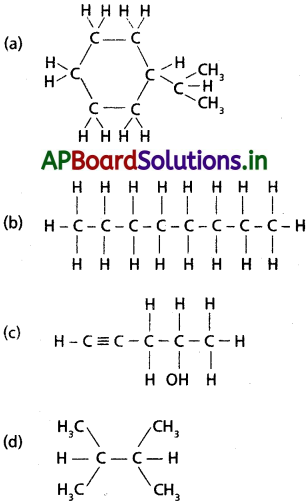
సాధన:
ప్రశ్న 7.
కొన్ని హైడ్రోకార్బన్ల నిర్మాణాలు, IUPAC నామాలను కింద ఇవ్వడమైంది. వీటికి బ్రాకెట్లలో రాసిన పేర్లు ఎందుకు సరైనవో కాదో తెలపండి.

సాధన:
(a) తక్కువ కార్బన్ సంఖ్యా సూచకం ప్రకారం 2, 5, 6 స్థానాలు 3, 4, 7 స్థానాల కంటే తక్కువలో ఉన్నాయి.
(b) ప్రతిక్షేపాలు సమస్థానాలలో ఉన్నాయి. ఆంగ్ల అక్షర క్రమంలో ముందు వచ్చే ప్రతిక్షేపానికి తక్కువ సంఖ్యను ఇవ్వడం జరుగుతుంది.
![]()
ప్రశ్న 8.
కింద ఇచ్చిన కర్బన సమ్మేళనాలు i-iv కు వాటి నిర్మాణాన్ని బట్టి IUPAC నామాలు రాయండి.

సాధన:
- ప్రమేయ సమూహం ఆల్కహాల్ (OH) కాబట్టి పదానుబంధం (suffix) ఓల్ అవుతుంది.
- – OH సమూహం ఉన్న అతిపెద్ద కర్బన శృంఖలంలో ఎనిమిది కార్బన్లు ఉన్నాయి కాబట్టి సంతృప్త హైడ్రో కార్బన్ – ఆక్టేన్.
- 3వ కార్బన్ మీద OH, 6వ కార్బన్ మీద మిథైల్ సమూహాలు జతపడి ఉన్నాయి.
కాబట్టి ఈ సమ్మేళనం సరైన పేరు 6- మిథైల్ ఆక్టేన్ – 3-ఓల్.
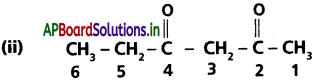
సాధన:
ప్రమేయ సమూహం కీటోన్ (>C=O) కాబట్టి పదానుబంధం ‘ఓన్’. రెండు కీటో సమూహాలు ఉన్నాయి కాబట్టి ‘డై’, పదానుబంధం ‘డైఓన్’ అవుతుంది. కీటో సమూహాలు అతిపెద్ద
అధ్యాయం 13 కర్బన రసాయన శాస్త్రం- సామాన్య సూత్రాలు, విధానాలు కార్బన్ శృంఖలంమీద 2, 4 స్థానాలలో ఉన్నాయి. శృంఖలంలో 6 కార్బన్లున్నాయి కాబట్టి సమ్మేళనం IUPAC నామం హెక్సేన్-2, 4-డైఓన్.

సాధన:
ఈ సమ్మేళనంలో కీటో, కార్బాక్సీ ఆమ్లం అనే రెండు ప్రమేయ సమూహాలు ఉన్నాయి. COOH ప్రాముఖ్య ప్రమేయం కాబట్టి ‘ఓయిక్ ఆమ్లం’ పదానుబంధంగా వాడాలి. సంఖ్యాసూచిక COOH కార్బన్ నుంచి మొదలవుతుంది. 5వ కార్బన్ వద్ద ఉన్న కీటో సమూహం ఆక్సో (oxo) గా రాయాలి. అతిపెద్ద శృంఖలంలో 6 కార్బన్లు ఉన్నాయి కాబట్టి సమ్మేళనం పేరు 5-ఆక్సో-హెక్సనోయిక్ ఆమ్లం.
![]()
సాధన:
ఈ సమ్మేళనంలో రెండు C=C ప్రమేయ సమూహాలు 1, 3 స్థానాలలో, C = C ప్రమేయం 5వ కార్బన్ వద్ద ఉన్నాయి. ఈ ప్రమేయాలను ‘డైఈన్’, ‘ఐన్’ పదానుబంధాలుగా సూచించాలి. కార్బన్ శృంఖలంలో 6 కార్బన్లు ఉన్నాయి కాబట్టి సమ్మేళనం పేరు `హెక్స-1,3-డైఈన్-5-ఐన్.
ప్రశ్న 9.
(i) 2 – క్లోరోహెక్సేన్,
(ii) పెంట్ -4-ఈన్-2-ఓల్,
(iii) 3-నైట్రోసైక్లోహెక్సీన్,
(iv) సైక్లోహెక్స్-2-ఈన్-1-ఓల్,
(v) 6-హైడ్రాక్సీ హెప్టనాల్ల నిర్మాణాలు రాయుము.
సాధన:
i) హెక్సేన్ శృంఖలంలో ఆరు కార్బన్లను సూచిస్తుంది. క్లోరిన్ ప్రమేయ సమూహం 2వ కార్బన్ వద్ద ఉంది. కనక ఈ సమ్మేళన నిర్మాణం
CH3CH2CH2CH2CH(CD)CH3.
(ii) “పెంట్’ అనే పదం శృంఖలంలోని 5 కార్బన్లను, ‘ఈన్’, ‘ఓల్’లు (=C, – OH ప్రమేయ సమూహాలను 4, 2 కార్బన్ల వద్ద ఉన్నాయని తెలుపుతాయి. సమ్మేళన నిర్మాణం
CH2 = CHCH2CH (OH)CH3.
(iii) సైక్లోహెక్సీన్ C = C బంధం ఉన్న ఆరు కార్బన్ల (I) వలయాన్ని సూచిస్తుంది. 3 నైట్రో అనే పూర్వపదం నైట్రో ప్రమేయం 3వ కార్బన్ మీద ఉన్నట్లు తెలుపుతుంది (II). పూర్తి నిర్మాణం
C = C పదానుబంధ ప్రమేయం, NO, పూర్వపద ప్రమేయం (prefix). కాబట్టి సంఖ్యా సూచికల్లో C = C కార్బన్లు నైట్రో ప్రమేయం ఉన్న కార్బన్ కంటే ముందు వస్తాయి.
(iv) 1-ఓల్ అంటే OH సమూహం 1వ కార్బన్ మీద ఉన్నట్లు, OH పదానుబంధ ప్రమేయం కాబట్టి C = C బంధం కంటే ప్రాముఖ్యం పొందుతుంది.
∴ సరైన నిర్మాణం (II).
(v) ‘హెప్టనాల్’ అనగా మాతృశృంఖలంలో ఏడు కార్బన్లు ఉన్న అల్డిహైడ్, 6-హైడ్రాకీ అంటే — OH సమూహం 6వ కార్బన్ మీద ఉంది. సమ్మేళనం నిర్మాణంలో – CHO ప్రమేయం మొదటిస్థానం పొందుతుంది. ఈ నిర్మాణం :
CH3CH(OH)CH2CH2CH2CH2CHO
ప్రశ్న 10.
కింది సమ్మేళనాల నిర్మాణ సంకేతాలను రాయండి.
(a) o-ఈథైల్ ఎనిసోల్, (b) p-నైట్రోఎనిలీన్ (c) 2,3 – డైబ్రోమో – 1 – ఫీనైల్ పెంటేన్ (d) 4 ఈథైల్ – 1 – ఫ్లోరో – 2 – నైట్రో బెంజీన్
సాధన:
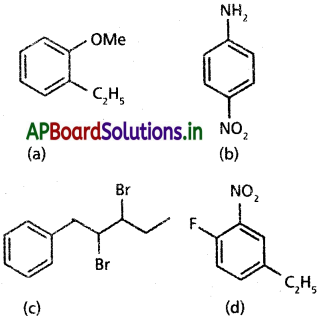
ప్రశ్న 11.
కింది సమయోజనీయ బంధాలు అసమ విచ్ఛిత్తి చెంది ఏర్పరిచే చర్యా మధ్యస్థానాలను వక్రబాణం (curved- arrow) తో చూపండి.
(a) CH3 – SCH3, (b) CH3 – CN, (c) CH3 – Cu
సాధన:
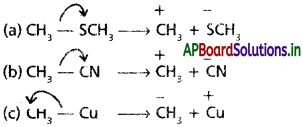
ప్రశ్న 12.
కింది అణువులు / అయాన్ల ను న్యూక్లియోఫైల్లు, ఎలక్ట్రోఫైల్లుగా విభజించి, సమర్థించండి.
HS–, BF3, C2H5O–, (CH3)3 N :,
![]()
సాధన:
న్యూక్లియోఫైల్లు :
HS–, C2H5O–, (CH3)3 N., H2N– : ఇవి ఎలక్ట్రాన్ల జతను ఎలక్ట్రోఫైల్కు దానం చేస్తాయి.
![]() ఇవి న్యూక్లియోఫైల్ నుంచి ఎలక్ట్రాన్లను గ్రహించి ఆక్టేట్ను పూర్తి చేసుకొంటాయి.
ఇవి న్యూక్లియోఫైల్ నుంచి ఎలక్ట్రాన్లను గ్రహించి ఆక్టేట్ను పూర్తి చేసుకొంటాయి.
ప్రశ్న 13.
కింది వాటిలో ఎలక్ట్రోఫిలిక్ స్థానాన్ని గుర్తించండి.
CH3CH = 0, CH3CN, CH3I.
సాధన:
CH3HC* = O, H3 CC* ≡ N, H3C*-I.
కార్బన్ పరమాణువులు ఎలక్ట్రోఫిల్లిక్ స్థానాలు ఎందుకంటే వాటికి పార్షిక ధనావేశం ఉంది.
![]()
ప్రశ్న 14.
కింది అణువుల జంటలలో ఏ బంధం ఎక్కువ ధ్రువణతను చూపిస్తుంది?
(a) H3C – H, H3C – Br
(b) H3C – NH2, H3C – ON
(c) H3C – OH, H3C – SH
సాధన:
(a) C – Br
(b) C – O Br, 0 ల రుణవిద్యుదాత్మకత క్రమంగా
(c) C – 0 H, N, S కంటే ఎక్కువ
ప్రశ్న 15.
CH3CH2CH2 Br నందు ఏ C – C బంధంలో ప్రేరేపక ప్రభావం తక్కువలో తక్కువ ఉండవచ్చు?
సాధన:
ప్రేరేపక ప్రభావం బంధాలు పెరిగేకొద్దీ తగ్గుతుంది. కాబట్టి ఈ ప్రభావం C3 కార్బన్, హైడ్రోజన్ బంధంలో తక్కువ.
ప్రశ్న 16.
CH3COO– రెజోనెన్స్ నిర్మాణాలు రాసి ఎలక్ట్రాన్ల కదలికలను బాణం గుర్తుల ద్వారా తెలపండి.
సాధన:

ప్రశ్న 17.
CH2 = CH – CHO రెజోనెన్స్ నిర్మాణం రాసి వాటి స్థిరత్వాన్ని క్రమపద్ధతిలో చూపించండి.
సాధన:
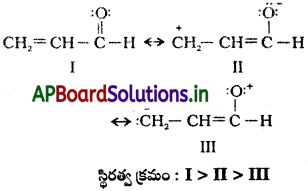
I : ఎక్కువ స్థిరత్వం – అత్యధిక సమయోజనీయ బంధాలు, ప్రతి పరమాణువుకు అష్టకప్రాప్తి, విద్యుదావేశాలు వేరుచేసి లేవు.
II : అధిక రుణవిద్యుదాత్మకత గల ఆక్సిజన్ మీద రుణావేశం, ధన విద్యుదాత్మకత కార్బన్ మీద ధనావేశం
III : ఆక్సిజన్ మీద +ve ఆవేశం కార్బన్ మీద ve ఆవేశం ఉండటం వల్ల స్థిరత్వం ఉండదు.
ప్రశ్న 18.
CH3COOCH3 కి I, II నిర్మాణాలు సంకర నిర్మాణానికి ఎక్కువగా ఎందుకు దోహదం చేయవు?
సాధన:
రెండు నిర్మాణాలూ అతి తక్కువ ప్రాముఖ్యమైనవి (విద్యుదా వేశాలు వేరుగా ఉండటం వల్ల) అంతేకాక I నిర్మాణంలో కార్బన్ అష్టకం పూర్తి కాలేదు.
ప్రశ్న 19.

సాధన:

ప్రశ్న 20.
0.246 గ్రాము కర్బన సమ్మేళనాన్ని దహనం చేసినప్పుడు 0.198 గ్రా. CO2 0.1014 గ్రా.ల నీటి ఆవిరి వెలు వడ్డాయి. కార్బన్, హైడ్రోజన్ల భారశాతాన్ని కనుక్కోండి.
సాధన:
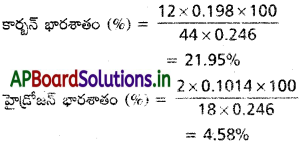
ప్రశ్న 21.
డ్యూమాన్ పద్ధతిలో 0.3 గ్రా.ల కర్బన సమ్మేళనం 300K, 715mm పీడనం దగ్గర 50ml ల నైట్రోజన్ను ఇస్తే సమ్మేళనంలో నైట్రోజన్ సంఘటన శాతాన్ని కనుక్కోండి. (జలబాష్ప పీడనం 300K వద్ద = 15 mm)
సాధన:
300K, 715mm పీడనం వద్ద
నైట్రోజన్ ఘనపరిమాణం = 50 mL
నైట్రోజన్ పీడనం = 715 – 15 =700 mm
ప్రశ్న 22.
జెల్దాల్ పద్ధతిలో ఒక కర్బన సమ్మేళనంలోని నైట్రోజన్ ను పరిమాణాత్మక విశ్లేషణ చేసేటప్పుడు 0.5 g కర్బన పదార్థం నుంచి వెలువడిన అమ్మోనియా వాయువును తటస్థీకరించ డానికి 1 M గాఢత కలిగిన H2SO4 ఆమ్లం 10 mL పడుతుంది. కర్బన సమ్మేళనంలోని నైట్రోజన్ భారశాతం కనుక్కోండి.
సాధన:
1 M గాఢత కలిగిన 10 mL H2SO 4 = 1M 20 mL NH3
1000 mL 1 M అమ్మోనియా 14 g ల నైట్రోజన్ ఉంటుంది.

ప్రశ్న 23.
కేరియస్ పద్ధతిలో హాలోజన్ల పరిమాణాత్మక విశ్లేషణ చేసేటప్పుడు 0.15 g కర్బన సమ్మేళనం 0.12 g లAgBr ను ఏర్పరిచింది. బ్రోమిన్ భార శాతాన్ని కనుక్కోండి.
సాధన:
AgBr అణు ద్రవ్యరాశి = 108 + 80 = 188 g mol-1
188 g ల AgBr లో 80 g ల బ్రోమిన్ ఉంది.

ప్రశ్న 24.
సల్ఫర్ పరిమాణాత్మక విశ్లేషణలో 0.157 g ల కర్బన సమ్మేళనం 0.4813 g ల బేరియం సల్ఫేట్ను ఏర్పరు స్తుంది. సమ్మేళనంలోని సల్ఫర్ భారశాతం ఎంత?
సాధన:
BaSO4 అణుభారం = 137 +32 + 64 = 233g
233 g ల బేరియం సల్ఫేట్ నందు 32 g సల్ఫర్ ఉంది.
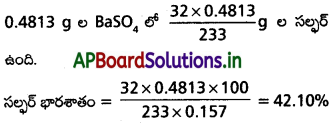
ప్రశ్న 25.
C6H14, అణు సంకేతం గల ఆల్కేన్ శృంఖల సాదృశ్యాల నిర్మాణాలను రాసి వాటి IUPAC నామాలను రాయండి.
సాధన:
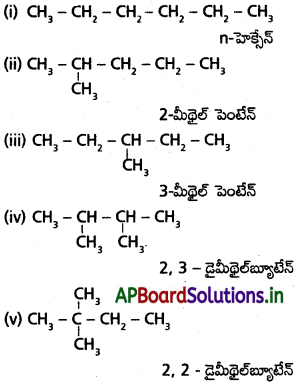
ప్రశ్న 26.
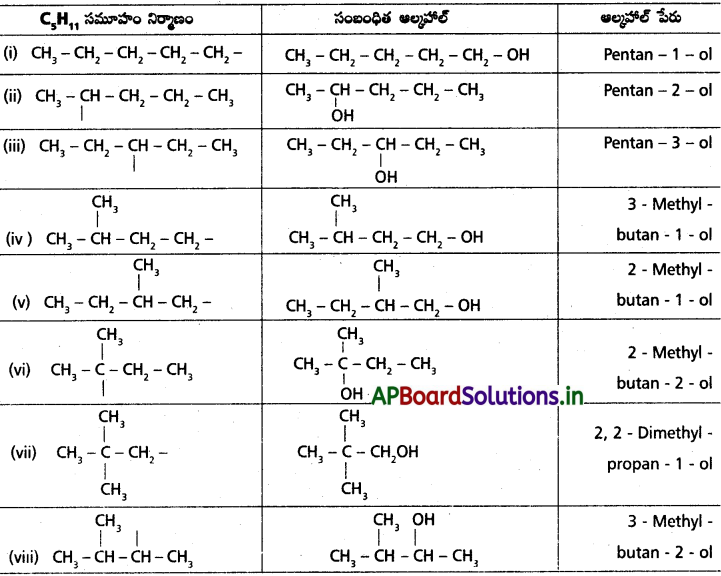
C5H11, అణు సంకేతం ఏర్పరచగల ఆల్కైల్ సమూహ సాదృశ్యాల నిర్మాణాలు రాయండి. వీటికి – OH సమూహాన్ని జతచేస్తే ఏర్పడే ఆల్కహాల్ IUPAC పేర్లను తెలపండి.
సాధన:
ప్రశ్న 27.
కింది సమ్మేళనాలకు IUPAC నామం రాయండి.
(i) (CH3)3 C CH2C(CH3)3
(ii) (CH3)2C(C2H5)2
(iii) టెట్రా-టెర్షియరీ బ్యూటైల్మీథేన్
సాధన:
(i) 2, 2, 4, 4-టెట్రా మీథైల్ పెంటేన్
(ii) 3, 3-డైమీథైల్ పెంటేన్
(iii)3,3-డైటెర్షియరీ బ్యూటైల్ -2, 2, 4, 4 – టెట్రామీథైల్ పెంటేన్
![]()
ప్రశ్న 28.
కింది సమ్మేళనాల నిర్మాణాత్మక సంకేతాలను రాయండి :
(i) 3, 4, 4, 5–టెట్రామీథైల్ హెప్టేన్
(ii) 2,5-డైమీథైల్ హెక్సేన్
సాధన:
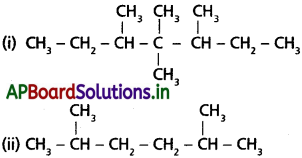
ప్రశ్న 29.
కింది సమ్మేళనాల నిర్మాణాలు రాయండి. ఇచ్చిన పేర్లు ఎందుకు సరైనవికావో తెలిపి వాటి సరైన IUPAC పేర్లు రాయండి.
(i) 2- ఈథైల్వెంటేన్
(ii) 5-ఈథైల్ – 3-మీథైల్ హెప్టేన్
సాధన:
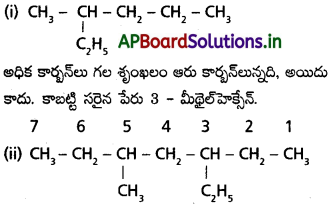
ఈథైల్ సమూహానికి తక్కువ సంఖ్య ఇచ్చే చివర నుంచి సంఖ్యాసూచికను రాయాలి. కాబట్టి సరైన పేరు :
3 – ఈథైల్ – 5-మీథైల్ హెప్టేన్
ప్రశ్న 30.
ప్రోపేన్ తయారుచేయడానికి ఏ కార్బాక్సిలిక్ ఆమ్ల లవణం కావాలి? ఈ చర్య సమీకరణాన్ని రాయండి.
సాధన:
ప్రశ్న 31.
కింది సమ్మేళనాల IUPAC నామాలు రాయండి.
సాధన:
(i) 2, 8 – డైమిథైల్ – 3, 6 – డెకాడైఈన్
(ii) 1, 3, 5, 7 ఆక్టాటెట్రాఈన్;
(iii) 2 – n – ప్రోపైల్వెంట్ – 1 – ఈన్;
(iv) 4 – ఈథైల్ – 2, 6 – డైమీథైల్ – డెక్ – 4 – ఈన్;
ప్రశ్న 32.
పైన ఇచ్చిన i-iv నిర్మాణాలలో ఎన్ని ఆ బంధాలు, ఎన్ని T బంధాలు ఉన్నాయో లెక్కించండి.
సాధన:
(i) σ బంధాలు : 33, π బంధాలు : 2
(ii) σ బంధాలు : 17, π బంధాలు : 4
(iii) σ బంధాలు : 23, π బంధాలు : 1
(iv) σ బంధాలు : 41, π బంధాలు : 1
ప్రశ్న 33.
C5H10 అణు సంకేతం గల ఆల్కీన్ల నిర్మాణాత్మక సాదృశ్యాల నిర్మాణాలు వాటి IUPAC పేర్లను రాయండి.
సాధన:
ప్రశ్న 34.
కింది సమ్మేళనాల సిస్, ట్రాన్స్ సాదృశ్యాలను గీసి వాటి IUPAC పేర్లను రాయండి :
(i) CHCl = CHCl
(ii) C2H5CCH3 = CCH3C2H5
సాధన:
ప్రశ్న 35.
కింది సమ్మేళనాలలో ఏవి సిస్, ట్రాన్స్ సాదృశ్యాలను చూపిస్తాయి?
(i) (CH3)2C = CH – C2H5
(ii) CH2 = CBr2
(iii) C6H5CH = CH – CH3
(iv) CH3CH = CCl CH3
సాధన:
(iii), (iv) చూపిస్తాయి. (i), (ii) లలో ఒకే రకమైన సమూహాలు ద్విబంధంలోని ఒకే కార్బన్కు జత చేయబడి ఉన్నాయి. కాబట్టి క్షేత్ర సాదృశ్యం చూపవు.
![]()
ప్రశ్న 36.
హెక్స్ -1- ఈన్ HBr లో ఏర్పరచే సంకలన ఉత్పన్నాల IUPAC పేర్లను రాయండి.
(i) పెరాక్సైడ్ సమక్షంలో (ii) పెరాక్సైడ్ లేకుండా
సాధన:
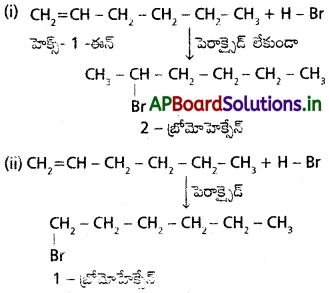
ప్రశ్న 37.
ఆల్మైన్ సమూహంలోని 5వ ఆల్కైనక్కు ఏర్పడగల సాదృశ్యాలను రాసి వాటి IUPAC పేర్లను రాయండి. వేర్వేరు జతల సాదృశ్యాలు ఎటువంటి సాదృశ్యాన్ని చూపిస్తాయో తెలపండి.
సాధన:
ఆల్కైన్లలో 5వ ఆల్మైన్ ఫార్ములా C6H10 సాదృశ్యాల నిర్మాణాలు :
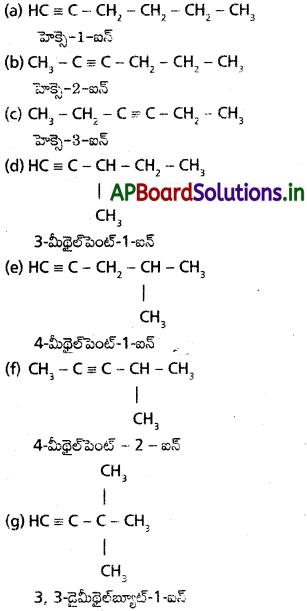
వేర్వేరు జతలు స్థాన, శృంఖల సాదృశ్యాలను చూపిస్తాయి.
![]()
ప్రశ్న 38.
ఈథనోయిక్ ఆమ్లంని బెంజీన్ గా ఎలా మారుస్తారు?
సాధన: