Andhra Pradesh BIEAP AP Inter 2nd Year Chemistry Study Material Lesson 3(a) విద్యుత్ రసాయనశాస్త్రం Textbook Questions and Answers.
AP Inter 2nd Year Chemistry Study Material Lesson 3(a) విద్యుత్ రసాయనశాస్త్రం
అతిస్వల్ప సమాధాన ప్రశ్నలు
ప్రశ్న 1.
గాల్వనిక్ ఘటం లేదా వోల్టాయిక్ ఘటం అంటే ఏమిటి? ఒక ఉదాహరణ తెలపండి.
జవాబు:
ఏ పరికరాలైతే అయత్నీకృతంగా జరిగే రిడాక్స్ చర్యలను ఉపయోగించి రసాయనశక్తిని విద్యుత్ శక్తిగా మార్పు చేస్తాయో వాటిని గాల్వనిక్ ఘటాలు లేదా వోల్టాయిక్ ఘటాలు అంటారు.
ఉదా : డానియల్ ఘటం
ప్రశ్న 2.
డేనియల్ ఘటంలో ఉపయోగించిన రసాయన సమీకరణాన్ని రాయండి. దీని అర్థఘట చర్యలను కూడా రాయండి.
జవాబు:
డేనియల్ ఘటంలో ఉపయోగించిన రసాయన సమీకరణాలు
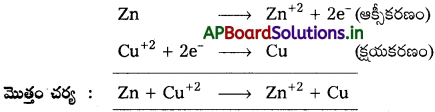
ప్రశ్న 3.
డేనియల్ ఘటంలో చోటుచేసుకొని ఉన్న రెండు అర్థఘట చర్యలను తెలపండి.
జవాబు:
డేనియల్ ఘటంలో చోటుచేసుకొని ఉన్న రెండు అర్థఘట చర్యలు
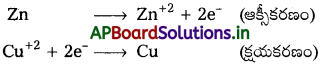
ప్రశ్న 4.
IUPAC సంప్రదాయంలో కాగితంపై గాల్వనిక్ ఘటాన్ని ఎలా వ్యక్తం చేస్తారు ? ఒక ఉదాహరణ ఇవ్వండి.
జవాబు:
గాల్వనిక్ ఘటాన్ని సూచించుట :
- ఆక్సీకరణ అర్థఘటాన్ని ఎడమవైపున వ్రాయలి
- క్షయకరణ అర్థఘటాన్ని కుడి వైపున వ్రాయలి
- ఈ రెండు అర్ధఘటాలను రెండు నిలువు సమాంతర గీతల(సాల్ట్ బ్రిడ్జ్)తో కలుపవలెను.
ఉదా : Cu(ఘ) | Cu2+(జల) || Ag+(జల)|Ag(ఘ)
ప్రశ్న 5.
కింది ఘటంలో జరిగే ఘట చర్యను రాయండి
Cu(ఘ) | Cu2+(జల) | | Ag+ (జల) | Ag(ఘ)
జవాబు:
ఇవ్వబడిన ఘటం Cu(ఘ) | Cu2+ (జల)|| Ag+(జల) / Ag(ఘ)
Cu → Cu+2 + 2e– (ఆక్సీకరణం)
2Ag+ + 2e– → 2Ag (క్షయకరణం)
![]()
ప్రశ్న 6.
ప్రమాణ హైడ్రోజన్ ఎలక్ట్రోడ్ అంటే ఏమిటి?
జవాబు:
ఏ ఎలక్ట్రోడ్ యొక్క పొటెన్షియల్ అయితే తెలిసి ఉంటుందో దానిని ప్రమాణ ఎలక్ట్రోడ్ లేదా ప్రమాణ హైడ్రోజన్ ఎలక్ట్రోడ్ అంటారు.
ఒక అర్థఘటం యొక్క పొటెన్షియల్ను హైడ్రోజన్ ఎలక్ట్రోడ్తో కలిపి కనుగొంటాము.
ప్రశ్న 7.
ప్రమాణ హైడ్రోజన్ ఎలక్ట్రోడ్ చక్కని పటాన్ని గీయండి.
జవాబు:
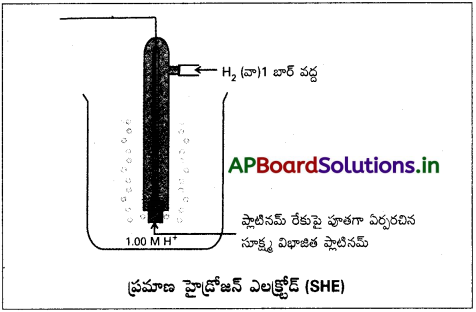
ప్రశ్న 8.
నెర్నెస్ట్ సమీకరణం అంటే ఏమిటి? ఎలక్ట్రోడ్ చర్య Mn+ (జల) + ne– M(ఘ) గల ఎలక్ట్రోడ్కు, ఎలక్ట్రోడ్ చర్య సమీకరణం రాయండి.
జవాబు:
ఎలక్ట్రోడ్ చర్యగల ఎలక్ట్రోడ్ పొటెన్షియల్ విలువను అయాన్ Mn+ ఏ గాఢత వద్దనైనా ప్రమాణ హైడ్రోజన్ ఎలక్ట్రోడ్ పరంగా కింది సమీకరణం ద్వారా వ్యక్తం చేయవచ్చు. దీనిని నెర్నెస్ట్ సమీకరణం అంటారు.

ప్రశ్న 9.
రుణ EΘ విలువ గల రిడాక్స్ జంట H+/H2 క్షయకరణ జంట కంటే ……………. దిగా సూచిస్తుంది.
(బలమైన లేదా బలహీనమైన)
జవాబు:
రుణ E° విలువ గల రిడాక్స్ జంట H+/H2 క్షయకరణ జంట కంటే బలమైనదిగా సూచిస్తుంది.
ప్రశ్న 10.
ధన EΘ విలువ గల రిడాక్స్ జంట H+/H2 జంట కంటే బలహీన ………………. జంటగా తెలుపుతుంది. (ఆక్సీకరణ లేదా క్షయకరణ)
జవాబు:
ధన E° విలువ గల రిడాక్స్ జంట H+/H2 జంటకంటే బలహీన క్షయకరణ జంటగా తెలుపుతుంది.
ప్రశ్న 11.
కింది ఘటం EMF కు నెర్నెస్ట్ సమీకరణం రాయండి.
Ni(ఘ) | Ni2+(జల) || Ag+(జల) | Ag
జవాబు:
ఇవ్వబడిన విద్యుత్ ఘటం
Ni(ఘ)| Ni2+(జల) || Ag+(జల) | Ag
పైన ఇవ్వబడిన ఘటానికి నెర్నెస్ట్ సమీకరణం
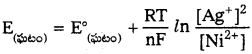
![]()
ప్రశ్న 12.
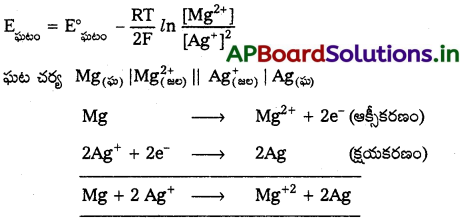
E(ఘటం) = EΘ(ఘటం) – \(\frac{\mathrm{RT}}{2 \mathrm{~F}} \ln \frac{\left[\mathrm{Mg}^{2+}\right]}{\left[\mathrm{Ag}^{+}\right]^2}\) ను సూచించే ఘటానికి ఘట చర్యా సమీకరణాన్ని రాయండి.
జవాబు:
ఇవ్వబడిన ఘటం
ప్రశ్న 13.
ఘట చర్య KC విలువకు, ఘటం E° కు మధ్యగల గణితాత్మక సంబంధాన్ని తెలపండి.
జవాబు:
ఘట చర్య KC విలువకు, ఘటం E° కు మధ్యగల గణితాత్మక సంబంధం
E°(ఘటం) = \(\frac{2.303 RT}{nF}\) log C
n = ఎలక్ట్రాన్ల సంఖ్య
F = ఫారడే = 96500 C mol-1
T = ఉష్ణోగ్రత
ప్రశ్న 14.
ఘటం emf (E) కు, గిబ్స శక్తి (G) కి మధ్యగల గణితాత్మక సంబంధాన్ని తెలపండి. SI ప్రమాణాలు ఇవ్వండి.
జవాబు:
ఘటం emf (E) కు, గిబ్స శక్తి (G) కి మధ్యగల గణితాత్మక సంబంధం
∆G° = – nFE(ఘటం)
∆G° = గిబశక్తి మార్పు
n = ఎలక్ట్రాన్ల సంఖ్య
F = ఫారడే
ప్రశ్న 15.
పధార్థం ‘విద్యుత్ వాహకత్వం’ నిర్వచించండి. SI యూనిట్లు తెలపండి.
జవాబు:
విశిష్టనిరోధకత(లేదా) నిరోధకత యొక్క విలోమాన్ని విద్యుద్వాహకత్వం అంటారు. దీనిని (K) తో సూచిస్తారు.
(లేదా)
ఒక యూనిట్ ఘన వాహకం యొక్క వాహకత్వాన్ని విద్యుద్వాహకత్వం అంటారు.
SI యూనిట్లు : ohm-1m-1 (or) Sm-1 S = సీమన్
ప్రశ్న 16.
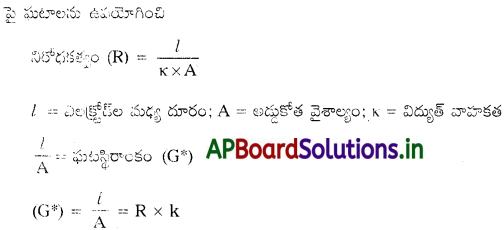
వాహకత్వఘటం ఘట స్థిరాంకం అంటే ఏమిటి?
జవాబు:
ఘట స్థిరాంకం :

నిరోధకత్వం మరియు విశిష్ట వాహకత్వం యొక్క లబ్దాన్ని ఆవాహకత్వ ఘటం యొక్క ఘటస్థిరాంకం అంటారు.
ప్రశ్న 17.
మోలార్ వాహకత్వం (∧m) నిర్వచించండి. దీనికి వాహకత్వం (k) తో ఎలా సంబంధం ఉంది?
జవాబు:
మోలార్ వాహకత్వం :
ఒక మీటరు లేదా ఒక సెం.మీ. ప్రమాణ దూరం ద్వారా వేరు చేయబడిన రెండు సమాంతర ఎలక్ట్రోడ్ల మధ్య ఆవృతమై ఉండే ఒక మోలార్ భారం కలిగి ఉండే విద్యుత్ విశ్లేష్యక ద్రావణం వాహకతను మోలార్ వాహకత్వం (∧m) అంటారు.
మోలార్ వాహకత్వం (∧m) మరియు వాహకత్వం (K)నకు సంబంధం :
∧m = \(\frac{k}{C}\) ; ∴ c = గాఢత
ప్రశ్న 18.
ద్రావణం మోలారిటి (c) తో మోలార్ వాహకత్వం (∧m) మారే తీరును సూచించే గణిత సమీకరణాన్ని రాయండి.
జవాబు:
ద్రావణం మోలారిటి (c) తో మోలార్ వాహకత్వం (∧m) మారే తీరును సూచించే గణిత సమీకరణం
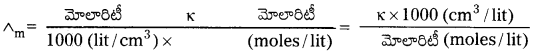
ప్రశ్న 19.
కోల్రాష్ అయాన్ల స్వతంత్రీయ అభిగమన నియమం తెలపండి.
జవాబు:
కోల్రాష్ అయాన్ల స్వతంత్రీయ అభిగమన నియమం :
ఒక విద్యుత్ విశ్లేష్యకం అవధిక మోలార్ విద్యుత్వాహకత్వం, విశ్లేష్యకం సమకూర్చిన కాటయాన్ల, ఆనయాన్ల వ్యక్తిగత వాహకత్వాల మొత్తానికి సమానం.
∧°m(AB) = ∧°A+ + ∧°B–
∧°m(AB) = అవధిక మోలార్ విద్యుత్ వాహకత్వం
∧°A+ = కాటయాన్ అవధిక మోలార్ విద్యుత్ వాహకత్వం
∧°B– = ఆనయాన్ అవధిక మోలార్ విద్యుత్ వాహకత్వం
ప్రశ్న 20.
ఫారడే విద్యుద్విశ్లేష్యణ ప్రక్రియ మొదటి నియమం తెలపండి. [AP. Mar.’16; TS. Mar.’15]
జవాబు:
ఫారడే విద్యుద్విశ్లేష్యణ ప్రక్రియ మొదటి నియమం :
విద్యుద్విశ్లేషణ ప్రక్రియలో ఎలక్ట్రోడ్ వద్ద జరిగే రసాయన చర్య పరిమాణం విద్యుద్విశ్లేష్యక పదార్ధంలో ప్రసారమయ్యే విద్యుత్ పరిమాణానికి అనులోమానుపాతంలో ఉంటుంది.
m ∝ Q; m = c × t
m = ect; m = \(\frac{Ect}{96,500}\)
e = విద్యుత్ రసాయన తుల్యాంకం t = సమయం (సెకన్లలో)
c = విద్యుత్ (ఆంపియర్లలో) E = రసాయన తుల్యాంకం
ప్రశ్న 21.
ఫారడే విద్యుద్విశ్లేషణ ప్రక్రియ రెండవ నియమం తెలపండి.
జవాబు:
ఫారడే విద్యుద్విశ్లేషణ ప్రక్రియ రెండవ నియమం :
విద్యుద్విశ్లేషణంలో భిన్న విద్యుద్విశ్లేష్యక ద్రావణాల ద్వారా సమాన పరిమాణంలో విద్యుత్ ప్రవహిస్తే ఎలక్ట్రోడ్ వద్ద వెలువడే భిన్న పదార్థాల పరిమాణాలు, వాటి రసాయనిక తుల్య భారాలకు అనులోమానుపాతంలో ఉంటాయి.
m ∝ E
ప్రశ్న 22.
గలన లేదా కరిగించిన NaCl ద్రవాన్ని విద్యుత్ విశ్లేషణ ప్రక్రియకు గురి చేసినప్పుడు ప్లాటినమ్ ఆనోడ్, ప్లాటినమ్ కాథోడ్ ల వద్ద ఏర్పడే పదార్థాలను తెలపండి.
జవాబు:
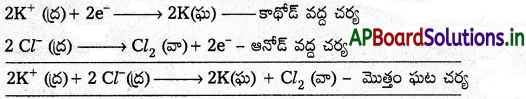
గలన లేదా కరిగించిన NaCl ద్రవాన్ని విద్యుద్విశ్లేషణ ప్రక్రియకు గురిచేస్తే ప్లాటినమ్ ఆనోడ్ వద్ద క్లోరిన్ వాయువు, ప్లాటినం కాథోడ్ వద్ద సోడియంలోహం ఏర్పడును.
2 NaCl → 2 Na+ + 2Cl–
2 Cl– → Cl2 + 2e– (ఆనోడ్)
2 Na+ + 2e– → 2 Na (కాథోడ్)
ప్రశ్న 23.
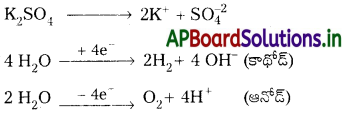
జల K2SO4 ద్రావణాన్ని విద్యుత్ విశ్లేషణ ప్రక్రియకు గురిచేస్తే ప్లాటినమ్ ఎలక్ట్రోడ్ వద్ద (కాథోడ్, ఆనోడ్) ఏర్పడే పదార్థాలను తెలపండి.
జవాబు:
జలK2SO4 ద్రావణాన్ని విద్యుద్విశ్లేషణం చేస్తే ప్లాటినం కాథోడ్ వద్ద హైడ్రోజన్ వాయువు, ప్లాటినం ఆనోడ్ వద్ద హైడ్రోజన్ వాయువు ఏర్పడును.

ప్రశ్న 24.
ప్లాటినమ్ ఆనోడ్ వద్ద H2O(ద్ర) ఆక్సీకరణం చెందే ప్రక్రియకు రసాయన సమీకరణం రాయండి.
జవాబు:
ప్లాటినమ్ ఆనోడ్ వద్ద H2O(ద్ర) ఆక్సీకరణం చెందే ప్రక్రియకు రసాయన సమీకరణం
2H2O(ద్ర) → O2(వా) + 4H+(జల) + 4e–
![]()
ప్రశ్న 25.
ప్లాటినమ్ ఎలక్ట్రోడ్ వద్ద ద్రవరూపంలో ఉండే నీరు H2O(ద్ర) క్షయీకరణానికి సంబంధించిన రసాయన సమీకరణం రాయండి.
జవాబు:
ప్లాటినమ్ ఎలక్ట్రోడ్ కాథోడ్ వద్ద ద్రవరూపంలో ఉండే నీరు H2O క్షయీకరణానికి సంబంధించిన రసాయన సమీకరణం
H2O(ద్ర) + \(\frac{1}{2}\)e– H2(వా) + OH–
ప్రశ్న 26.
ప్రైమరీ బ్యాటరీ అంటే ఏమిటి? ఒక ఉదాహరణ ఇవ్వండి. [AP. Mar:’17]
జవాబు:
ప్రైమరీ బ్యాటరీ :
ఏ బ్యాటరీలైతే కొంత కాలం వాడిన తరువాత ఘటక చర్యలు పూర్తయిపోయి పని చేయడం ఆగిపోతాయో వాటిని ప్రైమరీ బ్యాటరీలు అంటారు.
ఉదా : లెక్లాంచి ఘటం, అనార్ద్ర ఘటం.
ప్రశ్న 27.
సెకండరీ బ్యాటరీకి ఒక ఉదాహరణ ఇవ్వండి. దీని ఘటచర్యను రాయండి.
జవాబు:
సెకండరీ బ్యాటరీకి ముఖ్యమైన ఉదాహరణ లెడ్ నిక్షేప బ్యాటరీ. బ్యాటరీ వాడకంలో ఉన్నప్పుడు కింది ఘటచర్యలు చోటు చేసుకుంటాయి.
ఆనోడ్ : Pb(ఘ) + SO-24(జల) → PbSO4(ఘ) + 2e–
కాథోడ్ : PbO2(ఘ) + SO-24(జల) + 4H+(జల) + 2e– + PbSO4(ఘ) + 2 H2O(ద్ర)
కాథోడ్, ఆనోడ్ వద్ద ‘జరిగే మొత్తం చర్య
Pb(ఘ) + PbO2(ఘ) + 2H2SO4(జల) → 2PbSO4(ఘ) + 2H2O(ద్ర)
ప్రశ్న 28.
నికెల్-కాడ్మియమ్ సెకండరీ బ్యాటరీ ఘటచర్యను తెలపండి.
జవాబు:
నికెల్-కాడ్మియమ్ సెకండరీ బ్యాటరీ ఘటచర్య
Cd(ఘ) + 2Ni(OH)3(ఘ) → CdO(ఘ) + 2Ni(OH)2(ఘ) + H2O(ద్ర)
ప్రశ్న 29.
ఇంధన ఘటం అంటే ఏమిటి? సంప్రదాయ గాల్వనిక్ ఘటానికి, దీనికి గల భేదం ఏమిటి?
జవాబు:
విద్యుత్ రసాయన ప్రక్రియ ఆధారంగా ఇంధనం ఆక్సీకరణ వ్యవస్థలోని రసాయన శక్తిని ప్రత్యక్షంగా విద్యుత్ శక్తిగా మార్చే గాల్వనిక్ ఘటమే ఇంధన ఘటం అంటారు.
- సంప్రదాయ గాల్వనిక్ ఘటాలు రిడాక్స్ చర్యలను ఉపయోగించి రసాయన శక్తిని విద్యుత్ శక్తిగా మారుస్తాయి.
- ఇంధన ఘటాలు హైడ్రోజన్, మిథేన్ మొదలగునవి ఇంధనాల దహనం ద్వారా వచ్చిన శక్తిని విద్యుత్ శక్తిగా మారుస్తాయి. ఇవి తక్కువ కాలుష్యాన్ని కలిగిస్తాయి.
ప్రశ్న 30.
H2, O2, ఇంధన ఘటంలో కాథోడ్, ఆనోడ్ వద్ద జరిగే చర్యలను రాయండి.
జవాబు:
కాథోడ్ : O2(వా) + 2H2O(ద్ర) + 4e– → 40H–(జల)
ఆనోడ్ : 2H2(వా) + 40H–(జల) → 4H2O(ద్ర) + 4e–
మొత్తం చర్య : 2H2(వా) + O2(వా) → 2H2O(ద్ర)
ప్రశ్న 31.
లోహక్షయం అంటే ఏమిటి? ఒక ఉదాహరణ ఇవ్వండి. [TS. Mar.’17; AP. Mar.’15]
జవాబు:
లోహక్షయం :
ఒక లోహం, అది ప్రకృతిలో సహజంగా లభించే సమ్మేళన రూపంలో స్వచ్ఛందంగా మారిపోవడానికి ప్రదర్శించే సంసిద్ధతను లోహక్షయం అంటారు.
ఉదా : ఐరన్, తన ఆక్సైడ్ (Fe2O3-హెమటైట్) రూపంలోకి, కాపర్, తన కార్బనేట్ (మోలకైట్) రూపంలోకి మరియు సిల్వర్, తన సల్ఫైట్ (AgS సిల్వర్ గ్లాన్స్) రూపంలోకి మారిపోవడానికి ప్రయత్నిస్తాయి.
ఎనోడ్ వద్ద లోహం విద్రవణం చెందడాన్ని విద్యుత్ రసాయన లోహక్షయం అంటారు.
![]()
ప్రశ్న 32.
ఐరన్ లోహక్షయం లేదా తుప్పు పట్టడం తెలిపే విద్యుత్- రసాయన చర్యను పేర్కొనండి.
జవాబు:
ఐరన్ తుప్పు పట్టడం తెలిపే విద్యుత్-రసాయనచర్యలు
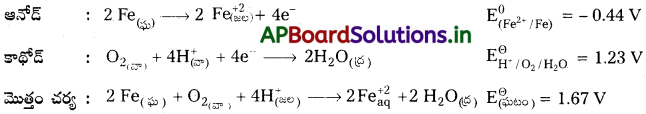
స్వల్ప సమాధాన ప్రశ్నలు
ప్రశ్న 1.
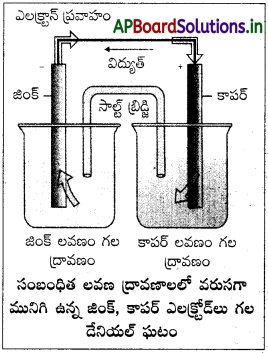
గాల్వనిక్ ఘటాలు అంటే ఏమిటి? డేనియల్ ఘటాన్ని ఉదాహరణగా తీసుకొని గాల్వనిక్ ఘటం ఎలా పనిచేస్తుంది అనే దానిని రేఖాచిత్రం సహాయంతో వివరించండి.
జవాబు:
ఏ పరికరాలైతే అయత్నీకృతంగా జరిగే రిడాక్స్ చర్యలను ఉపయోగించి రసాయనశక్తిని విద్యుత్ శక్తిగా మార్పు చేస్తాయో వాటిని గాల్వనిక్ ఘటాలు లేదా వోల్టాయిక్ ఘటాలు అంటారు.
ఉదా : డానియల్ ఘటం
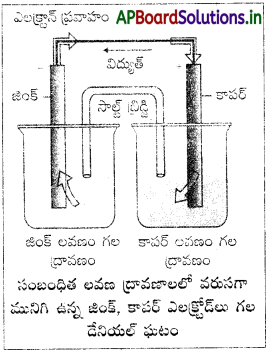
డానియల్ ఘటం :
ఇది ప్రత్యేకమైన గాల్వానిక్ ఘటం, దానిలో ఒకే పాత్రలో రెండు అర్థఘటాలు ఉంటాయి. ఈ పాత్ర రెండు భిన్న భాగాలుగా విభజింపబడుతుంది. ఎడమవైపు భాగం ZnSO4 జల ద్రావణంలో నింపబడి Zn కడ్డీని కలిగి ఉంటుంది. కుడివైపుభాగంలో CuSO4 జల ద్రావణంతో నింపబడి Cu కడ్డీని కలిగి ఉంటుంది. ఈ రెండింటినీ ఒక సాల్ట్ బ్రిడ్జ్ అనుసంధానం చేస్తారు. ఈ అర్థ ఘటాలు బాహ్య బ్యాటరీకి కలుపుతారు.
Zn/ZnSO4 అర్థ ఘటంలో ఆక్సీకరణ చర్య జరుగును.

ప్రశ్న 2.
చక్కని పటం సహాయంతో ప్రమాణ హైడ్రోజన్ ఎలక్ట్రోడ్ నిర్మాణాన్ని. అది పనిచేసే విధానాన్ని పేర్కొనండి.
జవాబు:
ఏ ఎలక్ట్రోడ్ యొక్క పొటెన్షియల్ అయితే తెలిసి ఉంటుందో దానిని ప్రమాణ ఎలక్ట్రోడ్ లేదా ప్రమాణ హైడ్రోజన్ ఎలక్ట్రోడ్ అంటారు.
ఒక అర్థఘటం యొక్క పొటెన్షియల్ను హైడ్రోజన్ ఎలక్ట్రోడ్తో కలిపి కనుగొంటాము.
Pt(ఘ)/H2(వా)/ H+(జల) గా వక్తం చేయబడిన ప్రమాణ హైడ్రోజన్ ఎలక్ట్రోడ్ అనే అర్ధ H+ ఘటం పొటెన్షియల్ విలువను అన్ని ఉష్ణోగ్రతల వద్ద సాంప్రదాయకంగా సున్నా వోల్టులుగా తీసుకొంటారు. ఈ పొటెన్షియల్ విలువ కింది అర్థఘట చర్య ద్వారా ఏర్పడుతుంది.
![]()
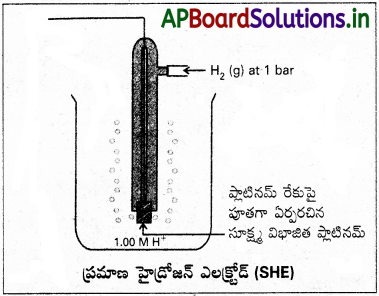
దీనినే ప్రమాణ ఎలక్ట్రోడ్ లేదా నిర్దేశిత ఎలక్ట్రోడ్ అంటారు. దీనిలో ప్లాటినమ్’ నలుపు పూత పూసిన ప్లాటినమ్ ఎలక్ట్రోడ్ ఉంటుంది. దీనిని ఆమ్లద్రావణంలో ముంచి ఉంచుతారు. వాతావరణ పీడనం వద్ద (1 bar) వద్ద (H2) వాయువును దీనిపై పంపుతారు. ప్రమాణ హైడ్రోజన్ ఎలక్ట్రోడ్ను ఆనోడ్గాను రెండవ అర్ధ ఘటాన్ని కాథోడ్గాను తీసుకొని నిర్మాణం చేసిన ఘటం (emf 298K) వద్ద రెండవ అర్థఘట పొటెన్షియల్ తెలుపుతుంది.
![]()
ప్రశ్న 3.
లోహ ఎలక్ట్రోడ్, అలోహ ఎలక్ట్రోడ్ల సహాయంతో నెర్నెస్ట్ సమీకరణాన్ని తెలిపి వివరించండి.
జవాబు:
ఎలక్ట్రోడ్ చర్యగల ఎలక్ట్రోడ్ పొటెన్షియల్ విలువను అయాన్ Mn+ ఏ గాఢత వద్దనైనా ప్రమాణ హైడ్రోజన్ ఎలక్ట్రోడ్ పరంగా కింది సమీకరణం ద్వారా వ్యక్తం చేయవచ్చు. దీనిని నెర్నెస్ట్ సమీకరణం అంటారు.

పై చర్యకు నెర్నెస్ట్ సమీకరణం

ప్రశ్న 4.
విద్యుత్ రసాయన ఘటం పనిచేసే తీరుకు, గిబ్స్ రసాయన శక్తికి గల సంబంధాన్ని అనువైన ఒక ఉదాహరణతో వివరించండి.
జవాబు:
విద్యుత్ రసాయన ఘటం, రసాయన చర్య గిబ్స్ శక్తి :
విద్యుత్ రసాయన ఘటంలో ఒక సెకన్లో జరిగే విద్యుత్ పని ప్రవహిస్తున్న మొత్తం ఆవేశం పరిమాణాన్ని ఎలక్ట్రికల్ పొటెన్షియల్తో గుణిస్తే వచ్చే లబ్దం విలువకు సమానంగా ఉంటుంది. గాల్వనిక్ ఘటం నుంచి మనకు విద్యుత్ పని గరిష్ఠ సాయిలో లభించాలి అంటే, విద్యుత్ ఆవేశాన్ని ఉత్రమణీయంగా ప్రవహింపజేయాలి. గాల్వనిక్ ఘటం ఉత్రమణీయ పద్ధతిలో జరిపిన విద్యుత్ పని, గిబ్స్ శక్తి తగ్గుదలకు సమానంగా ఉంటుంది. కాబట్టి ఘటం emf విలువ E ప్రవహించే విద్యుదావేశ పరిమాణం nF, వద్ద గిబ్స్ శక్తి ∆r G అయినట్లైతే
∆r G = – nFE(ఘటం)
E(ఘటం) అనేది గహన పరామితి, ∆r G అనేది విస్తీర్ణ ఉష్ణగతిక శాస్త్రీయ ధర్మం. ఇది n మీద ఆధారపడి ఉంటుంది. కాబట్టి చర్యను కింది విధంగా రాస్తే
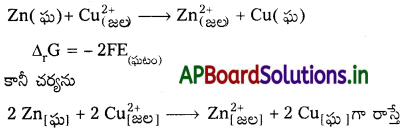
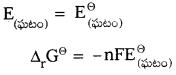
కాబట్టి EΘ(ఘటం) ను కొలిచి ముఖ్యమైన ఉష్ణగతిక శాస్త్రీయ ధర్మం ∆r GΘ (చర్మ ప్రమాణ గిబ్స్ శక్తి)ని లెక్కించవచ్చు. ∆r GΘ నుంచి సమతాస్థితి స్థిరాంకం Kc ని కింది సమీకరణం ద్వారా లెక్కించవచ్చు.
∆r GΘ = – RT ln Kc
ప్రశ్న 5.
విద్యుత్ విశ్లేష్యక జలద్రావణం విద్యుత్ వాహకత్వం ఏ కారణాంశాల మీద ఆధారపడుతుంది?
జవాబు:
విద్యుద్విశ్లేష్యక ద్రావణాల విద్యుత్ వాహకత కింది అంశాలపై ఆధారపడియుండును.
- విద్యుద్విశ్లేష్యకం స్వభావం
- విద్యుద్విశ్లేష్యకం వియోగంలో ఏర్పడిన అయాన్ల పరిమాణం, అయాన్ల ఆర్ద్రీకరణం
- ద్రావణి స్వభావము, స్నిగ్ధత
- విద్యుద్విశ్లేష్యక ద్రావణం గాఢత
- ఉష్ణోగ్రత
ప్రశ్న 6.
విద్యుద్విశ్లేష్యక జలద్రావణం విద్యుత్ వాహకత్వం ప్రయోగం ద్వారా ఎలా నిర్ణయిస్తారు?
జవాబు:
విద్యుత్ వాహకత్వం ప్రయోగం ద్వారా నిర్ణయించుట :
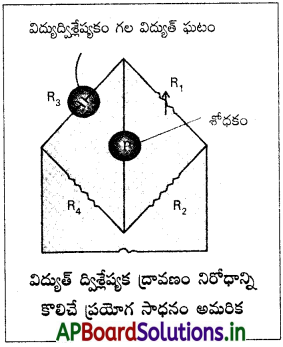
→ వీట్ స్ట్రోన్ బ్రిడ్జ్ సహాయంతో ఒక లోహపు తీగ నిరోధాన్ని కొలవవచ్చు. విద్యుద్విశ్లేష్యక ద్రావణాల నిరోధాన్ని ఈ విధానంలో కొలిచేటప్పుడు రెండు ఇబ్బందులు ఎదురౌతాయి.
(i) ప్రయోగ ద్రావణం ద్వారా ఏకముఖ ప్రవాహ కరెంటు DCను పంపినప్పుడు ద్రావణంలో జరిగే విద్యుద్విశ్లేషక ప్రక్రియ కారణంగా ద్రావణం సంఘటనం మారిపోవడం తటస్థిస్తుంది.
(ii) ఒక లోహ తీగను లేదా ఘనస్థితి వాహకాన్ని బ్రిడ్జ్ని సులభంగా సంధానం చేసినట్లు అయానిక ద్రావణాన్ని బ్రిడ్జికి సంధానం చేయలేము.
→ ఏకముఖి ప్రవాహ విద్యుత్ జనకానికి బదులుగా ఏకాంతర విద్యుత్ ప్రవాహ జనకం AC వాడటం వలన మొదటి ఇబ్బందిని అధిగమించవచ్చు ప్రత్యేకంగా తయారు చేసిన వాహకత్వఘటం అనే పాత్రను ఉపయోగించటం ద్వారా రెండవ ఇబ్బందిని అధిగమించవచ్చు.
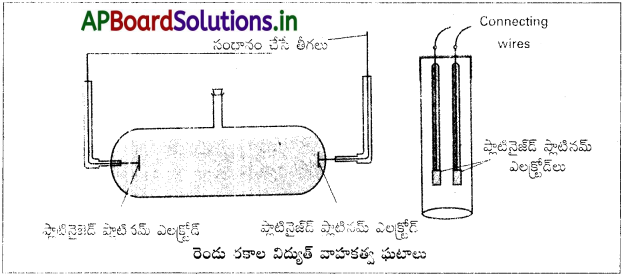
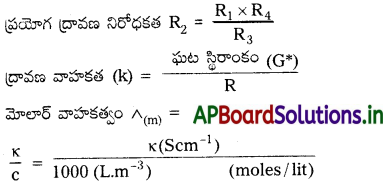
→ వాహకత్వం విలువ తెలిసిన ద్రావణంతో ఘటాన్ని నింపి దాని నిరోధాన్ని కొలిచి ఘటస్థిరాంకాన్ని నిర్ణయిస్తారు.
→ ఘటస్థిరాంకం నిర్ణయించిన తరువాత దానిని ద్రావణం వాహకత్వాన్ని లేదా నిరోధాన్ని కొలవడానికి ఉపయోగిస్తారు.
→ నిరోధాన్ని కొలిచే ప్రయోగసాధన అమరిక ఈ క్రింది ఇవ్వబడినది.
ప్రశ్న 7.
విద్యుద్విశ్లేష్యక ద్రావణం గాఢతతో మోలార్ విద్యుత్ వాహకత్వం ఎలా మారుతుందో వివరించండి. కారణాలు తెలపండి.
జవాబు:
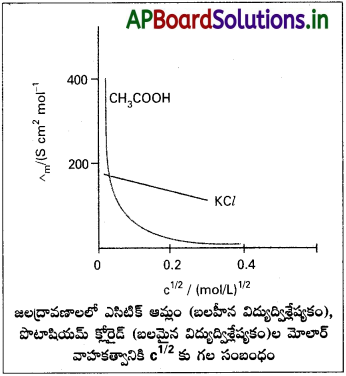
గాఢతతో వాహకత్వం, మోలార్ వాహకత్వం మారే తీరు :
విద్యుద్విశ్లేష్యక ద్రావణం వాహకత్వం, మోలార్ వాహకత్వం, ద్రావణం గాఢతతో మార్పు చెందుతాయి. బలహీన, బలమైన విద్యుద్విశ్లేష్యకాలు రెండింటికి కూడా ద్రావణం గాఢత తగ్గుదలతో వాహకత్వం కూడా తగ్గుతుంది. ద్రావణాన్ని విలీనం చేసినప్పుడు, దాని ఏకాంక ఘనపరిమాణంలోని విద్యుత్ను రవాణా చేసే అయాన్లల సంఖ్య తగ్గడం కారణంగా దీనిని విశదీకరిస్తారు. . ఏకాకం పొడవు (unit length) మధ్య దూరంగా కలిగి అడ్డుకోత వైశాల్యం ఏకాంక పరిమాణంలో గల రెండు ప్లాటినమ్ ఎలక్ట్రోడ్ల మధ్య చోటు చేసుకొన్న ఏకాంక ఘనపరిమాణంగల ద్రావణం ప్రదర్శించిన వాహకతను, నిర్దేశిత గాఢత వద్ద ఆ ద్రావణం వాహకత్వం అంటారు. ఇది కింది సమీకరణం ద్వారా తెలుస్తుంది.
G = \(\frac{kA}{l}\) = k(A, l లు రెండూ వాటి సరైన యూనిట్లు m లేదా cm లలో ఏకాంక విలువలను కలిగి ఉన్నప్పుడు) ఎలక్ట్రోడ్ మధ్య దూరం ఏకాంక పొడవులో ఉండి, అడ్డుకోత వైశాల్యం A గా గల రెండు ఎలక్ట్రోడ్ల మధ్య చోటుచేసుకొని ఒక మోల్ విద్యుత్ విశ్లేష్యకం గల V ఘనపరిమాణం గల ద్రావణం ప్రదర్శించే వాహకత, నిర్దేశిత గాఢత వద్ద మోలార్ వాహకత్వం అవుతుంది.

ద్రావణం గాఢత తగ్గిన కొద్దీ లేదా ద్రావణం విలీనత పెరిగినకొద్దీ ద్రావణం మోలార్ వాహకత్వం పెరుగుతుంది. దీనికి కారణం 1 మోల్ విద్యుత్ విశ్లేష్యకం గల ద్రావణం ఘనపరిమాణం V కూడా పెరుగుతుంది. ద్రావణం విలీనతతో k లో తటస్థించే తగ్గుదలను ఘనపరిమాణంలో వచ్చే అధిక పెరుగుదల ప్రతికరణం చేస్తుంది. భౌతికంగా దీనిని కింది విధంగా తెలపవచ్చు. ఒక మోల్ విద్యుద్విశ్లేష్యకాన్ని తనలో కరిగించుకో గలిగినతం ఘనపరిమాణంలో గల ద్రావణానికి తగినంత చోటు కల్పించగలిగే పరిమాణంలో అడ్డుకోత వైశాల్యం కలిగి, ఏకాంక పొడవు దూరంలో అమర్చిన రెండు ఎలక్ట్రోడ్లు గల వాహకత్వ ఘటంలో చోటుచేసుకొని ఉన్న విద్యుద్విశ్లేష్యక ద్రావణం ప్రదర్శించే వాహకతను ∧m నిర్దేశిత గాఢత వద్ద ∧m గా నిర్వచించవచ్చు. ద్రావణం గాఢత “సున్నా” విలువను చేరుకున్నప్పుడు ద్రావణం ప్రదర్శించే మోలార్ వాహకతాన్ని సీమాంత లేదా అవధిక మోలార్ వాహకత్వం అంటారు. దీనిని ∧°m తో సూచిస్తారు. బలమైన బలహీన విద్యుద్విశ్లేష్యత ద్రావణాలకు గాఢతతో ∧m మార్పు భిన్నంగా ఉంటుంది.
![]()
ప్రశ్న 8.
అయాన్ల స్వతంత్రీయ అభిగమనాల కోల్రష్ నియమాన్ని తెలిపి, వివరించండి.
జవాబు:
కోల్రాష్ అయాన్ల స్వతంత్రీయ అభిగమన నియమం :
ఒక విద్యుత్ విశ్లేష్యకం అవధిక మోలార్ విద్యుత్ వాహకత్వం, విశ్లేష్యకం సమకూర్చిన కాటయాన్ల ఆనయాన్ల వ్యక్తిగత వాహకత్వాల మొత్తానికి సమానం.

అనువర్తనాలు :
1. దుర్బల విద్యుద్విశ్లేష్యకాల అనంత విలీనం వద్ద తుల్యాంక వాహకతను (∧∞) లెక్కించడం :
దుర్బల ఎలక్ట్రోలైట్లు ద్రావణములలో తక్కువ అయనీకరణం చెందును. అధిక విలీనత వద్ద కూడ అవి పూర్తిగా అయనీకరణం చెందవు. కనుక బలహీన ఎలక్ట్రోలైట్ల ∧∞ విలువ ప్రయోగకముగా నిర్ణయించుట కష్టము. అటువంటి వాటి ∧∞ విలువలను కింది పద్ధతిలో కనుగొనవచ్చు.
ఎన్నికచేసిన ప్రబల ఎలక్ట్రోలైట్స్ ∧∞ విలువలనుండి :
ప్రబల ఎలక్ట్రోలైట్ల వాహకతకు, విలీనతకు గ్రాఫీచి, పొడిగించిన (extrapolation) అనంత విలీనతవద్ద తుల్యాంక వాహకతను కనుగొనవచ్చు. బలహీన ఎలక్ట్రోలైట్స్కు ∧∞ కనుగొనుట కష్టము.
ఉదా : ఎసిటిక్ ఆమ్లపు ∧∞ విలువను, HCl, NaCl, CH3 COONa ల ∧∞ విలువలనుండి గణించవచ్చును.
ఈ నియమం ప్రకారం.
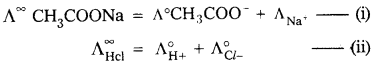
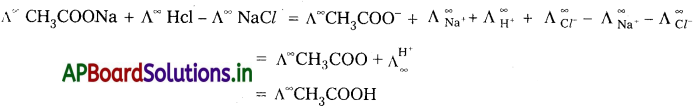
2. ఆమ్ల, క్షార వియోజన స్థిరాంకములను కనుగొనుటలో
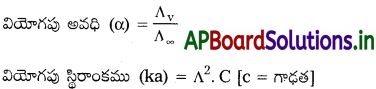
3. అల్ప ద్రావణీయత లవణ ద్రావణీయతను (S) నిర్ణయించుటలో
BaSO4, PbSO4, AgCl వంటి లవణములో నీటిలో తక్కువగా కరుగును. వాటి ద్రావణీయతను క్రింది విధంగా కనుగొనవచ్చు.

ప్రశ్న 9.
విద్యుత్ విశ్లేషణ ప్రక్రియ అంటే ఏమిటి? విద్యుత్ విశ్లేషణ ప్రక్రియకు సంబంధించిన ఫారడే మొదటి నియమం తెలపండి. [AP. Mar.’ 15]
జవాబు:
విద్యుత్ వియోజన ప్రక్రియ ద్వారా, సాధారణ పరిస్థితులలో స్వచ్ఛందంగా జరగని రసాయన చర్యలను జరిపించే ప్రక్రియను విద్యుత్ విశ్లేషణ అంటారు.
జలద్రావణ స్థితిలోనూ, గలన స్థితిలోనూ ఉన్న లవణాలు విద్యుద్విశ్లేషణ చెందుతాయి.
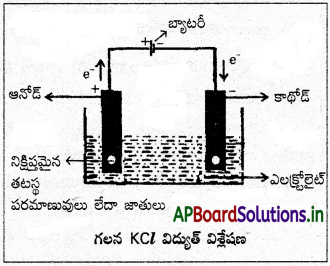
గలనస్థితిలో ఉన్న KCl లవణం విద్యుద్విశ్లేషణ :
పటములో చూపినట్లుగా విద్యుద్ఘాటంలో గలన స్థితిలో ఉన్న KCl ను తీసుకుంటారు. దానిలో రెండు ప్లాటినం కడ్డీలను వ్రేలాడదీస్తారు. అవి ఎలక్ట్రోడ్లుగా పనిచేస్తాయి. ఈ ఎలక్ట్రోడ్లను తీగెల సహాయంతో బ్యాటరీ రెండు కొనలకు కలుపుతారు. విద్యుత్ ప్రసరిస్తుంది. అపుడు K+ తటస్థ అయాన్లు కాథోడ్ వైపుకు, Cl– ప్రయాణిస్తాయి. అచ్చట అవి వాటి ఆవేశాన్ని కోల్పోయి ఉత్పన్నాలను ఇస్తాయి.
ఫారడే విద్యుద్విశ్లేష్యణ ప్రక్రియ మొదటి నియమం :
విద్యుద్విశ్లేషణ ప్రక్రియలో ఎలక్ట్రోడ్ వద్ద జరిగే రసాయన చర్య పరిమాణం విద్యుద్విశ్లేష్యక పదార్ధంలో ప్రసారమయ్యే విద్యుత్ పరిమాణానికి అనులోమానుపాతంలో ఉంటుంది.
m ∝ Q; m = c × t
m = ect; m = \(\frac{Ect}{96,500}\)
e = విద్యుత్ రసాయన తుల్యాంకం
t = సమయం (సెకన్లలో)
c = విద్యుత్ (ఆంపియర్లలో)
E = రసాయన తుల్యాంకం
ప్రశ్న 10.
ప్లాటినమ్ ఎలక్ట్రోడ్లు ఉపయోగించి విద్యుత్ విశ్లేషణ ప్రక్రియకు కింది వాటిని గురిచేస్తే కాథోడ్, ఆనోడ్ల వద్ద ఏ పదార్థాలు ఏర్పడతాయి?
(ఎ) గలన KCl (బి) జల CuSO4 ద్రావణం (సి) జల K2SO4 ద్రావణం
జవాబు:
ఎ) ప్లాటినమ్ ఎలక్ట్రోడ్లను ఉపయోగించి గలన KCl ను విద్యుద్విశ్లేషణ ప్రక్రియకు గురిచేస్తే పొటాషియం కాథోడ్ వద్ద క్లోరిన్ ఆనోడ్ వద్ద ఏర్పడుతుంది.
2 KCl → 2K+ + 2Cl–
2 Cl– → Cl2 + 2e– (ఆనోడ్)
2K+ + 2e– → 2K (కాథోడ్)
బి) ప్లాటినమ్ ఎలక్ట్రోడ్లను ఉపయోగించి CuSO4 జలద్రావణాన్ని విద్యుద్విశ్లేషణ ప్రక్రియకు గురిచేస్తే కాపర్ కాథోడ్ వద్ద, O2 వాయువు ఆనోడ్ వద్ద వెలువడతాయి.
2 CuSO4 → 2 Cu + 2 + 2 SO4
2 Cu+2 + 4e– → 2 Cu (కాథోడ్)
2 H2O – 4e– → O2 + 4H+ (ఆనోడ్)
సి) జలK2SO4 ద్రావణాన్ని విద్యుద్విశ్లేషణం చేస్తే ప్లాటినం కాథోడ్ వద్ద హైడ్రోజన్ వాయువు, ప్లాటినం ఆనోడ్ వద్ద హైడ్రోజన్ వాయువు ఏర్పడును.
ప్రశ్న 11.
ప్రైమరీ, సెకండరీ బ్యాటరీలు అంటే ఏమిటి ? ప్రతీ దానికి ఒక ఉదాహరణ ఇవ్వండి.
జవాబు:
ప్రైమరీ బ్యాటరీ :
బ్యాటరీలైతే కొంత కాలం వాడిన తరువాత ఘటక చర్యలు పూర్తయిపోయి పని చేయడం ఆగిపోతాయో వాటిని ప్రైమరీ బ్యాటరీలు అంటారు.
ఉదా : లెక్లాంచి ఘటం, అనార్ద్ర ఘటం.
సెకండరీ బ్యాటరీ :
ఏ బ్యాటరీని అయితే డిస్చార్జ్ అయిపోయిన దాన్ని తిరిగి చార్జ్ చేసి వాడుకోవచ్చో దానిని సెకండరీ బ్యాటరీ అంటారు.
ఉదా : సెకండరీ బ్యాటరీకి ముఖ్యమైన ఉదాహరణ లెడ్ నిక్షేప బ్యాటరీ. బ్యాటరీ వాడకంలో ఉన్నప్పుడు కింది ఘటచర్యలు చోటు చేసుకుంటాయి.

ప్రశ్న 12.
ఇంధన ఘటాలు అంటే ఏమిటి? ఇవి గాల్వనిక్ ఘటాల నుంచి ఏ విధంగా భేదిస్తున్నాయి? H2, O2 ఇంధన ఘటం నిర్మాణం తెలపండి? [TS. Mar.’17]
జవాబు:
విద్యుత్ రసాయన ప్రక్రియ ఆధారంగా ఇంధనం ఆక్సీకరణి వ్యవస్థలోకి రసాయన శక్తిని ప్రత్యక్షంగా విద్యుత్ శక్తిగా మార్చే గాల్వనిక్ ఘటమే ఇంధన ఘటం అంటారు.
- సంప్రదాయ గాల్వనిక్ ఘటాలు రిడాక్స్ చర్యలను ఉపయోగించి రసాయన శక్తిని విద్యుత్ శక్తిగా మారుస్తాయి.
- ఇంధన ఘటాలు హైడ్రోజన్, మిథేన్ మొదలగునవి ఇంధనాల దహనం ద్వారా వచ్చిన శక్తిని విద్యుత్ శక్తిగా మారుస్తాయి. ఇవి తక్కువ కాలుష్యాన్ని కలిగిస్తాయి.
ఉదా : H2 – O2 ఇంధన ఘటాలు :
గాఢ NaOH ద్రావణంలో ముంచి ఉంచిన రెండు సచ్ఛిద్ర కార్బన్ఎలక్ట్రోడ్లు ఈ ఇంధన ఘటంలో ఉంటాయి. H2, O2 వాయువులను, ఎలక్ట్రోడ్లు ఉపరితలం మీదికి బుడగల రూపంలో పంపుతారు. ఎలక్ట్రోడ్లలో అనువైన ఉత్ప్రేరకాలను పొదిగి ఉంచుతారు.
ఎలక్ట్రోడ్ చర్యలు కింది విధంగా ఉంటాయి.
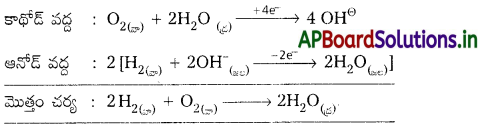
చర్యలో పాల్గొనే వాయువుల సరఫరా ఉండేంత వరకు ఘటం పనిచేస్తుంది. దహనశక్తి ప్రత్యక్షంగా విద్యుత్ శక్తిగా మారుతుంది.
ప్రశ్న 13.
లోహక్షయం అంటే ఏమిటి? ఐరన్ లోహక్షయం ఆధారంగా దీనిని వివరించండి.
జవాబు:
లోహక్షయం :
ఒక లోహం, అది ప్రకృతిలో సహజంగా లభించే సమ్మేళన రూపంలో స్వచ్ఛందంగా మారిపోవడానికి ప్రదర్శించే సంసిద్ధతను లోహక్షయం అంటారు.
ఉదా : ఐరన్, తన ఆక్సైడ్ (Fe2O3 -హెమటైట్) రూపంలోకి, కాపర్, తన కార్బనేట్ (మోలకైట్) రూపంలోకి మరియు సిల్వర్, తన సల్ఫైట్ (Ag2S సిల్వర్ గ్లాన్స్) రూపంలోకి మారిపోవడానికి ప్రయత్నిస్తాయి.
ఎనోడ్ వద్ద లోహం విద్రవణం చెందడాన్ని విద్యుత్ రసాయన లోహక్షయం అంటారు.
ఐరన్ తుప్పు పట్టడం తెలిపే విద్యుత్ – రసాయనచర్యలు

దీర్ఘ సమాధాన ప్రశ్నలు
ప్రశ్న 1.
విద్యుత్ రసాయన ఘటాలు అంటే ఏమిటి? వీటిని ఎలా నిర్మాణం చేస్తారు? భిన్న గాల్వనిక్ ఘటాలు పనిచేసే విధానాలను వివరించండి.
జవాబు:
అయత్నీకృతంగా జరిగే ఆక్సీకరణ-క్షయకరణ చర్యలను ఉపయోగించి రసాయనశక్తిని విద్యుత్ శక్తిగా మార్చే ఘటాలను విద్యుత్ రసాయన ఘటాలు అంటారు.
ఉదా : గాల్వానిక్ ఘటం, డానియల్ ఘటం.
ఏ పరికరాలైతే అయత్నీకృతంగా జరిగే రిడాక్స్ చర్యలను ఉపయోగించి రసాయనశక్తిని విద్యుత్ శక్తిగా మార్పు చేస్తాయో వాటిని గాల్వనాక్ ఘటాలు లేదా వోల్టాయిక్ ఘటాలు అంటారు.
ఉదా : డానియల్ ఘటం
డానియల్ ఘటం :
ఇది ప్రత్యేకమైన గాల్వానిక్ ఘటం, దానిలో ఒకే పాత్రలో రెండు అర్థఘటాలు ఉంటాయి. ఈ పాత్ర రెండు భిన్న భాగాలుగా విభజింపబడుతుంది. ఎడమవైపు భాగం ZnSO4 జల ద్రావణంలో నింపబడి Zn కడ్డీని కలిగి ఉంటుంది. కుడివైపుభాగంలో CuSO4 జల ద్రావణంతో నింపబడి Cu కడ్డీని కలిగి ఉంటుంది. ఈ రెండింటినీ ఒక సాల్ట్ బ్రిడ్జ్ అనుసంధానం చేస్తారు. ఈ అర్థ ఘటాలు బాహ్య బ్యాటరీకి కలుపుతారు.
Zn/ZnSO4 అర్ధ ఘటంలో ఆక్సీకరణ చర్య జరుగును.

గాల్వానిక్ ఘటాన్ని సూచించుట :
- ఆక్సీకరణ అర్థఘటాన్ని ఎడమవైపున వ్రాయలి
- క్షయకరణ అర్థఘటాన్ని కుడి వైపున వ్రాయలి
- ఈ రెండు అర్థఘటాలను రెండు నిలువు సమాంతర గీతల(సాల్ట్ బ్రిడ్జ్)తో కలుపవలెను.
ఉదా : Cu(ఘ)|Cu2+ (జల) | | Ag+ (జల) | Ag(ఘ)
ప్రైమరీ బ్యాటరీ :
ఏ బ్యాటరీలైతే కొంత కాలం వాడిన తరువాత ఘటక చర్యలు పూర్తయిపోయి పని చేయడం ఆగిపోతాయో వాటిని ప్రైమరీ బ్యాటరీలు అంటారు.
ఉదా : లెక్లాంచి ఘటం, అనార్ధ ఘటం.
సెకండరీ బ్యాటరీ :
ఏ బ్యాటరీని అయితే డిస్చార్జ్ అయిపోయిన దాన్ని తిరిగి చార్జ్ చేసి వాడుకోవచ్చో దానిని సెకండరీ బ్యాటరీ అంటారు.
ఉదా : సెకండరీ బ్యాటరీకి ముఖ్యమైన ఉదాహరణ లెడ్ నిక్షేపబ్యాటరీ. బ్యాటరీ వాడకంలో ఉన్నప్పుడు కింది ఘటచర్యలు చోటు చేసుకుంటాయి.
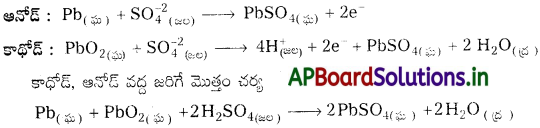
![]()
ప్రశ్న 2.
ద్రావణం విద్యుత్ వాహకత అంటే ఏమిటి? దీనిని ప్రయోగం ద్వారా ఎలా నిర్ణయిస్తారు?
జవాబు:
విశిష్టనిరోధకత(లేదా) నిరోధకత యొక్క విలోమాన్ని విద్యుద్వాహకత్వం అంటారు.
దీనిని (K) తో సూచిస్తారు.
(లేదా)
ఒక యూనిట్ ఘన వాహకం యొక్క వాహకత్వాన్ని విద్యుద్వాహకత్వం అంటారు.
SI యూనిట్లు : ohm-1 in-1 (or) Sm-1 S = సీమన్
విద్యుత్ వాహకత్వం ప్రయోగం ద్వారా నిర్ణయించుట :
→ వీట్ స్ట్రోన్ బ్రిడ్జ్ సహాయంతో ఒక లోహపు తీగ నిరోధాన్ని కొలవవచ్చు. విద్యుద్విశ్లేష్యక ద్రావణాల నిరోధాన్ని ఈ విధానంలో కొలిచేటప్పుడు రెండు ఇబ్బందులు ఎదురౌతాయి.
(i) ప్రయోగ ద్రావణం ద్వారా ఏకముఖ ప్రవాహ కరెంటు DCను పంపినప్పుడు ద్రావణంలో జరిగే విద్యుద్విశ్లేషక ప్రక్రియ కారణంగా ద్రావణం సంఘటనం మారిపోవడం తటస్థిస్తుంది.
(ii) ఒక లోహ తీగను లేదా ఘనస్థితి వాహకాన్ని బ్రిడ్జ్ని సులభంగా సంధానం చేసినట్లు అయానిక ద్రావణాన్ని బ్రిడ్జికి సంధానం చేయలేము.
→ ఏకముఖి ప్రవాహ విద్యుత్ జనకానికి బదులుగా ఏకాంతర విద్యుత్ ప్రవాహ జనకం AC వాడటం వలన మొదటి ఇబ్బందిని అధిగమించవచ్చు ప్రత్యేకంగా తయారు చేసిన వాహకత్వఘటం అనే పాత్రను ఉపయోగించటం ద్వారా రెండవ ఇబ్బందిని అధిగమించవచ్చు.


→ వాహకత్వం విలువ తెలిసిన ద్రావణంతో ఘటాన్ని నింపి దాని నిరోధాన్ని కొలిచి ఘటస్థిరాంకాన్ని నిర్ణయిస్తారు.

→ ఘటస్థిరాంకం నిర్ణయించిన తరువాత దానిని ద్రావణం వాహకత్వాన్ని లేదా నిరోధాన్ని కొలవడానికి ఉపయోగిస్తారు.
→ నిరోధాన్ని కొలిచే ప్రయోగసాధన అమరిక ఈ క్రింది ఇవ్వబడినది.

ప్రశ్న 3.
కోల్రాష్ అయాన్ల స్వతంత్రీయ అభిగమనాల నియమం అనువర్తనాలను తెలపండి. [AP. Mar.’15; TS. Mar.’16]
జవాబు:
కోల్రాష్ అయాన్ల స్వతంత్రీయ అభిగమన నియమం :
ఒక విద్యుత్ విశ్లేష్యకం అవధిక మోలార్ విద్యుత్ వాహకత్వం, విశ్లేష్యకం సమకూర్చిన కాటయాన్ల ఆనయాన్ల వ్యక్తిగత వాహకత్వాల మొత్తానికి సమానం.

అనువర్తనాలు :
1. దుర్బల విద్యుద్విశ్లేష్యకాల అనంత విలీనం వద్ద తుల్యాంక వాహకతను (∧∞) లెక్కించడం :
దుర్బల ఎలక్ట్రోలైట్లు ద్రావణములలో తక్కువ అయనీకరణం చెందును. అధిక విలీనత వద్ద కూడ అవి పూర్తిగా అయనీకరణం చెందవు. కనుక బలహీన ఎలక్ట్రోలైట్ల ∧∞ విలువ ప్రయోగకముగా నిర్ణయించుట కష్టము. అటువంటి వాటి ∧∞ విలువలను కింది పద్ధతిలో కనుగొనవచ్చు.
ఎన్నికచేసిన ప్రబల ఎలక్ట్రోలైట్స్ ∧∞ విలువలనుండి :
ప్రబల ఎలక్ట్రోలైట్ల వాహకతకు, విలీనతకు గ్రాఫీచి, పొడిగించిన (extrapolation) అనంత విలీనతవద్ద తుల్యాంక వాహకతను కనుగొనవచ్చు. బలహీన ఎలక్ట్రోలైట్స్కు ∧∞ కనుగొనుట కష్టము.
ఉదా : ఎసిటిక్ ఆమ్లపు ∧∞ విలువను, HCl, NaCl, CH3 COONa ల ∧∞ విలువలనుండి గణించవచ్చును.
ఈ నియమం ప్రకారం.
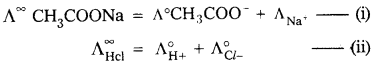
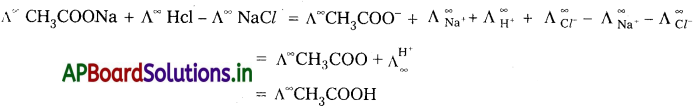
2. ఆమ్ల, క్షార వియోజన స్థిరాంకములను కనుగొనుటలో
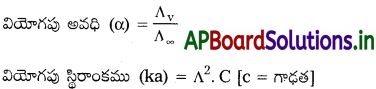
3. అల్ప ద్రావణీయత లవణ ద్రావణీయతను (S) నిర్ణయించుటలో
BaSO4, PbSO4, AgCl వంటి లవణములో నీటిలో తక్కువగా కరుగును. వాటి ద్రావణీయతను క్రింది విధంగా కనుగొనవచ్చు.

ప్రశ్న 4.
భిన్న రకాల బ్యాటరీలను వివరించండి. ప్రతీ రకం బ్యాటరీ నిర్మాణాన్ని పనిచేసే విధానాన్ని తెలపండి.
జవాబు:
ప్రైమరీ బ్యాటరీ :
ఏ బ్యాటరీలైతే కొంత కాలం వాడిన తరువాత ఘటక చర్యలు పూర్తయిపోయి పని చేయడం ఆగిపోతాయో వాటిని ప్రైమరీ బ్యాటరీలు అంటారు.
ఉదా : లెక్లాంచి ఘటం, అనార్ధ ఘటం.
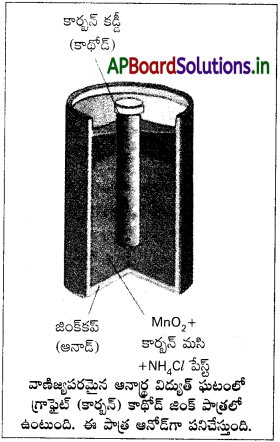
అనార్ధ ఘటము :
- ఇది లెక్లాంచి ఘటానికి రూపాంతరం. లెక్లాంచి ఘటంలోని ద్రవస్థితి విద్యుద్విశ్లేషకాలకు బదులు అర్ధ ఘనపదార్థస్థితిలో ఉండే పేస్ట్) విద్యుద్విశ్లేష్యకాలను ఉపయోగిస్తారు.
- ‘Zn’ పాత్ర చుట్టూ కార్డ్ బోర్డు అమరుస్తారు. దీన్ని పిల్తో సీల్ చేస్తారు. Zn పాత్ర ఋణ ఎలక్ట్రోడ్గా పనిచేస్తుంది.
- Zn పాత్ర మధ్యభాగంలో ఒక కర్బనకడ్డీ అమర్చుతారు. ఈ కడ్డీ ధన ఎలక్ట్రోడ్గా పనిచేస్తుంది. దీనిచుట్టూ (C + MnO2) మిశ్రమం పేస్ట్ రూపంలో ఉంటుంది. మిగిలిన భాగమంతా (NH4Cl + ZnCl2) పేస్ట్లో నింపబడి ఉంటుంది.
- పై రెండు పేస్ట్లను ఒక సచ్ఛిద్ర పలకతో వేరు చేస్తారు. ఈ బ్యాటరీలు సులభంగా వాడుకోవచ్చు. దీని EMF విలువ 1.5V
- ఎలక్ట్రోడ్ల వద్ద చర్యలు :
కాథోడ్ వద్ద : MnO2 + NH+4 + e– → MnO (OH) + NH3
ఆనోడ్ వద్ద : Zn + 2MnO2 + 2H2O → Zn2+ + 20HᎾ + 2MnO (OH) - ఈ బ్యాటరీలు డిస్చార్జి అయిపోతే, తిరిగి చార్జ్ చేయడానికి వీలుండదు.
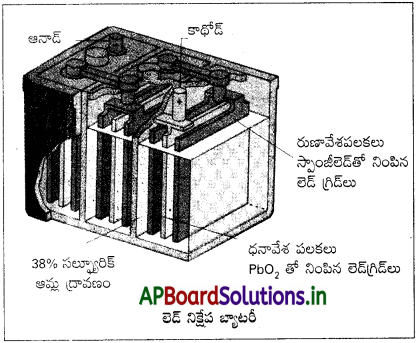
సెకండరీ బ్యాటరీలు :
వాడకంలో డిస్చార్జ్ అయి పోయిన సెకండరీ ఘటాన్ని తిరిగి చార్జ్ చేసి వాడుకోవచ్చు. మంచి సెకండరీ ఘటం అయినట్లైతే దానిని పలుమార్లు డిస్ఛార్జ్. ఛార్జ్ వలయ ప్రక్రియలకు గురిచేసి వాడకంలోకి రాబట్టవచ్చు. వాడకంలో ఉండే అతి ముఖ్యమైన సెకండరీ ఘటం లెడ్ నిక్షేప బ్యాటరీ (lead storage battery) దీనిని సాధారణంగా రవాణా వాహనాలలోను (ఆటో మొబైల్లు) ఇన్వర్టర్లలోను ఉపయోగిస్తారు. దీనిలో లెడ్ ఆనోడ్, లెడ్ ఆక్సైడ్ పూత పూసిన లెడ్ లోహపు పలక కాథోడ్గాను ఉంటాయి. 38% సల్ఫ్యూరిక్ ఆమ్ల ద్రావణాన్ని విద్యుద్విశ్లేష్యకంగా ఉపయోగిస్తారు. బ్యాటరీ వాడకంలో ఉన్నప్పుడు (డిస్ఛార్జ్ జరుగుతున్నప్పుడు) కింది ఘట చర్యలు చోటుచేసుకొంటాయి.
అనోడ్ : Pb(ఘ) + SO2-4(ఘ) → PbSO4 (ఘ) + 2e–
కాథోడ్ : PbO2(ఘ)+ SO2-4(జల) + 4H+ (జల) + 2e– → PbSO4 (ఘ) + H2O(ద్ర)
కాథోడ్, ఆనోడ్ వద్ద జరిగే చర్యల మొత్తం చర్యను క్రింది విధంగా రాస్తారు.
Pb(ఘ) + PbO2,(ఘ) + 2 H2SO4 (జల) → 2 PbSO4(ఘ) + 2H2O(ద్ర)
ఈ చర్య బ్యాటరీ వాడకంలో ఉన్నప్పుడు అంటే డిస్చార్జి కాలంలో జరుగుతుంది. బ్యాటరీని చార్జి ప్రక్రియకు గురిచేస్తే పై చర్య వ్యతిరేక దిశలో జరిగి PbSO4 (ఘ) అనాడ్ వద్ద ఏర్పడుతుంది. కాథోడ్ వరసగా Pb, PbO2 ల మిశ్రమంగా మారుతుంది.
సమస్యలు
ప్రశ్న 1.
కొన్ని ఎలక్ట్రోడ్ ప్రమాణ పొటెన్షియల్లు కింద ఇవ్వడమైంది. లోహాలను, వాటి క్షయీకరణ సామర్థ్యం పెరుగుదల క్రమంలో సమకూర్చండి.
ఎ) K+/K = − 2.93 V బి) Ag+/Ag 0.80 V సి) Cu2+/Cu = 0.34 V డి) Mg2+/Mg = – 2.37 V ఇ) Cr3+/Cr = – 0.74V ఎఫ్) Fe2+/Fe = – 0.44 V
సాధన:
ఇవ్వబడినవి
ఎలక్ట్రోడ్ ప్రమాణ విద్యుత్ పొటెన్షియల్లు

అల్ప క్షయకరణ పొటెన్షియల్ విలువ అధిక క్షయకరణ సామర్థ్యంను సూచిస్తుంది. అధిక విలువ అధిక ఆక్సీకరణ సామర్ధ్యం చూపును. కావున లోహాలు క్షయకరణ సామర్థ్యం పెరిగే క్రమం
Ag < Cu < Fe < Cr < Mg < K.
ప్రశ్న 2.
25°C వద్ద కింది ఘటం emf ను లెక్కించండి.
Cr | Cr3+ (0.1 M)|| Fe2+ (0.01M) | Fe, EΘCr3+/Cr = – 0.74V మరియు EΘFe2+/Fe = -0.44 V.
సాధన:
ఇవ్వబడిన ఘటం

ప్రశ్న 3.
Zn2+ (జల) అయాన్ల మోలారిటీ 0.001 M గా కలిగిన Zn – Zn2++ (జల) ఎలక్ట్రోడ్ పొటెన్షియల్ను లెక్కించండి.
EΘZn2+/Zn = -0.76 V
R = 8.314 JK-1 mol-1; F = 96500 C mol-1.
సాధన:
ఇవ్వబడిన ఎలక్ట్రోడ్
Zn | Zn+2(0.001 M), E0Zn2+/Zn = -0.76 V
నెర్నెస్ట్ సమీకరణం

ప్రశ్న 4.
వాచీలలో ఉపయోగించే బటన్ ఘటం ∆G0 విలువను నిర్ణయించండి.
ఘటచర్య Zn(ఘ) + Ag2O(ఘ) + H2O(ఘ) → Zn+2(ఘ) + 2 Ag(ఘ) + 2 OH–(ద్ర)
సాధన:
Ag+/Ag యొక్క E0 = 0.80 V
Zn+2/Zn యొక్క E0 = -0.76 V
ఘటాన్ని సూచించుట Zn/Zn+2||Ag+/Ag
emf = ERHS – ELHS = 0.80 – (-0.76) = 1.56
∆G = – nFE0 = -2 × 96500 × 1.56 = – 301.08 kJ/mole
![]()
ప్రశ్న 5.
క్రింది అర్ధఘటాలు ఏర్పరచిన ఘటం emf విలువను లెక్కించండి.
Al/Al3+ (0.001 M), Ni/Ni2+ (0.50 M). ఇచ్చినవి EΘNi2+/Ni = – 0.25 V
EΘAl3+/Al = – 1.66 V (log 8 × 10-6 = – 5.0969).
సాధన:
Al3+/Al యొక్క E0 = – 1.66 V
Ni+2/Ni యొక్క E0 = – 0.25 V

ప్రశ్న 6.
క్రింది చర్యకు K విలువను లెక్కించండి.
Ni(ఘ) + 2 Ag+(జల) → Ni2+(జల) + 2 Ag(జల) ; EΘ = 1.05 V.
సాధన:
ఇవ్వబడినది

ప్రశ్న 7.
0.1 M K2Cr2O7(జల), 0.2 M Cr3+(జల), 1.0 × 10-4 MH+(ఘ) గల అర్ధఘటం పొటెన్షియల్ లెక్కించండి.
(జల)’
అర్ధఘట చర్య Cr2O2-7(జల) + 14H+(జల) → 2Cr3+(జల) + 7H2O(ద్ర)
(Cr2O2-7 / Cr3+ యొక్క E0 = 1.33 V
సాధన:
ఇవ్వబడిన అర్ధఘటం

ప్రశ్న 8.
298 K వద్ద కింది చర్య K ను లెక్కించండి.

సాధన:
ఇవ్వబడినది

ప్రశ్న 9.
298 K వద్ద కింది ఘటం emf లెక్కించండి.
Sn(ఘ)|Sn2+ (0.05 M) || H+(జల) (0.02) M|H2(వా) 1 atm. Pt. ; E0Sn2+/Sn = -0.144V
సాధన:
ఘటచర్య Sn(ఘ) + 2H+(జల) → Sn²(జల) + H2(వా)

ప్రశ్న 10.
0.1 M గాఢత గల Cu2+, Ag+ అయాన్లను ఉపయోగించి నిర్మాణం చేసిన ఘటంలో సిల్వర్ అయాన్ల గాఢత లెక్కించండి. Cu, Ag లోహలను ఎలక్ట్రోడ్లుగా ఉపయోగించారు. ఘటం పొటెన్షియల్ 0.422 V.
[EΘAg2+/Ag = +0.80 V; EΘCu2+/Cu = +0.34 V]
సాధన:
Ag+/Ag యొక్క E0 = 0.80 V
Cu+2/Cu యొక్క E0 = 0.34 V
ఘటం = ERHS -ELHS = 0.80 – 0.34 = 0.46 V
ఘటం Cu+2(10.1M) || Ag+ | Ag

ప్రశ్న 11.
కింది ఘటచర్య గల ఘటం emf లెక్కించండి.
Ni(s) + 2 Ag+ (0.002M) → Ni2+ (0.160 M) + 2 Ag(s)
E0(ఘటం) = 1.05 V.
సాధన:
ఇవ్వబడిన ఘటానికి నెర్నెస్ట్ సమీకరణం

ప్రశ్న 12.
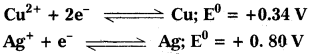
25°C Ag+(జల) అయాన్ల ఏ గాఢత వద్ద ఘటం emf సున్నా అవుతుంది. Cu2+ (జల) అయాన్ గాఢత 0.1 M.
(log 3.919 = 0.593)
సాధన:
Cu Cu+2 || Ag+|Ag
emf = ERHS – ELHS = 0.80 – 0.34 = 0.46 V

ప్రశ్న 13.
298 K వద్ద 0.20 M KCl ద్రావణం విద్యుత్ వాహకత్వం 0.0248 5 cm మోలార్ వాహకత్వాన్ని లెక్కించండి.
సాధన:
విద్యుత్ వాహకత (K) = 0.0248 S cm-1 = 0.0248 ohm-1 cm-1
మోలార్ గాఢత [c] = 0.20 mol L-1
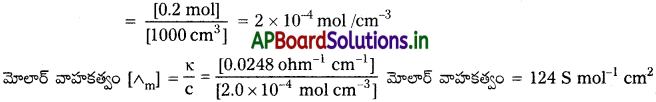
ప్రశ్న 14.
298 K వద్ద CH3COOH విఘటన పరిమితిని (a) ను లెక్కించండి.
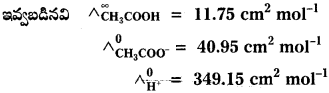
సాధన:
ఇవ్వబడినవి

సాధించిన సమస్యలు Textual Examples
ప్రశ్న 1.
కింది చర్య జరిగే ఘటాన్ని వ్యక్తం చేయండి.
Mg(ఘ) + 2Ag+ (0.0001M) → Mg2+ (0.130M) + 2 Ag(ఘ)
దీని EΘ(ఘటం) విలువ 3.17 V అయితే E(ఘటం) విలువ లెక్కించండి.
సాధన:
ఘటాన్ని క్రింది విధంగా రాస్తాం Mg | Mg2+ (0.130M) || Ag+ (0.0001M) | Ag

ప్రశ్న 2.
కింది చర్య సమతాస్థితి స్థిరాంకాన్ని లెక్కించండి.
Cu(ఘటం) + 2 Ag+(జల) → Cu2+(జల) + Ag(ఘ)
EΘ(ఘటం) = 0.46 V
సాధన:

ప్రశ్న 3.
డేనియల్ ఘటం ప్రకారం e.m.f. విలువ 1.IV కింది ఘటచర్యలకు గిబ్స్ శక్తిని లెక్కించండి.
Zn(ఘ) + Cu2+(జల) → Zn2+(జల) + Cu(ఘ)
సాధన:
∆rGΘ = -nFEΘ(జల)
పై సమీకరణంలో n విలువ 2, F = 96487 C mol-1 and EΘ(ఘటం) = 1.1 V
కాబట్టి ∆rGΘ = – 2 × 1.1V × 96487 C mol-1
= -21227 J mol-1
= -212.27 kJ mol-1
![]()
ప్రశ్న 4.
0.1 mol L-1 KCl ద్రావణంతో నింపిన విద్యుత్ వాహకత్వ ఘటం నిరోధం 100 Ω. ఇదే ఘటాన్ని 0.02 mol L-1 KCl ద్రావణంతో నింపి ఉంచినట్లైతే దాని నిరోధం 520 Ω, గా ఉంది. 0.02 mol L-1 KCl ద్రావణం విద్యుత్ వాహకత్వం, మోలార్ విద్యుత్ వాహకత్వం లెక్కించండి. 0.1 mol L-1 KCl ద్రావణం విద్యుత్ వాహకత్వం 1.29 S/m.
సాధన:
ఘటస్థిరాంకాన్ని కింది సమీకరణం ద్వారా తెలుపుతాం.
ఘటస్థిరాంకం G* = వాహకత్వం × నిరోధం
= 1.29 S/ m 100 Ω = 129 m-1 = 1.29 cm-1
0.02 mol L-1 KCl ద్రావణం వాహకత్వం = ఘటస్థిరాంకం/ నిరోధం


ప్రశ్న 5.
1 cm వ్యాసం, 50 cm పొడవు (1) ఉన్న ద్రవ స్థూపం గల 0.05 mol L-1 NaOH ద్రావణం విద్యుత్ నిరోధం 5.55 × 10³ ఓమ్లు. దీని నిరోధకత్వాన్ని, వాహకత్వాన్ని, మోలార్ వాహకత్వాన్ని లెక్కించండి.
సాధన:
A = πr² = 31.4 × 0.52 cm² = 0.785 cm² = 0.785 × 10-4 m²
l = 50 cm = 0.5 m

ప్రశ్న 6.
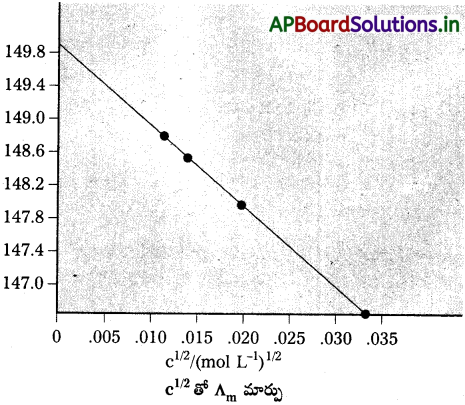
భిన్న గాఢతల వద్ద KCl మోలార్ వాహకత్వాల విలువలను, 298 K వద్ద కింద ఇవ్వడమైంది.

∧m, c1/2 గీచిన రేఖాపటం సరళరేఖగా ఉంటుందని చూపండి. KCl కు ∧0m, ‘A’ విలువలను లెక్కించండి.
సాధన:
గాఢతల వర్గమూలాలు ∧m విలువలు కింది విధంగా ఉన్నాయి.

∧m (y- అక్షంపైనా), (y- అక్షంపైన) ల మధ్య గీచిన రేఖాపటాన్ని చూడండి. ఇది సుమారు సరళరేఖగా ఉంది అని తెలుస్తుంది. అంతర ఖండం (c1/2 = 0) నుంచి
∧°m = 150.0 S cm² మోల్-1,
A = – వాలు = 87.46 S Cm² mol-11/(mol/L-1)1/2
ప్రశ్న 7.
పట్టిక 3.4లో ఇచ్చిన విలువల ఆధారంగా CaCl2, MgSO4 లకు ∧°m ను లెక్కించండి. కోల్రష్ నియమం నుంచి కింది విషయం మనకు తెలుసు.
సాధన:

ప్రశ్న 8.
NaCl, HCl, NaAc లకు వరుసగా ∧°m విలువలు 126.4, 425.9, 91.0 S cm2 mol-1 గా ఉన్నాయి. HAc కి ∧°ను లెక్కించండి.
సాధన:
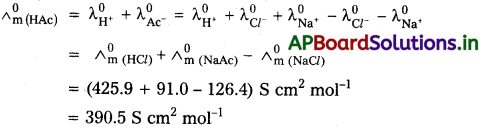
![]()
ప్రశ్న 9.
0.001028 mol L-1 ఎసిటిక్ ఆమ్లం వాహకత్వం 4.95 × 10-5 S cm-1 ఎసిటిక్ ఆమ్లం ^ విలువ 390.5 S cm2 mol’ ఎసిటిక్ ఆమ్ల విఘటన స్థిరాంకాన్ని లెక్కించండి.
సాధన:

ప్రశ్న 10.
1.5 ఆంపియర్ల కరెంటుతో CuSO4 ద్రావణాన్ని 10 నిమిషాలు విద్యుద్విశ్లేషణం చేశారు. అయితే కాథోడ్ వద్ద నిక్షిప్తమైన కాపర్ లోహం ద్రవ్యరాశి ఎంత? [AP & TS. Mar. ’15]
సాధన:
t = 600 s, విద్యుత్ పరిమాణం = కరెంటు × కాలం – 1.5A × 600s = 900 C కింది చర్య
Cu2+(జల) + 2e- Cu(ఘ) ఆధారంగా, 1 mol లేదా 63 g Cu ను నిక్షిప్తం చేయడానికి 2F లేదా 2 × 96487 C ల విద్యుత్ అవసరం అవుతుంది. కాబట్టి 900 C కు నిక్షిప్తమైన Cu భారం
= (63 g mol-1 × 900 C) / (2 × 96487 C mol-1) = 0.2938 g
పాఠ్యాంశ ప్రశ్నలు Intext Questions
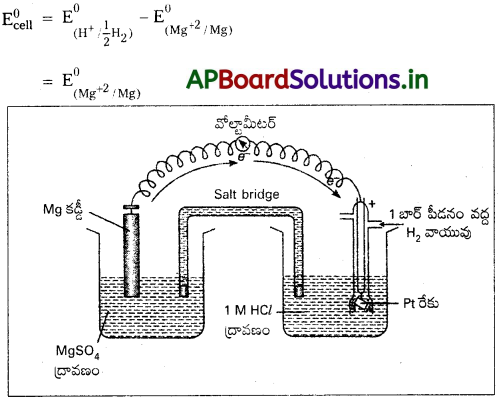
ప్రశ్న 1.
Mg2+|Mg వ్యవస్థ ప్రమాణ ఎలక్ట్రోడ్ పొటెన్షియల్ విలువను ఎలా నిర్ణయిస్తారు?
సాధన:
ఘటాన్ని ఈ క్రింది విధంగా సూచించవచ్చు.
Mg|Mg+2(1M)||H+(M)|H2 (1 atm, pt)
ప్రశ్న 2.
జింక్ పాత్రలో కాపర్ సల్ఫేట్ ద్రావణాన్ని నిలువ ఉంచగలమా?
సాధన:
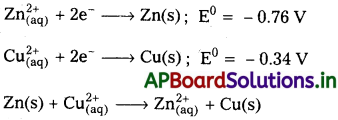
జింక్ పాత్రలో కాపర్ సల్ఫేట్ ద్రావణాన్ని నిల్వ ఉంచలేము. ఎందువలన అనగా జింక్ యొక్క E° విలువ కాపర్ కన్నా తక్కువ కావున జింక్ బలమైన క్షయకరణి.
ప్రశ్న 3.
అనువైన పరిస్థితులలో ఫెర్రస్ అయాన్లను ఆక్సీకరణం చేయగలిగే మూడు పదార్థాలను ప్రమాణ పొటెన్షియల్ విలువల ఆధారంగా తెలపండి.
సాధన:
ప్రమాణ పొటెన్షియల్ విలువల ఆధారంగా అనువైన పరిస్థితులలో ఫెర్రస్ అయానన్ను ఆక్సీకరణం చేయు పదార్థాలు
Cl2(వా) Br2(వా) మరియు F2(వా)
![]()
ప్రశ్న 4.
pH 10 గల ద్రావణంలో ముంచి ఉంచిన హైడ్రోజన్ ఎలక్ట్రోడ్ పొటెన్షియల్ను లెక్కించండి.
సాధన:
హైడ్రోజన్ ఎలక్ట్రోడ్ను H+ + e– → \(\frac{1}{2}\)H2
నెర్నెస్ట్ సమీకరణం అనువర్తించగా

ప్రశ్న 5.
క్రింది చర్య జరిగే ఘటం emf విలువను లెక్కించండి.
Ni(ఘ) + 2 Ag+ (0.002 M) → Ni2+ + 2Ag(ఘ)
EΘ = 1.05 V
సాధన:
ఇవ్వబడిన ఘటానికి నెర్నెస్ట్ సమీకరణం

ప్రశ్న 6.
కింది చర్య జరిగే ఘటానికి
2 Fe3+(జల) + 2I–(జల) → 2Fe2+(జల) + I2(జల)
298 K వద్ద EΘ(ఘటం) = 0.236 V, అయితే, ఘటచర్య ప్రమాణ గిబ్స్ శక్తిని, సమతాస్థితి స్థిరాంకాన్ని లెక్కించండి.
సాధన:
ఇవ్వబడిన రిడాక్స్ చర్యలోని రెండు అర్థఘటాలను ఈ క్రింది విధంగా వ్రాయవచ్చు.

ప్రశ్న 7.
ద్రావణం విలీనంతో, ద్రావణం విద్యుత్ వాహకత ఎందుకు తగ్గుతుంది?
సాధన:
ద్రావణ విద్యుద్వాహకత ద్రావణంలోని ప్రమాణ ఘనపరిమాణంలో అయాన్ల సంఖ్యపై ఆధారపడుతుంది. ద్రావణం విలీనం చేసినపుడు అయాన్ల సంఖ్య తగ్గును. కావున ద్రావణ విద్యుద్వాహకత తగ్గును.
ప్రశ్న 8.
నీటి ∧°m విలువను నిర్ణయించే పద్ధతిని తెలపండి.
సాధన:
నీటి యొక్క ∧°m విలువను కోల్ష్ నియమం ఆధారంగా లెక్కించవచ్చు.
![]()
![]()
ప్రశ్న 9.
0.025 mol L-1 గాఢత గల మిథనోయిక్ ఆమ్లం మోలార్ వాహకత్వం విలువ 46.1 S cm² mol-1. దీని విఘటన అవధిని, విఘటన స్థిరాంకాన్ని లెక్కించండి.
λ°(H+) = 349.6 S cm² mol-1, λ° (HCOO–) = 54.6 cm² mol-1
సాధన:
Step I : HCOOH విఘటన అవధి లెక్కించుట :

Step II : విఘటన స్థిరాంకం లెక్కించుట :

ప్రశ్న 10.
ఒక లోహపు తీగ ద్వారా 0.5 ఆంపియర్ల విద్యుత్ 2 గంటల కాలం పంపితే, తీగ గుండా ఎన్ని ఎలక్ట్రాన్లు ప్రవహిస్తాయి?
సాధన:
విద్యుత్ పరిమాణం, Q = C × t
= 0.5 × 2 × 60 × 60 s
= 3600 amp. sec = 3600 C
ఒక ఫారడే విద్యుత్ పంపినపుడు తీగ గుండా ప్రవహించే ఎలక్ట్రాన్ల సంఖ్య = 6.022 × 1023

ప్రశ్న 11.
విద్యుత్ విశ్లేషణ పద్ధతిలో సంగ్రహణం చేసే కొన్ని లోహాల జాబితాను తెలపండి.
సాధన:
సోడియం, పొటాషియం, కాల్షియం, మెగ్నీషియం వంటి లోహాలకు విద్యుద్విశ్లేషణ పద్ధతి ద్వారా సంగ్రహణం చేయవచ్చు.
ప్రశ్న 12.
క్రింది చర్యను పరిశీలించండి. Cr2O2-7 + 14H+ + 6e– → 2Cr3+ + 7H2O
1 మోల్ Cr2O2-7 ను క్షయకరణం చెందించడానికి ఎంత పరిమాణంలో విదుయత్ (కులూంబ్లలో) అవసరం అవుతుంది?
సాధన:
1 mole Cr2O2-7 → 6 Faraday
6 × 96500 C 5.79 × 105 C
విద్యుత్ పరిమాణం = 5.79 × 105 Coulomb
ప్రశ్న 13.
లెడ్ నిక్షేప ఘటం రీచార్జింగ్ ప్రక్రియ రసాయశాస్త్రాన్ని తెలపండి. ఈ రీఛార్జింగ్ ప్రక్రియలో పాల్గొనే ముఖ్య రసాయన పదార్థాలను పేర్కొనండి.
సాధన:
లెడ్ నిక్షేప ఘటం రీఛార్జ్ చేసినపుడు బాహ్య విద్యుత్ వనరు నుండి ఘటానికి విద్యుత్ శక్తి అందించబడును.
బ్యాటరీ ఉపయోగంలో ఉన్నపుడు రసాయన చర్యలు విలోమంగా జరుగుతాయి.

ప్రశ్న 14.
ఇంధన ఘటాలలో ఉపయోగించే హైడ్రోజన్ మినహా రెండు ఇతర ఇంధనాలను పేర్కొనండి.
సాధన:
మీథేన్ (CH4) మరియు మిథనోల్ (CH3OH).
![]()
ప్రశ్న 15.
ఐరన్ తుప్పు పట్టడాన్ని విద్యుత్ రసాయన ఘటం ఏర్పడటం అనే భావన ద్వారా వివరించండి.
సాధన:
లోహక్షయం :
ఒక లోహం, అది ప్రకృతిలో సహజంగా లభించే సమ్మేళన రూపంలో స్వచ్ఛందంగా మారిపోవడానికి ప్రదర్శించే సంసిద్ధతను లోహక్షయం అంటారు.
ఉదా : ఐరన్, తన ఆక్సైడ్ (Fe2O3 – హెమటైట్) రూపంలోకి, కాపర్, తన కార్బనేట్ (మోలకైట్) రూపంలోకి మరియు సిల్వర్, తన సల్ఫైట్ (Ag2 S సిల్వర్ గ్లాన్స్) రూపంలోకి మారిపోవడానికి ప్రయత్నిస్తాయి.
ఎనోడ్ వద్ద లోహం విద్రవణం చెందడాన్ని విద్యుత్ రసాయన లోహక్షయం అంటారు.
ఐరన్ తుప్పు పట్టడం తెలిపే విద్యుత్-రసాయనచర్యలు
