Andhra Pradesh BIEAP AP Inter 2nd Year Chemistry Study Material Lesson 6(c) 17వ గ్రూపు మూలకాలు Textbook Questions and Answers.
AP Inter 2nd Year Chemistry Study Material Lesson 6(c) 17వ గ్రూపు మూలకాలు
అతిస్వల్ప సమాధాన ప్రశ్నలు
ప్రశ్న 1.
హాలోజన్ నీటి ద్వారా పోయినప్పుడు O2, O3 ల మిశ్రమాన్ని ఏర్పరుస్తుంది?
జవాబు:
ఫ్లోరిన్ నీటిగుండా పోయినప్పుడు O2, O3 ల మిశ్రమం ఏర్పడును.
3 F2 + 3 H2O → 6 HF + O3
2 F2 + 2 H2O → 4 HF + O2
ప్రశ్న 2.
అంతర హాలోజన్ సమ్మేళనాలకు, ఫ్లోరిన్ మినహా మిగిలిన అనుఘటక హాలోజన్ల కంటే ఎక్కువ చర్యాశీలత ఉంటుంది. వివరించండి.
జవాబు:
అంతర హాలోజన్ సమ్మేళనాలకు, ఫ్లోరిన్ మినహా మిగిలిన అనుఘటక హాలోజన్ల కంటే చర్యాశీలత ఉంటుంది. అంతర హాలోజన్లలో X – X’ బంధం హాలోజన్లలోని X – X బంధం కంటే బలహీనమైనది. (F – F బంధం తప్ప)
ప్రశ్న 3.
ClF3 ఉపయోగం ఏమిటి?
జవాబు:
ClF3 ముఖ్యమైన ఫ్లోరినేటింగ్ కారకం. దీనిని VF6 ని ఉత్పత్తి చేయుటలో ఉపయోగిస్తారు.
U + 3 ClF3 → UF6 +3 ClF
ప్రశ్న 4.
ClO2 రెండు ఉపయోగాలు రాయండి.
జవాబు:
ClO2 ఉపయోగాలు :
- ClO2 అధిక చర్యాశీలత గల ఆక్సీకరణి.
- వస్త్రాలకు, కాగిత గుజ్జుని విరంజనం చేయుటకు ఉపయోగిస్తారు.
- నీటిని శుద్ధి చేయుటకు ఉపయోగిస్తారు.
ప్రశ్న 5.
హాలోజన్లకు రంగులు ఎందుకున్నాయి?
జవాబు:
దృగ్గోచర ప్రాంతంలో వికిరణాలను శోషించుటవలన హాలోజన్లు రంగు ప్రదర్శిస్తాయి. దృగ్గోచర ప్రాంతంలో శోషించుటవలన బాహ్యకక్ష్య ఎలక్ట్రాన్లు పై శక్తి స్థాయిలకు ఉత్తేజితం అవుతాయి. హాలోజన్లు వివిధ క్వాంటం వికిరణాలను శోషించుకొని వివిధ రంగులను ప్రదర్శిస్తాయి.
![]()
ప్రశ్న 6.
నీటితో F2, Cl2 ల చర్యలు రాయండి. [TS. Mar.’17]
జవాబు:
ఫ్లోరిన్ నీటిగుండా పోయినప్పుడు O2, O3 ల మిశ్రమం ఏర్పడును.
3 F2 + 3 H2O → 6 HF + O3
2 F2 + 2 H2O → 4 HF + O2
క్లోరిన్, నీటితో చర్యజరిపి క్లోరిన్ జలమును ఏర్పరుచును. అప్పుడే తయారు చేయబడిన క్లోరిన్ జలంతో HCl మరియు HOCl అస్థిరమైన మరియు వియోగం చెంది నవజాత ఆక్సిజన్ ను ఏర్పరచును.
Cl2 + H2O → HCl + HOCl
ప్రశ్న 7.
ఏ తటస్థ అణువుతో ClO– సమ ఎలక్ట్రానికంగా ఉంటుంది? అది ఒక లూయీ క్షారమా? కాదా?
(సూచన : ClF; అవును)
జవాబు:
- ClO– అయాన్ CIF అణువుతో సమ ఎలక్ట్రానికంగా ఉంటుంది.
- అవును, ఇది లూయీ క్షారం. (ఎలక్ట్రాన్ జంట దాత)
ప్రశ్న 8.
క్రింది వాటిని ప్రతి సమితికి సూచించిన ధర్మం క్రమంలో అమర్చండి.
ఎ) F2, Cl2, Br2, I2 – బంధ విఘటన ఎంథాల్పీ పెరిగే క్రమం
బి) HE, HCl, HBr, HI – ఆమ్లత్వం పెరిగే క్రమం
సి) HF, HCl, HBr, HI – బాష్పీభవన స్థానాలు పెరిగే క్రమం
జవాబు:
ఎ) బంధ విఘటన ఎంథాల్పీ పెరిగే క్రమం
I2 < F2 < Br2 < Cl2
బి) ఆమ్లత్వం పెరిగే క్రమం
HF < HCl < HBr < HI
సి) బాష్పీభవన స్థానాలు పెరిగే క్రమం
HCl < HBr < HI < HF
ప్రశ్న 9.
ఎలక్ట్రాన్ గ్రాహ్య ఎంథాల్పీ క్లోరిన్ కంటే ఫ్లోరిన్క తక్కువ – వివరించండి.
జవాబు:
ఎలక్ట్రాన్ గ్రాహ్య ఎంథాల్ఫీ క్లోరిన్ కంటే ఫ్లోరిన్క తక్కువ.
వివరణ :
F పరమాణువు సైజు Cl కంటే తక్కువగా ఉంటుంది. ఈ చిన్న సైజు కారణంగా పరమాణువులోకి ప్రవేశించే ఎలక్ట్రాన్కు అంతకుముందే ఉన్న ఎలక్ట్రాన్ జంటలకు మధ్య వికర్షణ పెరుగుతుంది. అందువల్ల ఫ్లోరిన్ ఎలక్ట్రాన్ను గ్రహించి, ఫ్లోరైడ్గా మారే ప్రక్రియ తక్కువగా జరుగుతుంది.
ఈ కారణంగా F యొక్క ఎలక్ట్రాన్ ఎఫినిటి విలువ తరువాత ఉన్న Cl పరమాణువు కంటే చాలా తక్కువ.
ప్రశ్న 10.
HF ద్రవం కానీ HCl వాయువు వివరించండి.
జవాబు:
అంతరణు హైడ్రోజన్ బంధం కలిగి ఉండుట వలన HF ద్రవంగా ఉంటుంది. కానీ HCl లో అటువంటి బంధం ఏర్పడదు. అందువలన వాయువు.
ప్రశ్న 11.
బంధ విఘటన ఎంథాల్పీ Cl2 కంటే F2 కు తక్కువ. వివరించండి.
జవాబు:
బంధ విఘటన ఎంథాల్పీ Cl2 కంటే F2 కు తక్కువ.
వివరణ :
F2 అణువులో ఒంటరి ఎలక్ట్రాన్ జంటల మధ్య ఎలక్ట్రాన్ వికర్షణలు ఎక్కువగా ఉంటాయి. ఇవి క్లోరిన్లో ఉన్న ఒంటరి ఎలక్ట్రాన్ జంటల కన్నా దగ్గరగా ఉంటాయి.
![]()
ప్రశ్న 12.
ఆక్సిజన్ ధన ఆక్సీకరణ స్థితులను ప్రదర్శించే సమ్మేళనాల ఫార్ములాలు రాయండి. వాటిలో ఆక్సిజన్ ఆక్సీకరణ స్థితులు ఏమిటి?
జవాబు:
ఆక్సిజన్ ధన ఆక్సీకరణ స్థితి ప్రదర్శించే సమ్మేళనాలు OF2 మరియు O2F2.
- OF2 లో ఆక్సిజన్ ఆక్సీకరణ స్థితి + 2.
- O2F2 లో ఆక్సిజన్ ఆక్సీకరణ స్థితి + 1.
ప్రశ్న 13.
O2F2, I2O5 ల,ఉపయోగాలు ఏమిటి?
జవాబు:
O2F2 ఉపయోగాలు :
O2F2 ఫ్లోరినేటింగ్ కారకం. O2F2 ప్లూటోనియంను PUF6 గా ఆక్సీకరణం చేయును. ఈ చర్యను ఉపయోగించి న్యూక్లియర్ ఇంధన చర్యల్లోని అవశేష ఇంధనం నుంచి ప్లూటోనియంను PUF6 రూపంలో తొలగిస్తారు.
I2O5 ఉపయోగాలు :
I2O5 బలమైన ఆక్సీకరణి. దీనిని కార్బన్ మోనాక్సైడ్ను నిర్ణయించడానికి ఉపయోగిస్తారు.
ప్రశ్న 14.
హైడ్రోజన్ క్లోరైడ్ రెండు ఉపయోగాలు రాయండి.
జవాబు:
హైడ్రోజన్ క్లోరైడ్ ఉపయోగాలు:
- ఔషధాలలో, ప్రయోగశాలలో కారకంగా ఉపయోగిస్తారు.
- Cl2, NH4Cl మరియు గ్లూకోజ్ల తయారీలో ఉపయోగిస్తారు.
- ఎముకల నుండి జిగురును సంగ్రహించడానికి, ఎముకల బొగ్గును శుద్ధి చేయుటకు కారకంగా ఉపయోగిస్తారు.
ప్రశ్న 15.
NaOH తో Cl2 చర్యలు రాయండి.
జవాబు:
i) చల్లటి విలీన NaOH తో చర్య :
క్లోరిన్ చల్లటి విలీన NaOH తో చర్య జరిపి సోడియం హైపో క్లోరైట్ మరియు సోడియం క్లోరైడ్ ఏర్పడును.

ii) వేడి గాఢ NaOH తో చర్య :
క్లోరిన్ వేడి గాఢ NaOH తో చర్య జరిపి సోడియం క్లోరేట్ మరియు సోడియం క్లోరైడ్ను ఏర్పరచును.

ప్రశ్న 16.
అనార్ద్ర, తడి సున్నంతో Cl2 చర్య జరిపితే ఏమవుతుంది? [AP. Mar.’17; AP. Mar.’16]
జవాబు:
క్లోరిన్ అనార్ధ తడి సున్నంతో చర్య జరిపి విరంజన చూర్ణం (బ్లీచింగ్ పౌడర్) ఏర్పడును.
Ca(OH)2 + Cl2 → CaOCl2 + H2O
ప్రశ్న 17.
క్లోరిన్ ఆక్సీకరణిగా పనిచేస్తుంది – దీనిని రెండు ఉదాహరణలతో వివరించండి.
జవాబు:
క్లోరిన్ ఆక్సీకరణిగా పనిచేస్తుంది.
ఉదా – 1 : Cl2 అయొడిన్ను అయొడేట్గా ఆక్సీకరణం చేయును.
I2 + 6 H2O + 5 Cl2 → 2HIO3 + 10 HCI
ఉదా – 2 : Cl2 సోడియం సల్ఫైట్ను సోడియం సల్ఫేట్గా ఆక్సీకరణం చేయును.
Cl2 + Na2SO3 + H2O → Na2SO4 + 2 HCl
![]()
ప్రశ్న 18.
ద్రవరాజం (ఆక్వారీజియా) అంటే ఏమిటి? బంగారం, ప్లాటినమ్ తో దాని చర్యలు రాయండి.
జవాబు:
మూడు భాగాల గాఢ HCl, ఒక భాగం HNO3 కలిపితే ద్రవరాజం (ఆక్వారీజియా) ఏర్పడుతుంది. దీనిని బంగారం, ప్లాటినమ్లాంటి ఉత్కృష్ట లోహాలను కరిగించడానికి ఉపయోగిస్తారు.
బంగారంతో చర్య :
Au + 4H+ + NO–3 + 4Cl– → AuCl–4 + NO + 2H2O
ప్లాటినంతో చర్య :
3Pt + 16H+ + 4NO–3 + 18Cl– → 3PtCl-26 + 4NO + 8 H2O
ప్రశ్న 19.
డీకన్ పద్ధతి ద్వారా క్లోరిన్ ఎలా ఉత్పత్తి చేస్తారు? [AP. Mar.’17]
జవాబు:
డీకన్ పద్ధతి :
హైడ్రోజన్ క్లోరైడ్ వాయువును వాతావరణ ఆక్సిజన్తో CuCl2 ఉత్ప్రేరక సమక్షంలో 723 K వద్ద ఆక్సీకరణం చేయుట ద్వారా క్లోరిన్ను ఉత్పత్తి చేస్తారు.
![]()
ప్రశ్న 20.
తేమ సమక్షంలో మాత్రమే క్లోరిన్ విరంజనకారిగా పనిచేస్తుంది – వివరించండి.
జవాబు:
తేమ సమక్షంలో మాత్రమే క్లోరిన్ విరంజనకారిగా పని చేస్తుంది.
వివరణ :
ఆర్ద్ర క్లోరిన్ శక్తివంతమైన విరంజనకారి. ఈ విరంజన ధర్మం ఆక్సీకరణం వల్ల ఏర్పడినది.
Cl + H2O → 2HCl + (O)
ఉదా : రంగు గల పదార్థం + (O) → రంగులేని పదార్థం.
ప్రశ్న 21.
హైపోహాలస్ ఆమ్లాల ఆమ్లత్వం తగ్గే క్రమం HClO > HBrO >HIO గా ఉంటుంది. కారణం తెలపండి.
జవాబు:
హైపోహాలస్ ఆమ్లాల ఆమ్లత్వం తగ్గే క్రమం HClO > HBrO > HIO
కారణం :
ఇది ఈ క్రింది Ka విలువల ఆధారంగా నిర్ధారించబడును.
| ఆమ్లం | Ka-విలువ |
| HCIO | 3 × 10-8 |
| HBrO | 2.5 × 10-9 |
| HIO | 2.3 × 10-11 |
ప్రశ్న 22.
క్లోరిన్ ఆక్సోఆమ్లాల ఆమ్ల స్వభావం :
HOCl < HClO2 < HClO3 < HClO4 – వివరించండి.
(సూచన : ![]() సంయుగ్మ (కాంజుగేట్) క్షారం, A– స్థిరత్వం ఎంత ఎక్కువగా ఉంటే దాని క్షార బలం అంత తక్కువగా ఉంటుంది. అంటే HA కు H+ను విడుదల చేసే స్వభావం అంత ఎక్కువగా ఉంటుంది. మరొక విధంగా చెబితే HA ఆమ్ల బలం ఎక్కువ. క్లోరిన్ ఆక్సోఆమ్లాల సంయుగ్మ క్షారాల స్థిరత్వ క్రమం :
సంయుగ్మ (కాంజుగేట్) క్షారం, A– స్థిరత్వం ఎంత ఎక్కువగా ఉంటే దాని క్షార బలం అంత తక్కువగా ఉంటుంది. అంటే HA కు H+ను విడుదల చేసే స్వభావం అంత ఎక్కువగా ఉంటుంది. మరొక విధంగా చెబితే HA ఆమ్ల బలం ఎక్కువ. క్లోరిన్ ఆక్సోఆమ్లాల సంయుగ్మ క్షారాల స్థిరత్వ క్రమం :
OCl– < ClO–2 > ClO–3 > ClO–4
జవాబు:
![]()
సంయుగ్మ (కాంజుగేట్) క్షారం, A– స్థిరత్వం ఎంత ఎక్కువగా ఉంటే దాని క్షార బలం అంత తక్కువగా ఉంటుంది. అంటే HA కు H+ ను విడుదల చేసే స్వభావం అంత ఎక్కువగా ఉంటుంది. మరొక విధంగా చెబితే HA ఆమ్ల బలం ఎక్కువ. క్లోరిన్ ఆక్సోఆమ్లాల సంయుగ్మ క్షారాల స్థిరత్వ క్రమం : OCl– < ClO–2 > ClO–3 > ClO–4
![]()
ప్రశ్న 23.
అంతర హాలోజన్ సమ్మేళనాలు అంటే ఏమిటి? రెండు ఉదాహరణలు ఇవ్వండి.
జవాబు:
హాలోజన్ మూలకాలు వాటిలో అవి సంయోగం చెంది ఏర్పరచే ద్విగుణ డయా అయస్కాంత పదార్థాలను అంతర హాలోజన్ సమ్మేళనాలు అంటారు.
ఉదా : IF7, ClF3, BrF3, ClF, IF3 మొదలగునవి.
ప్రశ్న 24.
ClF3 నిర్మాణాన్ని వివరించండి.
జవాబు:
ClF3 నిర్మాణం :
→ ClF3 లో మధ్యస్థ పరమాణువు ‘Cl’.
→ ‘Cl’ యొక్క ఉద్రిక్తస్థాయి ఎలక్ట్రాన్ విన్యాసం
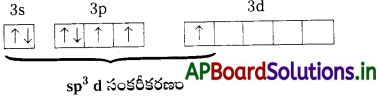
→ Cl పరమాణువు sp³d సంకరీకరణం చెందును.
→ ఇది వంచబడిన T-ఆకృతి (లేదా) రెండు స్థానాలు ఒంటరి ఎలక్ట్రాన్ జంటలతో ఆక్రమించబడిన ట్రైగోనల్ బైఫిరమిడల్ ఆకృతి.
ప్రశ్న 25.
OF2 ను ఆక్సిజన్ డైఫ్లోరైడ్ అనాలి కానీ ఫ్లోరిన్ ఆక్సైడ్ అని కాదు. ఎందుకు?
(సూచన : ఆక్సిజన్ కంటే ఫ్లోరిన్ రుణవిద్యుదాత్మకత ఎక్కువ)
జవాబు:
OF2 ను ఆక్సిజన్ డై ఫ్లోరైడ్ అనాలి. కానీ ఫ్లోరిక్ ఆక్సైడ్ అని కాదు.
ఆక్సిజన్ మరియు ఫ్లోరిన్ చర్య జరిపినపుడు ఏర్పడే ద్విగుణ సమ్మేళనాలను ఆక్సిజన్ ఫ్లోరైడ్లు అని పిలుస్తారు. దీనికి కారణం ఫ్లోరిన్ యొక్క ఋణవిద్యుదాత్మకత ఆక్సిజన్ కన్నా ఎక్కువ.
ప్రశ్న 26.
అయొడిన్ నీటిలో కంటే KI లో ఎక్కువగా కరుగుతుంది. వివరించండి.
(సూచన : అయొడిన్ KI తో సంయోగం చెంది నీటిలో కరిగే KI, సంక్లిష్టాన్ని ఏర్పరుస్తుంది.)
జవాబు:
అయొడిన్ నీటిలో కన్నా KI లో ఎక్కువ కరుగును.
కారణం :
- అయొడిన్, KI తో సంయోగం చెంది కరిగే సంక్లిష్టం KI3 ని ఏర్పరచును.
KI + I2 → KI3 - అయొడిన్ నీటిలో కరుగదు. దీనికి కారణం ధనాత్మక స్వేచ్ఛా శక్తి మార్పు (+ ∆G).
ప్రశ్న 27.
హాలోజన్ల హైడ్రైడ్రలో –
a) ఏది ఎక్కువ స్థిరమైనది?
b) ఏది బలమైన ఆమ్లం?
c) దేనికి కనిష్ఠ బాష్పీభవన స్థానం ఉంటుంది?
జవాబు:
a) హాలోజన్ హైడ్రైడ్లలో ఎక్కువ స్థిరమైనది HF.
b) హాలోజన్ హైడ్రైడ్లలో బలమైన ఆమ్లం HI.
c) హాలోజన్ హైడ్రైడ్రలో కనిష్ఠ బాష్పీభవన స్థానం కలది HCl (189K).
ప్రశ్న 28.
Cl2, SO2 ల విరంజన క్రియలను పోల్చండి.
జవాబు:
తేమ సమక్షంలో మాత్రమే క్లోరిన్ విరంజనకారిగా పని చేస్తుంది.
వివరణ :
ఆర్ద్ర క్లోరిన్ శక్తివంతమైన విరంజనకారి. ఈ విరంజన ధర్మం ఆక్సీకరణం వల్ల ఏర్పడినది.
Cl2 + H2O → 2HCl + (O)
ఉదా : రంగు గల పదార్థం + (O) → రంగులేని పదార్థం.
- కూరగాయలను, కర్బన పదార్థాలను తేమ సమక్షంలో విరంజనం చేస్తుంది. దీని విఠంజన ప్రభావం శాశ్వతమైనది.
- తేమ సమక్షంలో SO, విరంజనకారిగా పని చేయును.
SO2 + 2 H2O → H2SO4 + 2[H]
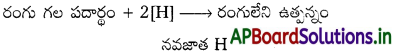
- SO2 ఊలు, సిల్క్ను విరంజనం చేయును.
ప్రశ్న 29.
క్రింది వాటిలో హాలోజన్ల ఆక్సీకరణ స్థితులను ఇవ్వండి.
ఎ) Cl2O
బి) ClO–2
సి) KBrO3
డి) NaClO4
జవాబు:
ఎ) Cl2O :
2x – 2 = 0
x = + 1
Cl2O యొక్క ఆక్సీకరణ స్థితి + 1.
బి) ClO–2:
x + 2(−2) = -1
x = – 1 + 4 = + 3
సి) KBrO3:
1 + x + 3(−2) = 0
= +5
డి) NaClO4
1 + x + 4(−2) = 0
x = + 7
ప్రశ్న 30.
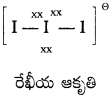
I–3; అణు ఆకృతిని వర్ణించండి.
(సూచన : కేంద్ర అయొడిన్ సంకరీకరణం sp³d – రేఖీయం)
జవాబు:
- ట్రై అయొడైడ్ అయాన్లో అయొడిన్ పరమాణువు sp³ d సంకరీకరణం చెందును.
- దీనిలో రెండు బంధ ఎలక్ట్రాన్ జంటలు రెండు ఒంటరి ఎలక్ట్రాన్ జంటలు ఉంటాయి.
- VSEPR సిద్ధాంతం ప్రకారం దీని ఆకృతి రేఖీయ ఆకృతి.
స్వల్ప సమాధాన ప్రశ్నలు
ప్రశ్న 1.
HCl నుంచి Cl2ను, Cl2 నుంచి HCl ను ఎలా తయారుచేస్తారు? చర్యలు రాయండి.
జవాబు:
i) HCl నుండి CL, తయారీ :
MnO2 ను గాఢ HCl తో వేడిచేయగా Cl2 వాయువు విడుదలగును.
MnO2+ 4 HCl → MnCl2 + Cl2 + 2 H2O
ఆర్ద్ర క్లోరిన్ శక్తివంతమైన విరంజనకారి. ఈ విరంజన ధర్మం ఆక్సీకరణం వల్ల ఏర్పడినది.
Cl2 + H2O → 2HCl + (O)
ఉదా : రంగు గల పదార్థం + (O) → రంగులేని పదార్థం.
![]()
ii) Cl2 నుండి HCl తయారీ :
Cl2, H2 తో చర్య జరిపి HCl ఏర్పరచును.
H2(వా) + Cl2(వా) → 2HCl(వా)
ప్రశ్న 2.
క్రింది వాటికి తుల్య రసాయనిక సమీకరణాలు రాయండి.
ఎ) MnO2, గాఢ H2SO4 సమక్షంలో NaCl ను వేడిచేయడం.
బి) Nal జల ద్రావణం గుండా క్లోరిన్ పంపించడం.
జవాబు:
ఎ) MnO2, గాఢ H2SO4 సమక్షంలో NaCl వేడి చేయడం ద్వారా Cl2 వాయువు వెలువడును.
4 NaCl + MnO2 + 4 H2SO4 → MnCl2 + 4 NaHSO4 + 2 H2O + Cl2
బి) Nal జలద్రావణం గుండా క్లోరిన్ పంపినప్పుడు జేగురు రంగు ఏర్పడును.
Cl2 + 2 Nal → 2 NaCl + I2
![]()
ప్రశ్న 3.
ఎ) BrF5, బి) IF7 నిర్మాణాలను వివరించండి.
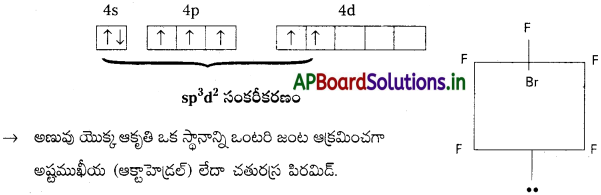
ఎ) BrF5 నిర్మాణం :
→ BrF5 లో మధ్యస్థ పరమాణువు ‘Br’.
→ ‘Br’ పరమాణువు రెండవ ఉద్రిక్త స్థాయిలో sp³d² సంకరీకరణం చెందును.
బి) IF7 నిర్మాణం :
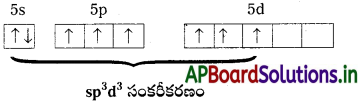
- IF7లో మధ్యస్థ పరమాణువు ‘I’.
- ‘I’ పరమాణువు మూడవ ఉద్రిక్త స్థాయిలో sp³d³ సంకరీకరణం చెందును.
- అణువు యొక్క ఆకృతి పెంటాగోనల్ బై పిరమిడల్.
ప్రశ్న 4.
హాలోజన్ల హైడ్రైడ్లపై లఘువ్యాఖ్య రాయండి.
జవాబు:
హాలోజన్ హైడ్రైడ్లు ఏర్పడుట :

- ఇవి నీటిలో కరిగి హైడ్రోహాలిక్ ఆమ్లాలను ఏర్పరుస్తాయి.
- బాష్పీభవన స్థానాలు
HF – 293 K
HCI – 189K
HBr – 206 K
HI – 238 K - ఆమ్లత్వం పెరిగే క్రమం
HF > HCl > HBr > HI - బాష్పీభవన స్థానాలు పెరిగే క్రమం .
HCl < HBr < HI < HF
ప్రశ్న 5.
ప్రయోగశాలలో క్లోరిన్ ను ఎలా పొందుతారు? అది క్రిందివాటితో ఎలా చర్య జరుపుతుంది? [TS. Mar.’16; TS. Mar.’15]
ఎ) చల్లని, విలీన NaOH బి) అధిక NH3 సి) KI
జవాబు:
HCl నుండి Cl2 తయారీ :
MnO2 ను గాఢ HCl తో వేడిచేయగా Cl2 వాయువు విడుదలగును.
MnO2 + 4 HCl → MnCl2 + Cl2 + 2 H2O
ఆర్ద్ర క్లోరిస్ శక్తివంతమైన విరంజనకారి. ఈ విరంజన ధర్మం ఆక్సీకరణం వల్ల ఏర్పడినది.
Cl2 + H2O → 2HCl + (O)
ఉదా : రంగు గల పదార్థం + (O) → రంగులేని పదార్థం.
![]()
ఎ) క్లోరిన్ చల్లటి విలీన NaOH తో చర్య జరిపి సోడియం హైపో క్లోరైట్ మరియు సోడియం క్లోరైడ్ ఏర్పడును.

బి) క్లోరిన్, అధిక NH3 తో చర్య జరిపి, నైట్రోజన్ మరియు NH4Cl ను ఏర్పరచును.
8 NH3 + 3 Cl2 → 6 NH4Cl + N2 ↑
సి) Cl2, KIతో చర్య జరిపి I2 ను విడుదల చేయును.
Cl2 + 2 KI → KCl + I2 ↑
ప్రశ్న 6.
అంతర హాలోజన్ సమ్మేళనాలు అంటే ఏమిటి? నిర్వచనాన్ని చిత్రించడానికి (illustrate) ఉదాహరణలు ఇవ్వండి. వాటిని ఎలా వర్గీకరిస్తారు?
జవాబు:
హాలోజన్ మూలకాలు వాటిలో అవి సంయోగం చెంది ఏర్పరచే ద్విగుణ డయా అయస్కాంత పదార్థాలను అంతర హాలోజన్ సమ్మేళనాలు అంటారు.
ఉదా : IF7, ClF3, BrF3, ClF, IF3 మొదలగునవి.
అంతర హాలోజన్ సమ్మేళనాలు నాలుగు రకాలుగా వర్గీకరించారు.
1) AX – రకం : ఉదా : ClF, BrF
2) AX3 – రకం : ఉదా : ClF3, BrF3
3) AX5 – రకం : ఉదా : ClF5, BrF5
4) AX7 – రకం : ఉదా : IF7
→ ‘A’ = తక్కువ ఋణవిద్యుదాత్మక మూలకం.
→ X = ఎక్కువ ఋణవిద్యుదాత్మక మూలకం.
దీర్ఘ సమాధాన ప్రశ్నలు
ప్రశ్న 1.
ClF3 ఎలా తయారుచేస్తారు? నీటితో ఇది ఎలా చర్య జరుపుతుంది? దాని నిర్మాణాన్ని వివరించండి.
జవాబు:
ClF3 తయారీ :
క్లోరిన్, అధిక Fతో చర్య జరిపి ClF3 ని ఏర్పరచును.

నీటితో చర్య :
ClF3 నీటితో విస్ఫోటన చర్య జరిపి నీటిని ఆక్సీకరణం చేయుట ద్వారా ఆక్సిజన్ లేదా తక్కువ పరిమాణంలో OF మరియు HF, HCl లను ఏర్పరచును.
ClF3 + 2H2O → 3 HF + HCl + O2
ClF3 + H2O → HF + HCl + OF2
ClF3 నిర్మాణం :
→ ClF3 లో మధ్యస్థ పరమాణువు ‘Cl’.
→ ‘Cl’ యొక్క ఉద్రిక్తస్థాయి ఎలక్ట్రాన్ విన్యాసం.
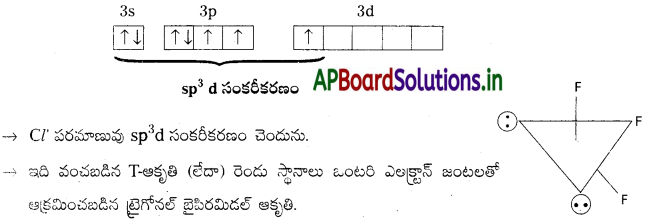
ప్రశ్న 2.
ప్రయోగశాలలో క్లోరిన్ ఎలా తయారుచేస్తారు? క్రిందివాటితో అది ఎలా చర్య జరుపుతుంది? [TS. Mar. 16; TS. Mar. 16]
ఎ) ఐరన్
బి) వేడి, గాఢ NaOH
సి) ఆమ్లీకృత FeSO4
డి) అయొడిన్
ఇ) H2S
ఎఫ్) Na2S2O3
జవాబు:
HCl నుండి Cl2 తయారీ :
MnO2 ను గాఢ HCl తో వేడిచేయగా Cl2 వాయువు విడుదలగును.
MnO2 + 4 HCl → MnCl2 + Cl2 + 2 H2O
ఆర్ద్ర క్లోరిన్ శక్తివంతమైన విరంజనకారి. ఈ విరంజన ధర్మం ఆక్సీకరణం వల్ల ఏర్పడినది.
Cl2 + H2O → 2HCl + (O)
ఉదా : రంగు గల పదార్థం + (O) → రంగులేని పదార్థం.
![]()
ఎ) Cl2 ఐరన్తో చర్య జరిపి FeCl3 ని ఏర్పరచును.
2 Fe + 3Cl2 → 2 FeCl3
బి) క్లోరిన్ వేడి గాఢ NaOH తో చర్య జరిపి సోడియం క్లోరేట్ మరియు సోడియం క్లోరైడ్ న్ను ఏర్పరచును.

సి) Cl2తో ఆమ్లీకృత FeSO4 చర్య జరిపి ఫెర్రిక్ అయాన్లు ఏర్పడును.
2 FeSO4 + H2SO4 + Cl2 → Fe2(SO4)3 + 2 HCl
డి) Cl2 తో అయొడిన్ చర్య జరిపి ICl ను ఏర్పరచును.
I2 + Cl2 → 2 ICl
ఇ) Cl2 తో H2S చర్య జరిపి HCl మరియు ‘S’ ఏర్పడును.
Cl2 + H2S → 2 HCl + S
ఎఫ్) Cl2 తో Na2S2O3 చర్య జరిపి ‘S’ అవక్షేపం ఏర్పడును.
Na2S2O3 + Cl2 + H2O → Na2SO4 + 2 HCl + S
![]()
ప్రశ్న 3.
ఫ్లోరిన్ అసంగత ప్రవర్తనను చర్చించండి.
జవాబు:
ఫ్లోరిన్ అసంగత ప్రవర్తన : హాలోజన్లలో మొట్టమొదటి మూలకమైన ఫ్లోరిన్ గణనీయంగా మిగతా హాలోజన్ల కంటే భిన్నత్వాన్ని కలిగి ఉంటుంది. ఈ క్రింది కారణాల వలన అసంగత ప్రవర్తనను వివరించవచ్చు.
- Fకు అల్ప పరమాణు పరిమాణం కలిగి ఉంటుంది.
- F కు అధిక ఋణవిద్యుదాత్మకత కలిగి ఉంటుంది.
- F- లో d-ఆర్బిటాళ్ళు లేకపోవుట వలన.
- F- లోని ఉపాంత కర్పరంలో రెండు ఎలక్ట్రాన్లు మాత్రమే కలవు. మిగతా హాలోజన్లలో 8-ఎలక్ట్రాన్లు కలవు.
F2 యొక్క కొన్ని అసంగత ధర్మాలు ఈ క్రింద ఇవ్వబడ్డాయి.
- ఫ్లోరిన్ – I ఆక్సీకరణ స్థితి ప్రదర్శిస్తుంది. అధిక ఋణవిద్యుదాత్మకత వలన ఇంక ఇతర ఆక్సీకరణ స్థితులను ప్రదర్శించదు.
- HF – హైడ్రోజన్ బంధాలను ఏర్పరుచును. HF, HF–2 అయాన్ ఏర్పరుచును. మిగిలిన హాలోజన్లు ఈ అయాన్. ఏర్పరచవు.
- F- కార్బన్తో సంయోగం చెందును. ఇతర హాలోజన్లు ప్రత్యేక పరిస్థితులలో కూడా చర్య జరుపవు.
- F2 కు Cl2 కంటే తక్కువ ఎలక్ట్రాన్ ఎఫినిటీ కలిగి ఉన్నది.
- హాలైడ్లన్నిటిలో ఫ్లోరైడ్లను అధిక అయానిక స్వభావం కలిగి ఉండును.
ఉదా : AlF3 అయానిక సమ్మేళనం, AlCl3 సంయోజనీయ సమ్మేళనం.
ప్రశ్న 4.
విద్యుద్విశ్లేషణ పద్ధతి ద్వారా క్లోరిన్ న్ను ఎలా తయారుచేస్తారు? దాని చర్యను ఎ) NaOH, బి) NH3 తో వివిధ పరిస్థితులలో వివరించండి. [AP. Mar.’16; AP. Mar.’15]
జవాబు:
విద్యుద్విశ్లేషణ పద్ధతి ద్వారా క్లోరిన్ తయారీ :
బ్రైన్ ద్రావణాన్ని విద్యుద్విశ్లేషణ చేయగా ఆనోడ్ వద్ద క్లోరిన్ ఏర్పడును.
2 NaCl → 2 Na– + 2Cl–
2 H2O + 2e– → 2 OH– + H2 (కాథోడ్)
2 Cl– → Cl2 + 2e– (ఆనోడ్)
ఎ) i) NaOH :
క్లోరిన్ చల్లటి విలీన NaOH తో చర్య జరిపి సోడియం హైపో క్లోరైట్ మరియు సోడియం క్లోరైడ్ ఏర్పడును.
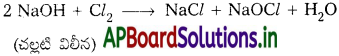
ii) NaOH :
క్లోరిన్ వేడి గాఢ NaOH తో చర్య జరిపి సోడియం క్లోరేట్ మరియు సోడియం క్లోరైడ్ను ఏర్పరచును.

బి) i) క్లోరిన్, అధిక NH3 తో చర్య జరిపి, నైట్రోజన్ మరియు NH4Cl ను ఏర్పరచును.
8 NH3 + 3 Cl2 → 6 NH4Cl + N2 ↑
ii) NH3, అధిక Cl2 తో చర్య జరిపి NCl3 మరియు HCl ఏర్పరచును.
NH3 + 3 Cl2 → NCl3 + 3HCl
![]()
ప్రశ్న 5.
క్లోరిన్ ఆక్సో ఆమ్లాల పేర్లు, నిర్మాణాలు రాయండి. వాటి నిర్మాణాలను, సాపేక్ష ఆమ్ల స్వభావాన్ని వివరించండి.
జవాబు:
క్లోరిన్ కు నాలుగు శ్రేణుల ఆక్సీ ఆమ్లాలు ఉన్నాయి. అవి : HOCl, HClO2, HClO3, HClO4. వీటిలో క్లోరిన్ వరుసగా .+1, +3, +5, +7 ఆక్సీకరణ సంఖ్యలను కల్గి ఉంటుంది.
హైపోక్లోరస్ ఆమ్లం (HClO) :
అప్పుడే తయారుచేసిన పసుపుపచ్చని మెర్క్యురిక్ ఆక్సైడ్ను క్లోరిన్ ద్రావణంలో కలిపి బాగా కలియబెట్టి హైపోక్లోరస్ ఆమ్లాన్ని తయారుచేస్తారు.
2 Cl2 + H2O + 2 HgO → 2 HClO + HgO + HgCl2
హైపోక్లోరస్ ఆమ్లంలో ClO– అయాన్ ఉంటుంది. దీనిలో Cl, sp³ సంకరీకరణంలో ఉంటుంది.
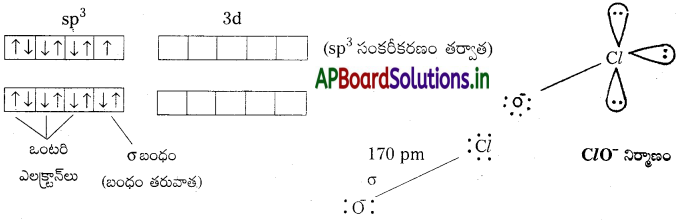
క్లోరస్ ఆమ్లం (HClO2) :
ఈ ఆమ్లంలో ఆనయాన్ ClO–2. ఇది ‘V’ ఆకృతిలో ఉంటుంది. ఇందులో క్లోరిన్ sp³ సంకరీకరణంలో ఉంటుంది. ఉద్రిక్తత చెందిన క్లోరిన్ sp³ సంకరీకరణం చెంది, ఒక ఎలక్ట్రాన్ d – ఆర్బిటాల్లోకి ప్రవేశిస్తుంది. క్లోరిన్ సంకర ఆర్బిటాల్లోని ఒంటరి ఎలక్ట్రాన్లు, రెండు ఆక్సిజన్లలోని ఒంటరి p ఎలక్ట్రాన్లతో బంధాలు ఏర్పరుస్తాయి. Cl కు చెందిన 3d ఆర్బిటాల్లోని ఒంటరి ఎలక్ట్రాన్, ఆక్సిజన్లోని ఒక p-ఆర్బిటాల్లోని ఎలక్ట్రాన్లతో బంధం (dπ-pπ)ను ఏర్పరుస్తుంది.
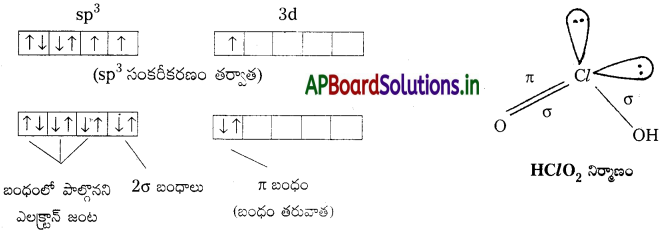
క్లోరిక్ ఆమ్లం నిర్మాణం (HClO3):
ఈ ఆమ్లంలో ఆనయాన్ ClO–3 ఇది పిరమిడ్ ఆకృతి కలిగి ఉంటుంది. ClO–3 లో Cl, sp³ సంకరీకరణంలో ఉంటుంది. d- ఆర్బిటాల్లోని ఒంటరి ఎలక్ట్రాన్లు రెండు ఆక్సిజన్ పరమాణువులలోని p -ఎలక్ట్రాన్లతో (dπ – pπ) బంధాలను ఏర్పరుస్తాయి. Cl పరమాణువుపై ఒక ఎలక్ట్రాన్ జంట ఉంది.
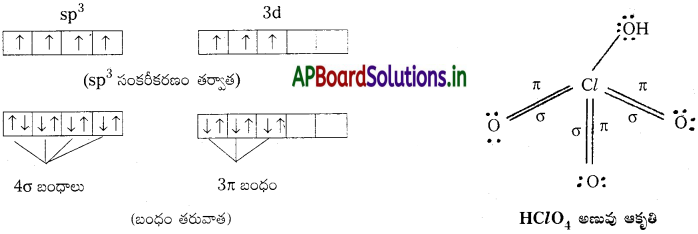
పెర్క్లోరిక్ ఆమ్లం నిర్మాణం (HClO4) :
ఈ ఆమ్లంలో ఆనయాన్ ClO–4. ఇందులో క్లోరిన్ sp³ సంకరీకరణం చెంది ఉంటుంది. అట్లేర్పడ్డ సంకర ఆర్బిటాల్లలో ఒక్కొక్కదానిలో ఒక్కొక్క ఒంటరి ఎలక్ట్రాన్ ఉంటుంది. నాలుగు ఎలక్ట్రాన్లు 4 ఆక్సిజన్ పరమాణువులతో 4σ బంధాలను ఏర్పరుస్తాయి. వీటితోపాటు d ఆర్బిటాల్లోని 3 ఎలక్ట్రాన్లు, 3 ఆక్సిజన్ పరమాణువులతో 3π (dπ – pπ) బంధాలను ఏర్పరుస్తాయి.
![]()
సంయుగ్మ (కాంజుగేట్) క్షారం, A స్థిరత్వం ఎంత ఎక్కువగా ఉంటే దాని క్షార బలం అంత తక్కువగా ఉంటుంది. అంటే HA కు H+ను విడుదల చేసే స్వభావం అంత ఎక్కువగా ఉంటుంది. మరొక విధంగా చెబితే HA ఆమ్ల బలం ఎక్కువ. క్లోరిన్ ఆక్సోఆమ్లాల సంయుగ్మ క్షారాల స్థిరత్వ క్రమం : OCl– < ClO–2 > ClO–3 > ClO–4
సాధించిన సమస్యలు Textual Examples
ప్రశ్న 1.
ఆవర్తన పట్టికలోని సంబంధిత పీరియడ్లలో హాలోజన్లకు గరిష్ఠ రుణ ఎలక్ట్రాన్ గ్రాహ్య ఎంథాల్పీ ఉంది. ఎందుకు?
సాధన:
సంబంధిత పీరియడ్లలో హాలోజన్లకు కనిష్ఠ పరిమాణం ఉండటం కారణంగా ప్రాభావిక కేంద్రకావేశం గరిష్ఠంగా ఉంటుంది. అందునల్ల అవి ఒక ఎలక్ట్రాన్ను తేలికగా గ్రహించి ఉత్కృష్ట వాయు ఎలక్ట్రాన్ విన్యాసాన్ని పొందుతాయి.
ప్రశ్న 2.
ఫ్లోరిన్ ఎలక్ట్రాన్ గ్రాహ్య ఎంథాల్పీ విలువ క్లోరిన్ విలువ కంటే తక్కువ అయినప్పటికీ క్లోరిన్ కంటే ఫ్లోరిన్ బలమైన ఆక్సీకరణిగా ఉంది. ఎందుకు?
సాధన:
- F- F బంధం అల్ప విఘటన ఎంథాల్పీ
- F అధిక హైడ్రేషన్ ఎంథాల్పీ విలువలు దీనికి కారణం.
![]()
ప్రశ్న 3.
ఫ్లోరిన్ కేవలం – 1 ఆక్సీకరణ స్థితిని మాత్రమే ప్రదర్శిస్తుంది. కానీ ఇతర హాలోజన్లు +1, +3, +5, +7, ఆక్సీకరణస్థితులను కూడా ప్రదర్శిస్తాయి. వివరించండి.
సాధన:
ఫ్లోరిన్ అత్యధిక రుణవిద్యుదాత్మకత గల మూలకం కాబట్టి ధన ఆక్సీకరణ సంఖ్యలను ప్రదర్శించదు. ఇతర హాలోజన్లలో d ఆర్బిటాళ్లు ఉండటం కారణంగా అవి ఎలక్ట్రాన్ అష్టకాన్ని విస్తరించుకుని +1, +3, +5, +7 ఆక్సీకరణస్థితులను కూడా ప్రదర్శిస్తాయి.
ప్రశ్న 4.
వేడి, గాఢ NaOH తో Cl2 జరిపే చర్యకు తుల్య రసాయన సమీకరణం వ్రాయండి. దీనిని అననుపాత చర్య అనవచ్చా? సమర్ధించండి.
సాధన:
3Cl2 + 6NaOH → 5NaCl + NaClO3 + 3 H2O
అవును, క్లోరిన్ ఆక్సీకరణస్థితి సున్నా నుంచి -1, +5 కు మారింది.
ప్రశ్న 5.
సూక్ష్మ విభాజిత ఐరన్ లోహంతో HCl చర్య జరిపినప్పుడు ఫెర్రస్ క్లోరైడ్ ఏర్పడుతుంది. కానీ ఫెర్రిక్ క్లోరైడ్ ఏర్పడదు. ఎందుకు?
సాధన:
ఐరన్ లోహంతో HCl చర్య జరిపినప్పుడు H2 ఏర్పడుతుంది.
Fe + 2HCl → FeCl2 + H2
చర్యలో విడుదలయిన హైడ్రోజన్ ఫెర్రిక్ క్లోరైడ్ ఏర్పడటాన్ని నిరోధిస్తుంది.
ప్రశ్న 6.
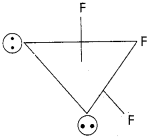
VSEPR సిద్ధాంతం ద్వారా BrF3 అణు ఆకృతిని చర్చించండి.
సాధన:
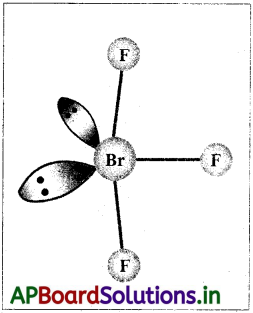
కేంద్ర పరమాణువు Br వేలెన్స్ కర్పరంలో ఏడు ఎలక్ట్రాన్లు ఉన్నాయి. వీటిలో మూడు ఎలక్ట్రాన్లు మూడు ఫ్లోరిన్ పరమాణువులతో బంధ ఎలక్ట్రాన్ జంటలను ఏర్పరుస్తాయి, ఇంకా నాలుగు ఎలక్ట్రాన్లు ఉంటాయి. అంటే 3 బంధ జంటలు 2 ఒంటరి జంటలు ఉంటాయి. VSEPR సిద్ధాంతం ప్రకారం ఇవి త్రికోణీయ బై పిరమిడ్ మూలలను ఆక్రమిస్తాయి. బంధజత – బంధజత వికర్షణల కంటే ఎక్కువగా ఉండే ఒంటరి జంట – ఒంటరి జంట వికర్షణలను కనిష్ఠంగా ఉంచడానికి రెండు ఒంటరి జంటలు ఈక్వటోరియల్ స్థానాలను ఆక్రమిస్తాయి. అంతేకాకుండా అక్షీయ (ఏక్సియల్) స్థానంలో ఉన్న ఫ్లోరిన్ పరమాణువులు ఈక్వటోరియల్ స్థానంలో ఉన్న ఫ్లోరిన్ వైపుగా వంగి ఒంటరి
జంట – ఒంటరి జంట వికర్షణలను కనిష్ఠంగా ఉంచడానికి ప్రయత్నిస్తాయి. కాబట్టి ఆకృతి కొద్దిగా వంగిన T లాగా ఉంటుంది.
పాఠ్యాంశ ప్రశ్నలు Intext Questions
ప్రశ్న 1.
బంధ విఘటన ఎంథాల్పీ, ఎలక్ట్రాన్ గ్రాహ్య ఎంథాల్పీ, హైడ్రేషన్ ఎంథాల్పీ లాంటి పరామితులను ఆధారంగా చేసుకుని F2, Cl2 ల ఆక్సీకరణ సామర్ధ్యాలను పోల్చండి.
జవాబు:
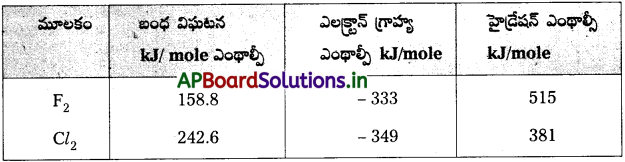
పై విలువల ఆధారంగా ఫ్లోరిన్, క్లోరిన్ కంటే బలమైన ఆక్సీకరణి అని తెలుస్తుంది.
ప్రశ్న 2.
ఫ్లోరిన్ అసంగత ప్రవర్తనను తెలిపే రెండు ఉదాహరణలు ఇవ్వండి.
జవాబు:
- F- కార్బన్తో సంయోగం చెందును. ఇతర హాలోజన్లు ప్రత్యేక పరిస్థితులలో కూడా చర్య జరుపవు.
- F2 కు Cl2 కంటే తక్కువ ఎలక్ట్రాన్ ఎఫినిటీ కలిగి ఉన్నది.
ప్రశ్న 3.
కొన్ని హాలోజన్లను సముద్రం ఒక గొప్ప ఉత్పత్తి స్థానం. వ్యాఖ్యానించండి.
జవాబు:
సముద్రపు నీటిలో Na, K, Mg మరియు Ca – ల క్లోరైడ్లు, బ్రోమైడ్లు మరియు అయోడైడ్లు ఎక్కువగా ఉంటాయి. సముద్రం నీటిలో NaCl – 2.5% ఉంటుంది. కావున సముద్రపు నీరు హాలోజన్లకు గొప్ప ఉత్పత్తి స్థానం.
ప్రశ్న 4.
Cl2 విరంజన క్రియకు కారణం తెలపండి.
జవాబు:
తేమ సమక్షంలో మాత్రమే క్లోరిన్ విరంజనకారిగా పని చేస్తుంది.
వివరణ : ఆర్ద్ర క్లోరిన్ శక్తివంతమైన విరంజనకారి. ఈ విరంజక ధర్మం ఆక్సీకరణం వల్ల ఏర్పడినది.
C2 + H2O → 2HCl + (O)
ఉదా : రంగు గల పదార్థం + (O) → రంగులేని పదార్థం.
![]()
ప్రశ్న 5.
క్లోరిన్ వాయువు నుంచి తయారుచేసే రెండు విష వాయువుల పేర్లు తెలపండి.
జవాబు:
- ఫాన్
- టిమర్ గ్యాస్ (బాష్ప వాయువు) CCl3NO2
- మస్టర్డ్ గ్యాస్ (ClCH2CH2S – CH2 – CH2 – Cl3)
ప్రశ్న 6.
I2 కంటే ICZ చర్యాశీలత ఎందుకు ఎక్కువ ?
జవాబు:
సాధారణంగా హాలోజన్ల కంటే అంతర హాలోజన్ సమ్మేళనాలకు ఎక్కువ చర్యాశీలత ఉంటుంది, ఎందుకంటే X – X బంధం కంటే X – X¹ బంధం బలహీనమైనది. అందువల్ల I2 కంటే ICl కు ఎక్కువ చర్యాశీలత ఉంటుంది.