Andhra Pradesh BIEAP AP Inter 2nd Year Chemistry Study Material Lesson 6(b) 16వ గ్రూపు మూలకాలు Textbook Questions and Answers.
AP Inter 2nd Year Chemistry Study Material Lesson 6(b) 16వ గ్రూపు మూలకాలు
అతిస్వల్ప సమాధాన ప్రశ్నలు
ప్రశ్న 1.
డై ఆక్సిజన్ వాయువు, కాని సల్ఫర్ ఘన పదార్థం. ఎందువల్ల?
జవాబు:
డై ఆక్సిజన్ వాయువు, కానీ సల్ఫర్ ఘన పదార్థం.
వివరణ :
ఆక్సిజన్ తక్కువ పరమాణు పరిమాణం, అధిక ఋణ విద్యుదాత్మకత కలిగి ఉండుట వలన Pπ – Pπ బహు బంధాన్ని ఏర్పరచి O2 అణువుగా ఏర్పడును. O2 అణువులో ఆక్సిజన్ పరమాణువులు మధ్య బలహీన వాండర్వాల్ బలాలు కలిగి ఉంటాయి. కావున ఆక్సిజన్ గది ఉష్ణోగ్రత వద్ద వాయువు.
సల్ఫర్ ఎక్కువ పరమాణు పరిమాణం, తక్కువ ఋణ విద్యుదాత్మకత కలిగి ఉండుట వలన S-S ఏకబంధాలను ఏర్పరచి S8 అణువుగా ఏర్పడును. S8 వలయం ముడతలు పడిన కిరీటం ఆకృతి కలిగి ఉంటుంది. కావున సల్ఫర్ గది ఉష్ణోగ్రత వద్ద ఘన పదార్థం.
ప్రశ్న 2.
ఈ క్రింది చర్యల్లో ఏం జరుగుతుంది?
a) KClO3 కి MnO2 ని కలిపి వేడిచేస్తే
b) KI ద్రావణం గుండా O3 ని పంపిస్తే
జవాబు:
ఎ) KClO3కి MnO2 కలిపి వేడిచేస్తే ఆక్సిజన్ వాయువు వెలువడును.
![]()
బి) KI ద్రావణం గుండా O3 ని పంపితే 12 వెలువడును.
2KI + O3 + H2O → 2KOH + I2 + 2O2
ప్రశ్న 3.
ద్విస్వభావక ఆక్సైడ్లకు, తటస్థ ఆక్సైడ్లకు ఒక్కోదానికి రెండు ఉదాహరణలు ఇవ్వండి.
జవాబు:
- ద్విస్వభావక ఆక్సైడ్లకు ఉదాహరణలు – Al2O3, SiO2, PbO.
- తటస్థ ఆక్సైడ్ కు ఉదాహరణలు – CO, NO మరియు N2O.
ప్రశ్న 4.
సాధారణంగా ఆక్సిజన్ ‘-2’ ఆక్సీకరణ స్థితిని మాత్రమే ప్రదర్శిస్తుంది. అయితే గ్రూపులోని ఇతర మూలకాలు +2, +4 +6 ఆక్సీకరణ స్థితులను కూడా చూపిస్తాయి – వివరించండి.
జవాబు:
- ఆక్సిజన్కు అధిక ఋణ విద్యుదాత్మకత కలిగి ఉండుట వలన -2 ఆక్సీకరణ స్థితిని ప్రదర్శిస్తుంది. ఈ సామర్థ్యం గ్రూపులో క్రిందికి పోయిన కొలది తగ్గును.
- గ్రూపులో క్రిందికి పోయిన కొలది ఋణ విద్యుదాత్మకత తగ్గుట వలన మిగిలిన మూలకాలు +2, +4 మరియు +6 ఆక్సీకరణ స్థితులు ప్రదర్శిస్తాయి.
ప్రశ్న 5.
ఆక్సిజన్ ‘–2’ కంటే భిన్న ఆక్సీకరణ స్థితిని చూపే ఏవేని రెండు సమ్మేళనాలను రాయండి. ఆ సమ్మేళనాలలో ఆక్సిజన్ ఆక్సీకరణ స్థితిని తెలపండి.
జవాబు:
OF2 మరియు O2F2 లలో ఆక్సిజన్ – 2 కంటే భిన్న ఆక్సీకరణ స్థితిని ప్రదర్శిస్తుంది.
- OF2 లో ఆక్సిజన్ ఆక్సీకరణ స్థితి +2
- O2F2 లో ఆక్సిజన్ ఆక్సీకరణ స్థితి +1.
![]()
ప్రశ్న 6.
ఆక్సిజన్ అణువుకు O2 ఫార్ములా ఉంటే సల్ఫర్కు S8 ఫార్ములా ఉంటుంది వివరించండి.
జవాబు:
- ఆక్సిజన్ తక్కువ పరమాణు పరిమాణం, అధిక ఋణ విద్యుదాత్మకత కలిగి ఉండుట వలన Pπ – Pπ బహు బంధాన్ని ఏర్పరచి O2 అణువుగా ఏర్పడును.
- సల్ఫర్ ఎక్కువ పరమాణు పరిమాణం, అల్ప ఋణ విద్యుదాత్మకత కలిగి ఉండుట వలన S – S ఏక బంధాలను ఏర్పరచి So అణువుగా ఏర్పడును.
ప్రశ్న 7.
H2O ద్రవం, కానీ H2S వాయువు – వివరించండి.
జవాబు:
H2O లో అంతర అణు హైడ్రోజన్ బంధాలు కలిగి ఉండుట వలన ద్రవంగా ఉంటుంది. H2S లో అటువంటి బంధాలు లేనందున వాయువుగా ఉంటుంది.
ప్రశ్న 8.
H2O కి తటస్థ గుణం ఉంటే H2S కు ఆమ్ల గుణం ఉంటుంది వివరించండి.
జవాబు:
H2O తటస్థ గుణం కంటే H2S కు ఆమ్ల గుణం ఉంటుంది.
కారణం :
O – H బంధ వియోజన శక్తి S – H బంధ వియోజన శక్తి కన్నా ఎక్కువ.
ప్రశ్న 9.
భూపటలంపై అత్యంత సమృద్ధిగా లభించే మూలకాన్ని తెలపండి.
జవాబు:
భూపటలంపై అత్యంత సమృద్ధిగా లభించే మూలకం ఆక్సిజన్ (46.6%).
ప్రశ్న 10.
16వ గ్రూపు మూలకాల్లో అత్యధిక కాటనేషన్ ఉన్న మూలకం.
జవాబు:
16వ గ్రూపులో అత్యధిక కాటనేషన్ ఉన్న మూలకం సల్ఫర్. ఇది S8 అణువుగా ఏర్పడి ముడతలు పడిన వలయ కిరీటాకృతిని కలిగి ఉండును.
ప్రశ్న 11.
చాల్కోజన్ హైడ్రైడ్లలో అత్యంత బలమైన ఆమ్లం, అత్యంత స్థిరత్వం ఉండే హైడ్రైడ్ ఏది?
జవాబు:
- చాల్కోజన్ హైడ్రైడ్లలో అత్యంత బలమైన ఆమ్లం H2Fe.
- చాల్కోజన్ హైడ్రైడ్లో అత్యంత స్థిరమైనది H2O.
ప్రశ్న 12.
ఈ క్రింది వాటిలో సల్ఫర్ సంకరీకరణాన్ని తెల్పండి.
ఎ) SO2 బి) SO3 సి) SF4 డి) SF6
జవాబు:
ఎ) SO2 లో ‘S’ సంకరీకరణం sp²
బి) SO2 లో ‘S’ సంకరీకరణం sp²
సి) SF4 లో ‘S’ సంకరీకరణం Sp³d
డి) SF6 లో ‘S’ సంకరీకరణం sp³d²
ప్రశ్న 13.
ఏవేని రెండు సల్ఫర్ ఆక్సోఆమ్లాల పేర్లు, వాటి ఫార్ములాలు రాయండి. వాటిలో సల్ఫర్ ఆక్సీకరణ స్థితిని తెలపండి.
జవాబు:
- పెరాక్సో మోనో సల్ఫ్యూరిక్ ఆమ్లం – H2SO5 – ‘S’ ఆక్సీకరణ స్థితి +6
- పెరాక్సో డై సల్ఫ్యూరిక్ ఆమ్లం – H2S2O8 – ‘S’ ఆక్సీకరణ స్థితి +6
![]()
ప్రశ్న 14.
SF4, SF6 నిర్మాణాలను వివరించండి.
జవాబు:
SF4 నిర్మాణం :
- SF4 లో ‘S’ sp³d సంకరీకరణం చెందును.
- SF4 ట్రైగోనల్ బై పిరమిడ్ నిర్మాణం కలిగి ఉంటుంది.
- SF4 లో మూడు ఈక్వటోరియల్ స్థానాల్లో ఒక స్థానం వద్ద ఒంటరి ఎలక్ట్రాన్ జంట ఉంటుంది. ఈ జ్యామితిని తూగుడు బల్ల జ్యామితి అని కూడా అంటారు.
SF6 నిర్మాణం :
- SF6 లో ‘S’ sp³d² సంకరీకరణం చెందును.
- SF6 అష్టముఖీయ ఆకృతి కలిగి ఉండును.
ప్రశ్న 15.
ఈ క్రింది వాటికి ఒక్కో ఉదాహరణ ఇవ్వండి.
ఎ) తటస్థ ఆక్సైడ్ బి) పెరాక్సైడ్ సి) సూపర్ ఆక్సైడ్
జవాబు:
ఎ) CO, N2O లు తటస్థ ఆక్సైడ్లు.
బి) Na2O2, BaO2 లు పెరాక్సైడ్లు.
సి) KO2, RbO2 లు సూపర్ ఆక్సైడ్లు.
ప్రశ్న 16.
“టెయిలింగ్ ఆఫ్ మెర్క్యురీ” అంటే ఏమిటి? దీనిని ఎలా తొలగిస్తారు? [AP & TS. Mar.’15]
జవాబు:
మెర్క్యురీ ఓజోన్తో చర్య జరిపినపుడు దాని తళుకునూ, ద్రవ వక్రతలాన్ని కోల్పోయి తత్ఫలితంగా గాజుకు అతుక్కునే గుణాన్ని పొందుటను “టెయిలింగ్ ఆఫ్ మెర్క్యురీ” అంటారు.
2Hg + O3 → Hg2O + O2
నీటిని కలిపి బాగా కుదుపుట ద్వారా Hg2O కరిగిపోయి తిరిగి పాదరస వక్రతలాన్ని పొందవచ్చు.
ప్రశ్న 17.
ఓజోన్ వాయువును పరిమాణాత్మకంగా నిర్ణయించే సూత్రాన్ని రాయండి.
జవాబు:
ఓజోన్ ను పరిమాణాత్మకంగా నిర్ణయించడానికి మొదట ఓజోన్ ను బోరేట్తో బఫర్ చేసిన (pH = 9.2) అధిక KI ద్రావణంతో చర్య జరిపితే I2 విడుదలగును. ఈ I2 ను ప్రమాణ సోడియం థయోసల్ఫేట్ ద్రావణంతో అంశమాపనం చేసి ని పరిమాణాత్మకంగా నిర్ణయిస్తారు.
![]()
ప్రశ్న 18.
ఓజోన్ నిర్మాణాన్ని రాయండి.
జవాబు:

ఓజోన్ నిర్మాణం :
- O3 లో 117° బంధకోణం కలిగి ఉంటుంది. ఇది కోణీయ అణువు.
- 0 – 0 బంధ దైర్ఘ్యం 128 pm.
ప్రశ్న 19.
SO2 ని యాంటిక్లోర్ ఉపయోగిస్తారు – వివరించండి.
జవాబు:
SO2 ను యాంటీ క్లోర్గా ఉపయోగిస్తారు. యాంటీక్లోర్ అనగా వస్త్రాలపై అధిక క్లోరినన్ను తొలగించేది. చార్కోల్ సమక్షంలో SO, క్లోరిన్తో చర్య జరిపి సల్ఫ్యూరైల్ క్లోరైడ్ను ఏర్పరచును.
SO2(వా) + Cl2(వా)(0) → SO2Cl2(వా)
ప్రశ్న 20.
ఓజోన్ ను ఏ విధంగా గుర్తిస్తారు?
జవాబు:
→ పరిశుద్ధ ఓజోన్ వాయురూపంలో లేత నీలిరంగు, ద్రవ రూపంలో ముదురు నీలిరంగు. ఘన రూపంలో నలుపురంగులో’ ఉంటుంది.
→ దీనిని టెయిలింగ్ ఆఫ్ మెర్క్యురీ ద్వారా గుర్తించవచ్చు.
2Hg + O3 → Hg2O + O2
బెంజిడీన్ కాగితాన్ని జేగురు రంగులోనికి మార్చును.
ప్రశ్న 21.
ఇథిలీన్తో ఓజోన్ ఏ విధంగా చర్య జరుపుతుంది?
జవాబు:
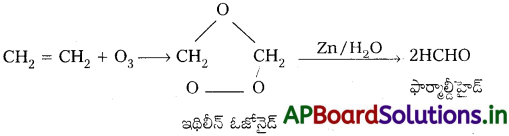
ఇథిలీన్ ఓజోన్తో చర్య జరిపి ఇథిలీన్ ఓజోనైడ్ను ఏర్పరచును. దీనిని జల విశ్లేషణ చేయగా ఫార్మాల్డీహైడ్ ఏర్పడును.
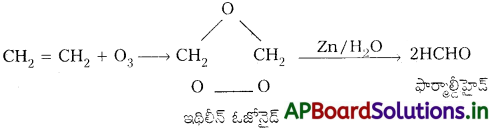
ప్రశ్న 22.
O2, O3 లలో ఏది పారా అయస్కాంత పదార్థం?
జవాబు:
- ఒంటరి ఎలక్ట్రాన్ ఉండుట వలన 0, పారా అయస్కాంత స్వభావం కలిగి ఉంటుంది.
- ఒంటరి ఎలక్ట్రాన్ లేనందువలన ౧౩ డయా అయస్కాంతత్వం కలిగి ఉండును.
ప్రశ్న 23.
O3, O2 లలో ఓజోన్ మెరుగైన ఆక్సీకరణి – ఎందువల్ల?
జవాబు:
O2, O3 లలో O3 మెరుగైన ఆక్సీకరణి. ఇది సులభంగా నవజాత ఆక్సిజన్ను విడుదల చేస్తుంది. ఇది ఫ్లోరిన్ తరువాత బలమైన ఆక్సీకరణి.
ప్రశ్న 24.
O3, H2SO4 ల ఉపయోగాలు ఒక్కోదానికి రెండేసి రాయండి.
జవాబు:
O3 ఉపయోగాలు :
- O3ని నీటిని శుద్ధి చేయుటలో ఉపయోగిస్తారు.
- కర్పూరం, కృత్రిమ సిల్క్ తయారీలో ఉపయోగిస్తారు.
- O3 ని క్రిమిసంహారిణిగా. సంక్రమణ వ్యాధుల నిరోధిగాను ఉపయోగిస్తారు.
H2SO4 ఉపయోగాలు :
- ఎరువుల తయారీలో ఉపయోగిస్తారు.
- పెట్రోల్ శుద్ధి చేయుటలో ఉపయోగిస్తారు.
- డిటర్జెంట్ పరిశ్రమలలో ఉపయోగిస్తారు.
![]()
ప్రశ్న 25.
ఏ రూపంలోని సల్ఫర్ పారా అయస్కాంత ధర్మాన్ని చూపుతుంది?
జవాబు:
సల్ఫర్ బాష్ప స్థితిలో పాక్షికంగా S2 అణువుగా ఉంటుంది. ఈ స్థితిలో రెండు ఒంటరి ఎలక్ట్రాన్లను కలిగి ఉండుట వలన పారా అయస్కాంత స్వభావం కలిగి ఉంటుంది.
ప్రశ్న 26.
SO2 ఉనికిని ఏ విధంగా గుర్తిస్తారు?
జవాబు:
SO2 ఘాటైన వాసనగల వాయువు. దీని ఉనికిని ఈ క్రింది విధంగా గుర్తిస్తారు.
1. SO2 నారింజరంగులో గల ఆమ్లీకృత పొటాషియం డైక్రోమేట్ ద్రావణంను ఆకుపచ్చ రంగులోనికి మార్చును.

2. SO2 ఆమ్లీకృత MnO ద్రావణాన్ని రంగు కోల్పోయేట్లు చేస్తుంది.

ప్రశ్న 27.
16వ గ్రూపు మూలకాలను ఎందువల్ల చాల్కోజన్లని పిలుస్తారు?
జవాబు:
చాల్కోజన్లు అనగా ‘ఖనిజాలు (లేదా) ధాతువులను ఏర్పరచే మూలకాలు అని అర్థం. భూపటలంలో ఎక్కువ మూలకాలు ఆక్సైడ్లు, సల్ఫైడ్లు, సెలినైడ్లు, టెలరైడ్లుగా లభిస్తాయి. కావున 16వ గ్రూపు మూలకాలను చాల్కోజన్లు అంటారు.
ప్రశ్న 28.
చాల్కోజన్లలో వేటికి అత్యధిక ఋణ విద్యుదాత్మకత, వేటికి అత్యంత ఎలక్ట్రాన్ అపేక్ష ఎంథాల్పీ ఉంటుంది?
జవాబు:
- చాల్కోజన్లలో అధిక ఋణ విద్యుదాత్మకత మూలకం ‘ఆక్సిజన్’.
- చాల్కోజన్లలో అధిక ఎలక్ట్రాన్ ఎఫినిటీ మూలకం ‘సల్ఫర్’.
ప్రశ్న 29.
16వ గ్రూపు హైడ్రైడ్లలో వేటికి అత్యధిక బాష్పీభవన స్థానం, అత్యల్ప ఆమ్ల స్వభావం ఉంటుంది?
జవాబు:
- 16వ గ్రూపు హైడ్రైడ్లలో H2O కు అధిక బాష్పీభవన స్థానం కలదు.
- 16వ గ్రూపు హైడ్రైడ్లలో H2O కు బలహీనమైన. ఆమ్ల స్వభావం కలదు.
స్వల్ప సమాధాన ప్రశ్నలు
ప్రశ్న 1.
O, S, Se, Te, Po మూలకాల స్థానాలను ఆవర్తన పట్టికలో ఎలక్ట్రాన్ విన్యాసం, ఆక్సీకరణ స్థితులు, హైడ్రైడ్లను ఏర్పరిచే సమర్థత ఆధారంగా ఏ విధంగా నిర్దేశించారు ?
జవాబు:
1) ఎలక్ట్రాన్ విన్యాసాలు : 16వ గ్రూపు మూలకాల సాధారణ బాహ్య కక్ష్య ఎలక్ట్రాన్ విన్యాసం ns² np4
ఆక్సిజన్ (O) – [He] 2s² 2p4
సల్ఫర్ (S) – [Ne] 3s² 3p4
సెలీనియం (Se) – [Ar] 3d10 4s² 4p1
టెలూరియం (Te) – [Kr] 4d10 5s² 5p+
పొలోనియమం (Po) – [Xe] 4f14 5d10 6s² 6p4
2) ఆక్సీకరణ స్థితులు :
- 16వ గ్రూపు మూలకాలు సాధారణంగా -2 ఆక్సీకరణ స్థితిని ప్రదర్శిస్తాయి.
- O-2, S-2, Se-2 etc.
3) హైడ్రైడ్లను ఏర్పరచే సమర్థత:
ఈ మూలకాలు EH,(E = చాల్కోజన్) రకమైన హైడ్రైడ్లు ఏర్పరుస్తాయి.
ఉదా : H2O, H2S, H2Se, H2Te, H2Po.
పైన వివరించబడిన వాటిని బట్టి O, S, Se, Te మరియు Po లు ఒకే గ్రూపులో కలవు అని తెలుస్తుంది.
![]()
ప్రశ్న 2.
H2SO4 ను కాంటాక్ట్ పద్ధతిలో ఏ విధంగా తయారుచేస్తారు?
జవాబు:
స్పర్శ పద్ధతిలో HSO్మ ను మూడు దశల్లో తయారుచేస్తారు.
i) సల్ఫర్ లేదా సల్ఫైడ్ ధాతువుని గాలిలో మండించి SO2 ను తయారు చేస్తారు.
S + O2 → SO2
4FeS2 + 11O2 → 2Fe2O3 + 8SO2
ii) V2O5 ఉత్ప్రేరక సమక్షంలో SO2 ను ఆక్సిజన్తో చర్య జరిపించి SO3 గా మారుస్తారు.
![]()
iii) పైన ఏర్పడిన SO2 H2SO4 లోకి అభిశోషణం చేస్తే ఓలియం (H2S2O7) ఏర్పడును. ఏర్పడిన ఓలియంను నీటితో సజలం చేసి కావలసిన గాఢతల్లో H2SO4 ఏర్పడుతుంది.
SO3 + H2SO4 → H2S2O7
H2S2O7 + H2O → 2H2SO4
ప్రశ్న 3.
ఓజోన్ ను ఏ విధంగా తయారుచేస్తారు ? ఈ క్రింది వాటితో దీని చర్యను తెలపండి.
ఎ) PbS బి) KI సి) Hg డి) Ag
జవాబు:
ఓజోన్ తయారీ :
నిశ్శబ్ద విద్యుదుత్సర్గం ద్వారా అనార్ధ ఆక్సిజన్ను ప్రవాహంలా పంపినట్లయితే ఆక్సిజన్ ఓజోన్ (10%) గా మార్పు చెందును. ఏర్పడిన ఉత్పన్నాన్ని ఓజోనైజ్డ్ ఆక్సిజన్ అంటారు.
3O2 → 2O3; ∆H° 142kJ/mole
- ఈ చర్య ఉష్ణగ్రాహక చర్య.
- ఆక్సిజన్ వియోగాన్ని నివారించడానికి నిశ్శబ్ద విద్యుదుత్సర్గాన్ని తప్పనిసరిగా ఉపయోగించాలి.
ఎ) PbS తో చర్య :
ఓజోన్ నల్లటి లెడ్ సల్ఫైడ్న తెల్లటి లెడ్సల్ఫేట్ ఆక్సీకరణం చేయును.
PbS + 4O3 → PbSO4 + 4O2
బి) KI తో చర్య :
ఓజోన్ ఆర్ధ KI ని అయోడిన్గా మార్చును.
2KI + H2O + O3 → 2KOH + I2 + O2
సి) Hg తో చర్య :
మెర్క్యురీ ఓజోన్ తో చర్య జరిపినపుడు దాని తళుకునూ, ద్రవ వక్రతలాన్ని కోల్పోయి తత్ఫలితంగా గాజుకు అతుక్కునే గుణాన్ని పొందుటను “టెయిలింగ్ ఆఫ్ మెర్క్యురీ” అంటారు.
2Hg + O3 → Hg2O + O2
నీటిని కలిపి బాగా కుదుపుట ద్వారా Hg2O కరిగిపోయి తిరిగి పాదరస వక్రతలాన్ని పొందవచ్చు.
డి) Ag తో చర్య :
ఓజోన్ Ag లోహాన్ని Ag2O గా ఆక్సీకరణం చేయును.
2Ag + O3 → Ag2O + O2
ప్రశ్న 4.
సల్ఫర్ రూపాంతరతను గురించి లఘు వ్యాఖ్య రాయండి.
జవాబు:
సల్ఫర్ యొక్క ముఖ్యమైన రూపాంతరాలు :
a) పసుపుపచ్చ రాంబిక్ సల్ఫర్ (α – సల్ఫర్)
b) మోనోక్లినిక్ సల్ఫర్ (β – సల్ఫర్)
→ గది ఉష్ణోగ్రత వద్ద α – సల్ఫర్ స్థిరమైనది.
α – సల్ఫర్ :
- రంగు : పసుపుపచ్చ
- ద్రవీభవన స్థానం : 385.8K.
- విశిష్ట సాంద్రత : 2.06.
- నీటిలో కరుగదు, ఆల్కహాల్, బెంజీన్ల లో CS2 లో త్వరగా కరుగును.
β – సల్ఫర్ :
- ద్రవీభవన స్థానం : 392K.
- విశిష్ట సాంద్రత : 1.98
- CS2 లో కరుగును.
![]()
ఈ ఉష్ణోగ్రతను సల్ఫర్ పారదర్శక ఉష్ణోగ్రత అంటారు.
ప్రశ్న 5.
SO2 ఈ క్రింది వాటితో ఏ విధంగా చర్య జరుపుతుంది?
ఎ) Na2SO3(జల) బి) Cl2 సి) Fe+3 అయాన్లు d) KMnO4
జవాబు:
ఎ) Na2SO3(జల) ద్రావణం SO2 తో చర్య జరిపి సోడియం హైడ్రోజన్ సల్ఫైట్ను ఏర్పరచును.
Na2SO3 + H2O + SO2 → 2NaHSO3
బి) చార్కోల్ సమక్షంలో SO2 వాయువు Cl2తో చర్య జరిపి సల్ఫ్యూరైల్ క్లోరైడ్ను ఏర్పరచును.
SO2 + Cl2 → SO2Cl2
సి) SO2 తో Fe+3 అయాన్లు Fe+2 అయాన్లుగా క్షయకరణం చెందుతాయి.
2Fe+3 + SO2 + 2H2O → 2Fe+2 + SO-24 + 4H+
డి) SO2 వాయువు ఆమ్లీకృత KMnO4 ను రంగు కోల్పోయేటట్లు చేస్తుంది.
5SO2 + 2MnO–4 + 2H2O2 → 5SO-24 + 4H+ + 2Mn+2
ప్రశ్న 6.
మూలక సల్ఫర్ నుంచి ప్రారంభించి, H2SO4ని ఎలా తయారుచేస్తారు?
జవాబు:
మూలక సల్ఫర్ నుంచి ప్రారంభించి, H2SO4 ని ఈ క్రింది విధంగా తయారుచేస్తారు.
స్పర్శ పద్ధతి :
స్పర్శ పద్ధతిలో H2SO4 ను మూడు దశల్లో తయారుచేస్తారు.
i) సల్ఫర్ లేదా సల్ఫైడ్ ధాతువుని గాలిలో మండించి SO2 ను తయారు చేస్తారు.
S + O2 → SO2
4FeS2 + 11O2 → 2Fe2O3 + 8SO2
ii) V2O5 ఉత్ప్రేరక సమక్షంలో SO2 ను ఆక్సిజన్తో చర్య జరిపించి SO3 గా మారుస్తారు.
![]()
iii) పైన ఏర్పడిన SO2ని H2SO4 లోకి అభిశోషణం చేస్తే ఓలియం (H2S2O7) ఏర్పడును. ఏర్పడిన ఓలియంను నీటితో సజలం చేసి కావలసిన గాఢతల్లో H2SO4 ఏర్పడుతుంది.
SO3 + H2SO4 → H2S2O7
H2S2O7 + H2O → 2H2SO4
అనుకూలించే అంశాలు :
ఉష్ణోగ్రత – 720 K
పీడనం – 2 bar
ఉత్ప్రేరకం – V2O5 (లేదా) ప్లాటినైజ్డ్ ఆస్బెస్టాజ్
ప్రశ్న 7.
SO-24, SO3ల నిర్మాణాలను వర్ణించండి.
జవాబు:
SO3 నిర్మాణం :
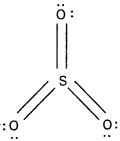
- SO3 లో సల్ఫర్ sp² సంకరీకరణం చెందును.
- ఆకృతి : సమతల త్రిభుజాకారం
- బంధ కోణం : 120°.
- S – O బంధ దైర్ఘ్యం : 143 pm.
SO-24 నిర్మాణం :
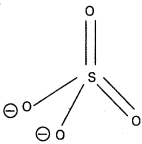
- SO-24 లో సల్ఫర్ sp³ సంకరీకరణం చెందును.
- ఆకృతి : టెట్రాహెడ్రల్ (చతుర్ముఖీయం)
- దీనికి పలు రెజొనెన్స్ నిర్మాణాలు గలవు.
- దీనిలో రెండు Pπ – dπ బంధాలు కలవు.
![]()
ప్రశ్న 8.
ఆక్సీకరణిగాను, క్షయకరణిగాను పనిచేసే సల్ఫర్ ఆక్సైడ్ ఏది? ఒక్కోదానికి ఒక్కో ఉదాహరణ ఇవ్వండి.
జవాబు:
ఆక్సీకరణిగాను, క్షయకరణిగాను పనిచేసే సల్ఫర్ ఆక్సైడ్, సల్ఫర్ డై ఆక్సైడ్ (SO2)
SO2 ఆక్సీకరణి :
సోడియం సల్ఫేట్ను SO2, హైపోగా ఆక్సీకరణం చేయును.
2Na2S + 3SO2 → 2Na2S2O3 + S
SO2 క్షయకరణి :
SO2, Fe+3 అయాన్లను Fe+2 అయాన్లుగా క్షయకరణం చేయును.
2Fe+3 + SO2 + 2H2O2→ 2 Fe+2 + SO-24 + 4H+
ప్రశ్న 9.
H2SO4 కాంటాక్ట్ పద్ధతిలో SO3 నుంచి SO2 ఏర్పడటానికి అనువైన పరిస్థితుల్ని వివరించండి.
జవాబు:
లీషాట్లీయర్ సూత్రం:
SO2 ను ఉత్ప్రేరక సమక్షంలో SO3 గా ఆక్సీకరణం చేయడం ద్విగత చర్య. ఈ మార్పుకు ఉష్ణ రసాయన సమీకరణం ఇలా వ్రాస్తారు.
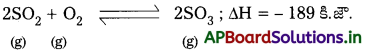
అంశాలు :
- 3 ఘనపరిమాణాల చర్యా జనకాలు మారి 2 ఘనపరిమాణాల SO3ని ఇస్తాయి. అంటే చర్య ఫలితంగా ఘనపరిమాణంలో తగ్గుదల ఉంటుంది:
- ఇది ఉష్ణమోచక చర్య.
- SO3 దిగుబడిని పెంచడానికి ఉత్ప్రేరకాన్ని వాడుతారు.
లీషాట్లీయర్ సూత్రం ప్రకారం :
- వ్యవస్థ ఘనపరిమాణం తగ్గాలంటే అధిక పీడనాలు అవసరం. కానీ పరిశ్రమల్లో 2 అట్మాస్ఫియర్ల పీడనాన్ని మాత్రమే వాడుతారు. అధిక పీడనాలు ఉపయోగించకపోవడానికి ఈ ఎక్కువ పీడనాలకు తట్టుకోగల ఆమ్ల నిరోధక గదులను నిర్మించడం కుదరదు.
- ఉష్ణమోచక చర్యలు అల్ప ఉష్ణోగ్రత వద్ద జరుగుతాయి. అల్ప ఉష్ణోగ్రత వద్ద పనిచేయడం పరిశ్రమలో వీలుకాదు. ఆ పరిస్థితుల్లో తగు మాత్రం ఉష్ణోగ్రతను వాడతారు. అప్పుడు తగినంత ప్రమాణాల్లో క్రియజన్యాలు వస్తాయి. H2SO4 పారిశ్రామిక తయారీలో SO2ని SO3 గా మార్చడానికి తగిన ఉష్ణోగ్రత 673 – 723 K.
- ఉత్ప్రేరకాన్ని వాడటం వల్ల SO3 ఏర్పడే చర్యా వేగం ఎక్కువ అవుతుంది.
![]()
ప్రశ్న 10.
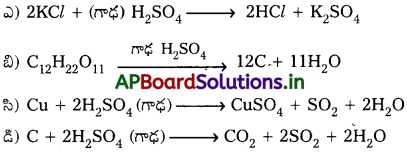
ఈ క్రింది చర్యలను పూర్తి చేయండి.

జవాబు:
ప్రశ్న 11.
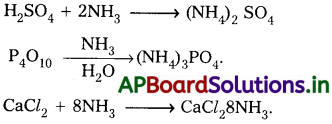
అమోనియాను తడి లేకుండా చేయడానికి దేనిని ఉపయోగిస్తారు?
జవాబు:
అమోనియాను తడి లేకుండా చేయుటకు పొడిసున్నాన్ని (CaO) ను ఉపయోగిస్తారు.
అమోనియాను పొడి చేయుటకు గాఢ H2SO4, P4O10 మరియు CaCl2 లను ఉపయోగించరు. ఎందువలన అనగా అమోనియా వీటితో చర్య జరిపి (NH4)2SO4, (NH4)3PO4 మరియు CaCl2. 8NH3 లను ఏర్పరచును.
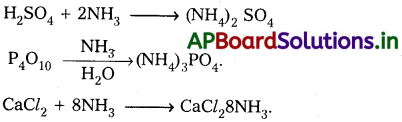
ప్రశ్న 12.
అమోనియాను తడి లేకుండా చేయడానికి గాఢ H2SO4, P4O14 అనార్ద్ర CaCl2 లను ఉపయోగించరు? ఎందుకు?
(సూచన : అమోనియా వీటితో చర్య జరిపి (NH4)2 SO4; (NH4)3 PO42; CaCl2, 8NH3 లను ఏర్పరుస్తుంది)
జవాబు:
అమోనియాను తడి లేకుండా చేయుటకు పొడిసున్నాన్ని (cao) ను ఉపయోగిస్తారు.
అమోనియాను పొడి చేయుటకు గాఢ H2SO4, P4O10 మరియు CaCl2 లను ఉపయోగించరు. ఎందువలన అనగా అమోనియా వీటితో చర్య జరిపి (NH4)2SO4, (NH4)3PO4 మరియు CaCl2. 8NH3 లను ఏర్పరచును.
దీర్ఘ సమాధాన ప్రశ్నలు
ప్రశ్న 1.
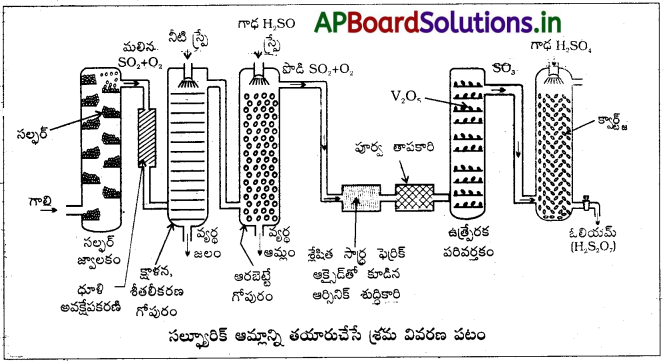
కాంటాక్ట్ పద్ధతిలో సల్ఫ్యూరిక్ ఆమ్లాన్ని తయారుచేసే పద్ధతిని విపులంగా వివరించండి.
జవాబు:
స్పర్శ పద్ధతిలో H2SO4 ను మూడు దశల్లో తయారుచేస్తారు.
i) సల్ఫర్ లేదా సల్ఫైడ్ ధాతువుని గాలిలో మండించి SO2 ను తయారు చేస్తారు.
S + O2 → SO2
4FeS2 + 11O2 → 2Fe2O3 + 8SO2
ii) V2O5 ఉత్ప్రేరక సమక్షంలో SO2 ను ఆక్సిజన్తో చర్య జరిపించి SO3 గా మారుస్తారు.
![]()
iii) పైన ఏర్పడిన SO2ని H2SO4 లోకి అభిశోషణం చేస్తే ఓలియం (H2S2O7) ఏర్పడును. ఏర్పడిన ఓలియంను నీటితో సజలం చేసి కావలసిన గాఢతల్లో H2SO4ఏర్పడుతుంది.
SO3 + H2SO4 → H2S2O7
H2S2O7 + H2O → 2H2SO4
లీషాట్లీయర్ సూత్రం :
SO2 ను ఉత్ప్రేరక సమక్షంలో SO3 గా ఆక్సీకరణం చేయడం ద్విగత చర్య. ఈ మార్పుకు ఉష్ణ రసాయన సమీకరణం ఇలా వ్రాస్తారు.
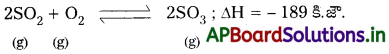
అంశాలు
- 3 ఘనపరిమాణాల చర్యా జనకాలు మారి 2 ఘనపరిమాణాల SO3 ని ఇస్తాయి. అంటే చర్య ఫలితంగా ఘనపరిమాణంలో తగ్గుదల ఉంటుంది.
- ఇది ఉష్ణమోచక చర్య.
- SO3 దిగుబడిని పెంచడానికి ఉత్ప్రేరకాన్ని వాడుతారు.
లీషాట్లీయర్ సూత్రం ప్రకారం :
- వ్యవస్థ ఘనపరిమాణం తగ్గాలంటే అధిక పీడనాలు అవసరం. కానీ పరిశ్రమల్లో 2 అట్మాస్ఫియర్ల పీడనాన్ని మాత్రమే వాడుతారు. అధిక పీడనాలు ఉపయోగించకపోవడానికి ఈ ఎక్కువ పీడనాలకు తట్టుకోగల ఆమ్ల నిరోధక గదులను నిర్మించడం కుదరదు.
- ఉష్ణమోచక చర్యలు అల్ప ఉష్ణోగ్రత వద్ద జరుగుతాయి. అల్ప ఉష్ణోగ్రత వద్ద పనిచేయడం పరిశ్రమలో వీలుకాదు. ఆ పరిస్థితుల్లో తగు మాత్రం ఉష్ణోగ్రతను వాడతారు. అప్పుడు తగినంత ప్రమాణాల్లో క్రియజన్యాలు వస్తాయి. H2SO4 పారిశ్రామిక తయారీలో SO2ని SO3 గా మార్చడానికి తగిన ఉష్ణోగ్రత 673 – 723 K.
- ఉత్ప్రేరకాన్ని వాడటం వల్ల SO3 ఏర్పడే చర్యా వేగం ఎక్కువ అవుతుంది.
![]()
ప్రశ్న 42.
ఆక్సిజన్ నుంచి ఓజోన్ ను ఎలా తయారుచేస్తారు? ఈ క్రింది వాటితో ఓజోన్ చర్యను వివరించండి. [AP & TS. Mar.’17; AP. Mar.’16]
ఎ) C2H4 బి) KI సి) Hg డి) PbS.
జవాబు:
ఓజోన్ తయారీ :
నిశ్శబ్ద విద్యుదుత్సర్గం ద్వారా అనార్ధ ఆక్సిజన్ను ప్రవాహంలా పంపినట్లయితే ఆక్సిజన్ ఓజోన్ (10%) గా మార్పు చెందును. ఏర్పడిన ఉత్పన్నాన్ని ఓజోనైజ్డ్ ఆక్సిజన్ అంటారు.
3O2 → 2O3
ΔΗ° = 142kJ/mole
- ఈ చర్య ఉష్ణగ్రాహక చర్య.
- ఆక్సిజన్ వియోగాన్ని నివారించడానికి నిశ్శబ్ద విద్యుదుత్సర్గాన్ని తప్పనిసరిగా ఉపయోగించాలి.
ఎ) C2H4 తో చర్య : ఇథిలీన్ ఓజోన్ తో చర్య జరిపి ఇథిలీన్ ఓజోనైడ్ ను ఏర్పరచును. దీనిని జల విశ్లేషణ చేయగా ఫార్మాల్డీహైడ్ ఏర్పడును. [AP. Mar.’17]
బి) KI తో చర్య :
ఓజోన్ ఆర్ధ KI ని అయోడిన్గా మార్చును.
2KI + H2O + O3 → 2KOH + I2 + O2
సి) Hg తో చర్య :
మెర్క్యురీ ఓజోన్ తో చర్య జరిపినపుడు దాని తళుకునూ, ద్రవ వక్రతలాన్ని కోల్పోయి తత్ఫలితంగా గాజుకు అతుక్కునే గుణాన్ని పొందుటను “టెయిలింగ్ ఆఫ్ మెర్క్యురీ” అంటారు.
2Hg + O3 → Hg2O + O2
నీటిని కలిపి బాగా కుదుపుట ద్వారా Hg2O కరిగిపోయి తిరిగి పాదరస వక్రతలాన్ని పొందవచ్చు.
డి) PbS తో చర్య :
ఓజోన్ నల్లటి లెడ్ సల్ఫైడు తెల్లటి లెడ్సల్ఫేట్ ఆక్సీకరణం చేయును.
PbS + 4O3 → PbSO4 + 4O2
సాధించిన సమస్యలు Textual Examples
ప్రశ్న 1.
ఒక పీరియడ్లో ఉండే 16 వ గ్రూపు మూలకం ప్రథమ అయనీకరణ ఎంథాల్పీ విలువ అదే పీరియడ్లోని 15 వ గ్రూపు మూలకం ఎంథాల్పీ విలువ కంటే తక్కువగా ఉంటుంది. ఎందువల్ల?
సాధన:
15వ గ్రూపు మూలకాల్లో సగం నిండిన p – ఆర్బిటాళ్లు గల ఎలక్ట్రాన్ విన్యాసం ఉండటం కారణంగా అవి అధిక స్థితిగ పొంది ఉన్నాయి. కాబట్టి, మూలకాల నుంచి ఎలక్ట్రాన్లను తొలగించాలంటే 15 వ గ్రూపు మూలకాలకు 16 వ గ్రూపు మూలకాల కంటే సాపేక్షంగా అధిక శక్తిని వినియోగించాల్సి ఉంటుంది.
ప్రశ్న 2.
H2S కి; H2Te కంటే తక్కువ ఆమ్ల గుణం ఉంటుంది. ఎందువల్ల?
సాధన:
గ్రూపులో పై నుంచి కిందికి వెళ్లేకొద్దీ బంధ (E-H) వియోజన ఎంథాల్పీ తగ్గుతూ ఉంటుంది. కాబట్టి ఆమ్ల స్వభావం పెరుగుతుంది.
![]()
ప్రశ్న 3.
ఏ రూపానికి చెందిన సల్ఫర్ పారా అయస్కాంత స్వభావాన్ని ప్రదర్శిస్తుంది?
సాధన:
బాషస్థితిలో, సల్ఫర్ పాక్షికంగా S, అణువుగా ఉంటుంది. 0౧ లాగా దీనిలోని అపబంధక T* ఆర్బిటాల్లో రెండు జతకూడని ఎలక్ట్రాన్లు ఉండి, పారా అయస్కాంతత్వాన్ని ప్రదర్శిస్తుంది.
ప్రశ్న 4.
ఈ క్రింది ప్రక్రియలు చేస్తే ఏం జరుగుతుంది?
i) గాఢ H2SO4 ని కాల్షియమ్ ఫ్లోరైడ్కి కలిపినప్పుడు
ii) SO3ని నీటిలోకి పంపినప్పుడు
సాధన:
i) హైడ్రోజన్, ఫ్లోరైడ్ను ఏర్పరుస్తుంది.
CaF +H2SO4 → CaSO4 + 2HF
ii) SO3 నీటిలో కరిగి H2SO4 ని ఏర్పరుస్తుంది.
SO3 + H2O → H2SO4
పాఠ్యాంశ ప్రశ్నలు Intext Questions
ప్రశ్న 1.
సల్ఫర్ లభించే ముఖ్యమైన ఉత్పత్తి స్థానాల పేర్లను తెల్పండి.
జవాబు:
i) సల్ఫేట్ల రూపంలో ఉదా : జిప్సం (CaSO4. 2H2O)
ఎప్సమ్’ లవణం (MgSO4. 7H2O)
ii) సల్ఫైడ్ల రూపంలో ఉదా : గలేనా (PbS), జింకెండ్ (ZnS)
కాపర్ పైరైటిస్ (CuFeS2)
ప్రశ్న 2.
16వ గ్రూపు మూలకాల హైడ్రైడ్ ఉష్ణ స్థిరత్వ క్రమాన్ని వ్రాయండి.
జవాబు:
H2O > H2S > H2Se > H2Te > H2PO.
ప్రశ్న 3.
H2O ద్రవం, H2S వాయువు. ఎందువల్ల?
జవాబు:
తక్కువ పరిమాణం, అధిక ఋణవిద్యుదాత్మకత కారణంగా నీటి అణువులు హైడ్రోజన్ బంధం ద్వారా సహచరితమై ఉంటాయి. ఫలితంగా నీరు ద్రవస్థితిలో ఉంటుంది.
![]()
ప్రశ్న 4.
ఈ క్రింది వాటిలో ఏది ఆక్సిజన్తో ప్రత్యక్షంగా చర్య జరపడు?
Zn, Ti, Pt, Fe
జవాబు:
ప్లాటినమ్ (Pt)
ప్రశ్న 5.
ఈ క్రింది చర్యను పూర్తి చేయండి :
i) C2H4 + O2 →
ii) 4Al + 3O2 →
జవాబు:

ప్రశ్న 6.
O3 ఎందువల్ల బలమైన ఆక్సీకరణిగా పనిచేస్తుంది?
జవాబు:
ఓజోన్ నవజాత ఆక్సిజన్ ను ఉత్పత్తి చేయుట వలన
O3 → O2 + (O) నవజాత ఆక్సిజన్
ప్రశ్న 7.
పరిమాణాత్మకంగా O3 ని ఎలా నిర్ణయిస్తారు?
జవాబు:
ఓజోన్ ను పరిమాణాత్మకంగా నిర్ణయించడానికి మొదట ఓజోన్ ను బోరేట్తో బఫర్ చేసిన (pH = 9.2) అధిక KI ద్రావణంతో చర్య జరిపితే I2 విడుదలగును. ఈ I2 ను ప్రమాణ సోడియం థయోసల్ఫేట్ ద్రావణంతో అంశమాపనం చేసి O3ని పరిమాణాత్మకంగా నిర్ణయిస్తారు.
ప్రశ్న 8.
Fe (III) లవణ జలద్రావణం గుండా 50 ను పంపితే ఏం జరుగుతుంది?
జవాబు:
SOతో Fe+3 అయాన్లు Fe+2 అయాన్లుగా క్షయకరణం చెందుతాయి.
2Fe+3 + SO2 + 2H2O → 2 Fe+2 + SO-24 + 4H+
ప్రశ్న 9.
SO2 అణువులోని రెండు S-O బంధాల స్వభావాన్ని గురించి వ్యాఖ్యానించండి. ఈ అణువులోని ఈ రెండు S-0 బంధాలు సమానమేనా?
జవాబు:
రెండు S-O బంధాలు సమయోజనీయమైనవి. రెజొనెన్స్ కారణంగా సమాన బలం ఉంటుంది.
ప్రశ్న 10.
SO2 ఉనికినీ ఎలా గుర్తిస్తారు?
జవాబు:
SO2 ఘాటైన వాసనగల వాయువు. దీని ఉనికిని ఈ క్రింది విధంగా గుర్తిస్తారు.
1. SO2 నారింజరంగులో గల ఆమ్లీకృత పొటాషియం డైక్రోమేట్ ద్రావణంను ఆకుపచ్చ రంగులోనికి మార్చును.
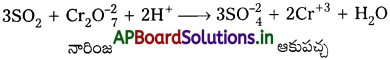
2. SO2 ఆమ్లీకృత MnO4 ద్రావణాన్ని రంగు కోల్పోయేట్లు చేస్తుంది.

ప్రశ్న 11.
H2SO4 ముఖ్య పాత్ర పోషించే మూడు రంగాలను పేర్కొనండి.
జవాబు:
- ఎరువుల తయారీలో ఉపయోగిస్తారు.
- పెట్రోల్ శుద్ధి చేయుటలో ఉపయోగిస్తారు.
- డిటర్జెంట్ పరిశ్రమలలో ఉపయోగిస్తారు.
ప్రశ్న 12.
కాంటాక్ట్ పద్ధతిలో H2SO4 దిగుబడిని పెంచే పరిస్థితుల్ని వ్రాయండి.
జవాబు:
ఉష్ణోగ్రత – 720 K
పీడనం – 2 bar
ఉత్ప్రేరకం – V2O5
![]()
ప్రశ్న 13.
నీటిలో H2SO4 కి Ka2 << Ka1 గా ఎందువల్ల ఉంటుంది?
జవాబు:
నీటిలో H2SO4 బలమైన ఆమ్లం. ఎందుకంటే అది మొదట H3O+, HSO–4 గా అయనీకరణం చెందుతుంది. అయితే రెండవ దశలో HSO–4 అయాన్ H3O+, SO2-4 లుగా అయనీకరణం చెందడం స్వల్పం. అందుకే Ka2 << Ka1