Andhra Pradesh BIEAP AP Inter 2nd Year Chemistry Study Material 5th Lesson లోహనిష్కర్షణలో సాధారణ సూత్రాలు Textbook Questions and Answers.
AP Inter 2nd Year Chemistry Study Material 5th Lesson లోహనిష్కర్షణలో సాధారణ సూత్రాలు
అతిస్వల్ప సమాధాన ప్రశ్నలు
ప్రశ్న 1.
ప్లవన ప్రక్రియలో నిమ్నకారుల పాత్ర ఏమిటి?
జవాబు:
ప్లవన ప్రక్రియలో నిమ్నకారులను ఉపయోగించుట ద్వారా రెండు సల్ఫైడ్ ధాతువులను వేరుచేయుట సాధ్యపడును.
ఉదా : ZnS మరియు PbS కలిగిన ధాతువులో NaCN ను నిమ్నకారిణిగా వాడుతారు. ఇది ZnS ను నురుగలోనికి రాకుండా అడ్డుకొని PbS ను నురుగలోనికి వచ్చేటట్లు చేస్తుంది.
ప్రశ్న 2.
C, CO లలో ఏది 673K వద్ద మంచి క్షయకరణి?
జవాబు:
C, CO లలో 673K వద్ద కార్బన్ మోనాక్సైడ్ (CO) మంచి క్షయకరణి.
- 983K మరియు ఆపై ఉష్ణోగ్రత వద్ద కోక్ (C) మంచి క్షయకరణి.
- పై పరిశీలనలు ఎల్లింగ్రామ్ పటాల నుండి గమనించబడినవి.
ప్రశ్న 3.
కాపర్ విద్యుత్ శోధన ప్రక్రియలో ఏర్పడే ఆనోడ్ బురదలో ఉన్న సాధారణ మూలకాలను గుర్తించండి.
జవాబు:
- కాపర్ విద్యుత్ శోధన ప్రక్రియలో ఏర్పడే ఆనోడ్ బురదలో ఉన్న సాధారణ మూలకాలు తక్కువ చర్యాశీలత గల విలువైన లోహాలు సిల్వర్ (Ag), గోల్డ్ (Au) మరియు ప్లాటినమ్ (pt).
- ఆనోడ్ వద్ద ఈ మూలకాలు ఎలక్ట్రాన్లు కోల్పోవు మరియు ఇవి ఆనోడ్ బురదలో గ్రహించబడతాయి.
ప్రశ్న 4.
కాపర్ లోహ నిష్కర్షణంలో సిలికా పాత్రను తెలపండి.
జవాబు:
కాపర్ లోహ నిష్కర్షణలో సిలికా ఆమ్ల ద్రావకారిగా ఉపయోగిస్తారు. సిలికా ఐరన్ లోని మలినాలతో చర్య జరిపి లోహ మలంను ఏర్పరచును.
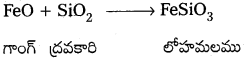
ప్రశ్న 5.
‘పోలింగ్’ ను విశదీకరించండి. [AP. Mar.’16; AP. Mar.’15]
జవాబు:
లోహాలతో ఆయా లోహాల ఆక్సైడ్లు మలినాలుగా ఉన్న సందర్భాలలో ఈ పద్ధతిని ఉపయోగిస్తారు. మలిన లోహాన్ని ద్రవస్థితిలోకి మార్చి కార్బన్ పొడితో కప్పి, పచ్చి కర్రలతో కలుపుతారు. పచ్చికర్రల నుంచి, కార్బన్ నుంచి వెలువడిన క్షయకరణ వాయువులు ‘లోహ ఆక్సైడ్రను తిరిగి శుద్ధ లోహాలుగా మారుస్తారు.
ఉదా : Cu, Sn లోహాలను ఈ పద్ధతిలో శోధనం చేస్తారు.
![]()
ప్రశ్న 6.
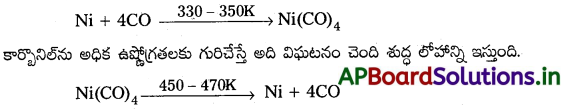
నికెల్ శోధనానికి ఒక పద్ధతిని వివరించండి.
జవాబు:
మాండ్ పద్ధతి:
ఈ పద్ధతిలో కార్బన్ మోనాక్సైడ్ సమక్షంలో నికెల్ను వేడిచేస్తే నికెల్ టెట్రా కార్బొనిల్ అనే బాష్పశీల సంక్లిష్ట పదార్థం ఏర్పడుతుంది.
ప్రశ్న 7.
పోతఇనుము దుక్కఇనుము నుంచి ఏ విధంగా విభేదిస్తుంది?
జవాబు:
బ్లాస్ట్ కొలిమి నుంచి లభించే ఐరన్, దాదాపు 4% కార్బన్ తక్కువ మొత్తంలో చాలా మాలిన్యాలు ఉంటాయి. దీనిని పిగ్ ఐరన్ (దుక్కఇనుము) అంటారు. పోత ఇనుము, దుక్క ఇనుము రెండూ వేరువేరు. దుక్కఇనుమును బొగ్గుతో వేడిగాలిని ఉపయోగించి ద్రవీభవనం చేస్తే పోతఇనుము తయారగును. దీనిలో కొంచెం తక్కువ కార్బన్ (3%) ఉంటుంది. ఇది చాలా గట్టిగా, పెళుసుగా ఉంటుంది.
ప్రశ్న 8.
ఖనిజం, ముడిఖనిజాల (ధాతువు) మధ్య తేడా ఏమిటి?
జవాబు:
ఖనిజం భూమి పై పొరలలో సహజసిద్ధంగా లభించే లోహం యొక్క రసాయన సమ్మేళనాలను ఖనిజాలు అంటారు.
ముడిఖనిజ ధాతువు :
ఖనిజాలలో కొన్నింటిని మాత్రమే రసాయనికంగా వాణిజ్యపరంగా లోహ నిష్కర్షణకు ఉపయోగిస్తారు. ఈ ఖనిజాలను ధాతువులు అంటారు.
ప్రశ్న 9.
సిలికా పూత ఉన్న కన్వర్టర్లో కాపర్మాటీని ఎందుకు ఉంచుతారు?
జవాబు:
కాపర్మాటీ Cu2S మరియు FeS లు కలిగి ఉంటుంది. ఈ మిశ్రమంలో FeS గాంగ్. ఈ గాంగ్ను తొలగించుటలో సిలికా పూత, ఉన్న కన్వర్టర్ ఆమ్ల ద్రవకారిగా పనిచేసి లోహమలంను ఏర్పరుచును.

ప్రశ్న 10.
అల్యూమినియమ్ లోహ నిష్కర్షణలో క్రయోలైట్ పాత్ర ఏమిటి? [TS. Mar.’16; TS. Mar.’15]
జవాబు:
శుద్ధ అల్యూమినాకు క్రయోలైట్ కలుపుట ద్వారా, శుద్ధ అల్యూమినా యొక్క ద్రవీభవన స్థానం తగ్గును మరియు శుద్ధ అల్యూమినా విద్యుత్ వాహకత పెరుగును.
ప్రశ్న 11.
తక్కువ శ్రేణి కాపర్ ముడిఖనిజాల విషయంలో ఏ విధంగా నిక్షాళనం చేస్తారు?
జవాబు:
తక్కువ శ్రేణి ముడిఖనిజాల నుండి జల లోహ సంగ్రహణం ద్వారా కాపర్ను నిష్కర్షణం చేస్తారు. Cu+2 ఉన్న ద్రావణాన్ని తుక్కు ఐరన్ లేదా H2 తో చర్య జరిపిస్తారు.
![]()
ప్రశ్న 12.
CO ను ఉపయోగించి జింక్ ఆక్సైడ్ను క్షయకరణం చేయడం ద్వారా జింక్ను ఎందువల్ల నిష్కర్షణం చేయరు?
జవాబు:
CO ను ఉపయోగించి జింక్ ఆక్సైడ్ను క్షయకరణం చేయుట ద్వారా జింక్ను నిష్కర్షణం చేయరు.
వివరణ :
2Zn + O2 → 2ZnO, ∆G° = – 650 kJ
2CO + O2 → 2CO2, ∆G° = – 450 kJ
2ZnO + 2CO → 2Zn + 2CO2, ∆G° 200 kJ
∆G° విలువ ధనాత్మకం అయినచో చర్య పురోగమించదు.
![]()
ప్రశ్న 13.
ఈ క్రింది మిశ్రలోహాల సంఘటనాన్ని ఇవ్వండి.
ఎ) ఇత్తడి బి) కంచు సి) జర్మన్ సిల్వర్ [AP & TS. Mar. 17]
జవాబు:
ఎ) ఇత్తడి సంఘటనం : 60 – 80% Cu, 20 – 40% Zn
బి) కంచు సంఘటనం : 75 – 90% Cu, 10 – 25% Sn
సి) జర్మన్ సిల్వర్ సంఘటనం : 50 – 60% Cu, 10 – 30% Ni, 20 – 30% Zn.
ప్రశ్న 14.
గాంగ్, లోహమలం ఈ పదాలను వివరించండి. [AP. Mar.’17]
జవాబు:
గాంగ్ :
ధాతువు భూమిపై పొరలలోని అనవసరపు రసాయన పదార్థాలతో మరియు ఖనిజాలతో మాలికుడును. ఈ అనవసరపు పదార్థాలను గాంగ్ అంటారు.
లోహమలం :
ద్రవకారిని గాంగ్తో చర్య జరిపినపుడు ఏర్పడే గలన పదార్థాన్ని లోహమలం అంటారు.

ప్రశ్న 15.
వెండి, బంగారం, వాటి ముడిఖనిజాల నిక్షాళనం ద్వారా ఎలా లభ్యం అవుతాయి?
జవాబు:
Ag మరియు Au లాంటి లోహాలను O2 సమక్షంలో NaCN (లేదా) KCN సజల ద్రావణాలతో నిక్షాళనం చేసినపుడు నిక్షాళన ద్రావణం నుండి జింక్ స్థానభ్రంశం ద్వారా లోహం ఏర్పడును.
4M(ఘ) + 8CN–(జల) + 2H2O(జల) + O2(జల) → 4[M(CN)2]–(జల) + 4OH–(జల)
2[M(CN)2]–(జల) + Zn(ఘ) → [Zn(CN)4]2-(జల) + 2M(ఘ)
ప్రశ్న 16.
ఎల్లింగ్హామ్ పటాల అవధులు ఏవి?
జవాబు:
ఎల్లింగ్హామ్ పటాల అవధులు :
- ఈ పటం ఉష్ణగతిక శాస్త్ర భావనలపై ఆధారపడి ఉంది. క్షయకరణ ప్రక్రియ గతిజశాస్త్రం గురించి ఏమీ తెలియజేయదు.
- ∆G° వివరణ K మీద ఆధారపడి ఉంది. [∆G° = -RTlnK], అంటే క్రియాజనకాలు, క్రియాజన్యాలు సమతాస్థితిలో ఉన్నట్లు భావిస్తుంది.

ఇది ఎల్లప్పుడూ సరికాదు. ఎందుకంటే క్రియాజనకాలు / క్రియాజన్యాలు ఘనపదార్థంగా ఉండవచ్చు.
ప్రశ్న 17.
కింది లోహాలకు చెందిన ఏవైనా రెండు ముడిఖనిజాలను సూత్రాలతో (ఫార్ములా) రాయండి.
ఎ) అల్యూమినియమ్ బి) జింక్ సి) ఐరన్ డి) కాపర్
జవాబు:
ఎ) అల్యూమినియమ్ ధాతువులు : బాక్సైట్ – Al2O3. 2H2O
క్రయోలైట్ – Na3AlF6
బి) జింక్ ధాతువులు : జింక్ బ్లెండ్ – ZnS
కాలమైన్ – ZnCO3
సి) ఐరన్ ధాతువులు : హెమటైట్ – Fe2O3
మాగ్నటైట్ – Fe3O4
డి) కాపర్ ధాతువులు : కాపర్ పై రైటిస్ – CuFeS2
కాపర్ గ్లాన్స్ – Cu2S.
ప్రశ్న 18.
మాటీ (matte) అంటే ఏమిటి? దాని సంఘటనాన్ని ఇవ్వండి.
జవాబు:
కాపరు కాపర్పైరైటిస్ నుండి లోహ నిష్కర్షణ చేయునపుడు బ్లాస్ట్ కొలిమిలో ఎక్కువగా Cu2S మరియు కొద్దిగా FeS ఏర్పడతాయి. ఈ ఉత్పన్నాన్ని మాటీ అంటారు.
![]()
ప్రశ్న 19.
బ్లిస్టర్ కాపర్ అంటే ఏమిటి? ఎందుకు దానిని అలా అంటారు?
జవాబు:
కాపర్మాటీ నుండి కాపర్ను నిష్కర్షణం చేయునపుడు బ్లాస్ట్ కొలిమిలో చర్యలు పూర్తి అయిన తరువాత దాదాపు ఐరన్ పూర్తిగా లోహమలంగా తీసివేయబడుతుంది. క్యూప్రస్ ఆక్సైడ్, క్యూప్రస్ సల్ఫైడ్లు చర్య జరిపి కాపర్ లోహం ఏర్పడుతుంది.
2Cu2O + Cu2S → 6Cu + SO2
ద్రవ లోహాన్ని ఇసుక అచ్చుల్లోపోసి చల్లారుస్తారు. SO, వాయువు బయటికి పోతుంది. ఇలా ఏర్పడిన కాపర్ను “బ్లిస్టర్ కాపర్” అంటారు. దీనిలో 98% శుద్ధత ఉంటుంది.
ప్రశ్న 20.
ముడిఖనిజం నుంచి మలినాల అయస్కాంత వేర్పాటును వివరించండి.
జవాబు:
విద్యుదయస్కాంత పద్ధతి (Electro-magnetic method) :
ముడిఖనిజంలో గల మలినాలు గానీ ముడిఖనిజం గానీ అయస్కాంతిక పదార్థం అయిఉంటే ఈ పద్ధతి ఉపయోగపడుతుంది. ఈ పద్ధతిలో ముడిఖనిజాన్ని చూర్ణం చేసి రెండు బలమైన విద్యుదయస్కాంత ధ్రువాల మీద తిరిగే బెల్ట్ మీద పడేలా చేస్తారు. అయస్కాంత, అనయస్కాంత పదార్థాలు రెండు వేరువేరు కుప్పలుగా పడతాయి.
ఉదాహరణకు, ఖనిజ కణాలు అయస్కాంత ధర్మాలు కలవి అనుకుందాం. అప్పుడు గాంగ్ అనయస్కాంత పదార్థం అవుతుంది. అయస్కాంత పదార్థం అయస్కాంత రోలర్ సమీపంలో పోగుగాపడుతుంది.
ఉదాహరణ : హెమటైట్, మాగ్నటైట్ అయస్కాంత ఖనిజకణాలుంటాయి. కాసిటరైట్ లేదా టిన్లోన్లో వుల్లోమైట్ అయస్కాంత మలినంగా ఉంటుంది.
ప్రశ్న 21.
ద్రవకారి అంటే ఏమిటి? ఒక ఉదాహరణ ఇవ్వండి.
జవాబు:
ఖనిజ ద్రవీభవన స్థానాన్ని తగ్గించుటకు ఖనిజాలకు బయటనుండి చేర్చిన పదార్థాలను ద్రవకారులు అంటారు.

ప్రశ్న 22.
కింది లోహాలలో, ప్రతి లోహానికి రెండు ఉపయోగాలు .ఇవ్వండి.
ఎ) జింక్ బి) కాపర్ సి) ఐరన్ డి) అల్యూమినియమ్
జవాబు:
ఎ) జింక్ ఉపయోగాలు :
- జింక్ను అధిక మొత్తంలో బ్యాటరీలలో ఉపయోగిస్తారు.
- ఐరన్ను గాల్వనైజ్ చేయుటకు ఉపయోగిస్తారు.
- చాలా మిశ్రమ లోహాలలో అనుఘటకంగా ఉపయోగిస్తారు. ఉదా : ఇత్తడి (Cu 60%, Zn 40%)
బి) కాపర్ ఉపయోగాలు :
- విద్యుత్ పరిశ్రమలో వాడే తీగలను తయారు చేయడానికి ఉపయోగిస్తారు.
- నీరు, ఆవిరి గొట్టాలను తయారు చేయడానికి కాపర్ను ఉపయోగిస్తారు.
- కాపర్ను మిశ్రమ లోహాల తయారీలో కూడా ఉపయోగిస్తారు.
సి) ఐరన్ ఉపయోగాలు :
- పోత ఇనుమును స్టవ్లు, రైలుబోగీలు, గట్టర్పైప్పులు, బొమ్మలకు పోతపోయడంలో వాడతారు.
- చేత ఇనుము, స్టీల్ తయారీలో వాడతారు.
డి) అల్యూమినియమ్ ఉపయోగాలు :
- పలుచని అల్యూమినియం రేకును చాక్లెట్ల మీద చుట్టడానికి వాడతారు.
- లోహ సూక్ష్మచూర్ణాన్ని పెయింట్లు, లాకర్లలో వాడతారు.
- ఎక్కువ చర్యాశీలత ఉండుట వలన అల్యూమినియంను క్రోమియం, మాంగనీస్లను వాటి ఆక్సైడ్ల నుండి నిష్కర్షణ చేయుటకు వాడతారు.
- అల్యూమినియం తీగలను విద్యుద్వాహకాలుగా వాడతారు.
ప్రశ్న 23.
C, COలలో, ఏది ZnO కు మంచి క్షయకరణి?
జవాబు:
కోక్ క్షయకరణిగా ZnO + C → Zn + CO ——— (1)
ఈ చర్యలో T > 1120K అయినపుడు ∆G° విలువ తక్కువగా ఉండును.
CO క్షయకరణిగా ZnO + CO2 → Zn + CO ——– (2)
ఈ చర్యలో T>1323K అయినపుడు ∆G° విలువ తక్కువగా ఉండును.
∆G° = ఋణాత్మకం అయినపుడు చర్య పురోగమిస్తుంది.
చర్య (1) లో తక్కువ ఉష్ణోగ్రత వద్ద ∆G° విలువ ఋణాత్మకం అగును. కావున ‘CO’ కన్నా ‘C’ మంచి క్షయకరణి.
ప్రశ్న 24.
ఎ) పోతఇనుము బి) చేతఇనుము సి) నికెల్ స్టీల్ డి) స్టెయిన్లెస్ స్టీల్ల ఉపయోగాలను ఇవ్వండి.
జవాబు:
ఎ) పోతఇనుము ఉపయోగాలు :
- పోత ఇనుమును స్టవ్లు, రైలుబోగీలు, గట్టర్పైపులు, బొమ్మలకు పోతపోయడంలో వాడతారు.
- చేతఇనుము, స్టీల్ తయారీలో వాడతారు.
బి) చేతఇనుము ఉపయోగాలు :
- చేతఇనుమును తీగలు, యాంకర్ల తయారీలో ఉపయోగిస్తారు.
- గొలుసులు, వ్యవసాయ సంబంధ ఉపయోగకరమైన వస్తువుల తయారీలో ఉపయోగిస్తారు.
సి) నికెల్ స్టీల్ ఉపయోగాలు :
- కేబుల్లు, ఆటోమొబైల్ భాగాలు, విమాన భాగాలలో ఉపయోగిస్తారు.
- లోలకం, కొలత టేపుల తయారీలో ఉపయోగిస్తారు.
డి) స్టెయిన్లెస్ స్టీల్ ఉపయోగాలు :
- సైకిళ్ళు, ఆటోమొబైల్లలో ఉపయోగిస్తారు.
- పాత్రలు, పెన్నుల తయారీలో ఉపయోగిస్తారు.
![]()
ప్రశ్న 25.
క్రోమియమ్, మాంగనీస్లను, వాటి ఆక్సైజ్ల నుంచి నిష్కర్షణం చేయడంలో అల్యూమినియమ్ ఎలా ఉపయోగపడుతుంది?
జవాబు:
- Al ను క్షయకరణిగా ఉపయోగిస్తారు.
- అల్యూమినో థర్మిట్ పద్ధతి ద్వారా Cr, Mn ల ఆక్సైడ్ నుంచి Cr, Mn లను నిష్కర్షణ చేస్తారు.
Cr2O3 + 2Al → 2Cr + Al2O3
3Mn3O4 + 8Al → 4Al2O3 + 9Mn
స్వల్ప సమాధాన ప్రశ్నలు
ప్రశ్న 1.
సార్ధలోహ సంగ్రహణ క్రియ ద్వారా కాపర్ను నిష్కర్షణం చేస్తారు, కానీ జింక్ను కాదు వివరించండి.
జవాబు:
సార్ధ లోహ సంగ్రహణ క్రియ ద్వారా కాపర్ను నిష్కర్షణం చేస్తారు, కానీ జింక్ను కాదు.
వివరణ :
- Zn+2/Zn యొక్క E° = -0.762V. ఇది _ Cu+2/Cu యొక్క E° 0.337V కన్నా తక్కువ.
- పై విలువల ఆధారంగా జింక్ బలమైన క్షయకరణి అని తెలియుచున్నది మరియు ఇది Cu+2 అయాను సులభంగా స్థానభ్రంశం చెందించును.

- జింకను సార్ధ లోహ సంగ్రహణ క్రియ ద్వారా నిష్కర్షణం చేయాలంటే జింక్ కన్నా బలమైన క్షయకరణిని ఉపయోగించాలి.
ప్రశ్న 2.
కాపర్ నిష్కర్షణ దాని ఆక్సైడ్ ముడిఖనిజాన్ని క్షయకరణం చేయడం ద్వారా కంటే పైరైటిస్ నుంచి ఎందుకు ఎక్కువ కష్టం?
జవాబు:
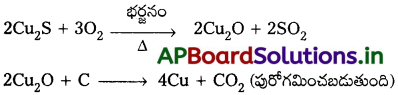
కాపర్ నిష్కర్షణ దాని ఆక్సైడ్ ముడి ఖనిజాన్ని క్షయకరణం చేయడం ద్వారా కంటే పైరైటిస్ నుండి ఎక్కువ కష్టం.
వివరణ :
పైరైటిస్ (Cu2S), కార్బన్ లేదా హైడ్రోజన్లతో క్షయకరణం చెందడు. ఎందువలన అనగా దాని ప్రమాణ స్వేచ్ఛాశక్తి ఏర్పాటు విలువ (∆G°) CS2 మరియు H2S కన్నా ఎక్కువ.
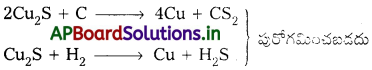
కాపర్ ఆక్సైడ్ యొక్క ∆G° విలువ CO2, కన్నా తక్కువ.
సల్ఫైడ్ ధాతువు మొదట ఆక్సైడ్గా భర్జన ప్రక్రియ ద్వారా మార్చబడుతుంది తరువాత క్షయకరణం చెందును.
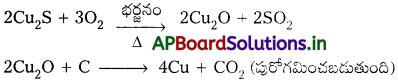
ప్రశ్న 3.
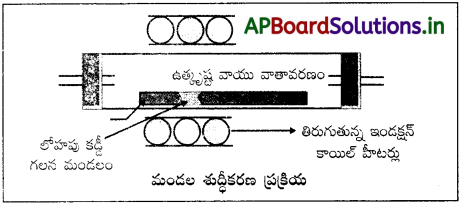
మండల శోధనను వివరించండి.
జవాబు:
మలినాలు ఘనస్థితిలో ఉన్న లోహంలో కంటే గలనస్థితిలో ఉండే లోహంలో ఎక్కువ కరిగి ఉంటాయనే నియమం మీద ఈ పద్ధతి ఆధారపడి ఉంది. అపరిశుద్ధ లోహపు కడ్డీకి ఒక చివర తిరిగే వృత్తాకార తాపకం బిగించబడి ఉంటుంది. ముందుకు తిరిగే తాపకంతోపాటు గలన మండలం తిరుగుతుంది. తాపకం ముందుకు జరుగుతున్నకొద్దీ, గలనం నుంచి శుద్ధలోహం స్ఫటికీకరణం చెందుతుంది. మలినాలు పక్కనున్న గలన మండలంలోకి వెళ్తాయి. ఈ ప్రక్రియను అనేకసార్లు పునరావృతం చేస్తారు. తాపకం ఒకే దిశలో ఒక చివర నుంచి ఇంకొక చివరకు తిరుగుతూ ప్రయాణిస్తుంది. ఒక చివరన మలినాలు సాంద్రీకరణం చెందుతాయి. ఈ చివరే సరిహద్దు (cut off). చాలా ఎక్కువ స్వచ్ఛత గల అర్ధవాహక శ్రేణి లోహాలను పొందడానికి ఈ పద్ధతి చాలా ఉపయోగకరం.
ఉదా : జెర్మేనియం, సిలికాన్, బోరాన్, గాలియమ్, ఇండియమ్.
ప్రశ్న 4.
జింక్ బ్లెండ్ నుంచి జింక న్ను నిష్కర్షణం చేయడంలో జరిగే రసాయన చర్యలను రాయండి.
జవాబు:
జింక్ బ్లెండ్ నుంచి జింక న్ను నిష్కర్షణం చేయునపుడు జరుగు రసాయన చర్యలు

ప్రశ్న 5.
ఐరన్ నిష్కర్షణం జరిగేటప్పుడు, బ్లాస్ట్ కొలిమిలో వివిధ మండలాలలో జరిగే రసాయన చర్యలను రాయండి.
జవాబు:
ఐరన్ నిష్కర్షణం జరిగేటప్పుడు, బ్లాస్ట్ కొలిమిలో వివిధ మండలాలలో జరిగే రసాయన చర్యలు

ప్రశ్న 6.
సిలికాతో కలిసి ఉన్న బాక్సైట్ ముడిఖనిజంలో సిలికా నుంచి అల్యూమినాను ఎలా వేరుచేస్తారు? [AP. Mar.’16]
జవాబు:
ఈ పద్ధతిని తెల్ల బాక్సైట్ను శుద్ధి చేయుటకు ఉపయోగిస్తారు.
సర్పైక్ పద్ధతి :
మెత్తగా నూరిన బాక్సైట్కు కోక్ కలిపి 2075K వద్ద వేడిచేస్తూ N2 వాయువును పంపుతారు. అల్యూమినియం నైట్రైడ్ ఏర్పడును. మలినం SiO2 క్షయకరణం చెంది ఏర్పడును.
Al2O3 + 3C + N2 → 2AIN + 3CO↑
SiO2 + 2C → Si↑ + 2 CO↑
అల్యూమినియం నైట్రైడ్తో నీటితో చర్య జరిపి Al(OH)3 ఏర్పరచును. Al(OH)3 ను 1200°C వద్ద వేడిచేయగా అనార్ద్ర Al2O3 ఏర్పడును.
AlN + 3H2O → Al(OH)3 + NH3↑
2Al(OH)3 → Al2O3 + 3H2O
![]()
ప్రశ్న 7.
భర్జనం, భస్మీకరణాలను భేదపరిచే ఉదాహరణలు ఇవ్వండి. [TS. Mar.’16]
జవాబు:
భర్జనం :
ఖనిజాన్ని విడిగా గాని, ఇతర పదార్థాలతో కలిపిగాని గాలి సమక్షంలో అధిక ఉష్ణోగ్రతలకు వేడిచేయడాన్ని భర్జనం అంటారు.
ఇది సల్ఫైడ్ ధాతువులకు అనువర్తనం చెందును.
ఉదా : 2ZnS + 3O2 → 2ZnO + 2SO2
భస్మీకరణం :
ఖనిజం ద్రవీభవించకుండా దానిలో గల బాష్పశీల పదార్థాలను, గాలి తగలకుండా వేడిచేయటం ద్వారా తొలగించే పద్ధతిని భస్మీకరణం అంటారు.
→ ఈ పద్ధతిని కార్బొనేట్లు, బైకార్బొనేట్లను భస్మీకరణం చేయుటకు వాడతారు.
ఉదా : CaCO3 → CaO + CO2
ప్రశ్న 8.
Cr2O3 ఏర్పాటుకు ∆G° విలువ – 540kJ mol-1, Al2O3 ఏర్పాటుకు – 827kJ mol-1. Al తో Cr2O3 క్షయకరణం సాధ్యమా?
జవాబు:
ఇవ్వబడిన దానిని బట్టి ఈ క్రింది ఉష్ణ రసాయన చర్యలు సాధ్యపడతాయి.
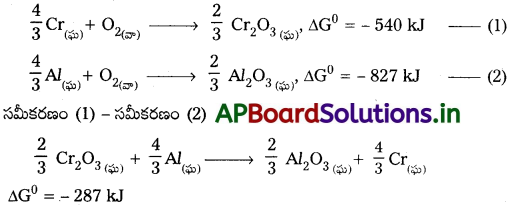
∆G° = ఋణాత్మకం కావున చర్య పురోగమిస్తుంది.
కావున Cr2O3 క్షయకరణం Al తో సాధ్యపడుతుంది.
ప్రశ్న 9.
అల్యూమినియమ్ విద్యుత్ లోహ సంగ్రహణంలో, గ్రాఫైట్ కడ్డీ పాత్ర ఏమిటి?
జవాబు:
అల్యూమినియం విద్యుత్ లోహ సంగ్రహణంలో (హాల్ – హెరోల్ట్ పద్ధతి) గ్రాఫైట్ ఆనోడ్గా పనిచేయును.
ఆనోడ్ వద్ద O2 వాయువు వెలువడును. ఈ O2 వాయువు కార్బన్ ఆనోడ్లో చర్య జరిపి CO2 ను ఏర్పరుచును. కావున ఈ గ్రాఫైట్ కడ్డీలు నెమ్మదిగా ఖర్చు అగుతాయి. కావున వీటిని సమయానుకూలంగా మరొక గ్రాఫైట్ కడ్డీతో మార్పిడి చేయాలి.

ప్రశ్న 10.
క్రింది లోహ శోధన పద్దతులలో సూత్రాలను పేర్కొనండి.
ఎ) మండలశోధనం బి) విద్యుత్ శోధనం (శుద్ధి చేయడం) సి) పోలింగ్ డి) బాష్ప ప్రావస్థ శోధనం
జవాబు:
ఎ) మండలశోధనం :
మలినాలు ఘనస్థితిలో ఉన్న లోహంలో కంటే గలనస్థితిలో ఉండే లోహంలో ఎక్కువ కరిగి ఉంటాయనే నియమం మీద ఈ పద్ధతి ఆధారపడి ఉంది. అపరిశుద్ధ లోహపు కడ్డీకి ఒక చివర తిరిగే వృత్తాకార తాపకం బిగించబడి ఉంటుంది. ముందుకు తిరిగే తాపకంతోపాటు గలన మండలం తిరుగుతుంది. తాపకం ముందుకు జరుగుతున్నకొద్దీ, గలనం నుంచి శుద్ధలోహం స్ఫటికీకరణం చెందుతుంది. మలినాలు పక్కనున్న గలన మండలంలోకి వెళ్తాయి. ఈ ప్రక్రియను అనేకసార్లు పునరావృతం చేస్తారు. తాపకం ఒకే దిశలో ఒక చివర నుంచి ఇంకొక చివరకు తిరుగుతూ ప్రయాణిస్తుంది. ఒక చివరన మలినాలు సాంద్రీకరణం చెందుతాయి. ఈ చివరే సరిహద్దు (cut off). చాలా ఎక్కువ స్వచ్ఛత గల అర్ధవాహక శ్రేణి లోహాలను పొందడానికి ఈ పద్ధతి చాలా ఉపయోగకరం.
ఉదా : జెర్మేనియం, సిలికాన్, బోరాన్, గాలియమ్, ఇండియమ్.

బి) విద్యుత్ శోధనం (శుద్ధి చేయడం) :
విద్యుద్విశ్లేషణ :
Cu, Ag. Au మొదలైన అపరిశుద్ధ లోహాలను ఈ పద్ధతిలో శోధనం చేస్తారు. ఈ పద్ధతిలో అపరిశుద్ధ లోహాన్ని ఆనోడ్గాను, శుద్ధలోహాన్ని కాథోడ్గాను ఉపయోగిస్తారు. ఆమీకృత లోహ లవణ ద్రావణం లేదా గలన స్థితిలో లోహ లవణాన్ని ఎలక్ట్రోలైట్గా వాడతారు. విద్యుత్ను పంపితే శుద్ధ లోహం కాథోడ్ పై నిక్షిప్తమవుతుంది. మలినాలు విద్యుత్ పాత్రలో ఆనోడ్ వద్ద అడుగుకు చేరతాయి. దీన్ని “ఆనోడ్ మడ్” అంటారు.
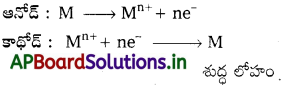
c) పోలింగ్ :
లోహాలతో ఆయా లోహాల ఆక్సైడ్లు మలినాలుగా ఉన్న సందర్భాలలో ఈ పద్ధతిని ఉపయోగిస్తారు. మలిన లోహాన్ని ద్రవస్థితిలోకి మార్చి కార్బన్ పొడితో కప్పి, పచ్చి కర్రలతో కలుపుతారు. పచ్చికర్రల నుంచి, కార్బన్ నుంచి వెలువడిన క్షయకరణ వాయువులు లోహ ఆక్సైడ్లను తిరిగి శుద్ధ లోహాలుగా మారుస్తారు. ఉదా : Cu, Sn లోహాలను ఈ పద్ధతిలో శోధనం చేస్తారు.
d) బాష్ప ప్రావస్థ శోధనం :
ఈ పద్ధతిలో, లోహాన్ని బాష్పశీల సమ్మేళనంగా మార్చి సంగ్రహిస్తారు. తరువాత, దానిని విఘటనం చెందించి శుద్ధ స్థితిలో లోహాన్ని రాబడతారు. కాబట్టి, ఈ పద్ధతికి కావలసినవి :
i) లభ్యమయ్యే కారకంతో లోహం బాష్పశీల సమ్మేళనాన్ని ఏర్పరచాలి.
ii) బాష్పశీల సమ్మేళనం సులభంగా విఘటనం చెందాలి, అప్పుడే సంగ్రహణం సులభమవుతుంది.
కింది ఉదాహరణ ఈ పద్ధతిని తెలియజేస్తాయి.
నికెల్ శోధనం – మాండ్ పద్ధతి :
ఈ పద్ధతిలో, కార్బన్ మోనాక్సైడ్ సమక్షంలో నికెల్ను వేడిచేస్తే నికెల్ టెట్రా కార్బొనిల్ అనే బాష్పశీల సంక్లిష్ట పదార్థం ఏర్పడుతుంది.
![]()
ప్రశ్న 11.
Al, MgO ను క్షయకరణం చేయడానికి పరిస్థితులను సూచించండి.
జవాబు:
రెండు ఆక్సైడ్లు ఏర్పడుటకు సమీకరణాలు

ఎల్లింగ్హామ్ పటంలో ఈ రెండు ఆక్సైడ్ రేఖలు ఒక బిందువు వద్ద కలుసుకుంటాయి. MgO ను Al లోహంతో క్షయకరణం చేయగా ∆G° విలువ సున్నా.
![]()
పైన ఇవ్వబడిన సమాచారం నుండి MgO, Al లోహంతో క్షయకరణం 1665 K తక్కువ ఉష్ణోగ్రత వద్ద జరుగదు. Mg, Al2O3 ని Al గా క్షయకరణం 1665 K కన్నా తక్కువ ఉష్ణోగ్రత వద్ద చేస్తుంది.
Al- లోహం MgO ను Mg గా క్షయకరణం 1665K పైన చేస్తుంది. ఎందువలన అనగా Al2O3 యొక్క ∆G° విలువ MgO యొక్క ∆G° విలువ కన్నా తక్కువ.
![]()
ప్రశ్న 12.
ప్లవన ప్రక్రియ పద్ధతిలో సల్ఫైడ్ ముడిఖనిజ శుద్ధీకరణను వివరించండి. [AP. Mar.’17; AP & TS. Mar.’15]
జవాబు:
ప్లవన ప్రక్రియ :
సల్ఫైడ్ ఖనిజాల నుంచి ఖనిజమాలిన్యాన్ని తొలగించడానికి ఈ పద్ధతి వాడకంలో ఉంది. చూర్ణం చేయబడ్డ ముడిఖనిజాన్ని నీటితో కలిపి అవలంబనం చేస్తారు. నూనె సమక్షంలో గాలిని పంపి, గుండ్రంగా తిరిగే తెడ్డుతో అవలంబనాన్ని గిలకరిస్తారు. ఖనిజ కణాలు గల నురుగు ఏర్పడుతుంది. ఈ అవలంబనానికి బుడగల సేకర్తలను, స్థిరీకరణులను కలుపుతారు. బుడగల సేకర్తలు (ఉదా : పైన్ ఆయిల్, కొవ్వు ఆమ్లాలు, గ్జాంథేట్లు మొదలైనవి) ఖనిజ కణాలను నీటిలోకి పోకుండా అడ్డుకుంటాయి. స్థిరీకరణులు (ఉదా : క్రిసాల్లు, ఎనిలీన్), నురుగును స్థిరీకరిస్తాయి. ఖనిజ కణాలు నూనెతో తడిగా అవుతాయి, ఖనిజ మాలిన్య కణాలు నీటితో తడిగా అవుతాయి. తెడ్డుతో తిప్పి మిశ్రమాన్ని క్షోభించటంతో గాలి లోపలికి ప్రవేశించి నురుగు ఏర్పడి ముడిఖనిజ కణాలు నురుగుతో కలసి వస్తాయి. అప్పుడు ముడిఖనిజ కణాలు నురుగు నుంచి లభ్యమవుతాయి.
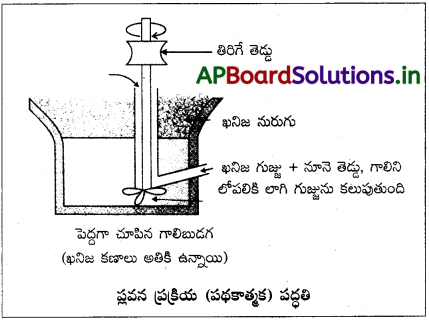
నురుగు తేలికగా ఉండటం వల్ల, తెట్టులాగ ఏర్పడిన దానిని వేరుచేయవచ్చు. తరువాత తెట్టును ఆరబెట్టి ఖనిజాన్ని పొందవచ్చు. నిమ్నకారులను వాడటం వల్ల గాని, నీరు, నూనె నిష్పత్తిని సరిచేయడం వల్ల గాని రెండు సల్ఫైడ్ ముడిఖనిజాల మిశ్రమాన్ని వేరుపరచవచ్చు. ఉదాహరణకు ZnS, PbS ఉన్న ముడిఖనిజానికి, NaCN ను నిమ్నకారిగా వాడతారు. ZnS ను నురుగులోకి రాకుండా NaCN ఆపి, NaCN, ZnS ఉపరితలం మీద Na2[Zn (CN)4] పొరను ఏర్పరుస్తుంది. PbS ను మాత్రమే నురుగులోకి . రానిస్తుంది.
ప్రశ్న 13.
బాక్సైట్ నుంచి అల్యూమినా నిక్షాళన పద్ధతిని వివరించండి. [TS. Mar. ’17]
జవాబు:
అల్యూమినియమ్ ముఖ్య ధాతువు అయిన బాక్సైట్లో SiO2, ఐరన్ ఆక్సైడ్లు, టైటానియమ్ ఆక్సైడ్ (TiO2) మలినాలు ఉంటాయి. చూర్ణం చేసిన ధాతువుకు గాఢ NaOH ద్రావణం కలిపి 473 – 523 K ఉష్ణోగ్రత, 35 – 36 bar పీడనం వద్ద చర్య జరిపిస్తారు. ఈ విధంగా, Al2O3 సోడియమ్ అల్యూమినేట్గా నిక్షాళనం (SiO2 కూడా సోడియమ్ సిలికేట్గా) చెందుతుంది. ఇతర మలినాలు ఉండిపోతాయి.
Al2O3(ఘ)(ఘ) + 2NaOH(జల) + 3H2O(ద్ర) → 2 Na[Al(OH)4](జల)
అల్యూమినేట్ క్షార ప్రవృత్తి గలది. దానిలోనికి CO2 వాయువును పంపి, తటస్థీకరించి, సార్ధ Al2O3 గా అవక్షేపిస్తారు. ఈ స్థితిలో అప్పుడే తయారుచేసిన సార్ధ Al2O3 ని ద్రావణానికి కొద్ది మొత్తంలో కలుపుతారు. Al2O3. xH2O పూర్తిగా అవక్షేపితమయ్యేటట్లు ఇది ప్రేరేపిస్తుంది.
2 Na[Al(OH)4](జల) + CO2(వా) → Al2O3. xH2O(ఘ) + 2NaHCO3(జల)
సోడియమ్ సిలికేట్ ద్రావణంలో ఉండిపోతుంది. అవక్షేపిత సార్ధ అల్యూమినాను వడపోత ద్వారా వేరుపరచి, తడిలేకుండా చేసి, వేడిచేస్తే శుద్ధ Al2O3 లభిస్తుంది.
![]()
ప్రశ్న 14.
ఎల్లింగ్హామ్ పటం అంటే ఏమిటి? ఆక్సైడ్ల క్షయకరణంలో ఈ పటాల ద్వారా ఏమి గ్రహించవచ్చు?
జవాబు:
గిబ్స్ శక్తి రేఖాపటాలను మొదటగా హెచ్.జె.టి. ఎల్లింగ్హమ్ వాడాడు. ఆక్సైడ్ క్షయకరణంలో క్షయకరణాల ఎంపికను పరిశీలించడానికి ఇది గట్టి ఆధారాన్ని ఇస్తుంది. దీనిని ఎల్లింగ్ హామ్ పటం అంటారు. ముడిఖనిజం ఉష్ట్రీయ క్షయకరణం ఎంతవరకు జరుగుతుందని చెప్పడానికి ఈ పటాలు ఉపయోగపడతాయి. చర్య జరగాలంటే, నిర్దిష్ట ఉష్ణోగ్రత వద్ద, చర్య గిబ్స్ శక్తి ఋణాత్మకంగా ఉండాలి.
ఎ) మూలకాల ఆక్సైడ్ తయారీకి (2xM(ఘ) + O2(వా) →2MxO(ఘ)) సంబంధించి ఎల్లింగ్హామ్ పటాలంటే ∆rGΘకి, Tకి పటాలు. ఈ చర్యలో, వాయువుల వినియోగం వల్ల వాయు పరిమాణం ఎడమ నుంచి కుడికి తగ్గుతుంది. ఇది ∆S విలువ రుణాత్మకం కావడానికి దారితీస్తుంది. అందువల్ల సమీకరణం (∆G = ∆H – T ∆S) లో రెండవ స్థిరాంకం గుర్తు మారుతుంది. తరువాత ఉష్ణోగ్రత పెరిగినప్పటికీ ∆G పెరుగుతుంది. (సాధారణంగా, ఉష్ణోగ్రత పెరిగితే, ∆G తగ్గుతుంది). ఫలితంగా Mx O(ఘ) తయారీకి పైన చూపించిన చాలా చర్యలకు ఎల్లింగ్హామ్ పటంలో వక్రాలకు ధనాత్మక వాలు ఉంటుంది.
బి) ప్రావస్థలో ఏదైనా మార్పు జరిగినప్పుడు (ఘ – ద్ర లేదా ద్ర వా) తప్ప ప్రతి పటం ఒక సరళరేఖే. వాలులో ధనాత్మక దిశలో పెరుగుదల అటువంటి మార్పు జరిగే ఉష్ణోగ్రతను సూచిస్తుంది. (ఉదా : Zn, ZnO పటంలో, సరళరేఖలో ఒక్కసారిగా జరిగే మార్పు ద్రవీభవనాన్ని సూచిస్తుంది).
సి) రేఖాపటంలో ఒక స్థానం కింద ∆G రుణాత్మకం అవుతుంది (అంటే MxO స్థిరంగా ఉంది). ఈ స్థానం పైన MxO దానంతట అదే విఘటనం చెందుతుంది.
డి) ఒక ఎల్లింగ్హామ్ పటంలో, సాధారణ లోహాల ఆక్సీకరణానికి (వాటి సంబంధిత జాతుల క్షయకరణానికి), కొన్ని క్షయకరణులకు ∆GΘపటాలు ఇచ్చారు. వివిధ ఉష్ణోగ్రతల వద్ద ∆rGΘవిలువలు, మొదలైన వాటిని (ఆక్సైడ్ తయారీకి) ఇచ్చారు. కాబట్టి వివరణ సులభతరమవుతుంది.
C, CO లలో 673K వద్ద కార్బన్ మోనాక్సైడ్ (CO) మంచి క్షయకరణి.
- 983K మరియు ఆపై ఉష్ణోగ్రత వద్ద కోక్ (C) మంచి క్షయకరణి.
- పై పరిశీలనలు ఎల్లింగ్హమ్ పటాల నుండి గమనించబడినవి.
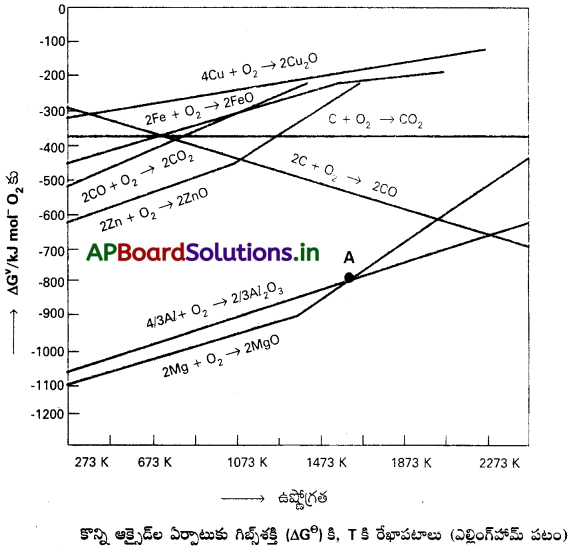
CO ను ఉపయోగించి జింక్ ఆక్సైడ్ను క్షయకరణం చేయుట ద్వారా జింక్ను నిష్కర్షణం చేయరు.
వివరణ :
2Zn + O2 → 2ZnO, ∆G° = -650 kJ
2CO + O2 → 2CO2, ∆G° = -450 kJ
2ZnO + 2CO → 2Zn + 2CO2, ∆G° = 200 kJ
∆G° విలువ ధనాత్మకం అయినచో చర్య పురోగమించదు.
పై పరిశీలనలు ఎల్లింగ్ హామ్ పటాల నుండి వివరించబడినది.
![]()
ప్రశ్న 15.
కాపర్ పైరైటిస్ నుంచి కాపర్ను ఎలా నిష్కర్షణ చేస్తారు?
జవాబు:
కాపర్ ఉనికి, నిష్కర్షణ సూత్రాలు :
మానవ జాతికి అనాదిగా కాపర్ గురించి తెలుసు. “Cuprum” అనే పదం నుంచి దీని సంకేతం ‘Cu’ వచ్చింది.
a) ఉనికి :
మూలకస్థితిలో కాపర్ లోహం చాలా తక్కువగా లభిస్తుంది. అది ఎక్కువగా ఆక్సీ సమ్మేళనాలుగానూ, సల్ఫర్ సమ్మేళనాలుగానూ లభిస్తుంది. కాపర్ ముఖ్యఖనిజాలు.
| ఖనిజం పేరు | ఫార్ములా |
| “క్యుప్రైట్” లేదా “రూబికాపర్” | Cu2O |
| కాపర్ గ్లాన్స్ | Cu2S |
| కాపర్ పైరైటీస్ | CuFeS2 లేదా Cu2S . Fe2S3. |
మాలకైట్, అజురైట్లు ఇతర ఖనిజాలు (ఫార్ములాల కోసం సాధారణ లోహ నిష్కర్షణను చూడండి).
b) కాపర్ నిష్కర్షణ :
కాపర్ మూలకాన్ని దాని సల్ఫైడ్ ఖనిజం నుంచి ముఖ్యంగా తయారుచేస్తారు. ధాతువును బట్టి దానికి చేసే అభిచర్యను ‘నిర్ణయిస్తారు.
సల్ఫైడ్ ధాతువుల నుంచి నిష్కర్షణ :
కాపర్ లోహానికి ముఖ్యధాతువు కాపర్ పైరైటీస్. ప్రగలన పద్ధతిలో కాపర్ లోహాన్ని ధాతువు నుంచి పొందుతారు. ఈ చర్యలో వివిధ దశలను క్రింద ఇచ్చాం.
i) ధాతువును “జా క్రషర్స్” (Jaw crushers) లోనూ తరవాత ‘బాల్ మిల్స్’ (ball mills) లోనూ వేసి మెత్తని చూర్ణంగా చేస్తారు. ఈ చూర్ణస్థితిలోని ధాతువును ప్లవన క్రియతో గాఢపరుస్తారు. ధాతు చూర్ణాన్ని నీటిలో అవలంబింపచేస్తారు. దానికి కొద్దిపాటి ‘పైన్ ఆయిల్’ (pine oil) ను కలుపుతారు. దాని తరువాత ఆ మిశ్రమంలోని బాగా గాలిని పంపి కలుపుతారు. అప్పుడు ఏర్పడిన నురుగుతో పాటు ధాతుకణాలు దాదాపు పూర్తిగా కలిసి వస్తాయి. తొట్టి అడుగుభాగానికి ‘గాంగ్’ చేరుకుంటుంది. నురుగును వేరు చేసి దాదాపు 95 శాతం శుద్ధ ధాతువును పొందుతారు.
ii) రివర్బొరేటరీ కొలిమి హార్త్ పై అధికంగా గాలిని పంపి ధాతువును భర్జనం చేస్తే దానిలోని బాష్పశీలి మలినాలు (As, Sb లాంటివి) బయటికి పోతాయి. కాపర్, ఐరన్ సల్ఫైడ్ల మిశ్రమం వస్తుంది. సల్ఫైడ్లు పాక్షికంగా ఆక్సీకరణం చెంది ఆయా ఆక్సైడ్లు ఏర్పడతాయి. ఈ చర్యలు కింది విధంగా ఉంటాయి.

iii) ప్రగలనం :
భర్జన ఫలితంగా వచ్చిన ధాతువుతో కొంచెం కోక్, ఇసుక (సిలికా)ను కలిపి బ్లాస్ట్ కొలిమిలో ప్రగలనం చేసి ద్రవీకృతం చేస్తారు. కోక్ దహనానికి కావలసిన గాలిని కొలిమి అడుగు భాగాన ఉన్న ‘టయర్స్’ నుంచి లోపలికి పంపుతారు. కాపర్, ఐరన్ సల్ఫైడ్ ఆక్సీకరణం ఇంకొంచెం ఎక్కువగా జరుగుతుంది. క్రింది చర్యలలో చూపించినట్లుగా ఐరన్ సిలికేట్ లోహమలం ఏర్పడుతుంది.

iv) బెస్సిమర్గీకరణం :
“మాటి” ని బెస్సిమ్హర్ కన్వర్టర్ వేస్తారు, బెస్సిమర్ కన్వర్టర్ ఒక అండాకారంలో ఉండే కొలిమి. దాన్ని ఉక్కు ప్లేటులతో చేస్తారు. ఈ కొలిమికి లైమ్తో గాని, మెగ్నీషియమ్ ఆక్సైడ్తో గాని క్షార లైనింగ్ ఇస్తారు. (ఇవి డోలమైట్ లేదా మాగ్నసైట్ నుంచి చేస్తారు). కన్వర్టర్ను ట్రానియన్ (Trunnions) ల సహాయంతో పట్టి ఉంచుతారు. దీన్ని మనకు కావలసిన వైపుకి వంపుకోవచ్చు. కొలిమి క్రింది భాగంలో ఉన్న ‘టయర్స్’ ద్వారా గాలి, ఇసుక కలిపిన వడిగాలిని పంపుతారు. ద్రవలోహం కన్వర్టర్ అడుగుభాగానికి చేరుకుంటుంది.
బ్లాస్ట్ కొలిమి జరిగే చర్యలన్నీ పూర్తి అవుతాయి. దాదాపు ఐరన్ పూర్తిగా లోహమలం రూపంలో తీసివేయబడుతుంది. క్యుప్రస్ ఆక్సైడ్, క్యుప్రస్ సల్ఫైడ్లు చర్య జరిపి కాపర్ లోహం ఏర్పడుతుంది.
2 Cu2O + Cu2S → 6 Cu + SO2
ద్రవ లోహాన్ని ఇసుక అచ్చుల్లో పోసి చల్లారుస్తారు. SO2 వాయువు బయటికి పోతుంది. అలా ఏర్పడిన కాపర్ను “బ్లిష్టర్ కాపర్” అంటారు. దీనిలో శుద్ధత దాదాపు 98% ఉంటుంది.
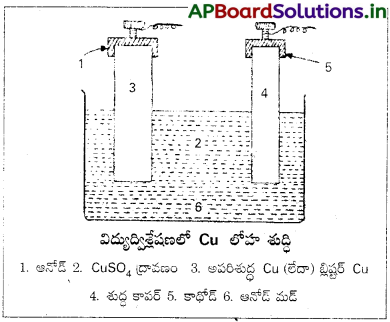
v) లోహ శుద్ధి :
“బ్లిష్టర్-కాపర్”ను విద్యు ద్విశ్లేషణ ద్వారా శుద్ధి చేస్తారు. అపరిశుద్ద కాపర్ లోహ ఫలకాలను ఆనోడ్గా వాడతారు. లెడ్ లైనింగ్ చేసిన తొట్టిలో కాపర్ (II) సల్ఫేట్ ద్రావణం పోసి అందులో వాటిని వేలాడదీస్తారు. పలచటి కాపర్ రేకులు కాథోడ్గా పనిచేస్తాయి. కాథోడ్ రేకులపై గ్రాఫైట్తో పూతపూస్తారు. విద్యుద్విశ్లేషణ చేస్తే కాథోడ్లపై శుద్ద కాపర్ నిక్షిప్తమవుతుంది. ఈ పద్దతిలో లభించే కాపర్ శుద్ధత 100% ఉంటుంది.
ప్రశ్న 16.
జింక్ బ్లెండ్ నుంచి జింక్ నిష్కర్షణాన్ని క్లుప్తంగా వివరించండి.
జవాబు:
జింక్ లోహ సంగ్రహణ :
జింక్ యొక్క ముఖ్య ధాతువులు :
జింక్ బ్లెండ్ ———- ZnS
జింకైట్ ———- ZnO
కాలమిన్ —— ZnCO3
వీటిలో “జింక్ బ్లెండ్” ముఖ్యమైనది.
వివిధ దశలు :
i) పొడి చేయడం :
ధాతువును “బాల్ మిల్”లలో మెత్తని చూర్ణంగా చేస్తారు.
ii) ధాతువును సాంద్రీకరణం చేయడం :
ధాతువును మొదటి గురుత్వ లక్షణాధార సాంద్రీకరణం చేస్తారు. ఇందులో పొడిగా చేసిన ధాతువును విల్లే బల్ల (Wilfley’s table) లపై నీటి ప్రవాహంలో కడుగుతారు. ఈ బల్ల పై భాగం ముడతలు పడినట్లుగా ఉన్న (corrugated) రేకులా ఉంటుంది. పైగా అది కదులుతూ ఉంటుంది. ఈ కదలికల వల్ల తేలికపాటి ‘గాంగ్’ కణాలు ప్రవాహంలో కొట్టుకునిపోతాయి. భారఖనిజ కణాలు బల్ల అడుగు భాగానికి చేరుకుంటాయి. ఈ విధానంలో ధాతువు పాక్షికంగా సాంద్రీకరణ చెందుతుంది.
పాక్షికంగా సాంద్రీకరణం చెందిన ధాతువును ప్లవన క్రియ ద్వారా మరింత సాంద్రీకరణం చేస్తారు. ఇందులో ధాతు కణాలు నురుగుతో పాటు వేరవుతాయి.
అప్పుడు గాంగ్లో ఐరన్ ఆక్సైడ్ ఉంటే విద్యుదయస్కాంత పద్ధతిలో పూర్తిగా సాంద్రీకృతమవుతుంది. ఐరన్ ఆక్సైడ్ అయస్కాంత పదార్థం అవడం వల్ల అయస్కాంత ధృవానికి సమీపంలో కుప్పగా పడుతుంది.
iii) పైన వచ్చిన సాంద్రీకృత ధాతువును రోటరీ షెల్ఫ్ బర్నర్ (rotary shelf burner) లో భర్జనం చేస్తారు. ఈ బర్నర్లో భూసమాంతర షెల్ఫ్ లు (లేదా గదులు మాదిరిగా) ఉంటాయి. వాటిలో చార్జిని కలపడానికి బ్లేడ్ల లాంటి వసతి ఉంటుంది. బర్నర్పై భాగం నుంచి ధాతువును వేసి, అడుగు నుంచి జింక్ ఆక్సైడ్ను తీసుకుంటారు. కింద ఇచ్చిన చర్యలు బర్నర్లో భర్జనం చేసినప్పుడు జరుగుతాయి.
2ZnS + 3O2 → 2ZnO + 2SO2
ZnS + 2O2 → ZnSO4
2ZnSO4 → 2ZnO + 2SO2 + O2.
లోహనిష్కర్షణకు ప్రారంభ పదార్థం కాలిమిన్ అయితే దాన్ని సరాసరి భస్మీకరణం చేస్తారు. జింక్ ఆక్సైడ్ ఏర్పడుతుంది.
![]()
iv)క్షయకరణం :
ఆక్సైడు లోహంగా క్షయకరణం చేయడానికి మూడు పద్ధతులు వాడుకలో ఉన్నాయి. ఎక్కువ వాడకంలో ఉన్న పద్ధతి “బెల్జియన్ పద్ధతి”. ఈ పద్ధతిలో భర్జనం చేసిన ధాతువుతో బొగ్గు లేదా కోక్తో బాగా కలుపుతారు. దాన్ని కొలిమి బంక మట్టితోగాని, మట్టితోగాని చేసిన రిటార్ట్లలోకి తీసుకుంటారు. ఈ రిటార్టు సీసాల ఆకారంలో ఉండే గొట్టాలు. వీటికి ఒక చివర మూసి ఉంటుంది. రెండో చివర మట్టితో చేసి, గాలితో చల్లబరచిన కండెన్సర్లతో కలిపి ఉంటాయి. పెద్ద కొలిమిలో ఈ రిటార్ట్లను అధిక సంఖ్యల్లో అరలుగా ఏర్పాటు చేస్తారు. వాయువులను మండించి రిటార్ట్లను 1100°C వద్దకు వేడిచేస్తారు. ఐరన్ ఫలకాలతో చేసిన “ప్రొలాంగ్” (Prolongs) లను కండెన్సర్లకు జతచేస్తారు. మట్టి కండెన్సర్లలోకి ప్రొలాంగ్లలోకి మలినలోహం చేరుకుంటుంది. ఈ లోహంలో జింక్ ఆక్సైడ్ కలిసి ఉంటుంది. దీన్ని “జింక్ డస్ట్” (zinc dust) అంటారు. కొంత జింక్ లోహం ద్రవస్థితిలో ఉంటుంది. దీన్ని అచ్చుల్లో పోసి ఘనీభవింపచేస్తారు. ఈ లోహాన్ని జింక్ స్పెక్టర్ (zinc spelter) అంటారు.
ZnO + C → Zn + CO;
ZnO + CO → Zn + CO2.
ప్రశ్న 17.
కాపర్ నిష్కర్షణలో ప్రగలనం పద్ధతిని వివరించండి.
జవాబు:
ప్రగలనం :
భర్జన ఫలితంగా వచ్చిన ధాతువుతో కొంచెం కోక్, ఇసుక (సిలికా)ను కలిపి బ్లాస్ట్ కొలిమిలో ప్రగలనం చేసి ద్రవీకృతం చేస్తారు. కోక్ దహనానికి కావలసిన గాలిని కొలిమి అడుగు భాగాన్న ఉన్న ‘టయర్స్’ నుంచి లోపలికి పంపుతారు. కాపర్, ఐరన్ సల్ఫైడ్ ఆక్సీకరణం ఇంకొంచెం ఎక్కువగా జరుగుతుంది. క్రింది చర్యలలో చూపించినట్లుగా ఐరన్ సిలికేట్ లోహమలం ఏర్పడుతుంది.

ప్రశ్న 18.
విద్యుత్ లోహ సంగ్రహణాన్ని సోదాహరణంగా వివరించండి.
జవాబు:
విద్యుత్ లోహ సంగ్రహణం :
ఏ లోహ సంగ్రహణంలో అయితే విద్యుత్ కొలిమిలు, విద్యుద్విశ్లేషణ పద్ధతులు మరియు ఇతర విద్యుత్ ప్రక్రియలు ఉపయోగిస్తారో దానిని విద్యుత్ లోహ సంగ్రహణం అంటారు.
గలన లోహ లవణ క్షయకరణంలో విద్యుద్విశ్లేషణ వాడతారు. అటువంటి పద్ధతులు విద్యుత్ రసాయన. నియమాలపై ఆధారపడతాయి.
ఆ నియమాలు ఈ క్రింది సమీకరణం ద్వారా అర్థమవుతాయి.
∆G° = – n FE°
n = ఎలక్ట్రాన్ల సంఖ్య
E° = ఎలక్ట్రోడ్ పొటెన్షియల్
అల్యూమినాను విద్యుద్విశ్లేషణం చేయుట :
పరిశుద్ధ అల్యూమినాను కరిగించిన క్రయొలైట్లో కరిగించి దానిని పెద్ద ఇనుప తొట్టెలో తీసుకుంటారు. ఈ తొట్టె కాథోడ్గా పనిచేస్తుంది. విద్యుద్విశ్లేష్యంలో మునిగేటట్లుగా వ్రేలాడదీయబడిన కార్బన్ కడ్డీలు ఆనోడ్గా పని చేస్తాయి. ఉష్ణోగ్రతను సుమారు 1000°C వద్ద ఉండేట్లుగా చూస్తారు.
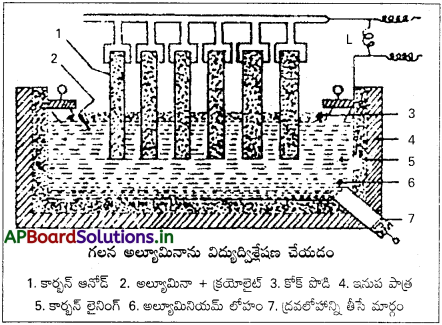
విద్యుత్ను ప్రసారం చేయగానే విద్యుద్విశ్లేషణం జరిగి కాథోడ్ వద్ద అల్యూమినియం, ఆనోడ్ వద్ద O2 వాయువు ఏర్పడతాయి. ఆనోడ్ వద్ద వెలువడిన 02 వాయువు దానితో చర్య జరిపి తినివేయబడటం వలన ఆనోడు తరచుగా మార్చుతూ ఉండాలి.
విద్యుద్విశ్లేషణలో జరిగే చర్యలు (ఊహించబడిన)
AlF3 → Al+3 + 3F– (అయనీకరణం)
Al+3 + 3e– → Al (కాథోడ్)
F– → F + e– (ఆనోడ్)
2A2O3 + 12F → 4lF3 + 3O2 (ఆనోడ్)
![]()
ప్రశ్న 19.
బాక్సైట్ నుంచి అల్యూమినియమ్ నిష్కర్షణను క్లుప్తంగా వివరించండి.
జవాబు:
అల్యూమినియమ్ సంగ్రహణ :
ముఖ్య ఖనిజాలు :
- కోరండం : Al2O3
- డయాస్పోర్ : Al2O3.H2O
- బాక్సైట్ : Al2O3. 2H2O
- గిబ్సైట్ : Al2O3. 3H2O
- క్రయొలైట్ : Na3 AlF6
అల్యూమినియంను ముఖ్యంగా బాక్సైట్ నుండి సంగ్రహిస్తారు. దీని సంగ్రహణలో మూడు దశలు ఉన్నాయి. అవి 1) బాక్సైట్ను శుద్ధి చేయుట 2) అల్యూమినాను విద్యుత్ క్షయకరణం చెందించుట, 3) లోహాన్ని శుద్ధిచేయుట.
1. బాక్సైట్ను శుద్ధిచేయుట :
ఐరన్ ఆక్సైడ్ మలినంగా ఉన్న బాక్సైట్ను (ఎర్రబాక్సైట్) బేయర్ లేదా హాల్ పద్ధతిని ఉపయోగించి శుద్ధి చేస్తారు. సిలికా మలినం ఉన్న బాక్సైట్ను తెల్ల బాక్సైట్ అంటారు. దీనిని సర్పెక్ పద్ధతి ద్వారా శుద్ధి చేస్తారు.
బేయర్ పద్ధతి :
బాక్సైట్ను మెత్తగా చూర్ణంచేసి భర్జనం చేస్తారు. అపుడు ఫెర్రస్ ఆక్సైడ్ ఫెర్రిక్ ఆక్సైడ్గా మారుతుంది. తరువాత గాఢ NaOH ద్రావణంతో ఆటోక్లేవ్లో 150°C వద్ద ఉడకబెడతారు. అపుడు ధాతువులోని అల్యూమినా కరిగి ద్రావణంలోకి పోతుంది. Fe2O3 మాత్రం కరగదు.
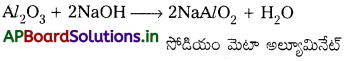
ద్రావణాన్ని వడపోసి మలినాలను వేరు చేస్తారు. గాలిత ద్రవానికి అపుడే అవక్షేపించబడిన Al(OH)3, అవక్షేపాన్ని కలిపి కొన్ని గంటలు కలియబెడతారు. అపుడు ద్రావణంలోని సోడియం మెటా అల్యూమినేట్ జల విశ్లేషణం చెంది Al(OH)3 అవక్షేపాన్ని ఇస్తుంది.
2NaAlO2 + 4H2O → 2Al(OH)3 + 2NaOH
అట్లేర్పడ్డ అవక్షేపాన్ని వడపోసి, నీటితో కడిగి, ఆరబెట్టి 1200°C పద్ద తీవ్రంగా వేడి చేస్తారు. అనార్ధ్ర Al2O3 ఏర్పడుతుంది.
![]()
హాల్ పద్ధతి :
బాక్సెట్ను చూర్ణంచేసి Na2CO3 తో గలనం చేస్తారు. సోడియం మెటా అల్యూమినేట్ ఏర్పడుతుంది. దీనిని నీటితో నిష్కర్షణ చేస్తారు. అపుడు Fe2O3 మలినాలు మిగిలిపోయి సోడియం మెటా అల్యూమినేట్ ద్రావణంలోకి పోతుంది.
Al2O3 + Na2CO3 → 2 NaAlO2 + CO2.
ద్రావణాన్ని వడపోసి మలినాలను వేరు చేస్తారు. గాలిత ద్రవాన్ని 50°C – 60°C కు వేడిచేసి దానిలోనికి CO2 వాయువును -పంపుతారు. జలవిశ్లేషణం జరిగి అల్యూమినియం హైడ్రాక్సైడ్ అవక్షేపం ఏర్పడుతుంది.
2NaAlO2 + 3H2O + CO2 – 2Al(OH)3 + Na2CO3
అట్లేర్పడ్డ అవక్షేపాన్ని వడపోసి, నీటితోకడిగి. ఆరబెట్టి 1200°C వద్ద తీవ్రంగా వేడి చేస్తారు. అనార్ద్ర Al2O, ఏర్పడుతుంది. సర్పక్ విధానం : బాక్సైట్ను మెత్తగా చూర్ణంచేసి కోక్ కలిపి నైట్రోజన్ వాయువును పంపుతూ 1800°C వద్ద వేడిచేస్తారు. అపుడు SiO2 కోక్ చేత సిలికాన్ గా క్షయకరణం చెందించబడి బాష్పంగా మారి బయటకు పోతుంది.
SiO2 + 2C → Si + 2CO.
అదే సందర్భంలో అల్యూమినా, అల్యూమినియం నైట్రైడ్గా మారుతుంది.
Al2O3 + 3C + N2 → 2Al N + 3CO
అట్లేర్పడిన అల్యూమినియం నైట్రైడ్ ను నీటితో మరిగిస్తారు. అల్యూమినియం హైడ్రాక్సెడ్ అవక్షేపం ఏర్పడుతుంది.
AlN + 3H2O → Al(OH)3 + NH3
Al(OH)3 అవక్షేపాన్ని వడపోసి, నీటితో కడిగి, 1200°C వద్ద తీవ్రంగా వేడిచేస్తారు. పరిశుద్ధమైన అల్యూమినా ఏర్పడుతుంది.
Al(OH)3 → Al2O3 + 3H2O

అల్యూమినాను విద్యుద్విశ్లేషణం చేయుట :
పరిశుద్ధ అల్యూమినాను కరిగించిన క్రయొలైట్లో కరిగించి దానిని పెద్ద ఇనుప తొట్టెలో తీసుకుంటారు. ఈ తొట్టె కాథోడ్గా పనిచేస్తుంది. విద్యుద్విశ్లేష్యంలో మునిగేటట్లుగా వ్రేలాడదీయబడిన కార్బన్ కడ్డీలు ఆ నో డ్ గా పని చేస్తాయి. ఉష్ణోగ్రతను సుమారు 1000°C వద్ద ఉండేట్లుగా చూస్తారు.
విద్యుత్ను ప్రసారం చేయగానే విద్యు ద్విశ్లేషణం జరిగి కాథోడ్ వద్ద అల్యూమినియం, ఆనోడ్ వద్ద 02 వాయువు ఏర్పడతాయి. ఆనోడ్ వద్ద వెలువడిన 02 వాయువు దానితో చర్య జరిపి తినివేయబడటం వలన ఆనోడు తరచుగా మార్చుతూ ఉండాలి.
విద్యుద్విశ్లేషణలో జరిగే చర్యలు (ఊహించబడిన)
AlF3 → Al+3 + 3F– (అయనీకరణం)
Al+3 + 3е– → Al (కాథోడ్)
F– → F + e– (ఆనోడ్)
2Al2O3 + 12F → 4AlF3 + 3O2 (ఆనోడ్)
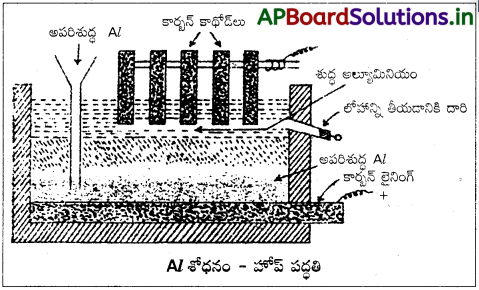
అల్యూమినియం లోహాలను శుద్ధిచేయుట :
ఈ పద్ధతిలో కార్బన్ లైనింగ్ ఉన్న ఇనుడుతొట్టె ఉంటుంది. దీనిలో మూడు పొరలు ఉంటాయి. క్రింది పొరలో కాపర్, సిలికాన్ మలినాలు ఉన్న అల్యూమినియం ఉంటుంది. ఇది ఆనోడ్గా పనిచేస్తుంది. మధ్యపొరలో (క్రయొలైట్ + బేరియం ఫ్లోరైడ్) మిశ్రమం ఉంటుంది. ఇది ఎలక్ట్రోలైట్గా పనిచేస్తుంది. పై పొరలో శుద్ధమైన అల్యూమినియంఉంటుంది. ఇది కాథోడ్గా పనిచేస్తుంది. విద్యుత్ ను పంపినప్పుడు మధ్యపొరనుండి అల్యూమినియం పై పొరలోకి చేరుకుంటుంది. అంతే పరిమాణం ఉన్న అల్యూమినియం అడుగు నుండి మధ్య పొరకు చేరుకుంటుంది. పై పొరనుండి ఎప్పటికప్పుడు అల్యూమినియంను తీసివేస్తారు. ఈ విధంగా లభించిన అల్యూమినియం 99.9% శుద్ధత్వం కలిగి ఉంటుంది.
దీర్ఘ సమాధాన ప్రశ్నలు
ప్రశ్న 1.
ఒక నిర్దిష్ట విషయంలో క్షయకారిణి ఎంపిక ఉష్ణగతిక ప్రభావకంపై ఆధారపడి ఉంటుంది. రెండు ఉదాహరణలతో వివరించండి.
జవాబు:
ఒక నిర్దిష్ట విషయంలో క్షయకరణి ఎంపిక ఉష్ణగతిక ప్రభావకంపై ఆధారపడి ఉంటుంది. ఈ విషయం ఈ క్రింది ఉదాహరణలను పరిగణనలోనికి తీసుకొనుట ద్వారా వివరించబడింది.
C, CO లలో 673 వద్ద కార్బన్ మోనాక్సైడ్ (CO) మంచి క్షయకరణి.
- 983K మరియు ఆపై ఉష్ణోగ్రత వద్ద కోక్ (C) మంచి క్షయకరణి.
- పై పరిశీలనలు ఎల్లింగ్రమ్ పటాల నుండి గమనించబడినవి.
CO ను ఉపయోగించి జింక్ ఆక్సైడ్ను క్షయకరణం చేయట ద్వారా జింక్ను నిష్కర్షణం చేయరు.
వివరణ :
2Zn + O2 → 2ZnO, ∆G° = -650 kJ
2CO + O2 → 2CO2, ∆G° = -450 kJ
2ZnO + 2CO → 2Zn + 2CO2, ∆G° = 200 kJ
∆G° విలువ ధనాత్మకం అయినచో చర్య పురోగమించదు.
కాపర్ నిష్కర్షణ దాని ఆక్సైడ్ ముడిఖనిజాన్ని క్షయకరణం చేయడం ద్వారా కంటే పైరైటిస్ నుండి ఎక్కువ కష్టం.
వివరణ :
పైరైటిస్ (Cu2S), కార్బన్ లేదా హైడ్రోజన్లతో క్షయకరణం చెందదు. ఎందువలన అనగా దాని ప్రమాణ స్వేచ్ఛాశక్తి ఏర్పాటు విలువ (∆G°) CS2 మరియు H2S కన్నా ఎక్కువ.
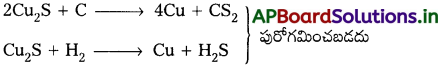
కాపర్ ఆక్సైడ్ యొక్క ∆G° విలువ CO2 కన్నా తక్కువ.
సల్ఫైడ్ ధాతువు మొదట ఆక్సైడ్గా భర్జన ప్రక్రియ ద్వారా మార్చబడుతుంది తరువాత క్షయకరణం చెందును.
ప్రశ్న 2.
జింక్ బ్లెండ్ నుంచి జింక్ నిష్కర్షణాన్ని వివరించండి.
జవాబు:
జింక్ లోహ సంగ్రహణ :
జింక్ యొక్క ముఖ్య ధాతువులు :
జింక్ బ్లెండ్ ———- ZnS
జింకైట్ ———- ZnO
కాలమిన్ —— ZnCO3
వీటిలో “జింక్ బ్లెండ్” ముఖ్యమైనది.
వివిధ దశలు :
i) పొడి చేయడం :
ధాతువును “బాల్ మిల్”లలో మెత్తని చూర్ణంగా చేస్తారు.
ii) ధాతువును సాంద్రీకరణం చేయడం :
ధాతువును మొదటి గురుత్వ లక్షణాధార సాంద్రీకరణం చేస్తారు. ఇందులో పొడిగా చేసిన ధాతువును విల్లే బల్ల (Wilfley’s table) లపై నీటి ప్రవాహంలో కడుగుతారు. ఈ బల్ల పై భాగం ముడతలు పడినట్లుగా ఉన్న (corrugated) రేకులా ఉంటుంది. పైగా అది కదులుతూ ఉంటుంది. ఈ కదలికల వల్ల తేలికపాటి ‘గాంగ్’ కణాలు ప్రవాహంలో కొట్టుకునిపోతాయి. భారఖనిజ కణాలు బల్ల అడుగు భాగానికి చేరుకుంటాయి. ఈ విధానంలో ధాతువు పాక్షికంగా సాంద్రీకరణ చెందుతుంది.
పాక్షికంగా సాంద్రీకరణం చెందిన ధాతువును ప్లవన క్రియ ద్వారా మరింత సాంద్రీకరణం చేస్తారు. ఇందులో ధాతు కణాలు నురుగుతో పాటు వేరవుతాయి.
అప్పుడు గాంగ్లో ఐరన్ ఆక్సైడ్ ఉంటే విద్యుదయస్కాంత పద్ధతిలో పూర్తిగా సాంద్రీకృతమవుతుంది. ఐరన్ ఆక్సైడ్ అయస్కాంత పదార్థం అవడం వల్ల అయస్కాంత ధృవానికి సమీపంలో కుప్పగా పడుతుంది.
iii) పైన వచ్చిన సాంద్రీకృత ధాతువును రోటరీ షెల్ఫ్ బర్నర్ (rotary shelf burner) లో భర్జనం చేస్తారు. ఈ బర్నర్లో భూసమాంతర షెల్ఫ్ లు (లేదా గదులు మాదిరిగా) ఉంటాయి. వాటిలో చార్జిని కలపడానికి బ్లేడ్ల లాంటి వసతి ఉంటుంది. బర్నర్పై భాగం నుంచి ధాతువును వేసి, అడుగు నుంచి జింక్ ఆక్సైడ్ను తీసుకుంటారు. కింద ఇచ్చిన చర్యలు బర్నర్లో భర్జనం చేసినప్పుడు జరుగుతాయి.
2ZnS + 3O2 → 2ZnO + 2SO2
ZnS + 2O2 → ZnSO4
2ZnSO4 → 2ZnO + 2SO2 + O2.
లోహనిష్కర్షణకు ప్రారంభ పదార్థం కాలిమిన్ అయితే దాన్ని సరాసరి భస్మీకరణం చేస్తారు. జింక్ ఆక్సైడ్ ఏర్పడుతుంది.
![]()
iv)క్షయకరణం :
ఆక్సైడు లోహంగా క్షయకరణం చేయడానికి మూడు పద్ధతులు వాడుకలో ఉన్నాయి. ఎక్కువ వాడకంలో ఉన్న పద్ధతి “బెల్జియన్ పద్ధతి”. ఈ పద్ధతిలో భర్జనం చేసిన ధాతువుతో బొగ్గు లేదా కోక్తో బాగా కలుపుతారు. దాన్ని కొలిమి బంక మట్టితోగాని, మట్టితోగాని చేసిన రిటార్ట్లలోకి తీసుకుంటారు. ఈ రిటార్టు సీసాల ఆకారంలో ఉండే గొట్టాలు. వీటికి ఒక చివర మూసి ఉంటుంది. రెండో చివర మట్టితో చేసి, గాలితో చల్లబరచిన కండెన్సర్లతో కలిపి ఉంటాయి. పెద్ద కొలిమిలో ఈ రిటార్ట్లను అధిక సంఖ్యల్లో అరలుగా ఏర్పాటు చేస్తారు. వాయువులను మండించి రిటార్ట్లను 1100°C వద్దకు వేడిచేస్తారు. ఐరన్ ఫలకాలతో చేసిన “ప్రొలాంగ్” (Prolongs) లను కండెన్సర్లకు జతచేస్తారు. మట్టి కండెన్సర్లలోకి ప్రొలాంగ్లలోకి మలినలోహం చేరుకుంటుంది. ఈ లోహంలో జింక్ ఆక్సైడ్ కలిసి ఉంటుంది. దీన్ని “జింక్ డస్ట్” (zinc dust) అంటారు. కొంత జింక్ లోహం ద్రవస్థితిలో ఉంటుంది. దీన్ని అచ్చుల్లో పోసి ఘనీభవింపచేస్తారు. ఈ లోహాన్ని జింక్ స్పెక్టర్ (zinc spelter) అంటారు.
ZnO + C → Zn + CO;
ZnO + CO → Zn + CO2.
![]()
ప్రశ్న 3.
బ్లాస్ట్ కొలిమిలో ఐరన్ నిష్కర్షణలో జరిగే చర్యలను వివరించండి.
జవాబు:
బ్లాస్ట్ కొలిమిలో వివిధ ఉష్ణోగ్రత అవధుల్లో ఐరన్ ఆక్సైడ్ క్షయకరణం జరుగుతుంది. కొలిమి అడుగు భాగం నుంచి వేడి గాలిని పంపుతారు. కింది భాగంలోనే దాదాపు 2200K ఉష్ణోగ్రత ఉండేటట్లు కోక్ను మండిస్తారు. ఈ పద్ధతికి కావాల్సిన ఎక్కువ ఉష్ణాన్ని, మండే బొగ్గు సరఫరా చేస్తుంది. CO, ఉష్ణం కొలిమి పై భాగంలో చేరతాయి. పై భాగంలో ఉష్ణోగ్రత తక్కువ. పై భాగం నుంచి వచ్చే ఐరన్ ఆక్సైడ్లు (Fe2O3, Fe3O4) అంచెలంచెలుగా FeO గా క్షయకరణం చెందుతాయి. కాబట్టి తక్కువ ఉష్ణోగ్రత అవధుల్లో, ఎక్కువ ఉష్ణోగ్రత అవధుల్లో జరిగే క్షయకరణ చర్యలు, ∆rGΘ కి, T కి గీసిన పటాలలో వాటి రేఖాపటాల ఖండన బిందువుల మీద ఆధారపడి ఉంటాయి. ఈ చర్యలను కింది విధంగా కలిపి చూపించవచ్చు.
500 – 800 K వద్ద (బ్లాస్ట్ కొలిమిలో తక్కువ ఉష్ణోగ్రతా అవధుల్లో)
3 Fe2O3 + CO → 2 Fe3O4 + CO2
Fe3O4 + 4 CO → 3 Fe + 4 CO2
Fe2O3 + CO → 2 FeO + CO2
900 – 1500 K వద్ద (బ్లాస్ట్ కొలిమిలో ఎక్కువ ఉష్ణోగ్రత అవధి) :
C + CO2 → 2 CO
FeO + CO → Fe + CO2
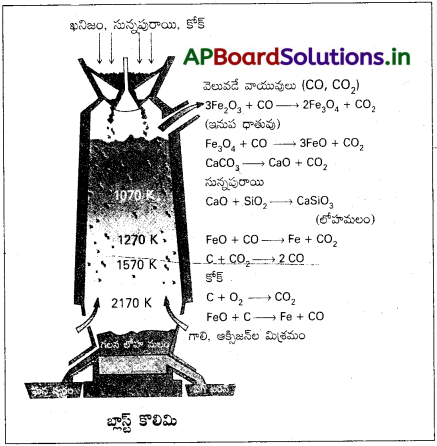
సున్నపురాయి CaOగా విఘటనం చెంది, ముడి ఖనిజంలోని సిలికేట్ మాలిన్యాన్ని CaSiO3 లోహమలంగా వేరుపరుస్తుంది. లోహమలం గలన స్థితిలో ఉండి. ఐరన్ నుంచి వేరవుతుంది.
బ్లాస్ట్ కొలిమి నుంచి లభించే ఐరన్లో దాదాపు 4% కార్బన్, తక్కువ మొత్తంలో చాలా మాలిన్యాలు (ఉదా : S, P, Si, Mn) ఉంటాయి. దీనిని పిగ్ ఐరన్ అంటారు. పోత ఇనుము, (కాస్ట్ ఐరన్), పిగ్ ఐరన్ (దుక్క ఇనుము) రెండూ వేరు వేరు. దుక్క ఇనుమును బొగ్గుతో వేడిగాలిని ఉపయోగించి ద్రవీభవనం చేస్తే పోత ఇనుము తయారవుతుంది. దీనిలో కొంచెం తక్కువ కార్బన్ (దాదాపు 3%) ఉంటుంది. ఇది చాలా ‘గట్టిగా, పెళుసుగా ఉంటుంది.
ప్రశ్న 4.
కాపర్ పైరైటిస్ నుంచి కాపర్ నిష్కర్షణాన్ని విశదీకరించండి.
జవాబు:
కాపర్ ఉనికి, నిష్కర్షణ సూత్రాలు :
మానవ జాతికి అనాదిగా కాపర్ గురించి తెలుసు. “Cuprum” అనే పదం నుంచి దీని సంకేతం ‘Cu’ వచ్చింది.
a) ఉనికి :
మూలకస్థితిలో కాపర్ లోహం చాలా తక్కువగా లభిస్తుంది. అది ఎక్కువగా ఆక్సీ సమ్మేళనాలుగానూ, సల్ఫర్ సమ్మేళనాలుగానూ లభిస్తుంది. కాపర్ ముఖ్యఖనిజాలు.
| ఖనిజం పేరు | ఫార్ములా |
| “క్యుప్రైట్” లేదా “రూబికాపర్” | Cu2O |
| కాపర్ గ్లాన్స్ | Cu2S |
| కాపర్ పైరైటీస్ | CuFeS2 లేదా Cu2S . Fe2S3. |
మాలకైట్, అజురైట్లు ఇతర ఖనిజాలు (ఫార్ములాల కోసం సాధారణ లోహ నిష్కర్షణను చూడండి).
b) కాపర్ నిష్కర్షణ :
కాపర్ మూలకాన్ని దాని సల్ఫైడ్ ఖనిజం నుంచి ముఖ్యంగా తయారుచేస్తారు. ధాతువును బట్టి దానికి చేసే అభిచర్యను ‘నిర్ణయిస్తారు.
సల్ఫైడ్ ధాతువుల నుంచి నిష్కర్షణ :
కాపర్ లోహానికి ముఖ్యధాతువు కాపర్ పైరైటీస్. ప్రగలన పద్ధతిలో కాపర్ లోహాన్ని ధాతువు నుంచి పొందుతారు. ఈ చర్యలో వివిధ దశలను క్రింద ఇచ్చాం.
i) ధాతువును “జా క్రషర్స్” (Jaw crushers) లోనూ తరవాత ‘బాల్ మిల్స్’ (ball mills) లోనూ వేసి మెత్తని చూర్ణంగా చేస్తారు. ఈ చూర్ణస్థితిలోని ధాతువును ప్లవన క్రియతో గాఢపరుస్తారు. ధాతు చూర్ణాన్ని నీటిలో అవలంబింపచేస్తారు. దానికి కొద్దిపాటి ‘పైన్ ఆయిల్’ (pine oil) ను కలుపుతారు. దాని తరువాత ఆ మిశ్రమంలోని బాగా గాలిని పంపి కలుపుతారు. అప్పుడు ఏర్పడిన నురుగుతో పాటు ధాతుకణాలు దాదాపు పూర్తిగా కలిసి వస్తాయి. తొట్టి అడుగుభాగానికి ‘గాంగ్’ చేరుకుంటుంది. నురుగును వేరు చేసి దాదాపు 95 శాతం శుద్ధ ధాతువును పొందుతారు.
ii) రివర్బొరేటరీ కొలిమి హార్త్ పై అధికంగా గాలిని పంపి ధాతువును భర్జనం చేస్తే దానిలోని బాష్పశీలి మలినాలు (As, Sb లాంటివి) బయటికి పోతాయి. కాపర్, ఐరన్ సల్ఫైడ్ల మిశ్రమం వస్తుంది. సల్ఫైడ్లు పాక్షికంగా ఆక్సీకరణం చెంది ఆయా ఆక్సైడ్లు ఏర్పడతాయి. ఈ చర్యలు కింది విధంగా ఉంటాయి.

iii) ప్రగలనం :
భర్జన ఫలితంగా వచ్చిన ధాతువుతో కొంచెం కోక్, ఇసుక (సిలికా)ను కలిపి బ్లాస్ట్ కొలిమిలో ప్రగలనం చేసి ద్రవీకృతం చేస్తారు. కోక్ దహనానికి కావలసిన గాలిని కొలిమి అడుగు భాగాన ఉన్న ‘టయర్స్’ నుంచి లోపలికి పంపుతారు. కాపర్, ఐరన్ సల్ఫైడ్ ఆక్సీకరణం ఇంకొంచెం ఎక్కువగా జరుగుతుంది. క్రింది చర్యలలో చూపించినట్లుగా ఐరన్ సిలికేట్ లోహమలం ఏర్పడుతుంది.

iv) బెస్సిమర్గీకరణం :
“మాటి” ని బెస్సిమ్హర్ కన్వర్టర్ వేస్తారు, బెస్సిమర్ కన్వర్టర్ ఒక అండాకారంలో ఉండే కొలిమి. దాన్ని ఉక్కు ప్లేటులతో చేస్తారు. ఈ కొలిమికి లైమ్తో గాని, మెగ్నీషియమ్ ఆక్సైడ్తో గాని క్షార లైనింగ్ ఇస్తారు. (ఇవి డోలమైట్ లేదా మాగ్నసైట్ నుంచి చేస్తారు). కన్వర్టర్ను ట్రానియన్ (Trunnions) ల సహాయంతో పట్టి ఉంచుతారు. దీన్ని మనకు కావలసిన వైపుకి వంపుకోవచ్చు. కొలిమి క్రింది భాగంలో ఉన్న ‘టయర్స్’ ద్వారా గాలి, ఇసుక కలిపిన వడిగాలిని పంపుతారు. ద్రవలోహం కన్వర్టర్ అడుగుభాగానికి చేరుకుంటుంది.
బ్లాస్ట్ కొలిమి జరిగే చర్యలన్నీ పూర్తి అవుతాయి. దాదాపు ఐరన్ పూర్తిగా లోహమలం రూపంలో తీసివేయబడుతుంది. క్యుప్రస్ ఆక్సైడ్, క్యుప్రస్ సల్ఫైడ్లు చర్య జరిపి కాపర్ లోహం ఏర్పడుతుంది.
2 Cu2O + Cu2S → 6 Cu + SO2
ద్రవ లోహాన్ని ఇసుక అచ్చుల్లో పోసి చల్లారుస్తారు. SO2 వాయువు బయటికి పోతుంది. అలా ఏర్పడిన కాపర్ను “బ్లిష్టర్ కాపర్” అంటారు. దీనిలో శుద్ధత దాదాపు 98% ఉంటుంది.

v) లోహ శుద్ధి :
“బ్లిష్టర్-కాపర్”ను విద్యు ద్విశ్లేషణ ద్వారా శుద్ధి చేస్తారు. అపరిశుద్ద కాపర్ లోహ ఫలకాలను ఆనోడ్గా వాడతారు. లెడ్ లైనింగ్ చేసిన తొట్టిలో కాపర్ (II) సల్ఫేట్ ద్రావణం పోసి అందులో వాటిని వేలాడదీస్తారు. పలచటి కాపర్ రేకులు కాథోడ్గా పనిచేస్తాయి. కాథోడ్ రేకులపై గ్రాఫైట్తో పూతపూస్తారు. విద్యుద్విశ్లేషణ చేస్తే కాథోడ్లపై శుద్ద కాపర్ నిక్షిప్తమవుతుంది. ఈ పద్దతిలో లభించే కాపర్ శుద్ధత 100% ఉంటుంది.
ప్రశ్న 5.
బాక్సైట్ నుంచి అల్యూమినియమ్ నిష్కర్షణంలో ఉన్న వివిధ అంచెలను వివరించండి.
జవాబు:
అల్యూమినియమ్ సంగ్రహణ :
ముఖ్య ఖనిజాలు :
- కోరండం : Al2O3
- డయాస్పోర్ : Al2O3.H2O
- బాక్సైట్ : Al2O3. 2H2O
- గిబ్సైట్ : Al2O3. 3H2O
- క్రయొలైట్ : Na3 AlF6
అల్యూమినియంను ముఖ్యంగా బాక్సైట్ నుండి సంగ్రహిస్తారు. దీని సంగ్రహణలో మూడు దశలు ఉన్నాయి. అవి 1) బాక్సైట్ను శుద్ధి చేయుట 2) అల్యూమినాను విద్యుత్ క్షయకరణం చెందించుట, 3) లోహాన్ని శుద్ధిచేయుట.
1. బాక్సైట్ను శుద్ధిచేయుట :
ఐరన్ ఆక్సైడ్ మలినంగా ఉన్న బాక్సైట్ను (ఎర్రబాక్సైట్) బేయర్ లేదా హాల్ పద్ధతిని ఉపయోగించి శుద్ధి చేస్తారు. సిలికా మలినం ఉన్న బాక్సైట్ను తెల్ల బాక్సైట్ అంటారు. దీనిని సర్పెక్ పద్ధతి ద్వారా శుద్ధి చేస్తారు.
బేయర్ పద్ధతి :
బాక్సైట్ను మెత్తగా చూర్ణంచేసి భర్జనం చేస్తారు. అపుడు ఫెర్రస్ ఆక్సైడ్ ఫెర్రిక్ ఆక్సైడ్గా మారుతుంది. తరువాత గాఢ NaOH ద్రావణంతో ఆటోక్లేవ్లో 150°C వద్ద ఉడకబెడతారు. అపుడు ధాతువులోని అల్యూమినా కరిగి ద్రావణంలోకి పోతుంది. Fe2O3 మాత్రం కరగదు.
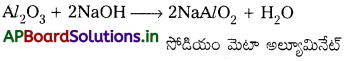
ద్రావణాన్ని వడపోసి మలినాలను వేరు చేస్తారు. గాలిత ద్రవానికి అపుడే అవక్షేపించబడిన Al(OH)3, అవక్షేపాన్ని కలిపి కొన్ని గంటలు కలియబెడతారు. అపుడు ద్రావణంలోని సోడియం మెటా అల్యూమినేట్ జల విశ్లేషణం చెంది Al(OH)3 అవక్షేపాన్ని ఇస్తుంది.
2NaAlO2 + 4H2O → 2Al(OH)3 + 2NaOH
అట్లేర్పడ్డ అవక్షేపాన్ని వడపోసి, నీటితో కడిగి, ఆరబెట్టి 1200°C పద్ద తీవ్రంగా వేడి చేస్తారు. అనార్ధ్ర Al2O3 ఏర్పడుతుంది.
![]()
హాల్ పద్ధతి :
బాక్సెట్ను చూర్ణంచేసి Na2CO3 తో గలనం చేస్తారు. సోడియం మెటా అల్యూమినేట్ ఏర్పడుతుంది. దీనిని నీటితో నిష్కర్షణ చేస్తారు. అపుడు Fe2O3 మలినాలు మిగిలిపోయి సోడియం మెటా అల్యూమినేట్ ద్రావణంలోకి పోతుంది.
Al2O3 + Na2CO3 → 2 NaAlO2 + CO2.
ద్రావణాన్ని వడపోసి మలినాలను వేరు చేస్తారు. గాలిత ద్రవాన్ని 50°C – 60°C కు వేడిచేసి దానిలోనికి CO2 వాయువును -పంపుతారు. జలవిశ్లేషణం జరిగి అల్యూమినియం హైడ్రాక్సైడ్ అవక్షేపం ఏర్పడుతుంది.
2NaAlO2 + 3H2O + CO2 – 2Al(OH)3 + Na2CO3
అట్లేర్పడ్డ అవక్షేపాన్ని వడపోసి, నీటితోకడిగి. ఆరబెట్టి 1200°C వద్ద తీవ్రంగా వేడి చేస్తారు. అనార్ద్ర Al2O, ఏర్పడుతుంది. సర్పక్ విధానం : బాక్సైట్ను మెత్తగా చూర్ణంచేసి కోక్ కలిపి నైట్రోజన్ వాయువును పంపుతూ 1800°C వద్ద వేడిచేస్తారు. అపుడు SiO2 కోక్ చేత సిలికాన్ గా క్షయకరణం చెందించబడి బాష్పంగా మారి బయటకు పోతుంది.
SiO2 + 2C → Si + 2CO.
అదే సందర్భంలో అల్యూమినా, అల్యూమినియం నైట్రైడ్గా మారుతుంది.
Al2O3 + 3C + N2 → 2Al N + 3CO
అట్లేర్పడిన అల్యూమినియం నైట్రైడ్ ను నీటితో మరిగిస్తారు. అల్యూమినియం హైడ్రాక్సెడ్ అవక్షేపం ఏర్పడుతుంది.
AlN + 3H2O → Al(OH)3 + NH3
Al(OH)3 అవక్షేపాన్ని వడపోసి, నీటితో కడిగి, 1200°C వద్ద తీవ్రంగా వేడిచేస్తారు. పరిశుద్ధమైన అల్యూమినా ఏర్పడుతుంది.
Al(OH)3 → Al2O3 + 3H2O

అల్యూమినాను విద్యుద్విశ్లేషణం చేయుట :
పరిశుద్ధ అల్యూమినాను కరిగించిన క్రయొలైట్లో కరిగించి దానిని పెద్ద ఇనుప తొట్టెలో తీసుకుంటారు. ఈ తొట్టె కాథోడ్గా పనిచేస్తుంది. విద్యుద్విశ్లేష్యంలో మునిగేటట్లుగా వ్రేలాడదీయబడిన కార్బన్ కడ్డీలు ఆ నో డ్ గా పని చేస్తాయి. ఉష్ణోగ్రతను సుమారు 1000°C వద్ద ఉండేట్లుగా చూస్తారు.
విద్యుత్ను ప్రసారం చేయగానే విద్యు ద్విశ్లేషణం జరిగి కాథోడ్ వద్ద అల్యూమినియం, ఆనోడ్ వద్ద 02 వాయువు ఏర్పడతాయి. ఆనోడ్ వద్ద వెలువడిన 02 వాయువు దానితో చర్య జరిపి తినివేయబడటం వలన ఆనోడు తరచుగా మార్చుతూ ఉండాలి.
విద్యుద్విశ్లేషణలో జరిగే చర్యలు (ఊహించబడిన)
AlF3 → Al+3 + 3F– (అయనీకరణం)
Al+3 + 3е– → Al (కాథోడ్)
F– → F + e– (ఆనోడ్)
2Al2O3 + 12F → 4AlF3 + 3O2 (ఆనోడ్)

అల్యూమినియం లోహాలను శుద్ధిచేయుట :
ఈ పద్ధతిలో కార్బన్ లైనింగ్ ఉన్న ఇనుడుతొట్టె ఉంటుంది. దీనిలో మూడు పొరలు ఉంటాయి. క్రింది పొరలో కాపర్, సిలికాన్ మలినాలు ఉన్న అల్యూమినియం ఉంటుంది. ఇది ఆనోడ్గా పనిచేస్తుంది. మధ్యపొరలో (క్రయొలైట్ + బేరియం ఫ్లోరైడ్) మిశ్రమం ఉంటుంది. ఇది ఎలక్ట్రోలైట్గా పనిచేస్తుంది. పై పొరలో శుద్ధమైన అల్యూమినియంఉంటుంది. ఇది కాథోడ్గా పనిచేస్తుంది. విద్యుత్ ను పంపినప్పుడు మధ్యపొరనుండి అల్యూమినియం పై పొరలోకి చేరుకుంటుంది. అంతే పరిమాణం ఉన్న అల్యూమినియం అడుగు నుండి మధ్య పొరకు చేరుకుంటుంది. పై పొరనుండి ఎప్పటికప్పుడు అల్యూమినియంను తీసివేస్తారు. ఈ విధంగా లభించిన అల్యూమినియం 99.9% శుద్ధత్వం కలిగి ఉంటుంది.
సాధించిన సమస్యలు Textual Examples
ప్రశ్న 1.
మెగ్నీషియమ్ అల్యూమినాను క్షయకరణం చేయగల పరిస్థితిని సూచించండి.
సాధన:
రెండు సమీకరణాలు :
a) \(\frac{4}{3}\) Al + O2 → \(\frac{2}{3}\)Al2O3
b) 2 Mg + O2 → 2MgO
చర్యకు, Al2O3, MgO రేఖాపటాల ఖండన బిందువు (ఎల్లింగ్హామ్ పటం లో “A” గా సూచించడమైంది) వద్ద కింది చర్యకు ∆GΘ ‘సున్నా’ అవుతుంది.
\(\frac{2}{3}\)Al2 O3 + 2Mg → 2MgO + \(\frac{4}{3}\)Al
ఆ బిందువు వద్ద మెగ్నీషియమ్ అల్యూమినాను క్షయకరణం చేయగలదు.
![]()
ప్రశ్న 2.
ఉష్ణగతికంగా సాధ్యమైనప్పటికీ, ఆచరణలో అల్యూమినియమ్ నిష్కర్షణలో అల్యూమినాను క్షయకరణం చేయడానికి మెగ్నీషియమ్ లోహాన్ని ఎందుకు ఉపయోగించరు?
సాధన:
Al2O3, MgO రేఖాపటాల ఖండన బిందువు కంటే తక్కువ ఉష్ణోగ్రతలలో, మెగ్నీషియమ్ అల్యూమినాను క్షయకరణం చేస్తుంది. కానీ ఈ పద్ధతి ఆర్థికంగా లాభదాయకం కాదు.
ప్రశ్న 3.
క్షయకరణ ఉష్ణోగ్రత వద్ద, లోహం ద్రవస్థితిలో ఏర్పడినట్లయితే, లోహ ఆక్సైడ్ క్షయకరణం సులభం. ఎందువల్ల?
సాధన:
ఘనస్థితిలో కంటే ద్రవస్థితిలో లోహం ఎంట్రోపి ఎక్కువ. క్షయకరణం చెందే లోహ ఆక్సైడ్ ఘనస్థితిలో, ఏర్పడే లోహం ద్రవస్థితిలో ఉంటే, ఆ క్షయకరణ పద్ధతికి ఎంట్రోపి మార్పు (∆S) విలువ ధనాత్మక దిశగా ఎక్కువగా ఉంటుంది. కాబట్టి ∆GΘ ఋణాత్మక దిశగా ఎక్కువగా ఉంటుంది, క్షయకరణం సులభం అవుతుంది.
ప్రశ్న 4.
ఒకేచోట, తక్కువ శ్రేణి కాపర్ ముడిఖనిజాలు, జింక్, ఐరన్ తుక్కు లభ్యమయినప్పుడు, రెండు తుక్కులలో ఏది నిక్షాళనం చేసిన కాపర్ ఖనిజాన్ని క్షయకరణం చేయడానికి సరిపోతుంది? ఎందువల్ల?
సాధన:
విద్యుత్ రసాయనిక శ్రేణిలో జింక్ ఐరన్ పైన ఉంటుంది (జింక్ ఎక్కువ చర్యాశీలత గల లోహం). కాబట్టి, జింక్ తుక్కును వాడినప్పుడు క్షయకరణం వేగంగా జరుగుతుంది. కానీ జింక్ ఐరన్ కంటే ఖరీదైన లోహం. కాబట్టి ఐరన్ తుక్కును వాడటం సహేతుకం.
పాఠ్యాంశ ప్రశ్నలు Intext Questions
ప్రశ్న 1.
పటంలో ఉదహరించిన ఏ ముడిఖనిజాలను అయస్కాంత వేర్పాటు పద్ధతిలో సాంద్రీకరిస్తారు?
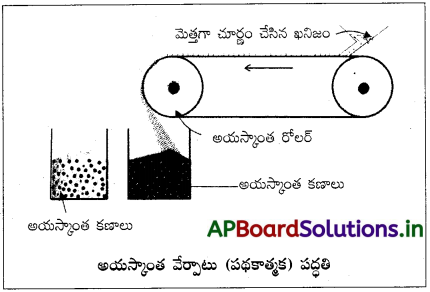
జవాబు:
అనుఘటకాలలో అయస్కాంత అనుఘటకం ఉన్న ముడి ఖనిజాన్ని (మలినం, అసలు ముడిఖనిజం) సాంద్రీకరించవచ్చు.
ఉదా : ఇనుప ముడిఖనిజాలు (హెమటైట్, మాగ్నటైట్, సిడరైట్, ఐరన్ పైరైటిస్).
ప్రశ్న 2.
అల్యూమినియమ్ నిష్కర్షణలో నిక్షాళనం ప్రాధాన్యత ఏమిటి?
జవాబు:
SiO2, Fe2O3 మొదలైన మలినాలను బాక్సైట్ ముడిఖనిజం నుంచి వేరుపరచడానికి నిక్షాళనం సాయపడుతుంది. కాబట్టి, చాలా ప్రముఖమైనది.
ప్రశ్న 3.
Cr2O3 + 2 Al → Al2O3 + 2 Cr (∆GΘ = – 421kJ) ఈ చర్య ఉష్ణగతికంగా జరిగే వీలుందని గిబ్స శక్తి విలువ నుంచి తెలుస్తుంది. కానీ, ఇది గది ఉష్ణోగ్రత వద్ద ఎందువల్ల జరగదు?
జవాబు:
ఉష్ణగతికంగా వీలైన చర్యలకు కూడా నిర్దిష్ట ఉత్తేజిత శక్తి అవసరం, కాబట్టి వేడిచేయాలి.
![]()
ప్రశ్న 4.
కొన్ని పరిస్థితులలో Mg, Al2O3ని క్షయకరణం చేయడం; Al, MgOని క్షయకరణం చేయడం నిజమా? ఆ పరిస్థితులేవి?
జవాబు:
అవును, 1350°C కి కింద Al2O3 ని Mg క్షయకరణం చేస్తుంది, 1350°C పైన, MgO ను Al క్షయకరణం చేస్తుంది.