Andhra Pradesh BIEAP AP Inter 2nd Year Chemistry Study Material Lesson 6(a) 15వ గ్రూపు మూలకాలు Textbook Questions and Answers.
AP Inter 2nd Year Chemistry Study Material Lesson 6(a) 15వ గ్రూపు మూలకాలు
అతిస్వల్ప సమాధాన ప్రశ్నలు
ప్రశ్న 1.
నైట్రోజన్ చర్యాశీలత ఫాస్ఫరస్ కంటే ఎందువల్ల భిన్నంగా ఉంటుంది?
జవాబు:
నైట్రోజన్ ద్విపరమాణుక అణువు. నైట్రోజన్ పరమాణువుల మధ్య త్రిబంధం ఉండుట వలన బంధ వియోగశక్తి (941.4 KJ /mole) ఎక్కువగా ఉంటుంది. కావున నైట్రోజన్ రసాయనికంగా జడత్వం కలిగి ఉంటుంది.
ఫాస్ఫరస్ చతుర్ పరమాణుక అణువు మరియు P-P బంధం N≡N కంటే బలహీనమైనది. P – P బంధ వియోగశక్తి 213 KJ/mole. కావున ఫాస్ఫరస్ నైట్రోజన్ కన్నా చర్యాశీలత కలిగియుండును.
ప్రశ్న 2.
ప్రయోగశాలలో నైట్రోజన్ని ఎలా తయారుచేస్తారు? రసాయన చర్యా సమీకరణాలను రాయండి.
జవాబు:
డై నైట్రోజన్ తయారీ :
→ బేరియం అజైడ్ను ఉష్ణ వియోగ చర్యకు గురి చేయడం ద్వారా అత్యంత స్వచ్ఛమైన డైనైట్రోజను పొందవచ్చు.
Ba(N3)2 → Ba + 3N2·
→ ప్రయోగశాలలో అమ్మోనియమ్ క్లోరైడ్ జల ద్రావణాన్ని సోడియం నైట్రైట్తో చర్య జరుపగా డై నైట్రోజన్ ఏర్పడును.
NH4Cl(జల) + NaNO2(జల) → N2(వా) + 2H2Oద్ర + NaCl(జల)
→ అమ్మోనియమ్ డైక్రోమేట్ను ఉష్ణ వియోగ చర్యకు గురిచేయడం ద్వారా డైనైట్రోజన్ ను పొందవచ్చు.
![]()
ప్రశ్న 3.
నైట్రోజన్ ద్విపరమాణుక అణువుగాను, ఫాస్ఫరస్ P4గాను ఉంటాయి. ఎందువల్ల? [TS. Mar.’15]
జవాబు:
నైట్రోజన్ ద్విపరమాణుక అణువు :
నైట్రోజన్ తక్కువ పరమాణు పరిమాణం మరియు అధిక ఋణ విద్యుదాత్మకత కలిగిన మూలకం. నైట్రోజన్ పరమాణువు Pπ – Pπ బహు బంధాలను ఏర్పరచును (త్రికబంధం). కావున అది ద్విపరమాణుక అణువుగా ఉంటుంది.
ఫాస్పరస్ P4 అణువు :
ఫాస్ఫరస్ ఎక్కువ పరమాణు పరిమాణం మరియు తక్కువ ఋణ విద్యుదాత్మకత కలిగి ఉండును. ఫాస్ఫరస్ P-P ఏకబంధాలను ఏర్పరచును. కావున P4 గా ఉంటుంది.
ప్రశ్న 4.
ఫాస్ఫరస్ కంటే నైట్రోజన్ తక్కువ కాటనేషన్ ధర్మాలను చూపించడానికి గల కారణమేమిటి?
జవాబు:
→ N-N ఏకబంధం P-P ఏకబంధం కన్నా బలహీనమైనది. దీనికి కారణం నైట్రోజన్లో అబంధక ఎలక్ట్రాన్ల వల్ల అధిక అంతర ఎలక్ట్రాన్ వికర్షణలు ఏర్పడతాయి మరియు నైట్రోజన్లో బంధ దైర్ఘ్యం తక్కువగా ఉండుటయే. కావున ఫాస్ఫరస్ కంటే నైట్రోజన్ తక్కువ కాటనేషన్ సామర్థ్యం కలిగి ఉంటుంది.
ప్రశ్న 5.
నైట్రోజన్ అణువుకు అధిక స్థిరత్వం ఉంటుంది. ఎందువల్ల?
జవాబు:
నైట్రోజన్ ద్విపరమాణుక అణువులో రెండు నైట్రోజన్ పరమాణువుల మధ్య త్రికబంధం ఉంటుంది. దీనిని విఘటనం చెందించుటకు అధిక శక్తి (941.4KJ/mole) అవసరం. కావున నైట్రోజన్ అణువు అధిక స్థిరత్వం కలిగి రసాయనికంగా జడత్వం ప్రదర్శిస్తుంది.
![]()
ప్రశ్న 6.
+3 ఆక్సీకరణ స్థితి ఉన్న బిస్మత్ సమ్మేళనాలకు అధిక స్థిరత్వం ఉండటానికి గల కారణం?
జవాబు:
బిస్మత్ +3 ఆక్సీకరణ స్థితి ఉన్న సమ్మేళనాలకు అధిక స్థిరత్వం కలిగి ఉంటాయి. దీనికి కారణం ‘Bi’, +5 ఆక్సీకరణ స్థితికి బదులుగా జడ ఎలక్ట్రాన్ జంట ప్రభావం వలన +3 స్థిరమైన ఆక్సీకరణ స్థితి ప్రదర్శిస్తుంది.
ప్రశ్న 7.
రూపాంతరత అంటే ఏమిటి? ఫాస్ఫరస్ భిన్న రూపాంతరాలను వివరించండి.
జవాబు:
రూపాంతరత :
ఒకే మూలకం వివిధ భౌతిక రూపాలను కలిగి ఉండి ఒకే రకమైన రసాయన ధర్మాలను కలిగి ఉంటే ఆ ధర్మాన్ని రూపాంతరత అంటారు.
‘P’ యొక్క రూపాంతరాలు :
- తెల్ల (లేదా) పసుపు ‘P’.
- ఎర్ర ‘P’
- స్కార్లెట్ ‘P’
- ఊదా ‘P’
- α – నల్ల ఫాస్ఫరస్ మరియు β – నల్ల ఫాస్ఫరస్.
తెల్ల ఫాస్ఫరస్ :
- ఇది తెల్లని మైనంలాంటి అర్థపారదర్శక ఘన పదార్థం.
- ఇది విష స్వభావం గల పదార్థం, నీటిలో కరగదు. కార్బన్ డై సల్ఫైడ్లో కరుగుతుంది.
- ఇది చీకటిలో రసాయన సందీప్తిని ప్రదర్శిస్తుంది.
- ఇది ఇతర ఘనప్రావస్థల కంటే చర్యాశీలత కలిగి ఉండును.
- దీనిని వేడి NaOH ద్రావణంలో కరిగించుట ద్వారా PH ని ఏర్పరచును.
P4 + 3NaOH + 3H2 → PH3 + 3NaH2PO2 - P4 అణువులో బంధకోణం 60° కలిగి ఉంటుంది మరియు గాలిలో తక్షణమే మండగలదు.
ఎర్ర ఫాస్ఫరస్ :

→ ఎర్ర ఫాస్ఫరస్ ఇనుప బూడిదరంగు ద్యుతిని ప్రదర్శిస్తుంది.
→ దీనికి వాసన, విష స్వభావం లేదు. ఇది నీటిలోనూ CS, లోనూ కరుగును.
→ తెల్ల ‘P’ కంటే తక్కువ చర్యాశీలత కలిగియుండును.
నల్ల ఫాస్ఫరస్ :
- α – నల్ల ‘P’ : ఎర్ర ‘P’ ను సీలువేసిన నాళికలో ఉంచి 803 ను వేడిచేస్తే α – నల్ల ఫాస్ఫరస్ లభిస్తుంది.
- β – నల్ల ‘P’ : తెల్ల ‘P’ ను 473 K, అధిక పీడనం వద్ద వేడిచేయగా β – నల్ల ఫాస్ఫరస్ ఏర్పడును.
ప్రశ్న 8.
నైట్రోజనికి ఉండే జడ స్వభావాన్ని ఎలా వివరిస్తారు?
జవాబు:
నైట్రోజన్ ద్విపరమాణుక అణువులో రెండు నైట్రోజన్ పరమాణువుల మధ్య త్రికబంధం ఉంటుంది. దీనిని విఘటనం చెందించుటకు అధిక శక్తి (941.4KJ/mole) అవసరం. కావున నైట్రోజన్ అణువు అధిక స్థిరత్వం కలిగి రసాయనికంగా జడత్వం ప్రదర్శిస్తుంది.
ప్రశ్న 9.
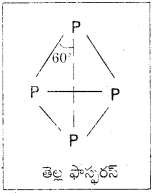
తెల్ల, ఎర్ర ఫాస్ఫరస్ల నిర్మాణాల్లోని భిన్నత్వాన్ని వివరించండి.
జవాబు:
తెల్ల ‘P’ లో వివక్త టెట్రాహెడ్రల్ P4 అణువులుగా ఉంటాయి. ఇవి ఒకదానితో ఒకటి వాండర్వాల్ బలాలతో బంధితమై ఉంటాయి.
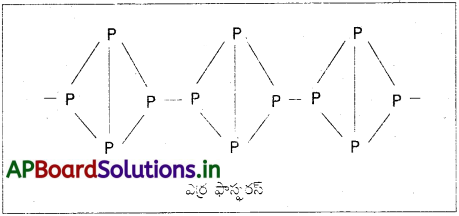
ఎర్ర ఫాస్ఫరస్ సంయోజనీయ బంధాలలో బంధితమైన P4 టెట్రాహెడ్రల్ ఏర్పరచిన గొలుసు రూపంలో ఉండే బహు అణుక పదార్థం.
ప్రశ్న 10.
ఎర్ర ఫాస్ఫరస్ నుంచి Q – నల్ల ఫాస్ఫరస్ను ఎలా తయారుచేస్తారు?
జవాబు:
- α – నల్ల ‘P’ : ఎర్ర ‘P’ ను సీలువేసిన నాళికలో ఉంచి 803 K ను వేడిచేస్తే α – నల్ల ఫాస్ఫరస్ లభిస్తుంది.
- β – నల్ల ‘P’ : తెల్ల ‘P’ ను 473 K అధిక పీడనం వద్ద వేడిచేయగా β – నల్ల ఫాస్ఫరస్ ఏర్పడును.
![]()
ప్రశ్న 11.
తెల్ల ఫాస్ఫరస్, ఎర్ర ఫాస్ఫరస్ ధర్మాల్లోని భిన్నత్వాన్ని (తేడా) వివరించండి.
జవాబు:
| తెల్ల’P’ | ఎర్ర ‘P’ |
| 1. ఇది తెల్లటి మైనంలాంటి అర్థ పారదర్శక పదార్థం. | 1. ఇనుప బూడిదరంగు ద్యుతిని కలిగి ఉంటుంది. |
| 2. నీటిలో కరుగదు. CS2 లో కరుగుతుంది. | 2. చల్లని నీటిలో, CS2 లో కరుగుతుంది. |
| 3. అధిక చర్యాశీలత కలిగి ఉండును. | 3. తెల్ల ‘P’ కంటే తక్కువ చర్యాశీలత కలిగి ఉండును. |
| 4. విషపూరితమైనది. | 4. విషపూరితమైనది కాదు. |
ప్రశ్న 12.
జడ జంట ప్రభావం అంటే ఏమిటి?
జవాబు:
జడ జంట ప్రభావం :
బంధంలో పాల్గొనటానికి ‘ns’ ఎలక్ట్రాన్ జంట విముఖత ప్రదర్శిస్తుంది. దీనినే జడ జంట ప్రభావం అంటారు. ఉదా : బిస్మత్ జడ జంట ప్రభావం వలన +5 కు బదులు + 3 స్థిరమైన ఆక్సీకరణ స్థితిని ప్రదర్శించును.
ప్రశ్న 13.
NH3 బలమైన క్షారం, BiH3 దుర్బల క్షారం. ఎందుకో వివరించండి.
జవాబు:
NH3 బలమైన క్షారం, BiH3 దుర్భల క్షారం :
వివరణ :
నైట్రోజన్ తక్కువ పరమాణు పరిమాణం కలిగి ఉండుట వలన నైట్రోజన్ పరమాణువుపై అధిక ఎలక్ట్రాన్ సాంద్రత కలిగి ఉంటుంది. ఈ ఎలక్ట్రాన్ సాంద్రత Bi పరమాణువు కన్నా ఎక్కువ. కావున NH3 కి ఎలక్ట్రాన్ దానం చేసే సామర్థ్యం ఎక్కువ.
ప్రశ్న 14.
15వ గ్రూపు మూలకాల హైడ్రేడ్లను క్షారబలం పెరిగే క్రమంలోను, క్షయకరణ స్వభావం తగ్గే క్రమంలోను అమర్చండి.
జవాబు:
i) 15వ గ్రూపు మూలకాల హైడ్రైడ్ల క్షారబలం పెరిగే క్రమం
BiH3 < SbH3 < AsH3 < PH3 < NH3.
ii) 15వ గ్రూపు మూలకాల హైడ్రైడ్ క్షయకరణ స్వభావం తగ్గే క్రమం
BiH3 > SbH3 > AsH3 > PH3 > NH3.
ప్రశ్న 15.
NH3 కంటే PH3 బలహీన క్షారం – వివరించండి.
జవాబు:
NH3 కంటే PH3 బలహీన క్షారం :
- NH3 లో నైట్రోజన్ పరమాణువు sp³ సంకరీకరణం చెంది ఉంటుంది. నైట్రోజన్ తక్కువ పరమాణు పరిమాణం కలిగి ఉండుట వలన PH3 లో ‘P’ కంటే ఎలక్ట్రాన్ సాంద్రత ఎక్కువగా ఉంటుంది.
- ‘P’ పరమాణువు అధిక పరమాణు పరిమాణం వలన ఒంటరి ఎలక్ట్రాన్ జంటకు ఎక్కువ ఉపరితల వైశాల్యం లభిస్తుంది.
ప్రశ్న 16.
15వ గ్రూపు మూలకాల్లోని ఒక హైడ్రైడ్ నీటిలో కరిగి క్షార ద్రావణాన్ని ఏర్పరచింది. ఈ ద్రావణం AgCl అవక్షేపాన్ని కరిగించింది. ఆ హైడ్రైడ్ ‘పేరేమిటి ఈ చర్యలోని రసాయన సమీకరణాలను రాయండి.
జవాబు:
15వ గ్రూపు మూలకాల్లోని ఒక హైడ్రైడ్ నీటిలో కరిగి క్షార ద్రావణాన్ని ఏర్పరచినది. ఈ ద్రావణం AgCl అవక్షేపాన్నీ కరిగించినది అని ఇవ్వబడినది.
- ఇవ్వబడిన హైడ్రైడ్ NH3. ఇది నీటిలో కరిగి OH– అయాన్లు ఏర్పరచుట వలన క్షార ద్రావణం ఏర్పరుస్తుంది.

- NH, ద్రావణం AgCl అవక్షేపాన్ని కరిగిస్తుంది. దీనికి కారణం సంక్లిష్ట సమ్మేళనం ఏర్పరచటమే.
AgClఘ +2NH3(జల) → [Ag(NH3)3]Cl(జల)
ప్రశ్న 17.
CO2 జడ వాతావరణంలో తెల్ల ఫాస్ఫరస్కు గాఢ NaOH ని కలిపి వేడిచేస్తే ఏం జరుగుతుంది? [AP. Mar. ’15]
జవాబు:
CO2 జడ వాతావరణంలో తెల్ల ఫాస్ఫరస్కు గాఢ NaOH కలిపి వేడిచేస్తే ఫాస్ఫేన్ ఏర్పడును.
P4 + 3NaOH + 3H2O → PH3 + 3NaH2PO2.
![]()
ప్రశ్న 18.
NH3 హైడ్రోజన్ బంధాలను ఏర్పరచగలడు, కానీ PH3 ఏర్పరచదు. ఎందువల్ల
జవాబు:
NH3 హైడ్రోజన్ బంధాలు ఏర్పరచగలదు కానీ PH3 ఏర్పరచదు.
కారణం :
అమ్మోనియా ధృవణ అణువు మరియు అందులోని N-H బంధం ధృవణత కలిగి ఉంటుంది. నైట్రోజన్కు ఫాస్ఫరస్ కంటే ఋణ విద్యుదాత్మకత ఎక్కువ. PH3 లో P-H బంధం తక్కువ ధృవణత కలిగి ఉంటుంది.
ప్రశ్న 19.
![]()
జవాబు:
15వ గ్రూపు హైడ్రైడ్లలో మధ్యస్థ పరమాణువు sp³ సంకరీకరణం చెందును. గ్రూపులో క్రిందికి పోయే కొలది ఋణ విద్యుదాత్మకత తగ్గి పరమాణు పరిమాణం పెరుగును. మధ్యస్థ పరమాణువు చుట్టూ ఉన్న పంచుకోబడ్డ ఎలక్ట్రాన్ జంటల మధ్య వికర్షణ బలాలు నెమ్మదిగా తగ్గును. కావున గ్రూపులో కిందికి పోయేకొలది బంధకోణం తగ్గును.

ప్రశ్న 20.
కాల్షియం ఫాస్ఫైడ్, భారజలం ఏ విధంగా చర్య జరుపుతాయి?
జవాబు:
కాల్షియం ఫాస్ఫైడ్ భారజలంతో చర్య జరిపి డ్యుటిరోఫాస్ఫేన్ ఏర్పడును.
Ca3P2 + 6D2O → 3 Ca (OD)2 + 2PD3
ప్రశ్న 21.
అమోనియా ఒక మంచి సంక్లిష్టకారి – ఉదాహరణతో వివరించండి.
జవాబు:
NH3 లూయి క్షారము. ఇది ఎలక్ట్రాన్ జంటను దానంచేసి లోహాలతో సమన్వయ సంయోజనీయ బంధం ఏర్పరచును. దీని ఫలితంగా సంక్లిష్ట సమ్మేళనాలు ఏర్పడతాయి.
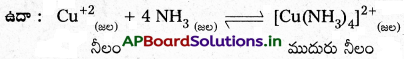
ప్రశ్న 22.
Ca3P2, CaC2 మిశ్రమాన్ని ‘హోల్మ్’ సంకేతాల తయారీలో ఉపయోగిస్తారు – వివరించండి. [AP. Mar.’16]
జవాబు:
అయత్నీకృతంగా మండే ఫాస్ఫీన్ను హోల్మ్ సంకేతాల్లో ఉపయోగిస్తారు. సముద్ర ప్రయాణంలో ఆపద ఎదురైనపుడు CaC2, Ca3P2 ఉన్న డబ్బాలకు రంధ్రాలు చేసి సముద్రంలోని నీటిలోనికి వేస్తారు. వాయువులు (PH3) మండి సంకేతాలుగా పనిచేస్తాయి.
ప్రశ్న 23.
నైట్రేట్ అయాన్ల జేగురు రంగు వలయ (brown ring) పరీక్షలో ఏ రసాయన సమ్మేళనం ఏర్పడుతుంది?
జవాబు:
నైట్రేట్ అయాన్ల జేగురు రంగు వలయ పరీక్షలో ఏర్పడు రసాయన సమ్మేళనం [Fe(H2O)5 NO]+2.
ప్రశ్న 24.
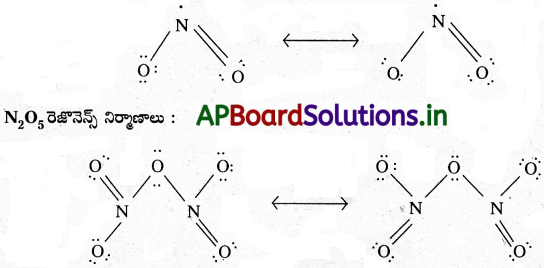
NO2, N2O5 ల రెజొనెన్స్ నిర్మాణాలను రాయండి.
జవాబు:
NO2 రెజొనెన్స్ నిర్మాణాలు :
ప్రశ్న 25.
R3P = O ఏర్పడుతుంది, కానీ R3N = O సాధ్యం కాదు ( R = ఆల్కైల్ గ్రూప్) ఎందువల్ల?
జవాబు:
R3 P = O ఏర్పడుతుంది, కానీ R3N = O సాధ్యం కాదు.
వివరణ :
నైట్రోజన్లో d- ఆర్బిటాళ్ళు లేకపోవడం వలన dπ – Pπ బహుబంధం ఏర్పరచలేదు. R3 N = 0 లో నైట్రోజన్ వేలన్సీ ‘5’ ఉండాలి. ఇటువంటి సమ్మేళనాలు ఏర్పడవు. కానీ ‘P’ లో d-ఆర్బిటాళ్ళు ఉండుట వలన ఇటువంటి సమ్మేళనాలు (R3P = O) ఏర్పరచగలదు. ‘P’ dπ – Pπ బహుబంధాలు ఏర్పరచగలదు.
ప్రశ్న 26.
నైట్రిక్ ఆక్సైడ్ను (NO) ఎలా తయారుచేస్తారు?
జవాబు:
NH3ని వాతావరణ ఆక్సిజన్తో ఉత్ప్రేరక ఆక్సీకరణం చేయుట ద్వారా నైట్రిక్ ఆక్సైడ్ ఏర్పరచును.
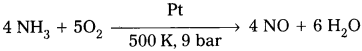
ప్రశ్న 27.
నైట్రోజన్ సాధారణ ఆక్సైడ్, మిశ్రమ ఆక్సైడ్లకు ఒక్కో ఉదాహరణ ఇవ్వండి.
జవాబు:
- నైట్రిక్ ఆక్సైడ్ (NO) సాధారణ నైట్రోజన్ ఆక్సైడ్కు ఉదాహరణ.
- డై నైట్రోజన్ ట్రై ఆక్సైడ్ (N2O3) మిశ్రమ నైట్రోజన్ ఆక్సైడ్కు ఉదాహరణ.
ప్రశ్న 28.
NO వాయుస్థితిలో పారాయస్కాంత ధర్మం చూపిస్తుంది. కానీ ద్రవస్థితిలో, ఘనస్థితిలో డయా అయస్కాంత ధర్మం చూపిస్తుంది. ఎందువల్ల?
జవాబు:
వాయు స్థితిలో NO ఒక ఒంటరి ఎలక్ట్రానన్ను కలిగి ఉండును. కావున పారా అయస్కాంత స్వభావం కలిగి ఉంటుంది. ఘన స్థితిలో, ద్రవస్థితిలో డైమ ర్ గా ఏర్పడుట వలన ఒంటరి ఎలక్ట్రాన్ జంటగా ఏర్పడును. కావున డయా అయస్కాంత స్వభావం కలిగి ఉండును.
ప్రశ్న 29.
ఈ క్రింది సమ్మేళనాలకు ఉదాహరణ ఇవ్వండి.
ఎ) ఫాస్ఫరస్ ఆమ్ల ఆక్సైడ్ బి) నైట్రోజన్ తటస్థ ఆక్సైడ్
జవాబు:
ఎ) P2O5 (లేదా) P4O10 ఫాస్ఫరస్ యొక్క ఆమ్ల ఆక్సైడ్కు ఉదాహరణ.
బి) నైట్రస్ ఆక్సైడ్ (N2O) నైట్రోజన్ యొక్క తటస్థ ఆక్సైడ్కు ఉదాహరణ.
![]()
ప్రశ్న 30.
ఈ క్రింది వాటిని వివరించండి.
ఎ) ఎర్ర ఫాస్ఫరస్ క్షారం చర్య బి) PCl3, H3PO3 ల మధ్య చర్య
జవాబు:
ఎ) ఎర్ర ఫాస్ఫరస్ క్షారంతో చర్య జరిపి హైపో ఫాస్ఫరస్ ఆమ్లం (H4P2O6) ఏర్పరచును.
బి) PCl3 ని జల విశ్లేషణ చేయగా H3PO3 ఏర్పడును.
PCl3 + 3H2O → H3PO3 + 3HCl
ప్రశ్న 31.
ఈ క్రింది వాటితో PCl3 చర్యను తెలపండి.
ఎ) CH3COOH బి) C2H5OH సి) నీరు
జవాబు:
ఎ) PCl3, CH3COOH తో చర్య జరిపి ఫాస్ఫరస్ ఆమ్లం, ఎసిటైల్ క్లోరైడ్ను ఏర్పరచును.
3CH3COOH + PCl3 → 3CH3COCl + H3PO3
బి) PCl3, C2H5OH తో చర్య జరిపి ఫాస్ఫరస్ ఆమ్లం, ఇథైల్ క్లోరైడ్ను ఏర్పరచును.
3C2H5OH + PCl3 → 2C2H5Cl + H3PO3
సి) PCl3 నీటితో చర్య జరిపి ఫాస్ఫరస్ ఆమ్లం ఏర్పడును.
PCl3 + 3H2O → H3PO3 + 3HCl.
ప్రశ్న 32.
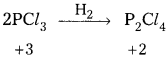
PCl3 ఆక్సీకరణిగాను, క్షయకరణిగాను పనిచేయగలదు వివరణ ఇవ్వండి.
జవాబు:
- PCl3 క్షయకరణి అని ఈ క్రింది చర్య ద్వారా తెలుస్తుంది.
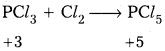
- PCl3 ఆక్సీకరణి అని ఈ క్రింది చర్య ద్వారా తెలుస్తుంది.
ప్రశ్న 33.
ఈ క్రింది వాటిలో వేటిని ఏర్పరచడం సాధ్యం కాదు?
PCl3, AsCl3, SbCl3, NCl5, BiCl5, PH5
జవాబు:
NCl5, BiCl5, PH5 లను ఏర్పరచుట సాధ్యం కాదు.
ప్రశ్న 34.
ఈ క్రింది వాటిలో వేటిని ఏర్పరచడం సాధ్యం కాదు?
SbCl5 లేదా SbCl3?
జవాబు:
SbCl5 కు ఎక్కువ సంయోజకత కలదు. ఎందువలన అనగా మూలకం అధిక ఆక్సీకరణ స్థితిలో ఎక్కువ ధృవణ సామర్థ్యం కలిగి ఉంటుంది. అందువలన SbCl3 కన్నా SbCl5 ఎక్కువ సంయోజకత కలిగి ఉంటుంది.
ప్రశ్న 35.
ఘన PCl5 లో ఫాస్ఫరస్ ఆక్సీకరణ స్థితులను రాయండి.
జవాబు:
ఘనస్థితిలో PCl5 అయానిక పదార్థం [PCl4]+ [PCl6]– గా ఉండును.
కావున ‘P’+5 ఆక్సీకరణ స్థితి కలిగి ఉండును.
![]()
ప్రశ్న 36.
కాపర్ లోహం HNO3 తో చర్య జరిపి భిన్న రకాల సమ్మేళనాలను ఏ విధంగా ఏర్పరుస్తుందో వర్ణించండి.
జవాబు:
కాపర్ లోహం సజల HNO3 తో చర్య
3Cu + 8HNO3(సజల) → 3Cu(NO3)2 + 2NO + 4H2O
కాపర్ లోహం గాఢ HNO3 తో చర్య
Cu + 4HNO3(గాఢ) → Cu(NO3)2 + 2NO2 + 2H2O
ప్రశ్న 37.
నైట్రిక్ఆమ్లంలోని నైట్రోజన్ ఆక్సీకరణ స్థితికి సమానమైన ఆక్సీకరణ స్థితి ఉన్న నైట్రోజన్ ఆక్సైడ్ ఏది?
జవాబు:
- HNO3 లో ‘N’ +5 ఆక్సీకరణ స్థితి కలిగి ఉండును.
- నైట్రోజన్ ఆక్సైడ్లలో N2O5 లో ‘N’ +5′ ఆక్సీకరణ స్థితి కలిగి ఉండును.
ప్రశ్న 38.
నైట్రిక్ ఆమ్లం తయారీలో జరిగే రసాయన చర్యలను రాయండి.
జవాబు:
నైట్రిక్ ఆమ్ల తయారీలో జరిగే రసాయన చర్యలు
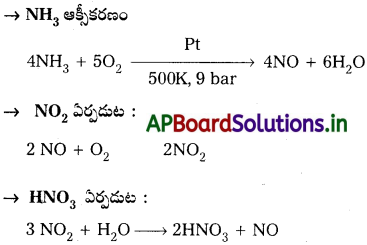
ప్రశ్న 39.
గాఢ HNO3 సమక్షంలో ఐరన్ క్రియారహితంగా ఉంటుంది. ఎందువల్ల?
జవాబు:
గాఢ HNO3 సమక్షంలో ఐరన్ క్రియారహితంగా ఉంటుంది. దీనికి కారణం ఐరన్ ఉపరితలంపై ఒక క్రియారహిత స్వభావం గల ఆక్సైడ్ పొర ఏర్పడుటయే.
![]()
ప్రశ్న 40.
నైట్రిక్ ఆమ్లం, అమోనియా ఉపయోగాలను తెలపండి.
జవాబు:
HNO3 ఉపయోగాలు :
- ఎరువుల తయారీలో ఉపయోగించే అమ్మోనియం నైట్రేట్ను, ప్రేలుడు పదార్థాలు, మందుగుండు సామగ్రిలో ఉపయోగించే ఇతర నైట్రేట్లను HNO3 తో తయారుచేస్తారు.
- రాకెట్ ఇంధనాలలో ఆక్సీకరణిగా ఉపయోగిస్తారు.
- స్టెయిన్లెస్ స్టీల్ శుద్ధిచేసే పిక్లింగ్ ప్రక్రియలో ఉపయోగిస్తారు.
NH3 ఉపయోగాలు :
- వివిధ రకాల నత్రజని ఎరువులలో ఉపయోగిస్తారు.
- HNO3 తయారీలో ఉపయోగిస్తారు.
- శీతలీకరణిగా ఉపయోగిస్తారు.
ప్రశ్న 41.
ఈ క్రింది వాటిలో ఫాస్ఫరస్ ఆక్సీకరణ స్థితులను తెలపండి.
ఎ) H3PO3
బి) PCl3
సి) Ca3P2
డి) Na3PO4
ఇ) POF3
జవాబు:
ఎ) H3PO3
3(1) + x + 3(-2) = 0
x = + 3
బి)PCl3
x + 3(−1) = 0
x = 3
సి) Ca3P2
3(+2) + 2x 0
x = -3
డి) Na3PO4
3(1) + x + 4(-2) – 0
x = +5
ఇ) POF3
x + (−2) + 3(-1) = 0
x = +5
ప్రశ్న 42.
H3PO3 డైప్రోటిక్, కానీ H3PO2 మోనోప్రోటిక్ ఎందువల్ల?
జవాబు:

పై నిర్మాణాల నుండి H3PO3 లో రెండు మార్పిడి చేయగల హైడ్రోజన్ పరమాణువులు గలవు. కానీ H3PO2 ఒక హైడ్రోజన్ కలదు. అందువలన H3PO2 మోనోప్రోటిక్, H3PO3 డైప్రోటిక్.
ప్రశ్న 43.
H3PO3 అననుపాత చర్యను తెలపండి.
జవాబు:
ఆర్థో ఫాస్ఫరస్ ఆమ్లం(H3PO3)ని వేడిచేయగా అననుపాత చర్య జరిగి ఆర్థో ఫాస్ఫారిక్ ఆమ్లం మరియు ఫాస్ఫేన్ ఏర్పడును
4H3PO3 → 3H3PO3 + PH3.
ప్రశ్న 44.
H3PO2 ఒక మంచి క్షయకరణి – ఉదాహరణతో వివరించండి.
జవాబు:
H3PO2 లో రెండు H- పరమాణువులు P-పరమాణువుకి నేరుగా బంధించబడి ఉంటాయి. దీనివలన H3PO2 కు క్షయకరణ స్వభావం కలిగి ఉంటుంది.
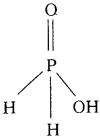
ప్రశ్న 45.
ఈ క్రింది సమ్మేళనాల నిర్మాణాలను రాయండి.
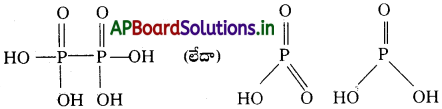
ఎ) హైపోఫాస్ఫారిక్ ఆమ్లం బి) చక్రీయ మెటాఫాస్ఫారిక్ ఆమ్లం
జవాబు:
ఎ) హైపోఫాస్ఫారిక్ ఆమ్లం (H4P2O6) నిర్మాణం :
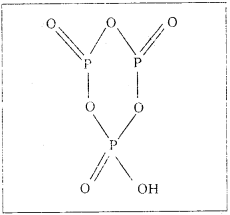
బి) చక్రీయ మెటాఫాస్ఫారిక్ ఆమ్లం (HPO3)3 నిర్మాణం :
స్వల్ప సమాధాన ప్రశ్నలు
ప్రశ్న 1.
15వ గ్రూపు మూలకాల అభిలాక్షణిక ధర్మాలను, వాటి ఎలక్ట్రాన్ విన్యాసం, ఆక్సీకరణ స్థితి, పరమాణు పరిమాణం, అయనీకరణ ఎంథాల్నీ, ఋణ విద్యుదాత్మకత పరంగా చర్చించండి.
జవాబు:
1) ఎలక్ట్రాన్ విన్యాసం :
నైట్రోజన్ యొక్క వేలన్సీ ఎలక్ట్రాన్ విన్యాసము, N (7) : 2s² 2p³
ఫాస్ఫరస్ యొక్క వేలన్సీ ఎలక్ట్రాన్ విన్యాసము. P (15) : 3s² 3p³
ఈ మూలకాల సాధారణ వేలన్సీ ఎలక్ట్రాన్ విన్యాసము : ns² np³, ఈ విన్యాసము, VA గ్రూపు మూలకాలు సాధారణ ఎలక్ట్రాన్ విన్యాసమే.
2) ఆక్సీకరణ స్థితులు :
ఈ రెండు మూలకాల సాధారణ ఎలక్ట్రాన్ విన్యాసము ns² np³.
- అన్నీ వేలన్సీ ఎలక్ట్రాను ఉపయోగించుకున్న పక్షంలో వీటి ఆక్సీకరణ స్థితి = +5.
ఆక్సైడ్ N, Pలు ఈ ఆక్సీకరణ స్థితిని ప్రదర్శిస్తాయి. - ‘ns²’ ఎలక్ట్రాన్లు జడత్వాన్ని ప్రదర్శిస్తే, మూడు ‘p’ ఎలక్ట్రాన్లతో +3 ఆక్సీకరణ స్థితిని చూపిస్తాయి. ఈ రెండు ఆక్సీకరణ స్థితులు VA గ్రూపు మూలకాలు ప్రదర్శించే ఆక్సీకరణ స్థితులే.
3) పరమాణు పరిమాణం :
15వ గ్రూపు మూలకాలలో పై నుండి క్రిందికి పోయే కొలది పరమాణు పరిమాణం పెరుగును. ‘N’ నుండి ‘P’ కు సంయోజనీయ వ్యాసార్థంలో, పెరుగుదల గణనీయంగా ఉంటుంది. AS నుండి Bi కి వెళ్ళేకొలది. వ్యాసార్థంలో పెరుగుదల తక్కువగా ఉంటుంది.
4) అయనీకరణ ఎంథాల్పీ :
15వ గ్రూపు మూలకాలలో క్రిందికి పోయే కొలది పరమాణు పరిమాణం పెరుగుట వలన అయనీకరణ ఎంథాల్పీ విలువలు తగ్గుతాయి.
5) ఋణ విద్యుదాత్మకత :
15వ గ్రూపు మూలకాలలో క్రిందికి పోయే కొలది ఋణ విద్యుదాత్మకత విలువలు తగ్గుతాయి.
దీనికి కారణం పరమాణు పరిమాణం పెరుగును.
ప్రశ్న 2.
15వ గ్రూపు మూలకాల రసాయన చర్యాశీలతలోని తీరును చర్చించండి.
జవాబు:
i) హైడ్రోజన్తో చర్య :
15వ గ్రూపు మూలకాలు EH3 రకమైన హైడ్రైడ్లను ఏర్పరుస్తాయి.
ఉదా : NH3, PH3, AsH3, SbH3, BiH3.
- పై హైడ్రేడ్లలో NH3 దుర్బల క్షయకరణి BiH, బలమైన క్షయకరణ్.
- NH3 నుండి BiH3 కి స్థిరత్వం తగ్గును.
- హైడ్రైడ్ క్షారత్వం ఈ క్రింది విధంగా తగ్గును.
NH3 > PH3 > AsH3 > SbH3 > BiH3.
ii) ఆక్సిజన్తో చర్య :
15వ గ్రూపు మూలకాలు E2O3 మరియు E2O5 రకమైన ఆక్సైడ్లను ఏర్పరచును.
ఉదా : P2O3, N2O5, P2O5, N2O3.
- ఆక్సైడ్ ఆమ్ల స్వభావం గ్రూపులో క్రిందికి పోయే కొలది తగ్గును.
- ‘N’ మరియు ‘P’ ల E2O3 ఆక్సైడ్ ఆమ్ల స్వభావం కలవు. As మరియు Sb ఆక్సైడ్లు ద్విస్వభావాన్ని Bi యొక్క ఆక్సైడ్ క్షార స్వభావాన్ని కలిగియుండును.
iii) హాలోజన్లతో చర్య :
15వ గ్రూపు మూలకాలు EX3 మరియు EX5 రకమైన హాలైడ్లను ఏర్పరచును.
పెంటాహాలైడ్లను ఏర్పరచదు. దీనికి కారణం d- ఆర్బిటాళ్ళు లేకపోవడమే.
హాలైడ్లు ట్రైహాలైడ్ల కన్నా అధిక సంయోజనీయ స్వభావం కలిగి ఉంటాయి.
iv) లోహాలతో చర్య :
ఈ మూలకాలు లోహాలతో చర్య జరిపి + 3 ఆక్సీకరణ స్థితి కలిగిన ద్విగుణ సమ్మేళనాలను ఏర్పరచును.
ఉదా : Ca3N2, Ca3P2.
![]()
ప్రశ్న 3.
P. ఈ క్రింది వాటితో ఎలా చర్య జరుపుతుంది?
ఎ) SOCl2
బి) SO2Cl2
జవాబు:
ఎ) P4, SOCl2 తో చర్య జరిపి ఫాస్ఫరస్ ట్రైక్లోరైడ్ను ఏర్పరచును.
P4 + 8 SOCl2 → 4 PCl3 + 4 SO2 + 2 S2Cl2
బి) P4, SO2Cl2 తో చర్య జరిపి ఫాస్ఫరస్ పెంటాక్లోరైడ్ను ఏర్పరచును.
P4 + 10 SOCl2 → 4 PCl5 + 10 SO2
ప్రశ్న 4.
15వ గ్రూపులోని నైట్రోజన్ అసంగత ధర్మాన్ని వివరించండి.
జవాబు:
నైట్రోజన్ అసంగత ధర్మాలు :
- నైట్రోజను ఉన్న తక్కువ పరిమాణం, అధిక ఋణ విద్యుదాత్మకత, అధిక అయనీకరణ ఎంథాల్పీ, d- ఆర్బిటాళ్ళు లేకపోవడం కారణంగా గ్రూపులోని ఇతర మూలకాలతో పోలిస్తే భిన్న స్వభావం కలిగి ఉంటుంది.
- నైట్రోజన్కు స్వయంగా దానితోనూ, అల్ప పరిమాణం, అధిక ఋణ విద్యుదాత్మకత ఉన్న ఇతర మూలకాలతోను Pπ – Pπ బహు బంధాలను ఏర్పరిచే ప్రత్యేక సామర్థ్యం ఉంటుంది.
నైట్రోజన్ ద్విపరమాణుక అణువులో రెండు నైట్రోజన్ పరమాణువుల మధ్య త్రికబంధం ఉంటుంది. దీనిని విఘటనం చెందించుటకు అధిక శక్తి (941.4KJ/mole) అవసరం. కావున నైట్రోజన్ అణువు అధిక స్థిరత్వం కలిగి రసాయనికంగా జడత్వం ప్రదర్శిస్తుంది.
N-N ఏకబంధం P-P ఏకబంధం కన్నా బలహీనమైనది. దీనికి కారణం నైట్రోజన్లో అబంధక ఎలక్ట్రాన్ల వల్ల అధిక అంతర ఎలక్ట్రాన్ వికర్షణలు ఏర్పడతాయి మరియు నైట్రోజన్లో బంధ దైర్ఘ్యం తక్కువగా ఉండుటయే. కావున ఫాస్ఫరస్ కంటే నైట్రోజన్ తక్కువ కాటనేషన్ సామర్థ్యం కలిగి ఉంటుంది.
R3 P = O ఏర్పడుతుంది, కానీ R3N = O సాధ్యం కాదు.
నైట్రోజన్లో d- ఆర్బిటాళ్ళు లేకపోవడం వలన dπ – Pπ బహుబంధం ఏర్పరచలేదు. R3N = O లో నైట్రోజన్ వేలన్సీ ‘5’ ఉండాలి. ఇటువంటి సమ్మేళనాలు ఏర్పడవు. కానీ ‘P’ లో d-ఆర్బిటాళ్ళు ఉండుట వలన ఇటువంటి సమ్మేళనాలు (R3P = O) ఏర్పరచగలదు. ‘P’ dπ – Pπ బహుబంధాలు ఏర్పరచగలదు.
నైట్రోజన్లో d- ఆర్బిటాళ్ళు లేకపోవడం వలన పెంటాహాలైడ్లను ఏర్పరచదు.
ప్రశ్న 5.
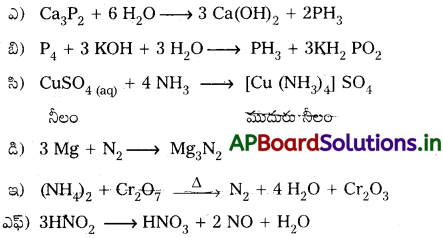
ఈ క్రింది చర్యలను పూర్తి చేయండి.
జవాబు:
ప్రశ్న 6.
PCl5 ఈ క్రింది వాటితో ఎలా చర్య జరుపుతుంది?
ఎ) నీరు
బి) C2H5OH
సి) CH3COOH
డి) Ag
జవాబు:
ఎ) PCl5 జల విశ్లేషణ చేయగా ఫాస్ఫారిక్ ఆమ్లం ఏర్పడుతుంది.
PCl5 + H2O → POCl3 + 2HCl
POCl3 + 3H2O → H3PO4 + 3 HCl
బి) PCl5, C2H5OH తో చర్య జరిపి ఇథైల్ క్లోరైడ్ ఏర్పడును.
C2H5OH + PCl5 → C2H5Cl + POCl3 + HCl
సి) PCl5, CH2COOH తో చర్య జరిపి ఎసిటైల్ క్లోరైడ్ ఏర్పడును.
CH3COOH + PCl5 → CH3COCl + POCl3 + HCl
డి) PCl5, Ag తో చర్య జరిపి PCl3, మరియు AgCl ఏర్పరచును.
PCl5 + 2 Ag → PCl3 + 2 AgCl
![]()
ప్రశ్న 7.
ఈ క్రింది చర్యలను పూర్తి చేయండి.
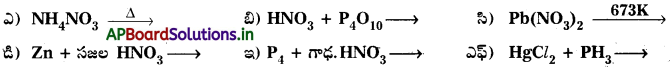
జవాబు:
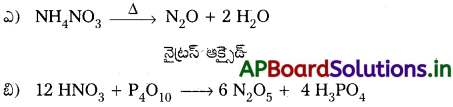
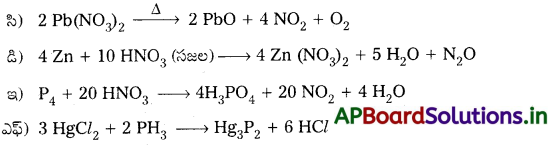
దీర్ఘ సమాధాన ప్రశ్నలు
ప్రశ్న 1.
అమోనియాను హేబర్ పద్ధతిలో ఎలా తయారుచేస్తారు ? ఈ క్రింది వాటితో అమోనియా చర్యను వివరించండి. [TS. Mar.’17]
ఎ) ZnSO4(జల)
బి) CuSO4(జల)
సి) AgCl(ఘ)
జవాబు:
నైట్రోజన్ మరియు హైడ్రోజన్ వాయువులను అధిక ఉష్ణోగ్రత మరియు పీడనాల వద్ద ఉత్ప్రేరకం సమక్షంలో చర్య జరిపిస్తే అమోనియా వాయువు ఏర్పడుతుంది. ఇది ఉష్ణమోచక చర్య మరియు ద్విగత చర్య.
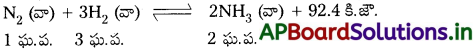
ఈ చర్యలో పురోగామి చర్య అంటే అమోనియా ఏర్పడే చర్యలో ఘ.ప. ల సంఖ్య తగ్గుతుంది. లీషాట్లియర్ సూత్రం ప్రకారం అధిక అమోనియా దిగుబడి జరగాలంటే అధిక పీడనాలు కావాలి. అమోనియా ఏర్పడే చర్య ఉష్ణమోచక చర్య. లీషాట్లియర్ సూత్రం ప్రకారం అధిక అమోనియా దిగుబడి జరగాలంటే అల్ప ఉష్ణోగ్రతలను ఏర్పాటుచేయాలి. అధిక అమోనియా దిగుబడికి ఈ క్రింది అనుకూల పరిస్థితులు అనువుగా ఉంటాయి.
ఉష్ణోగ్రత : 725K నుండి 775 K వరకు
పీడనం : 200 అట్మా
ఉత్ప్రేరకం :
సూక్ష్మ విభాజిత ఐరన్ ఉత్ప్రేరకంగానూ, అల్ప పరిమాణంలో మోలిబ్దినం ప్రవర్ధకంగానూ ఉపయోగిస్తారు.
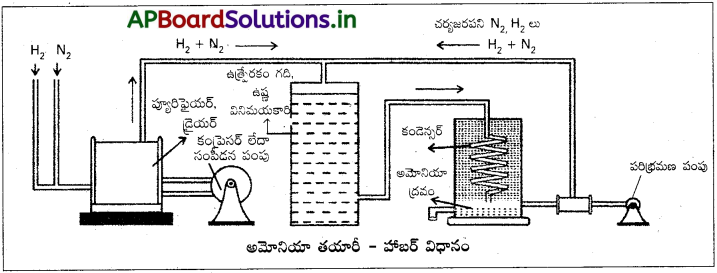
విధానం :
నైట్రోజన్ మరియు హైడ్రోజన్ వాయువులను 1 : 3 నిష్పత్తిలో కలిపి 200 అట్మాపీడనంతో సంపీడ్యం చెందిస్తారు. ఆవిధంగా సంపీడ్యం చెందించిన మిశ్రమాన్ని 450°C నుండి 500°C వరకు వేడిచేయబడిన సూక్ష్మవిభాజిత ఐరన్ మరియు కొద్దిగా మోలిబ్దినం పొడి కలిగి ఉన్న ఉత్ప్రేరక శిఖరం గుండా పంపుతారు. ఇచ్చట నైట్రోజన్, హైడ్రోజన్లు సంయోగం చెంది అమ్మోనియాను ఇస్తాయి. ఉత్ప్రేరక శిఖరం గుండా బయటకు వచ్చే వాయు మిశ్రమంలో 10 నుండి 15% వరకు అమోనియా ఉంటుంది. మిగిలినది సంయోగం చెందని నైట్రోజన్ మరియు హైడ్రోజన్లు. అట్లేర్పడ్డ NH3 వాయువును శీతలీకరణ శిఖరం గుండా పంపి ద్రవీకరింపచేస్తారు. సంయోగం చెందని N, H2 వాయువులను మరల తిరిగి మొదటి శిఖరంలోకి పంపుతారు.
![]()
ప్రశ్న 2.
ఆస్వాల్డ్ పద్ధతిలో నైట్రికామ్లాన్ని ఎలా తయారుచేస్తారు? ఈ క్రింది వాటితో HNO3 ఎలా చర్య జరుపుతుంది? [AP. Mar.’17]
ఎ) కాపర్ బి) Zn సి) S8 డి) P4
జవాబు:
అమోనియా నుంచి (ఆస్వాల్డ్ పద్ధతిలో) :
అమోనియాని గాలితో 1 : 7 లేదా 1 : 8 నిష్పత్తిలో కలిపి వేడిగా ఉన్న ప్లాటినమ్ వల (platinum gauze) ఉత్ప్రేరకంపై పంపుతారు. అప్పుడు చాలా. వంతు (దాదాపు 95%) NO గా ఆక్సీకరణం చెందుతుంది. ఆ చర్య క్రింది విధంగా ఉంటుంది.
![]()
ఉత్పన్నమయిన ఉష్ణరాశి ఉత్ప్రేరకాన్ని వేడిగా ఉంచుతుంది. NO ను చల్లబరచి ఆక్సిజన్తో కలుపుతారు. నైట్రోజన్ డై ఆక్సైడ్ ఏర్పడుతుంది. ఈ చర్య పెద్ద ఖాళీ గదుల్లో (ఆక్సీకరణ గదులు) జరుగుతుంది. అప్పుడు వచ్చిన క్రియాజనితాన్ని ఎక్కువ గాలి సమక్షంలో సంపీడనం చేసి వెచ్చని నీటిలోకి పంపుతారు. HNO3 ఏర్పడుతుంది.
4NO2 + O2 + 2H2O → 4 HNO3
ఇలా ఏర్పడిన ఆమ్లానికి దాదాపు 61% గాఢత ఉంటుంది.
a) కాపర్ లోహం సజల HNO3 తో చర్య
3Cu + 8HNO3(సజల) → 3Cu(NO3)2 + 2NO + 4H2O
కాపర్ లోహం గాఢ HNO3 తో చర్య
Cu + 4HNO3(గాఢ) → Cu(NO3)2 + 2NO + 2H2O
b) జింక్ సజల HNO3 మరియు గాఢ HNO3 చర్య జరిపి N2O మరియు NO2 లను ఏర్పరచును.
4 Zn + 10 HNO3(సజల) → 4 Zn (NO3)2 + 5 H2O + N2O
Zn + 4 HNO3(గాఢ) → Zn(NO3)2 + 2H2O + 2 NO2
c) S8గాఢ HNO3 తో చర్య జరిపి H2SO4, NO2 ను ఏర్పరచును.
S8 + 48 HNO3 → 8 H2SO4 + 48 NO2 + 16 H2O
d) P4 గాఢ HNO3 తో చర్య జరిపి H3PO4, NO2 ను ఏర్పరచును.
P4 + 20 HNO3 → 4 H3PO4 + 20 NO2 + 4 H2O
సాధించిన సమస్యలు Textual Examples
ప్రశ్న 1.
నైట్రోజన్ + 5 ఆక్సీకరణస్థితిని ప్రదర్శించినప్పటికీ, పెంటా హాలైడ్ను ఏర్పరచదు. కారణాన్ని తెలపండి.
సాధన:
ప్రధాన క్వాంటం సంఖ్య n = 2 గల నైట్రోజన్లో s, p ఆర్బిటాళ్ళు మాత్రమే సాధ్యమవుతాయి. దీనిలో d ఆర్బిటాళ్ళు లేని కారణంగా దీని సమయోజనీయత నాలుగును మించి ఉండదు. అందువల్ల నైట్రోజన్ పెంటా హాలైడ్లను ఏర్పరచలేదు.
ప్రశ్న 2.
NH3 కంటే PH3 కి తక్కువ బాష్పీభవన స్థానం ఉంటుంది. ఎందుకు? [TS. Mar.’16]
సాధన:
NH3 లాగా, PH3 అణువులు ద్రావణ స్థితిలో హైడ్రోజన్ బంధాలతో సాహచర్యాన్ని పొంది ఉండవు. ఈ కారణంగా PH3 బాష్పీభవన స్థానం NH3 కంటే తక్కువగా ఉంది.
ప్రశ్న 3.
సోడియమ్ అజైడ్ ఉష్ణ వియోజన చర్యను వ్రాయండి.
సాధన:
సోడియమ్ అజైడ్ ఉష్ణ వియోగం చెంది డైనైట్రోజన్ వాయువును ఇస్తుంది.
2NaN3 → 2Na + 3N2
ప్రశ్న 4.
NH2 ఎందువల్ల లూయీస్ క్షారంగా పనిచేస్తుంది?
సాధన:
NH3 లో నైట్రోజన్ పరమాణువుపై ఒక ఒంటరి ఎలక్ట్రాన్ జంట ఉంది. ఇది చర్యలో దానం చేయడానికి సిద్ధంగా ఉంటుంది. అందువల్ల NH3 లూయీస్ క్షారంగా పనిచేస్తుంది.
![]()
ప్రశ్న 5.
NO2 ఎందువల్ల ద్విఅణుకరణం (Dimerise) చెందుతుంది?
సాధన:
NO2 లో వేలెన్సీ ఎలక్ట్రాన్లు బేసి సంఖ్యలో ఉంటాయి. అందువల్ల ఇది ఒక విలక్షణమైన అస్థిర విషము అణుకరణం ప్రవర్తిస్తుంది. ద్విఅణుకరణం చెంది సరిసంఖ్యలో ఉన్న ఎలక్ట్రాన్లు గల N2O4 అనే స్థిరమైన అణువుగా మార్పు చెందుతుంది.
ప్రశ్న 6.
PH,కి క్షార స్వభావం ఉందని ఏ విధంగా నిరూపిస్తారు?
సాధన. ఫాస్ఫీన్ HI లాంటి ఆమ్లాలతో చర్య జరిపి PHI లాంటి సమ్మేళనాలను ఏర్పరుస్తుంది. కాబట్టి ఫాన్ కు క్షార స్వభావుం ఉందని తెలుస్తుంది.
PH3 + HI → PH4I
పై చర్యలో ఫాస్ఫీన్లోని ఫాస్ఫరస్ పరమాణువుపై ఒంటరి ఎలక్ట్రాన్ జంట ఉండటం కారణంగా PH3 లూయీస్ కారం పనిచేస్తుంది.
ప్రశ్న 7.
తేమ సమక్షంలో PCl3 ఎందుకు పొగలను ఏర్పరుస్తుంది?
సాధన:
తేమలో PCl3 జలవిశ్లేషణం చెంది HCl పొగలను ఏర్పరుస్తుంది.
PCl3 + 3H2O → H2PO3 + 3HCl
ప్రశ్న 8.
PCl అణువులోని ఐదు P – Cl బంధాలు సర్వ సమానమేనా? మీ సమాధానాన్ని సమర్థించండి.
సాధన:
PCl5 కి ట్రైగోనల్ బైపిరమిడల్ నిర్మాణం ఉంటుంది. దీనిలోని మూడు P – Cl ఈక్వటోరియల్ బంధాలు సర్వ సమానం మిగిలిన రెండు P – CI అక్షీయ బంధాలు వేరుగా ఉండి, ఈక్వటోరియల్ బంధాలకంటే పొడవుగా ఉన్నాయి.
ప్రశ్న 9.
H3PO2 నిర్మాణం ఆధారంగా దానికి క్షయకరణ ధర్మం ఉందని ఎలా వివరిస్తావు?
సాధన:
H3PO2లో రెండు H పరమాణువులు ప్రత్యక్షంగా P తో బంధాన్ని ఏర్పరచుకొని, ఉండటం వల్ల అవి ఆమ్లానికి క్షయకరణ ధర్మాన్ని ఆపాదింపజేస్తాయి.
పాఠ్యాంశ ప్రశ్నలు Intext Questions
ప్రశ్న 1.
ట్రైహాలైడ్ల కంటే పెంటాహాలైడ్లకు ఎందువల్ల అధిక సమయోజనీయత ఉంటుంది?
జవాబు:
కేంద్ర పరమాణువుపై ధనావేశం పెరుగుతున్న కొద్దీ ధ్రువణం చేసే స్వభావం పెరుగుతుంది. దీని కారణంగా కేంద్ర పరమాణువుకు ఇతర పరమాణువులకు మధ్య సమయోజనీయ బంధ స్వభావం పెరుగుతుంది.
ప్రశ్న 2.
15 వ గ్రూపు మూలకాలన్నింటికంటే BiH3 ఎందువల్ల ప్రబల క్షయకరణి?
జవాబు:
15వ గ్రూపు హైడ్రైడ్లలో BiH3 స్థిరత్వం కనిష్టం కాబట్టి.
ప్రశ్న 3.
గది ఉష్ణోగ్రత వద్ద N2 కి తక్కువ చర్యాశీలత ఉంది. ఎందుకు?
జవాబు:
బలమైన pπ – pπ అతిపాతం ఫలితంగా ఏర్పడే త్రికబంధం, N ≡ N.
ప్రశ్న 4.
NH3 దిగుబడిని గరిష్ఠపరచడానికి అనువైన పరిస్థితులను పేర్కొనండి.
జవాబు:
ఉష్ణోగ్రత – 700K (సుమారుగా)
పీడనం – 200 atm
ఉత్ప్రేరకం – ఐరన్ (Fe)
ప్రవర్థకం – Mo
ప్రశ్న 5.
Cu2+ ద్రావణంతో NH3 ఏ విధంగా చర్య జరుపుతుంది?
జవాబు:
Cu2+ ద్రావణం అమ్మోనియా జల ద్రావణంతో చర్య జరిపి ముదురు నీలం రంగు ద్రావణం ఏర్పడును.
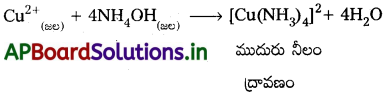
ప్రశ్న 6.
N2O5 లో నైట్రోజన్ సమయోజనీయత (కోవేలన్స్) ఎంత?
జవాబు:
N2O5 నిర్మాణం ‘నుంచి నైట్రోజన్ సమయోజనీయత నాలుగు అని తెలుస్తుంది.
ప్రశ్న 7.
PH+4 లోని బంధకోణం PH3 కంటే ఎక్కువ. ఎందువల్ల?
జవాబు:
రెండింటిలో sp³ సంకరీకరణం ఉంటుంది. PH+4 లో మొత్తం నాలుగు ఆర్బిటాళ్ళు బంధగతమైనవి. PH3 లో ఒక ఒంటరి జంట ఎలక్ట్రాన్లు P పై ఉన్నాయి. దీని కారణంగా బంధజంట ఒంటరిజంట వికర్షణల కారణంగా PH3 లో బంధకోణం 109° 28′ కంటే తక్కువ అవుతుంది.
ప్రశ్న 8.
CO2 తెల్ల ఫాస్ఫరస్ ను రసాయన జడ పరిస్థితులలో గాఢ NaOH ద్రావణంతో కలిపి వేడిచేస్తే ఏం జరుగుతుంది?
జవాబు:
CO2 జడ వాతావరణంలో తెల్ల ఫాస్ఫరస్కు గాఢ NaOH కలిపి వేడిచేస్తే ఫాస్ఫేన్ ఏర్పడును.
P4 + 3NaOH + 3H2O → PH3 + 3NaH2PO2.
![]()
ప్రశ్న 9.
PCl5 ని వేడిచేస్తే ఏం జరుగుతుంది?
జవాబు:
PCl3, ని వేడిచేస్తే PCl3 ఏర్పడును.
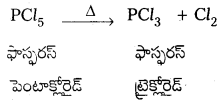
ప్రశ్న 10.
భారజలంతో PCl5 జరిపే జలవిశ్లేషణ చర్యకు సమతుల్యం చేసిన రసాయన సమీకరణాన్ని వ్రాయండి.
జవాబు:

ప్రశ్న 11.
H3PO5 క్షారత (basicity) ఎంత?
జవాబు:
H3PO4 అణువులో మూడు P – OH గ్రూపులు ఉన్నాయి. కాబట్టి దీని క్షారత మూడు.