Andhra Pradesh BIEAP AP Inter 1st Year Chemistry Study Material 2nd Lesson మూలకాల వర్గీకరణ – ఆవర్తన ధర్మాలు Textbook Questions and Answers.
AP Inter 1st Year Chemistry Study Material 2nd Lesson మూలకాల వర్గీకరణ – ఆవర్తన ధర్మాలు
అతిస్వల్ప సమాధాన ప్రశ్నలు
ప్రశ్న 1.
మెండలీవ్ ఆవర్తన నియమ పద్ధతికి, ఆధునిక ఆవర్తన నియమ పద్ధతికి గల తేడా ఏమిటి?
జవాబు:
- మెండలీవ్ ప్రకారం మూలకాల భౌతిక రసాయన ధర్మాలు పరమాణు భారాలకు ఆవర్తన ప్రమేయాలు.
- నూతన ఆవర్తన నియమం ప్రకారం మూలకాల భౌతిక రసాయన ధర్మాలు పరమాణు సంఖ్యలకు ఆవర్తన ప్రమేయాలు.
ప్రశ్న 2.
Z = 1144 గల మూలకాన్ని ఏ పీరియడ్, ఏ గ్రూప్లో
జవాబు:
Z = 114 గల మూలకం 7వ పీరియడ్ IVA గ్రూపులో ఉంచబడును ఉంచుతారు?
ప్రశ్న 3.
ఆవర్తన పట్టికలో మూడో పీరియడ్, పదిహేడో గ్రూప్లో ఉన్న మూలకం పరమాణు సంఖ్యను తెలపండి.
జవాబు:
3వ పీరియడ్ మరియు 17వ గ్రూపులో ఉండు మూలకం క్లోరిన్ ‘Cl’ (Z = 17)
ప్రశ్న 4.
(a) లారెన్స్ బరీ ప్రయోగశాల (b) సీబర్గ్ గ్రూప్ వీరిచే నామకరణం చేయబడిన మూలకాలు ఏవై ఉంటాయి?
జవాబు:
a) లారెన్స్ బర్క్లీ ప్రయోగశాల – లాంథనైడ్
b) సీబర్గ్ గ్రూప్ – ఆక్టినైడ్
ప్రశ్న 5.
ఒకే గ్రూప్ లోని మూలకాలు సారూప్య భౌతిక, రసాయన ధర్మాలను ఎట్లా కలిగి ఉంటాయి ?
జవాబు:
ఒకే గ్రూపులోని మూలకాలు ఒకే సంఖ్యలో వేలన్సీ ఎలక్ట్రాన్లను కలిగి ఉంటాయి. మరియు ఒకే రకమైన బాహ్య కక్ష్య ఎలక్ట్రాన్ విన్యాసం కలిగి ఉంటాయి. కావున ఒకేరకమైన భౌతిక, రసాయన ధర్మాలు కలిగి ఉంటాయి.
ప్రశ్న 6.
ప్రాతినిధ్య మూలకాలంటే ఏమిటి ? వాటి వేలన్సీ కక్ష్య విన్యాసాన్ని తెలపండి.
జవాబు:
పరివర్తన మూలకాలు మరియు ‘0’ గ్రూపు మూలకాలు కాకుండా మిగిలిన మూలకాలను ‘ప్రాతినిధ్య మూలకాలు’ అంటారు. వీటి వేలన్సీ కక్ష్యలు ఎలక్ట్రాన్లతో అసంపూర్ణంగా నిండి ఉంటాయి. సాధారణ వేలన్సీ కక్ష్య ఎలక్ట్రాన్ విన్యాసం : ns1-4 np0-5.
![]()
ప్రశ్న 7.
ఆవర్తన పట్టికలో f – బ్లాక్ మూలకాల స్థానాన్ని సమర్థించండి.
జవాబు:
పరమాణు సంఖ్య ఆధారంగా లాంథనైడ్ మూలకాలను వర్గీకరణ పట్టిక ప్రధాన భాగంలో తీసుకుంటే అది మూలకాల వర్గీకరణ ఆవశ్యకతను నాశనం చేస్తుంది మరియు మూలకాల సౌష్ఠవ అమరిక కూడా దెబ్బతింటుంది. అందువల్ల ప్రధాన భాగం నుండి విడదీసి వర్గీకరణ పట్టిక క్రింది భాగంలో అమర్చుట జరిగింది.
ప్రశ్న 8.
‘X’ అనే మూలకం పరమాణు సంఖ్య 34. ఆవర్తన పట్టికలో దాని స్థానాన్ని తెలపండి.
జవాబు:
వేలన్సీ స్థాయి ఎలక్ట్రాన్ విన్యాసము, 34X = [Ar] 3d10 4s² 4p4
∴ ఈ మూలకం (X) నాల్గవ పీరియడ్కు మరియు VIA గ్రూపుకు చెంది ఉంటుంది. (p – బ్లాక్ మూలకము).
ప్రశ్న 9.
పరివర్తన మూలకాల అభిలాక్షణిక ధర్మాలకు కారణమయ్యే అంశాలు ఏవి?
జవాబు:
చిన్న పరమాణు పరిమాణం, అధిక కేంద్రక ఆవేశం; d – ఆర్బిటాల్లలో ఒంటరి ఎలక్ట్రాన్లు ఉండటం మొ॥ పరివర్తన మూలకాల విలక్షణ ధర్మాలకు కారణమైన అంశాలు.
ప్రశ్న 10.
d – బ్లాక్, f – బ్లాక్ మూలకాల బాహ్య కక్ష్యల ఎలక్ట్రాన్ విన్యాసాన్ని ఇవ్వండి.
జవాబు:
- d – బ్లాకు మూలకాల బాహ్య కక్ష్య విన్యాసం – ns1-2 (n – 1)d1-10
- f – బ్లాకు మూలకాల బాహ్య కక్ష్య విన్యాసం – ns² (n – 1)d0 (or) 1 (n – 2) f1-14
ప్రశ్న 11.
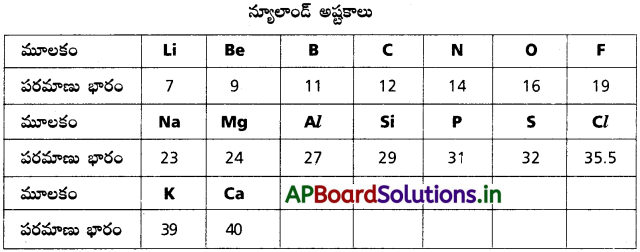
డోబరైనర్ త్రిక నియమాన్ని, న్యూలాండ్ అష్టక నియమాన్ని నిర్వచించి ఒక్కొక్క ఉదాహరణను ఇవ్వండి.
జవాబు:
1. డోబరైనర్ ప్రకారం ప్రతి త్రికంలో మధ్య ఉన్న మూలక పరమాణు భారం మిగిలిన రెండు మూలకాల పరమాణు భారాల మధ్య ఉంటుంది.

2. న్యూలాండ్ ప్రకారం మూలకాలను పరమాణు భారాలు పెరిగే క్రమంలో అమర్చినపుడు ప్రతి ఎనిమిదవ మూలకం మొదటి మూలక ధర్మాలతో పోలి ఉంటుంది. ఈ సంబంధం సంగీత స్వరాలలో ఎనిమిదవ స్వరం మొదటి స్వరంతో పోలిక ఉంటుంది.
ప్రశ్న 12.
మెండలీవ్ ఆవర్తన పట్టికలోని అసంగత మూలకాల జంటలు ఏవి?
జవాబు:
అసంగత జంటలు : ఆధునిక మెండలీవ్ ఆవర్తన పట్టికలో నాలుగు జతల మూలకాల్లో పరమాణు భారాల వరసలు అపక్రమంలో ఉన్నాయి. అవి :
పరమాణు భారం మూలకానికి మౌళిక లక్షణం కాదు కాబట్టి ఈ విధమైన అసంగత జంటలేర్పడ్డాయి.
ప్రశ్న 13.
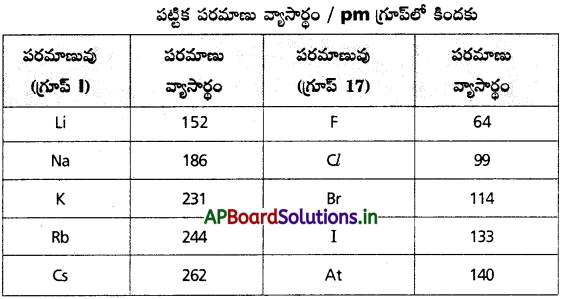
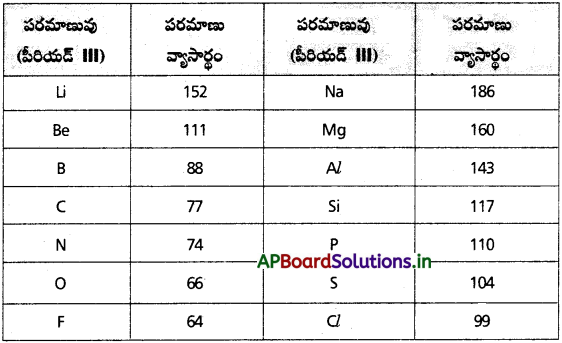
పీరియడ్లో, గ్రూప్లో పరమాణు వ్యాసార్థం ఎలా మార్పు చెందుతుంది ? మార్పును ఎట్లా విశదీకరిస్తారు?
జవాబు:
ఆవర్తన క్రమం :
i) గ్రూపులో :
గ్రూపులో పైనుండి కిందికి కక్ష్యల సంఖ్య పెరుగుతాయి కాబట్టి పరమాణు వ్యాసార్థం కూడా అదే క్రమంలో పెరుగుతుంది.
ii) పీరియడ్లో :
పీరియడ్లో ఎడమ నుంచి కుడికి కక్ష్యలు పెరగవు కాని కేంద్రకావేశం పెరుగుతుంది. కాబట్టి పరమాణు వ్యాసార్థం క్రమంగా తగ్గుతుంది.
ప్రశ్న 14.
N-3, O-2, F–, Na+, Mg+2, Al+3 లను పరిశీలించండి. (a) వీటిలో గల సారూప్యత ఏమిటి? (b) వీటిని అయానిక వ్యాసార్థ పెరుగుదల క్రమంలో అమర్చండి.
జవాబు:
ఇవ్వబడిన అయాన్లు N-3, O-2, F–, Na+, Mg+2 మరియు Al+3
a) అన్ని అయాన్లు ఒకే ఎలక్ట్రాన్ల సంఖ్య కలిగి ఉన్నవి. కావున వీటిని సమ ఎలక్ట్రాన్ జాతులు అంటారు.
b) అయానిక వ్యాసార్ధ పెరుగుదల Al+3 < Mg+2< Na+ < F–< O-2 < N-3
వివరణ :
సమ ఎలక్ట్రాన్ జాతులలో కేంద్రక ఆవేశం పెరిగేకొలది అయానిక వ్యాసార్థం తగ్గును.
![]()
ప్రశ్న 15.
అయొనైజేషన్ ఎంథాల్పీని నిర్వచించినప్పుడు, భూస్థితిలోని ఒంటరి పరమాణువు అను పదానికి గల ప్రాముఖ్యం ఏమిటి? (సూచన: పోల్చడానికి అవసరమైంది.)
జవాబు:
వాయుస్థితిలోని ఒంటరి తటస్థ పరమాణువు యొక్క బాహ్య కర్పరంలోని ఒక ఎలక్ట్రాను తీసివేయుటకు కావలసిన శక్తిని అయనీకరణ శక్తి (ప్రథమ అయనీకరణ శక్తి) అంటారు.
ప్రశ్న 16.
భూస్థితిలో హైడ్రోజన్ పరమాణువులోని ఎలక్ట్రాన్ శక్తి – 2.18 × 10-18J. హైడ్రోజన్ పరమాణువు అయొనైజేషన్ ఎంథాల్పీని J mol-1 లలో లెక్కకట్టండి.
జవాబు:
భూస్థితిలో హైడ్రోజన్ పరమాణువులోని ఎలక్ట్రాన్ శక్తి = – 2.18 × 10-18 J.
ఒక మోల్ పరమాణువులకు – 2.18 × 10-18 × 6.023 × 1023
=- 13.13 × 105 J/Mole
∴ హైడ్రోజన్ పరమాణువు అయొనైజేషన్ ఎంథాల్పీ = 13.13 × 105 J/Mole.
ప్రశ్న 17.
‘O’ అయొనైజేషన్ ఎంథాల్పీ ‘N’ కంటే తక్కువ – విశదీకరించండి.
జవాబు:
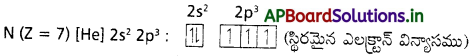
1. నైట్రోజన్ నందు కేంద్రకావేశం ఎక్కువ.
2. నైట్రోజన్ యొక్క సగం నిండిన ఎలక్ట్రాన్ విన్యాసం వలన దానికి స్థిరత్వం ఎక్కువ. అందువలన అయనీకరణ శక్తి ఎక్కువ.
ప్రశ్న 18.
కింది ప్రతి జంటలో, దేనికి అధిక రుణాత్మక ఎలక్ట్రాన్ గ్రాహ్య ఎంథాల్పీ ఉంది? (a) O, F, (b) F, Cl.
జవాబు:

ప్రశ్న 19.
లోహాలకు, అలోహాలకు ఉన్న ముఖ్యమైన తేడాలు ఏవి?
జవాబు:
| లోహాలు | అలోహాలు |
| → ఇవి సాధారణంగా ఘనరూపంలో ఉంటాయి (Hg తప్ప) | → ఇవి ఘన (లేదా) ద్రవ (లేదా) వాయు రూపంలో ఉంటాయి. |
| → అధిక ద్రవీభవన మరియు బాష్పీభవన స్థానాలు కలిగి ఉంటాయి. | → తక్కువ ద్రవీభవన మరియు బాష్పీభవన స్థానాలు కలిగి ఉంటాయి. |
| → మంచి ఉష్ణ మరియు విద్యుద్వాహకాలు | → ఇవి మంచి ఉష్ణ మరియు విద్యుద్వాహకాలు కాదు. |
ప్రశ్న 20.
ఆవర్తన పట్టిక సహాయంతో కింది మూలకాలను గుర్తించండి.
(a) బాహ్య ఉపస్థాయిలో 5 ఎలక్ట్రాన్లు ఉన్నాయి.
(b) రెండు ఎలక్ట్రాన్లను పోగొట్టుకోగలది
(c) రెండు ఎలక్ట్రాన్లను గ్రహించగలది.
జవాబు:
a) బాహ్య కర్పరంలో ‘5’ ఎలక్ట్రాన్లు కలిగి ఉండేవి 15 వ గ్రూపు మూలకాలు
ఉదా : N, P, As……… (ns² np³)
b) రెండు ఎలక్ట్రాన్లను కోల్పోయేవి IIA – గ్రూపు మూలకాలు.
ఉదా : Mg, Ca, (ns²)
c) రెండు ఎలక్ట్రాన్లను గ్రహించేవి VIA – గ్రూపు మూలకాలు.
ఉదా : O, S (ns² np4)
ప్రశ్న 21.
s, p, d, f – బ్లాక్ మూలకాల బాహ్య ఎలక్ట్రాన్ విన్యాసాన్ని ఇవ్వండి.
జవాబు:

ప్రశ్న 22.
B, AT, Hg, K ల లోహ స్వభావం పెరిగే క్రమాన్ని రాయండి.
జవాబు:
ఇవ్వబడిన మూలకాలు B, Al, Mg మరియు K
లోహ స్వభావం పెరిగే క్రమం
B < Al < Mg < K
ప్రశ్న 23.
B, C, N, F, Si ల సరైన అలోహ స్వభావ పెరుగుదల క్రమాన్ని రాయండి.
జవాబు:
ఇవ్వబడిన మూలకాలు B, C, N, F మరియు Si
అలోహ స్వభావం పెరిగే క్రమం
Si < B < C < N < F
![]()
ప్రశ్న 24.
N, O, F, CL ల సరైన రసాయన చర్యాశీలత పెరుగుదల క్రమాన్ని వాటి ఆక్సీకరణ ధర్మం పరంగా రాయండి.
జవాబు:
ఆక్సీకరణ ధర్మం పరంగా రసాయన చర్య శీలత పెరుగుదల క్రమం
F > O > CI > N.
ప్రశ్న 25.
రుణ విద్యుదాత్మకత అంటే ఏమిటి ? మూలకాల స్వభావాన్ని తెలుసుకోవడానికి ఇది ఎలా ఉపయోగమవుతుంది?
జవాబు:
సమయోజనీయ బంధంతో బంధితమై ఉన్న రెండు పరమాణువులలో, ఒక పరమాణువు బంధజంట ఎలక్ట్రాన్లను తనవైపుకు ఆకర్షించుకునే స్వభావాన్ని ఋణవిద్యుదాత్మకత అంటారు.
ఋణ విద్యుదాత్మకత – ఉపయోగము :
ఋణ విద్యుదాత్మక విలువల నుంచి రసాయనబంధ స్వభావాన్ని అర్థం చేసుకోవచ్చు. బంధితమయిన రెండు పరమాణువుల EN విలువల మధ్య తేడా 1.70 లేదా అంతకన్నా ఎక్కువ అయితే వాటి మధ్య బంధానికి 50% లేదా అంతకంటే ఎక్కువ అయానిక స్వభావం ఉంటుంది. అట్లాగే రెండు పరమాణువుల మధ్య EN విలువల తేడా 1.70 కంటే తక్కువ అయినప్పుడు ఏర్పడిన బంధానికి 50% కంటే ఎక్కువ కోవలెంట్ స్వభావం ఉంటుంది.
ప్రశ్న 26.
పరిరక్షక ప్రభావం అంటే ఏమిటి ? అది ఏ విధంగా అయొనైజేషన్ ఎంథాల్పీ (IE) తో సంబంధం కలిగి ఉంది?
జవాబు:
పరిరక్షక ప్రభావము :
“పరమాణు అంతర కర్పరాలలోని ఎలక్ట్రాన్లు బాహ్య కర్పరాలలోని ఎలక్ట్రాన్లను కేంద్రక ఆకర్షణ బారి నుండి రక్షించుట”. పరిరక్షక ప్రభావము పెరిగే కొలది అయనీకరణ శక్తి తగ్గుతుంది.

ప్రశ్న 27.
మూలకాల రుణ విద్యుదాత్మకత లోహ, అలోహ లక్షణాలకు సంబంధం ఏమిటి?
జవాబు:
- సాధారణంగా ఋణవిద్యుదాత్మక విలువలు అలోహ స్వభావాన్ని సూచిస్తాయి.
- అల్ప ఋణ విద్యుదాత్మక విలువలు అల్ప అలోహ స్వభావాన్ని అధిక లోహ స్వభావాన్ని సూచిస్తాయి. ఋణ
ప్రశ్న 28.
ఆక్సిజన్, హైడ్రోజన్ పరంగా ఆర్సినిక్కు సాధ్యమయ్యే వేలన్సీ ఎంత?
జవాబు:
ఆర్సినిక్ రెండు ఆక్సైడ్ నిస్తుంది. అవి As2O3 మరియు As2O5 లు. As2O3 లో ఆర్సినిక్ వేలన్సీ ‘3’, As2O5లో ఆర్సినిక్ వేలన్సీ ‘5’.
ప్రశ్న 29.
ద్విస్వభావిక ఆక్సైడ్ అంటే ఏమిటి? 13వ గ్రూప్ మూలకం ఏర్పరచే ద్విస్వభావిక ఆక్సైడ్ ఫార్ములాని ఇవ్వండి.
జవాబు:
ఆమ్ల, క్షార ఆక్సైడ్ స్వభావం గల ఆక్సైడ్ను ద్విస్వభావ ఆక్సైడ్ అంటారు.
ఉదా : Al2O3 Sb2O3 మొ॥
→ 13వ గ్రూపు మూలకం ఏర్పరచే ద్విస్వభావ ఆక్సైడ్. ఉదా : Al2O3.
![]()
ప్రశ్న 30.
అధిక రుణ విద్యుదాత్మకత కల మూలకం ఏది? దానికి అత్యధిక ఎలక్ట్రాన్ గ్రాహ్య ఎంథాల్పీ ఉందా? ఎందుకు ఉంది? ఎందుకు లేదు?
జవాబు:
అత్యధిక ఋణవిద్యుదాత్మకత కలిగిన మూలకము ‘ఫ్లోరిన్ (F). కాని ఫ్లోరిన్క అత్యధిక EA విలువ లేదు. క్లోరిన్ (CI) కు ఫ్లోరిన్ కన్నా అధిక EA విలువ ఉంటుంది.
కారణం :
ఫ్లోరిన్ పరమాణువు క్లోరిన్ పరమాణువు కంటే చిన్నది కావడం వల్ల వస్తుంది. ఫ్లోరిన్లో బలమైన అంతర్ ఎలక్ట్రాన్ వికర్షణలు కూడా ఉంటాయి. కాబట్టి ఫ్లోరిన్ పరమాణువుకు ఎలక్ట్రాన్ను చేర్చినప్పుడు విడుదలైన శక్తిలో కొంత భాగం అంతర్ ఎలక్ట్రాన్ వికర్షణలను అధిగమించడానికి వినియోగమవుతుంది. కాబట్టి నికరంగా విడుదలైన శక్తి క్లోరిన్లో కంటే ఫ్లోరిన్లో తక్కువగా ఉంటుంది.
ప్రశ్న 31.
కర్ణ సంబంధం అంటే ఏమిటి ? ఈ సంబంధం ఉన్న ఒక మూలకాల జంటను ఇవ్వండి.
జవాబు:
కర్ణ సంబంధం :
“ఆవర్తన పట్టికలో రెండవ పీరియడ్లోని ఒక మూలకానికి మూడవ పీరియడ్లోని తరువాత గ్రూపు రెండో మూలకానికి సారూప్య ధర్మాలుంటాయి. ఈ సంబంధాన్ని కర్ణ సంబంధం అంటారు.”
ఉదా : (Li, Mg); (Be, Al); (B, Si)
ప్రశ్న 32.
మూడో పీరియడ్లో ఆక్సైడ్ స్వభావం ఎలా మారుతుంది?
జవాబు:
మూడవ పీరియడ్ :
మూలకాల ఆక్సైడ్ ధర్మాలు :
ఈ పీరియడ్లో ఎడమ నుండి కుడి వైపుకు పోయే కొలది ఆక్సైడ్ క్షార ధర్మం క్రమంగా తగ్గి ఆమ్ల ధర్మం క్రమంగా పెరుగుతుంది.
ఉదా : Na2O క్షార ఆక్సైడ్ కాగా క్లోరిన్ ఆక్సైడ్లు ఆమ్లంగా ఉంటాయి.
ప్రశ్న 33.
ఐరన్ పరమాణువు, వాటి అయాన్ల వ్యాసార్థాలు పాటించే క్రమం Fe > Fe2+ > Fe3+ – విశదీకరించండి.
జవాబు:
లోహ పరమాణువుపై ఆవేశం పెరిగేకొలదీ, కేంద్రక ప్రభావిత ఆవేశం పెరుగుట వల్ల అయాన్ పరిమాణం తగ్గును. కావున
Fe > Fe+2 > Fe+3
ప్రశ్న 34.
ఒక మూలకం రెండో అయొనైజేషన్ ఎంథాల్పీ (IE2) కంటె మొదటి అయొనైజేషన్ ఎంథాల్పీ (IE1) తక్కువ. ఎందుకు?
జవాబు:
ఒక ఎలక్ట్రాన్ను తొలగించిన తరువాత మిగిలి ఉన్న ఎలక్ట్రాన్లపై కేంద్రక ప్రభావిత ఆవేశం పెరుగును. అందువల్ల కేంద్రక ఆకర్షణ మిగిలిన ఎలక్ట్రాన్లపై పెరుగును. అందువల్ల IE2 > IE1
ప్రశ్న 35.
లాంథనైడ్ సంకోచం అంటే ఏమిటి? దాని ఫలితాలలో ఒక దానిని చెప్పండి.
జవాబు:
లాంథనైడ్ మూలకాల పరమాణువుల మరియు అయాన్ల పరిమాణంలోని క్రమబద్ధమైన తగ్గుదలను లాంథనైడ్ సంకోచం అంటారు.
ఫలితాలు :
లాంథనైడ్ సంకోచం వల్ల లాంథనైడ్ మూలకాలను వేరుపరచుట కష్టమైంది.
ప్రశ్న 36.
అధిక సంఖ్యలో జతగూడని 2p ఎలక్ట్రాన్ల లు ఉన్న మూలకం పరమాణు సంఖ్య ఎంత? అది ఏ గ్రూప్కు చెందింది?
జవాబు:
అధిక సంఖ్యలో జతగూడని 2p ఎలక్ట్రాన్లు కలిగిన మూలకం నైట్రోజన్ పరమాణు సంఖ్య ‘7’.

→ ‘N’ VA గ్రూపుకు చెందును.
ప్రశ్న 37.
సోడియంకు బలమైన లోహ స్వభావం ఉంటుంది. క్లోరిన క్కు బలమైన అలోహ స్వభావం ఉంటుంది. విశదీకరించండి.
లేదా
సోడియం బలమైన లోహం కాగా, క్లోరిన్ బలమైన అలోహం – ఎందుకు?
జవాబు:
‘Na’ ఒక క్షార లోహము, ఇది IA – గ్రూపు మూలకం, దీనికి ఎలక్ట్రాన్ కోల్పోయే సామర్థ్యం కలదు. ధన విద్యుదాత్మకత కలిగియుండును. కావున దీనికి బలమైన లోహ స్వభావం కలదు.
‘C’ ఒక హాలోజన్, ఇది VIIA – గ్రూపు మూలకం. దీనికి ఎలక్ట్రాన్ సంగ్రహించే సామర్థ్యం కలదు. ఋణ విద్యుదాత్మకత కలిగియుండును. కావున దీనికి బలమైన అలోహ స్వభావం కలదు.
![]()
ప్రశ్న 38.
శూన్య గ్రూప్ మూలకాలను ఉత్కృష్ట లేదా తటస్థ వాయువులని ఎందుకు అంటారు?
జవాబు:
- శూన్య గ్రూపు మూలకాల్ని బాహ్య ఎలక్ట్రాన్ విన్యాసం ns’ np’ (‘He’ తప్ప).
- ఇవి స్థిరమైన అష్టక విన్యాసం కలిగి ఉండి రసాయనికంగా జఢత్వాన్ని కలిగి ఉంటాయి. కావున వీటిని జడవాయువులు (లేదా) తటస్థ వాయువులు అంటారు.
- ఈ మూలకాలు ఎలక్ట్రాన్లను కోల్పోవడం గానీ, సంగ్రహించడం గాని జరగదు అందువలన వీటిని ఉత్కృష్ట వాయువులు అంటారు.
ప్రశ్న 39.
ప్రతి జంటలో, తక్కువ అయనీకరణ శక్తి ఉన్న దానిని గుర్తించి, కారణాన్ని తెలపండి.
(a) I, I– (b) Br, K. (c) Li, Li+ (d) Ba, Sr (e) O, S (f) Be, B (g) N, O
జవాబు:
a) I కంటే I– కు తక్కువ అయనీకరణ శక్తి అవసరం. IΘ పరిమాణం I కంటే ఎక్కువ.
b) Br కంటే Kకు తక్కువ అయనీకరణ శక్తి అవసరం. K ధన విద్యుదాత్మక మూలకం, Br ఋణ విద్యుదాత్మక మూలకం.
c) Li+ కంటే Li కు తక్కువ అయనీకరణ శక్తి అవసరం. Liకు Li+ కంటే పరమాణు పరిమాణం ఎక్కువ.
d) ‘O’ కంటే S కు తక్కువ అయనీకరణ శక్తి అవసరం. ‘S’ కు ‘O’ కంటే పరమాణు పరిమాణం ఎక్కువ.
e) ‘Be’ కంటే ‘B’ కు తక్కువ అయనీకరణ శక్తి అవసరం. ‘Be’ నందు పూర్తిస్థాయిలో నిండిన ఆర్బిటాళ్లు కలవు.
f) ‘N’ కంటే ‘O’ కు తక్కువ అయనీకరణ శక్తి అవసరం. ‘N’ నందు సగం నిండిన ఆర్బిటాళ్లు కలవు.
ప్రశ్న 40.
ఆక్సిజన్ IE1 < నైట్రోజన్ IE1 కాని ఆక్సిజన్ IE2 > నైట్రోజన్ IE2 – విశదీకరించండి.
జవాబు:
- ‘N’ లో సగం నిండిన ఆర్బిటాళ్లు కలవు (1s² 2s² 2p³) కావున ఆక్సిజన్ IE1 < నైట్రోజన్ IE1.
- O+ అయాన్లో సగం నిండిన ఆర్బిటాళ్లు కలిగి ఉండును కావున ఆక్సిజన్ IE2 > నైట్రోజన్ IE2.
ప్రశ్న 41.
Na+, Ne లకు ఒకే ఎలక్ట్రాన్ విన్యాసం ఉన్నప్పటికీ, Na+ కు Ne కంటే ఎక్కువ అయనీకరణ శక్మపు విలువను కలిగి ఉంది విశదీకరించండి.
జవాబు:
Na+, Ne లకు ఒకే ఎలక్ట్రాన్ విన్యాసం ఉన్నప్పటికీ Na+ కు Ne కంటే ఎక్కువ అయనీకరణ శక్మం విలువను కలిగి ఉంది.
వివరణ :
- Na+ అయాన్, Ne లకు ఎలక్ట్రాన్ విన్యాసం 1s² 2s² 2p6
- Na+ అయాన్లో ‘Ne’ లో కంటే కేంద్రక ఆవేశం ఎక్కువగా ఉండును.
ప్రశ్న 42.
కింది ప్రతి జంటలో దేనికి ఎక్కువ రుణాత్మక ఎలక్ట్రాన్ గ్రాహ్య ఎంథాల్పీ ఉంది? విశదీకరించండి.
(a) N, O
(b) F, CL
జవాబు:
a) ఆక్సిజన్కు నైట్రోజన్ కంటే అధిక రుణాత్మక ఎలక్ట్రాన్ గ్రాహ్య ఎంథాల్పీ కలిగి ఉంటుంది. దీనికి కారణం నైట్రోజన్లో స్థిరమైన సగం నిండిన ఎలక్ట్రాన్ విన్యాసం కలిగి ఉండును.
b) క్లోరిన్కు ఫ్లోరిన్ కంటే అధిక రుణాత్మక ఎలక్ట్రాన్ గ్రాహ్య ఎంథాల్పీని కలిగి ఉంటుంది. దీనికి కారణం ‘F’ యొక్క తక్కువ పరమాణు పరిమాణం మరియు అధిక ఎలక్ట్రాన్ వికర్షణలు.
ప్రశ్న 43.
క్లోరిన్ ఎలక్ట్రాన్ అఫినిటి ఫ్లోరిన్ కంటే ఎక్కువ – విశదీకరించండి.
జవాబు:
అత్యధిక ఋణవిద్యుదాత్మకత కలిగిన మూలకము ‘ఫ్లోరిన్ (F). కాని ఫ్లోరిన్కు అత్యధిక EA విలువ లేదు. క్లోరిన్ (CI) కు ఫ్లోరిన్ కన్నా అధిక EA విలువ ఉంటుంది.
కారణం :
ఫ్లోరిన్ పరమాణువు క్లోరిన్ పరమాణువు కంటే చిన్నది కావడం వల్ల వస్తుంది. ఫ్లోరిన్లో బలమైన అంతర్ ఎలక్ట్రాన్ వికర్షణలు కూడా ఉంటాయి. కాబట్టి ఫ్లోరిన్ పరమాణువుకు ఎలక్ట్రానన్ను చేర్చినప్పుడు విడుదలైన శక్తిలో కొంత భాగం అంతర్ ఎలక్ట్రాన్ వికర్షణలను అధిగమించడానికి వినియోగమవుతుంది. కాబట్టి నికరంగా విడుదలైన శక్తి క్లోరిన్లో కంటే ఫ్లోరిన్లో తక్కువగా ఉంటుంది.
ప్రశ్న 44.
కింది ప్రతి జంటలో దేనికి ఎక్కువ ఎలక్ట్రాన్ అఫినిటీ ఉంది?
(a) F, Cl–
(b) O, O–
(c) Na+, F
(d) F, F–
జవాబు:
a) ‘F’ కు Cl– కంటే ఎక్కువ ఎలక్ట్రాన్ ఎఫినిటీ కలదు దీనికి కారణం Cl– జడవాయు విన్యాసం కలిగి ఉండటమే.
b) ‘O’ కు O– కంటే ఎక్కువ ఎలక్ట్రాన్ ఎఫినిటీ కలదు. దీనికి కారణం O– త్వరగా ఎలక్ట్రాన్ను స్వీకరించలేదు.
c) ‘F’ కు Na+ కంటే ఎక్కువ ఎలక్ట్రాన్ ఎఫినిటీ కలదు. దీనికి కారణం Na+ జడ వాయు విన్యాసం కలిగి ఉండటమే.
d) Fకు F– కంటే ఎక్కువ ఎలక్ట్రాన్ ఎఫినిటీ కలదు. దీనికి కారణం F– జడ వాయు విన్యాసం కలిగి ఉండటమే.
![]()
ప్రశ్న 45.
కింది వాటిని అయానిక వ్యాసార్థ పెరుగుదల క్రమంలో అమర్చండి.
(a) Cl–, P-3, S-2, F–
(b) Al+3, Mg+2, Na+, O-2, F–
(c) Na+, Mg+2, K+
జవాబు:
a) అయానిక వ్యాసార్థ పెరుగుదల క్రమం F– < Cl– < S-2 < P-3
b) అయానిక వ్యాసార్థ పెరుగుదల క్రమం Al+3 < Mg+2 < Na+ < F– < O-2
C) అయానిక వ్యాసార్థ పెరుగుదల క్రమం Mg+2 < Na+ < K+
ప్రశ్న 46.
Mg+2, O-2 రెండు ఒకే ఎలక్ట్రాన్ విన్యాసాన్ని కలిగి ఉన్నప్పటికీ, పరిమాణంలో Mg+2, O-2 కంటే తక్కువ.
జవాబు:
- Mg+2 మరియు O-2 అయాన్లు సమ ఎలక్ట్రాన్ జాతులు.
- సమ ఎలక్ట్రాన్ జాతులనందు కేంద్రక ఆవేశం పెరిగే కొలది అయాన్ పరిమాణం తగ్గును. కావున Mg+2 పరిమాణం O-2 కంటే తక్కువ.
ప్రశ్న 47.
B, Al, C, Si మూలకాలలో
(a) దేనికి అత్యధిక ప్రథమ అయొనైజేషన్ ఎంథాల్పీ ఉంది?
(b)దేనికి ఎక్కువ రుణాత్మక ఎలక్ట్రాన్ గ్రాహ్య ఎంథాల్పీ ఉంది?
(c) దేనికి అత్యధిక పరమాణు వ్యాసార్థం ఉంది?
(d) దేనికి ఎక్కువ లోహ స్వభావం ఉంది?
జవాబు:
a) అధిక I.E కలిగిన మూలకం కార్బన్
b) ఎక్కువ ఋణాత్మక గ్రాహ్య ఎంథాల్పీ కలిగిన మూలకం కార్బన్ (- 122 KJ/mole)
c) ఎక్కువ పరమాణు వ్యాసార్థం కలిగినది Al (1.43 Å)
d) అధిక లోహ స్వభావం కలిగినది ‘Al’.
ప్రశ్న 48.
N, P, O, S మూలకాలను గమనించండి. వాటిని
(a) ప్రథమ అయొనైజేషన్ ఎంథాల్పీ పెరుగుదల క్రమంలో
(b) రుణాత్మక ఎలక్ట్రాన్ గ్రాహ్య ఎంథాల్పీ పెరుగుదల క్రమంలో
(c) అలోహ స్వభావం పెరిగే క్రమంలో రాయండి.
జవాబు:
a) మొదటి అయనీకరణ శక్తి పెరుగుదల క్రమం S < P < O < N.
b) రుణాత్మక ఎలక్ట్రాన్ గ్రాహ్య ఎంథాల్పీ పెరుగుదల క్రమం N < P < 0 < S
c) అలోహ స్వభావం పెరుగుదల క్రమం P < N < S < 0.
ప్రశ్న 49.
ఇచ్చిన క్రమంలో అమర్చండి :
(a) ఎలక్ట్రాన్ గ్రాహ్య (EA) పెరుగుదల: 0, Sse
(b) IE1 పెరుగుదల : Na, K, Rb
(c) వ్యాసార్థం పెరుగుదల : I–, I+, I
(d) రుణవిద్యుదాత్మకత పెరుగుదల : F, Cl, Br, I
(e) EA పెరుగుదల : F, Cl, Br, I
(f) వ్యాసార్థం పెరుగుదల : Fe, Fe+2, Fe+3
జవాబు:
a) ఎలక్ట్రాన్ ఎఫినిటీ పెరుగుదల క్రమం O < Se < S.
b) IE1 పెరుగుదల క్రమం Rb < K < Na.
c) వ్యాసార్ధం పెరుగుదల క్రమం I+ < I < I–
d) రుణవిద్యుదాత్మక పెరుగుదల క్రమం I < Br < C < F
e) ఎలక్ట్రాన్ ఎఫినిటీ పెరుగుదల క్రమం I < Br < F< Cl
f) వ్యాసార్థం పెరుగుదల క్రమం Fe+3 < Fe+2 < Fe.
ప్రశ్న 50.
(a) అత్యధిక అయొనైజేషన్ ఎంథాల్పీ ఉన్న మూలకం ఏది?
(b)అత్యధిక అయొనైజేషన్ ఎంథాల్పీ విలువ గల గ్రూపు ఏది?
(c) అత్యధిక ఎలక్ట్రాన్ అఫినిటీని చూపే మూలకం ఏది?
(d)మెండలీవ్ కాలానికి తెలియని మూలకాల పేర్లు తెలపండి.
(e)ఏవైనా రెండు ప్రాతినిథ్య మూలకాల పేర్లు తెలపండి.
జవాబు:
a) అధిక IE1 కలిగిన మూలకం ‘హీలియం’.
b) అధిక IE కలిగిన గ్రూపు శూన్య గ్రూపు (లేదా) జడవాయువులు.
c) అధిక ఎలక్ట్రాన్ ఎఫినిటీ కలిగిన మూలకం క్లోరిన్.
d) మెండలీవ్ కాలానికి తెలియని మూలకాలు జెర్మేనియం (ఎకాసిలికాన్), స్కాండియం (ఎకా అల్యూమినియం), గాలియం (ఎకాబోరాన్).
e) అల్యూమినియం, సిలికాన్, ఫాస్ఫరస్లు ప్రాతినిధ్య మూలకాలకు ఉదా :
![]()
ప్రశ్న 51.
(a) ఏవైనా రెండు వారధి మూలకాల పేర్లు తెలపండి.
(b) కర్ణ సంబంధం చూపే ఏదైనా రెండు జంటలను తెలపండి.
(c) రెండు పరివర్తన మూలకాల పేర్లు తెలపండి.
(d) రెండు విరళ మృత్తిక మూలకాల పేర్లు తెలపండి.
(e) రెండు ట్రాన్స్లేయురానిక్ మూలకాల పేర్లు తెలపండి.
జవాబు:
a) రెండవ పీరియడ్ మూలకాలను వారధి మూలకాలు అంటారు. ఉదా : బెరీలియం, బోరాన్,
b) Li మరియు Mg కర్ణ సంబంధాన్ని కలిగి ఉంటాయి.
Be మరియు AZ కర్ణ సంబంధాన్ని కలిగి ఉంటాయి.
c) స్కాండియం, క్రోమియం, కోబాల్ట్ మొ||నవి పరివర్తన మూలకాలు.
d) లాంథనైడ్లను విరళ మృత్తికలు అంటారు. ఉదా : సీరియం, ప్రసోడైమియం
e) నెప్ట్యూనియం, కాలిఫోర్నియం, ఫెర్మియంలు ట్రాన్స్ యురోనిక్ మూలకాలకు ఉదాహరణలు.
స్వల్ప సమాధాన ప్రశ్నలు
ప్రశ్న 1.
ఆవర్తన పట్టికలోని 6వ పీరియడ్లో 32 మూలకాలు ఉన్నాయని, క్వాంటమ్ సంఖ్యల ఆధారంతో సమరించండి.
జవాబు:
6వ పీరియడ నందు 6s, 4f, 5, 6p ఉపకర్పరాలు కలవు
→ 6s నందు రెండు ఎలక్ట్రాన్లు [2 మూలకాలు]
→ 4f నందు 14 ఎలక్ట్రాన్లు [14 మూలకాలు]
→ 5d నందు 10 ఎలక్ట్రాన్లు [10 మూలకాలు]
→ 6p నందు 6 ఎలక్ట్రాన్లు [6 మూలకాలు]
కావున 6వ పీరియడ్ నందు మొత్తం మూలకాల సంఖ్య = 2 + 14 + 10 + 6 32.
ప్రశ్న 2.
పరమాణు భారం కంటె పరమాణు సంఖ్య మూలకాల ప్రాథమిక ధర్మమని, పరమాణు సంఖ్యలపై మోస్లే జరిపిన కృషి ఎలా తెలుపుతుంది?
జవాబు:
మోస్లే సమీకరణము
√υ = a (Z – b) υ = పౌనఃపున్యం ; Z = పరమాణు సంఖ్య a, b = స్థిరాంకాలు.
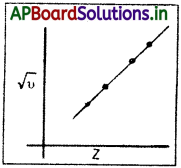
√υ, Z ల మధ్య గీసిన రేఖాపటం సరళరేఖగా ఉంటుంది. దీన్ని రేఖాపటంగా చూపవచ్చు. అయితే ఇదే రకమైన సంబంధాన్ని √υ, పరమాణు ద్రవ్యరాశుల మధ్య చూడలేము. పరమాణు సంఖ్య, మోస్లే ప్రకారం, ఆవర్తన పట్టికలో ఆ మూలకపు వరుస సంఖ్య. మూలకాల పరమాణు సంఖ్యలు పెరిగినట్లయితే వాటి స్వాభావిక X – వికిరణాల తరంగదైర్ఘ్యాలు తగ్గుతాయి. దీనివల్ల పరమాణు సంఖ్యతో పాటు క్రమ దశలో పెరిగే మౌళిక అంశం పరమాణువులో ఉందని మోస్లే ఒక నిర్ణయానికి వచ్చాడు. ఇదే ధనావేశిత కేంద్రకంపై ఉండే విద్యుదావేశం. X – కిరణ వర్ణపటాలను, పరమాణు సంఖ్యను సమన్వయపరచుకుంటే మూలకానికి విలక్షణమయిన ధర్మం పరమాణు సంఖ్య అనీ పరమాణు భారంకాదనీ తెలుస్తుంది. మూలక ధర్మాలు దాని పరమాణు సంఖ్యతో మారతాయి. అంటే మూలకం ధర్మాలు దాని ఎలక్ట్రాన్ల సంఖ్య మీద, ముఖ్యంగా కేంద్రకానికి వెలుపల వాటి అమరికపై ఆధారపడి ఉంటాయి. దీన్నిబట్టి మూలకాల వర్గీకరణలో పరమాణు ద్రవ్యరాశి అంత ప్రముఖమయింది కాదు అని తెలుస్తుంది.
ప్రశ్న 3.
ఆధునిక ఆవర్తన నియమాన్ని తెలపండి. విస్తృత ఆవర్తన పట్టికలో ఎన్ని గ్రూప్లు, పీరియడ్లు ఉన్నాయి?
జవాబు:
ఆధునిక ఆవర్తన నియమం ఎలక్ట్రాన్ విన్యాసంపై ఆధారపడి ఉంటుంది. “మూలకాల భౌతిక, రసాయన ధర్మాలు వాటి పరమాణు సంఖ్యల ఆవర్తన ప్రమేయాలు” – ఆధునిక ఆవర్తన నియమము.
విస్తృత ఆవర్తన పట్టికలో 18 గ్రూపులు, 7 పీరియడ్లు ఉంటాయి.
ప్రశ్న 4.
f- బ్లాక్ మూలకాలను అసలు పట్టిక కింద ఎందుకు ఉంచారు?
జవాబు:
అంతర పరివర్తన మూలకాలు (f-బ్లాకు మూలకాలు) ఆరు మరియు ఏడవ పీరియడ్కు III B గ్రూపు మూలకాలు అయినప్పటికీ లాంథనైడ్లు మరియు ఆక్టినైడ్లనే రెండు శ్రేణులుగా విభజించి ఆవర్తన పట్టిక అడుగు భాగాన రెండు వరుసలుగా స్థానాన్ని కల్పించారు. అవి 4f – శ్రేణి లాంథనైడ్లు [Ce (Z = 58) నుంచి Lu (Z : 71)] మరియు 5f – శ్రేణి ఆక్టినైడ్లు (Th (Z = 90) నుంచి Lr (Z = 108)].
ఈ మూలకాల్లో భేదాత్మక ఎలక్ట్రాన్, (n – 2)f ఉప శక్తిస్థాయిలోకి చేరుతుంది. ఈ మూలకాల భౌతిక, రసాయన ధర్మాలు చాలా సన్నిహితంగా ఉంటాయి. అందువలన వీటిని ఒక సమూహంగా రెండు శ్రేణులలో ఆవర్తన పట్టీ అడుగుభాగాన స్థానం కల్పించారు.
పరమాణు సంఖ్య ఆధారంగా వీటికి వర్గీకరణ పట్టిక ప్రధాన భాగంలో తీసుకుంటే మూలకాల సౌష్ఠవ అమరికను మరియు వర్గీకరణ ఆవశ్యకతను నాశనం చేస్తుంది. అందువల్ల ప్రధాన భాగం నుండి విడదీసి వర్గీకరణ పట్టిక క్రింది భాగాన అమర్చుట జరిగింది.
ప్రశ్న 5.
విస్తృత ఆవర్తన పట్టికలోని ప్రతి పీరియడ్లో ఉన్న మూలకాల సంఖ్యను తెలపండి.
జవాబు:

ప్రశ్న 6.
కింద వాటి సాధారణ బాహ్య కక్ష్య ఎలక్ట్రాన్ విన్యాసాలను తెలపండి.
(a) ఉత్కృష్ట వాయువులు
(b) ప్రాతినిధ్య మూలకాలు
(c) పరివర్తన మూలకాలు
(d) అంతర పరివర్తన మూలకాలు
జవాబు:
| వర్గీకరింపబడిన మూలకాలు | సాధారణ బాహ్య కక్ష్య ఎలక్ట్రాన్ విన్యాసము |
| a) ఉత్కృష్ట వాయువులు | ns² np6 |
| b) ప్రాతినిధ్య మూలకాలు | ns1-2 np0-5 |
| c) పరివర్తన మూలకాలు | (n – 1) d1-10 ns1-2 |
| d) అంతర పరివర్తన మూలకాలు | (n – 2) f1 – 14 (n – 1) do-1 ns² |
![]()
ప్రశ్న 7.
పరివర్తన మూలకాలు ఏవైనా నాలుగు అభిలాక్షణిక ధర్మాలను తెలపండి.
జవాబు:
పరివర్తన మూలకాల అభిలాక్షణిక ధర్మాలు :
- ఒకటి కంటే ఎక్కువ ఆక్సిడేషన్ స్థితులను ప్రదర్శిస్తాయి. (చర సంయోజకత)
- d – d – పరివర్తనాల వల్ల ఈ మూలకాలు మరియు వాటి అయాన్లు రంగులు కలిగినవిగా ఉంటాయి.
- ఒంటరి d – ఎలక్ట్రాన్లను కలిగి ఉండటం వల్ల ఈ మూలకాలు మరియు వాటి అయాన్లు పారాయస్కాంత స్వభావాన్ని చూపిస్తాయి.
- ఈ మూలకాలు ఒకదానితో మరొకటి కలిపి మిశ్రమ లోహాలనేర్పరుస్తాయి.
- ఈ మూలకాలు మరియు వాటి సమ్మేళనాలు వివిధ రసాయన ప్రక్రియల్లో మంచి ఉత్ప్రేరకాలుగా పనిచేస్తాయి.
ప్రశ్న 8.
విరళ మృత్తికా లోహాలు, ట్రాన్స్ యురానిక్ మూలకాలు అంటే ఏమిటి?
జవాబు:
ఎ) లాంథనైడ్ మూలకాలను విరళ మృత్తికలు అంటారు. ఈ మూలకాలలో భేదాత్మక ఎలక్ట్రాన్ 4f – ఆర్బిటాల్లోకి ప్రవేశిస్తుంది.
బి) యురేనియం తరువాత మూలకాలను యురేనియమ్ ఉత్తర మూలకాలు (లేదా) ట్రాన్స్ యురానిక్ మూలకాలు అంటారు. ఇవన్నీ రేడియోధార్మిక మరియు కృత్రిమ మూలకాలు.
ప్రశ్న 9.
సమ ఎలక్ట్రానిక్ శ్రేణులంటే ఏమిటి? కింద ఉన్న ప్రతి పరమాణువు, అయాన్లకు సంబంధించిన సమ ఎలక్ట్రానిక్ శ్రేణులను తెలపండి.
(a) F– (b) Ar (c) He (d) Rb+
జవాబు:
సమానమైన సంఖ్యలో ఎలక్ట్రాన్లను కలిగి ఉండే శ్రేణులను సమ ఎలక్ట్రాన్ శ్రేణులు అంటారు.
a) F– శ్రేణి – N-3, O-2, F–, Ne, Na+, Mg+2, Al+3
b) Ar శ్రేణి – P-3, S-2, Cl–, Ar, K+, Ca+2
c) He శ్రేణి – H–, He, Li+2, Be+2
d) Rb+ శ్రేణి – As-3, Se-2, Br–, Kr, Rb+, Sr+2
ప్రశ్న 10.
వ్యాసార్థంలో మాతృక పరమాణువుల కంటే ఎందుకు కాటయాన్ చిన్నగా ఉంటుందో, ఆనయాన్ పెద్దగా ఉంటుందో విశదీకరించండి.
జవాబు:
కాటయాన్ అనగా ధనావేశిత అయాన్. ఇది పరమాణువు (లేదా) మూలకం ఎలక్ట్రాన్ కోల్పోయినపుడు ఏర్పడును.
M → M+ + e–
కాటయాన్ నందు కేంద్రక ఆవేశం ఎక్కువగా ఉంటుంది కావున పరిమాణం తగ్గును, వ్యాసార్థం కూడా కాటయాన్లో తగ్గును.
ఆనయాన్ అనగా ఋణావేశిత అయాన్. ఇది పరమాణువు (లేదా) మూలకం ఎలక్ట్రాన్ గ్రహించినపుడు ఏర్పడును.
M+e– → M–
ఆనయాన్ నందు తక్కువ కేంద్రక ఆవేశం ఉంటుంది. కావున పరిమాణం పెరుగును, వ్యాసార్థం కూడా పెరుగును.
ప్రశ్న 11.
రెండో పీరియడ్ మూలకాలను, వాటి ప్రథమ అయొనైజేషన్ ఎంథాల్పీలు పెరిగే క్రమంలో అమర్చండి. B కంటే Be కు అధిక IE1 ఎందుకు ఉందో తెలపండి.
జవాబు:
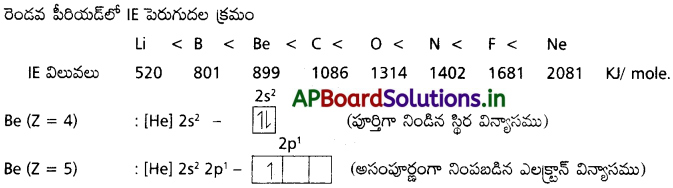
పూర్తిగా నిండిన మరియు వేలన్సీ ఎలక్ట్రాన్లు జతకూడి ఉండటం వల్ల ‘Be’ అయనీకరణ శక్తి ఎక్కువ.
అసంపూర్ణంగా నింపబడిన మరియు ఒంటరి (2p¹) వేలన్సీ ఎలక్ట్రాన్ ఉండటం వల్ల ‘B’ అయనీకరణ శక్తి తక్కువ.
ప్రశ్న 12.
Mg కంటే Na IE1 తక్కువ, కానీ Mg కంటే Na IE2 ఎక్కువ – విశదీకరించండి.
జవాబు:
→ Na యొక్క IE1 Mg కన్నా తక్కువ
వివరణ :
→ Na – ఎలక్ట్రాన్ విన్యాసం [Ne] 3s¹
→ Mg – ఎలక్ట్రాన్ విన్యాసం [Ne] 3s²
Mg పూర్తిగా నిండిన విన్యాసం కలిగి ఉండును. ఇది ఎక్కువ స్థిరమైనది.
→ Na యొక్క IE2 Mg కన్నా ఎక్కువ.
→ Na+ లో స్థిరమైన జడవాయు విన్యాసం కలదు. కావున Na యొక్క IE2 ఎక్కువగా ఉండును.
→ Mg+ అనగా Na ఎలక్ట్రాన్ విన్యాసం కావున Mg+ నుండి ఎలక్ట్రాన్ త్వరితగతిన కోల్పోయి Mg+2 (స్థిరమైనది) ఏర్పడును.
![]()
ప్రశ్న 13.
ప్రాతినిధ్య గ్రూప్ మూలకాల IE గ్రూప్ లో కిందకు తగ్గడానికి గల కారణాలు ఏమిటి?
జవాబు:
IE పై ప్రభావితం చేయు అంశాలు
i) పరమాణు వ్యాసార్థం
ii) కేంద్రక ఆవేశం
iii) పరిరక్షక ప్రభావం
iv) సగం నిండిన (లేదా) పూర్తి స్థాయిలో నిండిన ఎలక్ట్రాన్ విన్యాసాలు
v) చొచ్చుకుపోయే స్వభావం.
ప్రాతినిధ్య గ్రూపు మూలకాలలో IE విలువలు పై నుండి కిందకు గ్రూపులో తగ్గును. దీనికి కారణం గ్రూపులలో పై నుండి కిందకు పరమాణు వ్యాసార్థం (పరమాణు పరిమాణం) పెరుగును.
ప్రశ్న 14.
13వ గ్రూప్ మూలకాల ప్రథమ అయొనైజేషన్ ఎంథాల్పి విలువలు (kJ mol-1) లలో

సాధారణ క్రమం నుంచి ఈ విచలనాన్ని ఏ విధంగా విశదీకరిస్తారు?
జవాబు:
13 వ గ్రూపులో IE, విలువలు (KJ / mole)

సాధారణంగా గ్రూపులలో కిందికి పోయే కొలది IE విలువలు తగ్గును కాని పై విలువలలో సరైన తగ్గుదల గమనింపబడలేదు.
వివరణ :
- B నుండి Al కు పరిమాణం పెరుగును కావున IE విలువ తగ్గినది.
- Al, Ga, In మరియు Tl లలో సరైన క్రమంలో తగ్గుదల గమనింపబడలేదు. దీనికి కారణం d, f – ఎలక్ట్రాన్లపై అల్ప పరిరక్షక ప్రభావం ఉండటమే.
ప్రశ్న 15.
ఆక్సిజన్ రెండవ ఎలక్ట్రాన్ గ్రాహ్య ఎంథాల్పీ, మొదటి ఎలక్ట్రాన్ గ్రాహ్య ఎంథాల్పీ కంటె ధనాత్మకమా? ఎక్కువ రుణాత్మకమా? లేదా తక్కువ రుణాత్మకమా? సమర్థించండి.
జవాబు:
రెండవ ఎలక్ట్రాన్ గ్రాహ్య ఎంథాల్పీ అనగా ఏకమాత్ర ఋణావేశిత అయాన్కు ఎలక్ట్రాన్ కలిపినపుడు విడుదలయ్యే శక్తి.
O(ar) + e– → O–(ar) + 141 KJ/mole
O–(ar) + e– → O-2r(ar) – 780 KJ/mole
ఆక్సిజన్ యొక్క రెండవ ఎలక్ట్రాన్ గ్రాహ్య ఎంథాల్పీ ధనాత్మకమైనది ఎందువలన అనగా O– అయాన్ ఎలక్ట్రాన్ను త్వరగా స్వీకరించలేదు. వికర్షణ బలాలు అధికంగా ఉంటాయి.
ప్రశ్న 16.
ఎలక్ట్రాన్ గ్రాహ్య ఎంథాల్పీ, ధన విద్యుదాత్మకతల మధ్య ప్రాథమికమైన తేడా ఏమిటి?
జవాబు:
- ఎలక్ట్రాన్ గ్రాహ్య ఎంథాల్పీ అనగా వాయుస్థితిలో ఉన్న ఒంటరి తటస్థ పరమాణువుకు ఒక ఎలక్ట్రాన్ కలుపుట వలన విడుదలయ్యే శక్తి.
- ఒక మూలకం ఎలక్ట్రాన్లను కోల్పోయే సామర్ధ్యాన్ని ధన విద్యుదాత్మకత అంటారు.
- ఎలక్ట్రాన్ గ్రాహ్య ఎంథాల్పీ ఋణవిద్యుదాత్మకతకు కొలమానం.
- ఎలక్ట్రాన్ గ్రాహ్య ఎంథాల్పీ మరియు ఋణవిద్యుదాత్మక విలువోమానుపాతంలో ఉండును.
ప్రశ్న 17.
ఒకే మూలకపు రెండు ఐసోటోప్ల IE1 లు ఒకేలా ఉంటాయో లేదో ఊహించగలరా? సమర్థించండి.
జవాబు:
- ఐసోటోప్లు అనగా ఒకే మూలకం ద్రవ్యరాశి సంఖ్య వేరుగా కలిగి ఉండేవి.
- అధిక ద్రవ్యరాశి సంఖ్య కలిగిన ఐసోటోప్ తక్కువ IE విలువ కలిగి ఉండును.
- దీనికి కారణం తక్కువ కేంద్రక ఆకర్షణ కలిగి ఉండటమే.
- కానీ ఐసోటోప్ల IE విలువలు దాదాపుగా సమానంగా ఉంటాయి.
![]()
ప్రశ్న 18.
గ్రూప్ 1 మూలకాల చర్యాశీలత పెరిగే క్రమం Li < Na < K < Rb < Cs, అయితే గ్రూప్ 17 మూలకాలకు ఈ క్రమం F > Cl > Br > I – విశదీకరించండి.
జవాబు:
a) గ్రూప్ – 1 మూలకాల చర్యాశీలత పెరిగే క్రమం Li < Na < K < Rb < Cs
వివరణ :
- గ్రూప్ – 1 మూలకాలు క్షారలోహాలు. ఇది ఎలక్ట్రాన్ను త్వరగా కోల్పోతాయి. అధిక ధన విద్యుదాత్మకత కలిగి ఉంటాయి.
- ఇవి అయానిక బంధాలను ఏర్పరుస్తాయి. మంచి క్షయ కారిణులు.
- ఈ గ్రూపులో ధన విద్యుదాత్మకత పై నుండి కిందకు పెరుగును కావున పై చర్యాశీలత క్రమం.
b) గ్రూపు – 17 మూలకాలలో చర్యాశీలత క్రమం F > Cl > Br > I
వివరణ :
- ఇవి హాలోజన్లు. వీటికి అధిక ఋణ విద్యుదాత్మకత ఉంటుంది. వీటికి పరమాణు పరిమాణం తక్కువగా ఉంటుంది.
- గ్రూపులో పైనుండి కిందకు ఋణవిద్యుదాత్మకత తగ్గును.
ప్రశ్న 19.
కింద ఇచ్చిన బాహ్య ఎలక్ట్రాన్ విన్యాసం గల మూలకం స్థానాన్ని తెలపండి.
(a) ns²np4 (n = 3)
(b) (n – 1)d² ns² (n = 4)
జవాబు:
a) ns²np4 (n = 3)
3s²3p4 – మూలకం సల్ఫర్
సల్ఫర్ VIA గ్రూపు, 3వ పీరియడ్కు చెందినది.
b) (n – 1)d² ns² (n = 4)
3d² 4s² – మూలకం టైటానియం
టైటానియం IVB గ్రూపు, 4వ పీరియడ్కు చెందినది.
ప్రశ్న 20.
కింద ఉన్న జంట మూలకాల కలయికతో ఏర్పడగల స్థిర యుగ్మ సమ్మేళనాల ఫార్ములాలను నిర్దేశించండి.
(a) Li, O
(d) Si, O
(b) Mg, N
(e) P, Cl
(c) Al, I
(f) పరమాణు సంఖ్య 30 గల మూలకం, Cl
జవాబు:
a) ‘Li’ మరియు ‘O’ తో ఏర్పడు స్థిరమైన యుగ్మ సమ్మేళనం Li2O
b) ‘Mg’ మరియు ‘N’ తో ఏర్పడు స్థిరమైన యుగ్మ సమ్మేళను Mg3N2
c) ‘A’ మరియు ‘I’ తో ఏర్పడు స్థిరమైన యుగ్మ సమ్మేళనం AlI3
d) ‘Si’ మరియు ‘O’ తో ఏర్పడు స్థిరమైన యుగ్మ సమ్మేళనం SiO2
‘P’ మరియు ‘C’ తో ఏర్పడు స్థిరమైన యుగ్మ సమ్మేళనం PCl3, మరియు PCl5
f) పరమాణు సంఖ్య (Zn) 30 మరియు ‘Cl’ లతో ఏర్పడు స్థిరమైన యుగ్మ సమ్మేళనం ZnCl2
ప్రశ్న 21.
గ్రూప్లో, పీరియడ్లో లోహ స్వభావంలో మార్పుపై వివరణ ఇవ్వండి.
జవాబు:
లోహాలు ఎలక్ట్రాన్లను కోల్పోవడం ద్వారా ధనవిద్యుదాత్మకతను చూపుతాయి. అలోహాలు ఎలక్ట్రాన్లను స్వీకరించడం ద్వారా ఋణవిద్యుదాత్మకతను చూపుతాయి.
ఆవర్తన క్రమము :
a) గ్రూపులో :
గ్రూపులో పై నుండి క్రిందికి మూలకాల పరమాణు పరిమాణం క్రమేపీ పెరుగుట వలన ఎలక్ట్రాను కోల్పోయే స్వభావం పెరిగి తద్వారా అదే క్రమంలో లోహ స్వభావం పెరుగుతుంది.
b) పీరియడ్లో :
పీరియడ్లో ఎడమ నుండి కుడికి మూలకాల పరమాణు పరిమాణం క్రమేపీ తగ్గడం వలన ఎలక్ట్రాను కోల్పోయే స్వభావం తగ్గి తద్వారా, అదే క్రమంలో మూలకాల లోహ స్వభావం తగ్గుతుంది.
ప్రశ్న 22.
గ్రూప్ – 7లో కోవలెంట్ వ్యాసార్థం ఏ విధంగా పెరుగుతుంది?
జవాబు:
సంయోజనీయ వ్యాసార్థం (కోవలెంట్ వ్యాసార్థం) గ్రూప్లో పై నుండి కిందకు పెరుగును.

ప్రశ్న 23.
3వ పీరియడ్లో ఏ మూలకానికి అత్యధిక IE1 ఉన్నది? ఈ పీరియడ్లో IE1 లో మార్పును విశదీకరించండి.
జవాబు:
III వ పీరియడ్ మూలకాల్లో అత్యధిక IE ఉన్న మూలకము “ఆర్గాన్ (Ar)”.
కారణం :
ప్రతి పీరియడ్లోను చిట్టచివరి మూలకమైన జడవాయు మూలకానికి ఆ పీరియడ్లో అత్యధిక I.E విలువ ఉంటుంది. దీనికి కారణము ఆ మూలకాలలో పూర్తిగా నిండిన ఆర్బిటాళ్ళు ఉండటమే. అష్టక విన్యాసము (ns’ np) ఉంటుంది.
III వ పీరియడ్ – IE మార్పు :
III వ పీరియడ్ మూలకాలు (Na, Mg, Al, Si, P, S, CI మరియు Ar) లో ఎడమ నుంచి కుడికి పరమాణు పరిమాణంలో క్రమేపి తగ్గుదల ఉండటం వలన అదే క్రమంలో IE విలువలు పెరుగుతాయి. ‘A’ మరియు ‘S’ లకు ఊహించిన దానికంటే తక్కువ IE ఉండటానికి కారణము వాటికి ఎలక్ట్రాన్ను కోల్పోయే స్వభావం అధికంగా ఉండటమే. Ar కు అత్యధిక IE విలువ ఉంటుంది.
![]()
ప్రశ్న 24.
మూలకం సంయోజకత (valency) అంటే ఏమిటి? మూడో పీరియడ్లో హైడ్రోజన్ పరంగా ఇది ఎట్లా మారుతుంది?
జవాబు:
సంయోజకత :
“ఒక మూలకము యొక్క సంయోగ సామర్థ్యమును ‘సంయోజకత’ అంటారు.” (లేదా)
‘ఏదైనా మూలక పరమాణువుతో సంయోగం చెందే హైడ్రోజన్ పరమాణువుల సంఖ్యను (లేదా) క్లోరిన్ పరమాణువుల సంఖ్యను (లేదా) ఆక్సిజన్ పరమాణువుల సంఖ్యకు రెట్టింపు సంఖ్యను ఆ మూలకపు సంయోజకత అంటారు.
సంయోజకత = హైడ్రోజన్ పరమాణువుల సంఖ్య
= క్లోరిన్ పరమాణువుల సంఖ్య
= 2 X ఆక్సిజన్ పరమాణువుల సంఖ్య
ఆవర్తన క్రమము :
i) పీరియడ్లో : పీరియడ్లో సంయోజకత పెరుగును. ‘H’ పరంగా 1 నుంచి 4 వరకు పెరిగి తర్వాత ‘1’కి తగ్గును.
ii) గ్రూపులో :
గ్రూపులో సంయోజకత గ్రూపు సంఖ్యకు సమానమవుతుంది. (IV వ గ్రూపు వరకు) (లేదా) (8 – గ్రూపు సంఖ్యకు) సమానమవుతుంది. (V గ్రూపు తరువాత).
ప్రాముఖ్యత :
సమ్మేళనాల, ‘ఫార్ములాలు’ రాయడానికి మూలకాల సంయోజకత ఉపయోగపడుతుంది.
ప్రశ్న 25.
కర్ణసంబంధం అంటే ఏమిటి? కర్ణ సంబంధం గల ఒక మూలకాల జంటను తెలపండి. అవి ఈ సంబంధాన్ని ఎందుకు చూపిస్తాయి?
జవాబు:
కర్ణ సంబంధం :
“ఆవర్తన పట్టికలో రెండవ పీరియడ్లోని ఒక మూలకానికి మూడవ పీరియడ్లోని తరువాత గ్రూపు రెండో మూలకానికి సారూప్య ధర్మాలుంటాయి. ఈ సంబంధాన్ని కర్ణ సంబంధం అంటారు.”
ఉదా : (Li, Mg); (Be, Al); (B, Si)
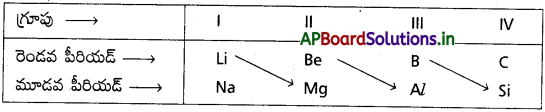
రెండవ మరియు మూడవ పీరియడ్లకు చెందిన I, II, III, IV గ్రూపు మూలకాలు కర్ణ సంబంధాన్ని చూపిస్తాయి. ధృవణ సామర్థ్యం ఒకటి గల మూలకాలు కర్ణ సంబంధాన్ని చూపుతాయి.
కర్ణ సంబంధం ఉన్న ఆయా మూలక పరమాణువుల (లేదా అయాన్ల) పరిమాణాలు సమానంగా ఉండటం లేదా వాటి ఋణవిద్యుదాత్మకత విలువలు సమానంగా ఉంటాయి. కర్ణ సంబంధం గల సారూప్య మూలకాలకు ఒకేలాంటి ధృవణ సామర్థ్యం (అయానిక ఆవేశం) ఉంటుంది.
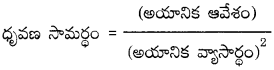
ఉదా : Be మరియు Al ల ధృవణ సామర్థ్యం విలువలు వరుసగా 6.40 మరియు 6.00 కావున ఈ రెండు మూలకాల మధ్య కర్ణ సంబంధం ఉంటుంది.
ప్రశ్న 26.
లాంథనైడ్ సంకోచం అంటే ఏమిటి ? వాటి ఫలితాలు ఏమిటి?
జవాబు:
లాంథనైడ్ సంకోచం – నిర్వచనం :
“f – ఆర్బిటాళ్ళ బలహీన పరిరక్షక ప్రభావం వల్ల లాంథనైడ్లు 14 మూలకాలలో (మరియు వాటి అయాన్లలో) ఎడమ నుండి కుడికి పరమాణు (అయానిక) పరిమాణం క్రమంగా తగ్గుతుంది. దీనినే లాంథనైడ్ సంకోచరం అంటారు.”
లాంథనైడ్ సంకోచం – ఫలితాలు :
- Ce నుంచి Lu వరకు లాంథనైడ్ సంకోచం ప్రభావం వల్ల మూలకాల గట్టిదనం, ద్రవీభవన స్థానాలు, బాష్పీభవన స్థానాలు మొదలైనవి పెరుగుతాయి.
- లాంథనైడ్ శ్రేణి సంకోచం ప్రభావం వల్ల మూడవ పరివర్తన శ్రేణిలో ఉన్న మూలకాల సైజులు వాటికి ఉంటాయనుకున్న వాటి కంటే తక్కువగా ఉంటాయి.
- ఈ సంకోచం వల్ల Sc → Y → La లలో సాధారణంగా ఉండే సైజులో పెరుగుదల లాంథనైడ్ల తరువాత ఉండదు. అపుడు (Zr, Hf), (Nb, Ta), (Mo, W) మూలకాల జంటల సైజులు దాదాపు ఒకటే ఉంటాయి.
- లాంథనైడ్ సంకోచం వల్ల 4d, 5d పరివర్తన మూలకాలలో పరమాణు పరిమాణం దాదాపు సమానంగా ఉంటాయి. అందువల్ల 4d, 5d శ్రేణి మూలకాల ధర్మాలు సమానంగా ఉంటాయి.
- ఈ సంకోచం వల్ల స్ఫటిక నిర్మాణం, మూలకాల ఇతర ధర్మాలు అత్యంత సన్నిహిత సారూప్యత కలిగి ఉంటాయి. దీని ఫలితంగా వాటి మిశ్రమం నుంచి వాటిని వేరుచేయడం కష్టమైన పని.
ప్రశ్న 27.
లిథియం ప్రథమ IE 5.41 eV, CI ఎలక్ట్రాన్ అఫినిటి – 3.61eV Li(g) + Cl(g) → Li(g)+ + Cl–(g) : ఈ చర్య ∆H ను kJ mol-1 లో లెక్కించండి.
జవాబు:
ఇవ్వబడిన చర్య
Li(g) + Cl(g) → Li+(g) + Cl–(g)
Li+(g) ఏర్పడుట
Li(g) → Li+(g) + e– ∆H1 = 5.41ev
Cl–(g) ఏర్పడుట
Cl(g) + e– → Cl–(g) ∆H2 = – 3.61ev
మొత్తం చర్య
Li(g) + Cl(g) → Li+(g) + Cl–(g)
∆H = ∆H1 + ∆H2 = 5.41 – 3.61 = 1.8 ev
= 173.7 KJ/mole
![]()
ప్రశ్న 28.
Cl + e → Cl– ప్రక్రియలో ఒక అవగాడ్రో సంఖ్యలోని పరమాణువులకు విడుదలయ్యే శక్తితో Cl → Cl+ + e ప్రక్రియలో ఎన్ని Cl పరమాణువులను అయనీకరణం చెందించవచ్చు. IE = 13.0 ev, EA=3.60 eV. అవగాడ్రో సంఖ్య = 6 × 1023
జవాబు:
Cl(g) + e– → Cl–(g) ∆H = -3.6ev
1 – పరమాణువు → ఎలక్ట్రాన్ ఎఫినిటీ 3.6ev
6.023 × 1023 పరమాణువులు – 6.023 × 1023 × 3.6 = 21.6828 × 1023 ev
13 ev లు ఒక Cl పరమాణువును అయనీకరణం చేయును.
21.6828 × 1023 ev —–?
![]()
ప్రశ్న 29.
Cl– ఎలక్ట్రాన్ అఫినిటీ 3.7 eV. వాయుస్థితిలో 29. క్లోరిన్ పరమాణువులు పూర్తిగా Cl– అయాన్లుగా మారినప్పుడు kCal లలో ఎంత శక్తి విడుదల అగును? (1 e V = 23.06 kCal/mol-1)
జవాబు:
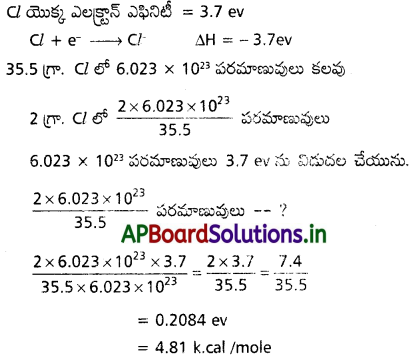
దీర్ఘ సమాధాన ప్రశ్నలు
ప్రశ్న 1.
మెండలీవ్ మూలకాల వర్గీకరణ గురించి రాయండి.
జవాబు:
మెండలీవ్ ఆవర్తన నియమము :
“మూలకాలు, వాటి సమ్మేళనాల ధర్మాలు వాటి పరమాణు భారాల ఆవర్తన ప్రమేయాలు”.
మెండలీవ్ మూలకాల వర్గీకరణ :
ఇంతకు ముందు భాగాల్లో ఆవర్తన నియమాన్ని నిర్వచించాం. ఈ నియమాన్ని ప్రతిపాదించేటప్పుడు చాలా అంశాలను మెండలీవ్ కనుగొన్నాడు. అందులో కొన్నింటిని కింది భాగాల్లో తెలపటం జరిగింది. ఒకే రకమైన ధర్మాలున్న మూలకాలకు
a) దాదాపు సమాన పరమాణు భారాలు ఉంటాయి.
ఉదా : Fe (56), Co (59), Ni (59); Os (191), Ir (193), Pt (195) లేదా
b) పరమాణు భారాల విలువల్లో స్థిరమైన పెరుగుదల ఉంటుంది.
ఉదా : K(39), Rb(85), Cs(133); Ca(40), Sr(88), Ba(137)
(పరమాణు భారాలను సమీప పూర్ణాంకాలుగా సవరించడమైనది.)
మూలకాలను గ్రూపులుగా అమర్చడంవల్ల రసాయన ధర్మాల్లోనూ, వేలన్సీలోనూ ఏదైనా శ్రేణిలో వచ్చే మార్పులు తెలుస్తాయి.
ఉదా : 1. ఒక శ్రేణిలో లోహ స్వభావం క్రమంగా తగ్గుతుంది.
(ఉదా : Li నుంచి F వరకు; Cu మంచి Br వరకు)
ఉదా : 2. హైడ్రోజన్ సంయోజకత 1 నుంచి 4 వరకు పెరిగి తరువాత మళ్ళీ 1 వరకు తగ్గుతుంది.
అల్ప పరమాణు భారాలు గల మూలకాలన్నీ ప్రకృతిలో విరివిగా దొరుకుతాయి. వాటి స్వభావాలు స్పష్టంగా తెలుస్తాయి. వీటిని విలక్షణ మూలకాలంటారు. అలాంటి మూలకాలన్నీ ఆవర్తన పట్టిక పొట్టి పీరియడ్లలో ఉంటాయి.
ఈ శ్రేణులలో హైడ్రోజన్కు ఏ ఇతర మూలకానికీ లేని ప్రత్యేక స్థానాన్ని ఇచ్చారు.
మెండలీవ్ పట్టిక VIII వ గ్రూపులో మూడు ట్రయడ్లు ఉంటాయి. అవి : (Fe, Co, Ni); (Ru, Rh, Pb); (Os, Ir, Pt)లు; ఈ ట్రయడ్లను పరివర్తన మూలకాలంటారు. ఈ పరివర్తన మూలకాలలోనే Sc (21) నుంచి Zn (30) వరకు; లాంథనైడ్లు, ఆక్టినైడ్లు కూడా కలిపి ఉంటాయి.
ఆసన్న మూలకాలు, వాటి సమ్మేళనాలను అధ్యయనం చేసి, మెండలీవ్ కొన్ని మూలకాల ధర్మాలను, చెప్పగలిగాడు. ఈ ఊహాగానాలే తరువాత చాలా కచ్చితంగా ఉన్నాయని తెలిసింది.
ఉదా : ఎకా అల్యూమినియం (Eka Al) (ఇప్పుడు దీన్ని గాలియమ్ అంటారు). ఎకా సిలికాన్ (Eka Si) (ఇప్పుడు దీన్ని జెర్మేనియమ్ అంటారు). ఎకా బోరాన్ (Eka B) (ఇప్పుడు దీన్ని స్కాండియమ్ అంటారు).
ఆధునిక మెండలీవ్ ఆవర్తన పట్టికలో పరమాణు భారాల వరుసలు నాల్గు జతల మూలకాల్లో అపక్రమంలో ఉన్నాయి. అవి అయొడిన్, ఆర్గాన్, పొటాషియం, కోబాల్టు, నికెల్ మరియు థోరియం – ప్రొటాక్టేనియంలు. ఈ జంటలలో మొదటిదాని కన్నా రెండవ మూలకం పరమాణు భారం అధికము. వీటిని “అసంగత జంట” అంటారు. కాని రసాయన ధర్మాలు మరియు పరమాణు సంఖ్యలను బట్టి చూస్తే, ఈ అమరిక సరియైనదేనని తెలుస్తుంది.
మెండలీవ్ ఆవర్తన పట్టిక అవధులు :
- కొన్ని మూలకాల స్థానాలు వాటి రసాయన ధర్మాలకు అనుగుణంగా లేవు. ఉదా : నాణె లోహాలైన Cu, Ag, Au లను క్షార లోహాలైన K, Rb, Cs తో కలిపి I- గ్రూపులో ఉంచారు. నాణె లోహాలకు, క్షార లోహాలకు ధర్మాలలో చాలా భేదమున్నది.
- విరళమృత్తిక (లాంథనైడు)లను ఈ పట్టికలో ఒకే స్థానంలో ఉంచినారు.
- హైడ్రోజన్ స్థానం సంతృప్తికరంగా లేదు. ఇది అటు క్షార లోహాలను (IA) ఇటు హాలోజన్ అలోహాలను (VIA) పోలిన ధర్మాలు చూపుతుంది.
ప్రశ్న 2.
తెలియని మూలకం ధర్మాలను, దాని పక్కనున్న మూలకాల ధర్మాల అధ్యయనం వల్ల, నిర్దేశించవచ్చు – ఒక ఉదాహరణతో సమర్థించండి.
జవాబు:
ఆసన్న మూలకాలు, వాటి సమ్మేళనాలను అధ్యయనం చేసి, మెండలీవ్ కొన్ని మూలకాల ధర్మాలను, చెప్పగలిగాడు. ఈ ఊహాగానాలే తరువాత చాలా కచ్చితంగా ఉన్నాయని తెలిసింది.
ఉదా : ఎకా అల్యూమినియం (Eka Al) (ఇప్పుడు దీన్ని గాలియమ్ అంటారు). ఎకా సిలికాన్ (Eka Si) (ఇప్పుడు దీన్ని జెర్మేనియమ్ అంటారు). ఎకా బోరాన్ (Eka B) (ఇప్పుడు దీన్ని స్కాండియమ్ అంటారు).
మెండలీఫ్ ఊహించిన మూలకాల లక్షణాలనూ, ప్రాయోగికంగా మూలకాల ఆవిష్కరణ తరువాత తెలుసుకున్న ధర్మాలనూ పోల్చడం చూస్తారు.
మెండలీవ్ ఊహించిన ధర్మాలు, ప్రాయోగిక ధర్మాలను పోల్చడం :
| ధర్మం | మెండలీవ్ ఊహించిన ధర్మాలు | ప్రాయోగికంగా కనుగొన్న ధర్మాలు |
| 1. మూలకం పేరు | ఎకా అల్యూమినియమ్ [EKa Al] | గాలియమ్ (Ga) |
| 2. పరమాణు భారం | 68 | 70 |
| 3. సాంద్రత (గ్రా. సెం.మీ-3) | 5.90 | 5.94 |
| 4. ద్రవీభవన స్థానం (Å లలో) | తక్కువగా ఉండాలి | 302.93 |
| 5. ఆక్సైడ్ ఫార్ములా | (EKa Al)2 O3 | Ga2O3 |
| 6. క్లోరైడ్ ఫార్ములా | (Eka Al) Cl3 | GaCl3 |
![]()
ప్రశ్న 3.
విస్తృత ఆవర్తన పట్టిక నిర్మాణాన్ని తెలపండి.
జవాబు:
ఆవర్తన పట్టిక – నిర్మాణము :
ఈ పట్టికలోని అడ్డు వరుసలను పీరియడ్లు అని, నిలువు గడులను గ్రూపులని అంటారు. దీనిలో 7 పీరియడ్లు 18 గ్రూపులు ఉన్నాయి.
మొదటి పీరియడ్లో రెండు మూలకాలు మాత్రమే ఉన్నాయి. అవి H, He దీనిని అతి పొట్టి పీరియడ్ అంటారు. రెండవ, మూడవ పీరియడ్లలో ఒక్కొక్క దానిలో 8 మూలకాలు ఉన్నాయి. వీటిని పొట్టి పీరియడ్లు అంటారు. రెండవ పీరియడ్ లిథియంతో ప్రారంభమై నియాన్తో అంతం అవుతుంది. మూడవ పీరియడ్ సోడియంతో ప్రారంభమై ఆర్గాన్తో అంతం అవుతుంది.
నాలుగు, ఐదు పీరియడ్లలో ఒక్కొక్క దానిలో 18 మూలకాలు ఉన్నాయి. వీటిని పొడుగు పీరియడ్లు అంటారు. నాల్గవ పీరియడ్ పొటాషియంతో ప్రారంభమై క్రిప్టాన్తో అంతం అవుతుంది. అయిదవ పీరియడ్ రుబీడియంతో ప్రారంభమై గ్జినాన్తో అంతం అవుతుంది.
ఆరవ పీరియడ్లో 32 మూలకాలు ఉన్నాయి. దీనిని అతి పొడవైన పీరియడ్ అంటారు. ఈ పీరియడ్ సీసియంతో ప్రారంభమై రేడాన్ అంతం అవుతుంది.
ఏడవ పీరియడ్ను అసంపూర్ణ పీరియడ్ అంటారు. దీనిలో 20 మూలకాలు మాత్రమే ఉన్నాయి. వీటిలో చాలా భాగం కృత్రిమ మూలకాలు.
ఆధునిక ఆవర్తన పట్టికలో 18 గ్రూపులు ఉన్నాయి. వాటికి ఈ క్రింది విధంగా సంకేతాలు ఇవ్వబడినాయి.
IA, IIA, IIIB, IVB, VB, VIB, VIIB, VIII, IB, IIB, IIIA, IVA, VA, VIA, VIIA, O (లేక) 1 నుండి 18
ఈ పట్టికలోని కుడివైపు చివరన ఉన్న ‘0’ గ్రూపు మూలకాలను జడవాయువులు అంటారు.
ప్రతి పీరియడ్లోను మొదటి మూలకంలో భేదపరిచే ఎలక్ట్రాను ‘s’ ఆర్బిటాల్లోకి ప్రవేశిస్తుంది. ఆఖరి మూలకంలో ‘p’ ఆర్బిటాల్ పూర్తిగా నింపబడి s² p6 విన్యాసం (అష్టక విన్యాసం) కలిగి ఉంటుంది.
ఆఫ్ బౌ సూత్రం ప్రకారం ఎలక్ట్రాన్లు ఏ వరుస క్రమంలో వివిధ ఉపస్థాయిలలోకి ప్రవేశిస్తాయో అదే వరుసలో మూలకాలు ఆధునిక ఆవర్తన పట్టికలో అమర్చబడ్డాయి.
మొదటి శక్తి స్థాయిలో (1s) లో రెండు ఎలక్ట్రాన్లు మాత్రమే ఉండగలవు. అందువలననే మొదటి పీరియడ్లో రెండు మూలకాలు ఉన్నాయి. వాటి విన్యాసాలు వరుసగా 1s¹ మరియు 1s².
రెండవ పీరియడ్లోని మూలకాల ఎలక్ట్రాన్ విన్యాసం 2s¹ నుండి 2s²2p6 వరకు క్రమంగా మారుతుంది. వీటిలో 2s, 2p ఉపస్థాయిలు నిండుతాయి. వీటిలో ఉండదగిన గరిష్ఠ ఎలక్ట్రాన్ల సంఖ్య 8 అందువలన 2వ పీరియడ్లో 8 మూలకాలు ఉన్నాయి.
మూడవ పీరియడ్లోని మూలకాలలో ఎలక్ట్రాన్లు 3s, 3p స్థాయిలలో క్రమంగా ప్రవేశిస్తాయి. ఈ రెండు స్థాయిల ఎలక్ట్రాన్ల సామర్థ్యం కూడా 8. అందువలన ఈ పీరియడ్లో కూడా 8 మూలకాలు ఉన్నాయి.
నాల్గవ పీరియడ్లో మొదటి రెండింటిలో 45 స్థాయిలోనూ, తరువాత 10 మూలకాలలో 3d స్థాయిలోనూ, ఆ తరువాత 6 మూలకాలలో 4p స్థాయిలోనూ ఎలక్ట్రాన్లు ప్రవేశిస్తాయి. ఈ 4s, 3d, 4p స్థాయిల మొత్తం సామర్థ్యం (2 + 10 + 6) = 18 ఎలక్ట్రాన్లు. అందువలననే ఈ పీరియడ్లో 18 మూలకాలు ఉంటాయి.
అయిదవ పీరియడ్లో కూడా 18 మూలకాలు ఉంటాయి. వీటిలోని మూలకాలలో ఎలక్ట్రాన్లు 5s, 4d, 5p స్థాయిలలో ప్రవేశిస్తాయి. ఆరవ పీరియడ్లో 32 మూలకాలు ఉంటాయి. ఈ మూలకాలలో వరుసగా 6s, 4f, 5d, 6p స్థాయిలలో ఎలక్ట్రాన్లు ప్రవేశిస్తాయి. వీటిలో ఉండగల గరిష్ఠ ఎలక్ట్రాన్ల సంఖ్య 2 + 14 + 10 + 6 = 32. అందువలన ఈ పీరియడ్లో 32 మూలకాలు ఉంటాయి. ఏడవ పీరియడ్లో 20 మూలకాలు మాత్రమే ఉన్నాయి. వీటిలో ప్రస్తుతం నిండిన ఉపస్థాయిలు 7s, 5f (పూర్తిగా) 6d (అసంపూర్తిగా) 5f స్థాయి ఆక్టీనియం తర్వాత నిండుతుంది. ఆక్టినైడ్ మూలకాలు ఈ పీరియడ్కు చెందినవే.
ప్రశ్న 4.
కక్ష్యలోని ఉపశక్తి స్థాయిలలో పూర్తిగా నిండిన ఎలక్ట్రాన్ల సంఖ్యకూ, పీరియడ్లో ఉండే మూలకాల అత్యధిక సంఖ్యకూ గల సంబంధాన్ని విశదీకరించండి.
జవాబు:
ఈ కింది పద్ధతిలో మూలకాలకు పీరియడ్లలో స్థానం కల్పించారు.
మొదటి పీరియడ్ :
ఒకటి లేదా రెండు ఎలక్ట్రాన్లు మాత్రమే ఉండే K – కర్పరం ఈ పీరియడ్ ఏర్పాటులో విస్తరిస్తుంది. ఈ పీరియడ్లో రెండు మూలకాలుంటాయి. అవి హైడ్రోజన్ (151) మరియు హీలియం (153).
రెండవ పీరియడ్ :
లిథియమ్ పరమాణువులో K కక్ష్య రెండు ఎలక్ట్రాన్లతో సంపూర్తి అవుతుంది. ఇంకొక కొత్త కక్ష్య, L కక్ష్య, ఒక ఎలక్ట్రాన్తో మొదలవుతుంది. ఈ పీరియడ్లో ఇతర మూలకాలలో (అంటే Be నుంచి F తరువాత Ne వరకు) Lకక్ష్యలోకి క్రమేపి ఎలక్ట్రాన్లు నిండుతాయి. ఈ నింపడం. Ne వరకు జరుగుతుంది. Ne లో K కక్ష్య, L – కక్ష్యలు రెండూ పూర్తిగా నిండుతాయి. ఇక్కడే రెండో ప్రధాన శక్తిస్థాయి ఎనిమిది. ఎలక్ట్రాన్లతో పూర్తిగా నిండుతుంది. కాబట్టే 2వ పీరియడ్లో ఎనిమిది మూలకాలుంటాయి.
మూడవ పీరియడ్ :
సోడియమ్తో (Z = 11) M – కక్ష్య ప్రారంభమవుతుంది. ఈ కక్ష్య ఆర్గాన్ (Z = 18) వచ్చే వరకు క్రమంగా పెరుగుతుంది. ఈ మూలకాలన్నిటినీ 3వ పీరియడ్లో ఉంచడమైనది. అందుకే 3వ పీరియడ్లో కూడా ఎనిమిది మూలకాలే ఉంటాయి. అప్పుడు భేదపరిచే ఎలక్ట్రాన్ M కక్ష్యలోకి (అంటే 3వ కక్ష్యలోకి) పోదు. బదులుగా N – కక్ష్యలోకి (అంటే 4వ కక్ష్యలోకి) పోతుంది. ఈ పీరియడ్ పొటాషియమ్ (Z = 19) తో ప్రారంభమవుతుంది. దీని ఎలక్ట్రాన్ విన్యాసం 2, 8, 8, 1. దీని తరువాత మూలకం కాల్షియమ్ N కక్ష్యలో రెండు ఎలక్ట్రాన్లుంటాయి. దీని ముందు కక్ష్యలు (K, L, M కక్ష్యలు) పూర్తి అయి ఉంటాయి. తరువాత మూలకం స్కాండియమ్ (Z = 21, Sc) తో మొదలుకొని ఉపబాహ్య కక్ష్య M కక్ష్యలో 18 ఎలక్ట్రాన్లు నిండే వరకు పెరుగుతుంది.
4, 5, 6, 7 పీరియడ్లు :
జింక్ మూలకంతో M – కక్ష్య పూర్తి అవుతుంది. తరువాత వచ్చి చేరే ఎలక్ట్రాన్లు బాహ్య కక్ష్యలోకి పోతాయి. Ga, Ge, As, Se, Br, Kr క్రమంగా వస్తాయి. 4వ పీరియడ్లో కొన్ని మూలకాలు పరివర్తన మూలకాలు లేదా పరివర్తన లోహాలు. పరివర్తన మూలకాలు, జడవాయువులు కాకుండా మిగిలిన మూలకాలను సాధారణ మూలకాలు లేదా ప్రాతినిధ్య మూలకాలు అంటారు. 4వ పీరియడ్లో 4s, 3d, 4p స్థాయిలు వరుసగా ఎలక్ట్రాన్లతో నిండుతాయి. అందుకే నాలుగో పీరియడ్లో 18 ఎలక్ట్రాన్లుంటాయి. 4వ పీరియడ్లో క్రమాన్ని 5వ పీరియడ్ దాదాపు అదే రీతిలో అనుసరిస్తుంది. ఈ పీరియడ్లో నాలుగో పీరియడ్లో కంటే తరచుగా ఎలక్ట్రాన్ బాహ్య కక్ష్య నుంచి ఉపబాహ్య కక్ష్యలోకి మారుతుంది. దీనికి కారణం 4d, 5p స్థాయిలు శక్త్యాత్మకంగా అతిసన్నిహితంగా ఉండటం. కాడ్మియమ్ (Z = 48; (d) తో ఈ పీరియడ్ పూర్తి అవుతుంది. ఈ పీరియడ్లో 5s, 4d, 5p స్థాయిలు వరుసగా భేదపరిచే ఎలక్ట్రాన్లతో నిండుతాయి. అందువల్ల ఈ పీరియడ్లో కూడా 18 మూలకాలుంటాయి.
![]()
ప్రశ్న 5.
s, p, d, f బ్లాక్ మూలకాలపై వ్యాసాన్ని రాయండి.
జవాబు:
మూలకాలను వివిధ బ్లాకులుగా విభజించుట :
భేదాత్మక ఎలక్ట్రాన్ ప్రవేశించే ఆర్బిటాళ్ళ ఆధారంగా మూలకాలను 4 బ్లాకులుగా విభజించారు. అవి :
1) s – బ్లాకు, 2) p – బ్లాకు, 3) d – బ్లాకు, 4) f – బ్లాకు
1) s – బ్లాకు :
- భేదాత్మక ఎలక్ట్రాన్ బాహ్యస్థాయిలోని 5 ఉపస్థాయిలో ప్రవేశించు మూలకాలను 5 – బ్లాకు మూలకాలు అంటారు.
- దీనిలో 2 గ్రూపులు కలవు. (ఎ) క్షార లోహాలు IA (బి) క్షార మృత్తిక లోహాలు – 1IA.
- IA గ్రూపు మూలకాల సాధారణ ఎలక్ట్రాన్ విన్యాసం – ns’, ilA గ్రూపు మూలకాల సాధారణ ఎలక్ట్రాన్ విన్యాసం – ns .
- s – బ్లాకు మూలకాల సాధారణ విన్యాసం ns’ -2.
- హైడ్రోజన్ తప్ప మిగిలిన 5 – బ్లాకు మూలకాలన్నీ లోహాలు.
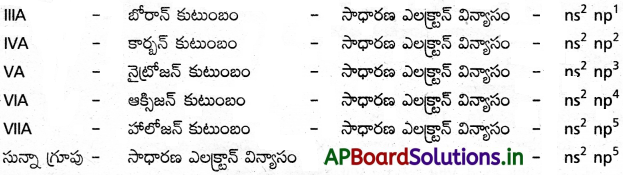
2) p – బ్లాకు :
అధ్యాయం 2 మూలకాల వర్గీకరణ – ఆవర్తన ధర్మాలు
- భేదాత్మక ఎలక్ట్రాన్ బాహ్యస్థాయిలోని p ఉపస్థాయిలో ప్రవేశించు మూలకాలను p-బ్లాకు మూలకాలు అంటారు.
- దీనిలో ఆరు గ్రూపులు కలవు. అవి IIIA నుండి VIIA, సున్నా గ్రూపు.
- ఈ బ్లాకు మూలకాల సాధారణ ఎలక్ట్రాన్ విన్యాసం – ns’ np’ నుండి ns’ np.
- ఈ బ్లాకులో అలోహాలు, లోహాలు, అర్ధలోహాలు కలవు.
3) d – బ్లాకు :
- భేదాత్మక ఎలక్ట్రాన్ (n – 1)d ఉపకక్ష్యలో ప్రవేశించు మూలకాలను d – బ్లాకు మూలకాలు అంటారు.
- వీటి సాధారణ ఎలక్ట్రాన్ విన్యాసం (n – 1)d1 నుండి 10, ns1 లేదా 2 n = 4, 5, 6 లేదా 7
- d – ఉపస్థాయి 10 ఎలక్ట్రాన్లకు స్థానం కల్పించగలదు. అందువల్ల దీనిలో 10 గ్రూపులు కలవు. అవి IB నుండి VIIB, మరియు VIII (దీనిలో 3 నిలువు వరుసలు కలవు.)
- d – బ్లాకులో ఒక్కొక్క శ్రేణిలో 10 మూలకాల చొప్పున 4 శ్రేణులు కలవు. అవి :
a) 3d – శ్రేణి 21Sc నుండి 30Zn
b) 4d – శ్రేణి 39Y నుండి 48Cd
c) 5d – శ్రేణి 57La, 72Hf నుండి 80Hg
d) 6d – శ్రేణి 89Ac నుండి (మిగిలినవి కనుక్కోవాలి) - అన్ని d – బ్లాకు మూలకాలు లోహాలే.
4) f – బ్లాకు :
- భేదాత్మక ఎలక్ట్రాన్ (n – 2) కర్పరంలో ప్రవేశించే మూలకాలను f – బ్లాకు మూలకాలు అంటారు.
- f – బ్లాకు మూలకాలను 2 శ్రేణులుగా విభజించారు. ప్రతి శ్రేణిలో 14 మూలకాలను అమర్చారు. అవి
a) 4f – శ్రేణి లాంథనైడ్లు 58Ce నుండి 71Lu
b) 5f – శ్రేణి – ఆక్టినైడ్లు 90Th నుండి 103Lr - అన్ని f – బ్లాకు మూలకాలు లోహాలు. ఇవి IIIB గ్రూపుకు చెందినవి.
ప్రశ్న 6.
మూలకాల వర్గీకరణలో మూలకాల ఎలక్ట్రాన్ విన్యాసానికి, వాటి ధర్మాలకు గల సంబంధాన్ని తెలపండి.
జవాబు:
రసాయన ధర్మాల ఆధారంగా మూలకాల వర్గీకరణ :
మూలకాల రసాయన ధర్మాల ఆధారంగా వాటిని 4 రకాలుగా వర్గీకరించారు. అవి
- జడవాయు మూలకాలు,
- ప్రాతినిధ్య మూలకాలు,
- పరివర్తన మూలకాలు,
- అంతర పరివర్తన మూలకాలు.
1) జడవాయు మూలకాలు :
- మూలకాల వర్గీకరణ పట్టికలో సున్నా గ్రూపు (18వ గ్రూపు IUPAC) మూలకాలను జడవాయువులు అంటారు. He, Ne, Ar, Kr, Xe, Rn.
- He ఎలక్ట్రాన్ విన్యాసం 1s² మిగిలిన జడవాయువుల విన్యాసం ns² np6.
- స్థిర ఎలక్ట్రాన్ విన్యాసం కలిగి ఉండుటచే, అవి రసాయనికంగా జడత్వాన్ని ప్రదర్శించును.
- ఇవి అన్నీ ఏక పరమాణుక అణువులు. Rn తప్ప మిగిలినవి అన్నీ గాలిలో స్వల్ప పరిమాణంలో లభిస్తాయి.
2) ప్రాతినిధ్య మూలకాలు :
- సున్నా గ్రూపు తప్ప మిగిలిన s, p బ్లాకు మూలకాలను ప్రాతినిధ్య మూలకాలు అంటారు.
- వీటిలో బాహ్య స్థాయి అసంపూర్ణంగా ఉంటాయి.
- వీటి సాధారణ ఎలక్ట్రాన్ విన్యాసం ns1 – 2 np1 – 5.
- వీటిలో లోహాలు, అలోహాలు, అర్ధలోహాలు కలవు.
- ఈ మూలకాలు ఎలక్ట్రాన్లను పంచుకోవడం ద్వారా కానీ, కోల్పోవడం ద్వారా గానీ స్థిర విన్యాసం పొందుతాయి. అందువల్ల ప్రాతినిధ్య మూలకాల చర్యాశీలత అధికం.
3) పరివర్తన మూలకాలు :
- ఇవి d – బ్లాకు మూలకాలు.
- వీటి సాధారణ విన్యాసం (n – 1) d1 – 10 ns1 – 2
- పరివర్తన మూలకాలలో n, n – 1 వ కర్పరాలు అసంపూర్ణంగా నింపబడి ఉంటాయి.
- IIB గ్రూపు తప్ప IIIB నుండి VIIB మరియు VIII గ్రూపులు ఈ రకానికి చెందినవి.
- స్వల్ప పరమాణు పరిమాణం, అధిక ఆవేశం, d – ఆర్బిటాళ్ళలో ఒంటరి ఎలక్ట్రాన్లు కలిగి ఉండుటవల్ల, ఈ మూలకాలు కొన్ని అభిలాక్షణిక ధర్మాలను ప్రదర్శిస్తాయి. అవి :
ఎ) గట్టిగా ఉండే, భారాత్మక లోహాలు.
బి) అధిక ద్రవీభవన స్థానం, బాష్పీభవన స్థానం, సాంద్రత కలిగి ఉండుట.
సి) ఉత్తమ ఉష్ణ, విద్యుత్ వాహకాలు.
డి) చర సంయోజకతను ప్రదర్శిస్తాయి. ఉదా : Fe ఆక్సీకరణ స్థితులు +2, +3.
ఇ) రంగును ప్రదర్శించుట.
ఎఫ్) పారా అయస్కాంత స్వభావాన్ని కలిగి ఉంటాయి.
జి) మిశ్రమ లోహాలను ఏర్పరుస్తాయి.
4) అంతర పరివర్తన మూలకాలు :
- ఇవి f – బ్లాకు మూలకాలు.
- ఈ మూలకాలలో n, n – 1, n – 2 కర్పరాలు అసంపూర్ణంగా నింపబడి ఉంటాయి.
- ఈ మూలకాల సాధారణ ఎలక్ట్రాన్ విన్యాసం (n – 2) f1 నుంచి 14 (n – 1) do, 1 ns².
- ఈ మూలకాలను లాంథనైడ్లు, ఆక్టినైడ్లుగా వర్గీకరించారు.
- చివరి రెండు కర్పరాలలో ఒకే ఎలక్ట్రాన్ విన్యాసం కలిగి ఉండుట వల్ల ఈ మూలకాల సాధారణ ఆక్సీకరణ స్థితి +3.
- యురేనియం (Z = 92) తర్వాత మూలకాలు మానవులు కనిపెట్టినవి.
- లాంథనైడ్లను విరళ మృత్తికలు అంటారు.
ప్రశ్న 7.
ఆవర్తన ధర్మమనగానేమి? కింది ధర్మాలు గ్రూప్లో పీరియడ్లో ఏ విధంగా మారతాయి? విశదీకరించండి. [A.P. & T.S. Mar. ’15 Mar. ’14]
(a) పరమాణు వ్యాసార్థం (b) ఎలక్ట్రాన్ గ్రాహ్య ఎంథాల్పీ
జవాబు:
ఆవర్తన ధర్మం :
“ఆవర్తన పట్టికలో మూలకాల ధర్మాలు క్రమంగా ఎలక్ట్రానిక్ విన్యాసంతోపాటు మారతాయి. ఈ మార్పుల సరళి క్రమ వ్యవధుల్లో పునరావృతమవుతుంది. ఇట్లే ఒక ధర్మం పునరావృతమవడాన్ని ‘ఆవర్తనం’ అంటారు. పునరావృతమయ్యే ధర్మాలను ఆవర్తన ధర్మాలు అంటారు”.
ఆవర్తన ధర్మాలు :
a) పరమాణు వ్యాసార్థం :
“లోహ స్ఫటికంలో రెండు ఆసన్న లోహ పరమాణు కేంద్రకాంతర్గత మధ్య బిందువుల మధ్య దూరంలో సగాన్ని పరమాణు వ్యాసార్థం అంటారు”. దీనినే స్ఫటిక వ్యాసార్థం అంటారు.
ఆవర్తన క్రమం :
i) గ్రూపులో :
గ్రూపులో పై నుండి కిందికి కక్ష్యల సంఖ్య పెరుగుతాయి కాబట్టి పరమాణు వ్యాసార్థం కూడా అదే క్రమంలో పెరుగుతుంది.
ii) పీరియడ్లో :
పీరియడ్లో ఎడమ నుంచి కుడికి కక్ష్యలు పెరగవు కాని కేంద్రకావేశం పెరుగుతుంది. కాబట్టి పరమాణు వ్యాసార్థం క్రమంగా తగ్గుతుంది.
b) ఎలక్ట్రాన్ గ్రాహ్య ఎంథాల్పీ (ఎలక్ట్రాన్ ఎఫినిటి) :
“వాయుస్థితిలోని మూలకం తటస్థ పరమాణువుకు ఎలక్ట్రాన్ను చేర్చి దాన్ని అయాన్ మార్చినప్పుడు విడుదలైన శక్తిని ఆ మూలకం ఎలక్ట్రాన్ ఎఫినిటి అంటారు”.
ఆవర్తన క్రమము :
i) గ్రూపులో :
గ్రూపులో పై నుండి కిందికి పోయే కొద్దీ పరిమాణం పెరగడంవల్ల ఎలక్ట్రాన్ ఎఫినిటి విలువలు తగ్గుతాయి.
ii) పీరియడ్లో :
పీరియడ్లో ఎడమ నుంచి కుడికి పోయే కొద్దీ పరిమాణం తగ్గుతుంది. దీని ఫలితంగా ఎలక్ట్రాన్లపై ఆపేక్ష పెరుగుతుంది. అంటే ఎలక్ట్రాన్ ఎఫినిటి విలువలు పెరుగుతాయి.
ప్రశ్న 88.
ఆవర్తన ధర్మం అంటే ఏమిటి? కింది ధర్మాలు గ్రూప్లో, పీరియడ్లో ఎట్లా మారతాయి? విశదీకరించండి. [A.P. & T.S. Mar. ’15 Mar. ’14]
(a) IE (b) EN
జవాబు:
ఆవర్తన ధర్మం :
“ఆవర్తన పట్టికలో మూలకాల ధర్మాలు క్రమంగా ఎలక్ట్రానిక్ విన్యాసంతోపాటు మారతాయి. ఈ మార్పుల సరళి క్రమ వ్యవధుల్లో పునరావృతమవుతుంది. ఇట్లే ఒక ధర్మం పునరావృతమవడాన్ని ‘ఆవర్తనం’ అంటారు. పునరావృతమయ్యే ధర్మాలను ఆవర్తన ధర్మాలు అంటారు”.
a) IE :
అయనీకరణ శక్తి గ్రూపులలో పై నుండి కిందకు తగ్గును. దీనికి కారణం పరమాణు పరిమాణం గ్రూపులలో పై నుండి కిందకు పెరుగును.
అయనీకరణ శక్తి పీరియడ్లలో ఎడమ నుండి కుడికి పెరుగును. దీనికి కారణం పరమాణు పరిమాణం పీరిడ్లలో ఎడమ నుండి కుడికి తగ్గడమే.
b) EN (ఋణ విద్యుదాత్మకత) :
“విజాతీయ పరమాణువులున్న ఒక ద్విపరమాణుక అణువులో (లేదా) ధృవ సంయోజనీయ బంధంలో సమిష్టిగా పంచుకున్న ఎలక్ట్రాన్ జంటను మూలక పరమాణువు తనవైపుకు ఆకర్షించుకునే ప్రవృత్తిని ఆ మూలకం ఋణ విద్యుదాత్మకత అంటారు”.
ఆవర్తన క్రమము :
i) గ్రూపులో : గ్రూపులో పై నుంచి కిందికి పోయే కొద్దీ పరమాణు పరిమాణం పెరగడం వల్ల ఋణవిద్యుదాత్మకత తగ్గుతుంది.
ii) పీరియడ్లో : పీరియడ్లో ఎడమ నుంచి కుడివైపుకు పరమాణు పరిమాణం తగ్గడం వల్ల ఋణ విద్యుదాత్మకత పెరుగుతుంది.
![]()
ప్రశ్న 9.
(a) పరమాణు వ్యాసార్థం (b) లోహ వ్యాసార్థం (c) సంయోజక వ్యాసార్థం ల గురించి రాయండి.
జవాబు:
(a) స్ఫటిక వ్యాసార్థం :
“లోహ స్ఫటికంలో రెండు ఆసన్న లోహ పరమాణు కేంద్రకాంతర్గత మధ్య బిందువుల మధ్య దూరంలో సగాన్ని స్ఫటిక వ్యాసార్థం అంటారు”. దీనినే పరమాణు వ్యాసార్థం అని కూడా అంటారు.
యూనిట్లు : À, nm, m, cm మొ॥ ఈ వ్యాసార్థం లోహ పరమాణువులకు వర్తిస్తుంది.
ఉదా : సోడియం స్ఫటిక వ్యాసార్థం = 1.86 Å.
b) వాండర్ వాల్స్ వ్యాసార్థం :
“అతిసన్నిహితంగా భిన్న అణువుల్లోని రెండు పరమాణువుల కేంద్రకాల మధ్య దూరంలో సగాన్ని “వాండర్ వాల్స్ వ్యాసార్థం” అంటారు.
ఈ వ్యాసార్థం ఘనస్థితిలో ఉన్న అణుపదార్థాలకు వర్తిస్తుంది. ఉదా : క్లోరిన్ వాండర్ వాల్స్ వ్యాసార్థం = 1.86 .
c) సంయోజనీయ వ్యాసార్థం :
“సజాతీయ పరమాణువులున్న అణువులో కోవలెంట్ బంధంతో కలపబడి ఉన్న రెండు పరమాణు కేంద్రకాల మధ్య దూరంలో సగాన్ని కోవలెంట్ వ్యాసార్థం అంటారు”.
ఈ వ్యాసార్థం అలోహాలకు వర్తిస్తుంది. ఉదా : క్లోరిన్ కోవలెంట్ వ్యాసార్థం = 0.99 .
ప్రశ్న 10.
IE1, IE2 లను నిర్వచించండి. ఏదైనా పరమాణువుకు IE2 > IE1 గా ఎందుకు ఉంటుంది? ఒక మూలకపు IE ని ప్రభావితం చేసే అంశాలను చర్చించండి. [Mar. ’14]
జవాబు:
ప్రథమ అయనీకరణ శక్తి I1:
“స్వేచ్ఛా స్థితిలో ఉండే వాయు పరమాణువు H నుంచి అత్యంత బలహీనంగా బంధితమైన ఎలక్ట్రాన్లు విడదీసి వాయుస్థితిలో అయాన్ను ఏర్పరచడానికి అవసరమైన కనీస శక్తిని ప్రథమ అయనీకరణ శక్తి (I,) అంటారు.”
M(g) + I1 → M+(g) + e–
ద్వితీయ అయనీకరణ శక్తి (I2):
“ఏక ధనావేశిత అయాన్ నుంచి రెండో ఎలక్ట్రానన్ను తీసివేయడానికి కావలసిన కనీస శక్తిని ద్వితీయ అయనీకరణ శక్తి (I)
M+(g) + I2 → M2+(g) + e–
అయనీకరణ శక్తిని ఎలక్ట్రాన్ – వోల్ట్ / పరమాణువు (లేదా) కిలో కాలరీ / మోల్ (లేదా) కిల్తో జౌల్/మోల్లలో కొలుస్తారు.
ప్రథమ అయనీకరణ శక్తి కంటే ద్వితీయ అయనీకరణ శక్తి ఎక్కువ i.e., I2 > I1 – కారణము :
పరమాణువు నుంచి ఒక ఎలక్ట్రాన్ ను తీసివేస్తే ఏర్పడే ఏక ధనావేశిత అయాన్లో తటస్థ పరమాణువులో కంటే అధిక ప్రభావక కేంద్రక ఆవేశం ఉంటుంది. దీనివల్ల ఎలక్ట్రాన్ల మధ్య వికర్షణలు తగ్గుతాయి. అదే సమయంలో బాహ్య కక్ష్యలలోని ఎలక్ట్రాన్లపై కేంద్రక ఆకర్షణ ఎక్కువవుతుంది. దీని ఫలితంగా ఏక ధనావేశిత అయాన న్నుంచి ఒక ఎలక్ట్రాన్ ను తీసివేయడానికి ఎక్కువ శక్తి అవసరమవుతుంది. కాబట్టి I2 > I1.
అయనీకరణ శక్తి – ప్రభావితం చేసే అంశాలు :
1) పరమాణు వ్యాసార్థం :
పరమాణు వ్యాసార్థం పెరిగినకొద్దీ, వేలన్సీ ఎలక్ట్రాన్లు కేంద్రకం నుంచి దూరం అవుతాయి. కాబట్టి బలహీన కేంద్రక ఆకర్షణలకు లోనవుతాయి. అందువల్ల పరమాణువులోని ఎలక్ట్రాన్లను వేరుచేయడానికి తక్కువ శక్తి సరిపోతుంది. అంటే 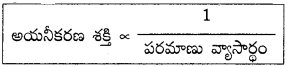
2) యవనికా ప్రభావం (లేదా) పరిరక్షక ప్రభావం :
“సంపూర్ణమైన ఆర్బిటాల్లలోని అంతర ఎలక్ట్రాన్లు బాహ్య ఎలక్ట్రాన్లకు కేంద్రకం మధ్య ఆకర్షణలపై కనబరిచే ప్రభావాన్ని పరిరక్షక (లేదా) యవనికా ప్రభావం అంటారు”.
అంతర కక్ష్యలలోని ఎలక్ట్రాన్ల సంఖ్య పెరిగితే వాటి యవనికా ప్రభావం కూడా పెరుగుతుంది. కావున బాహ్య ఎలక్ట్రాన్లపై కేంద్రక ఆకర్షణ తగ్గుతుంది. అయనీకరణ శక్తి తగ్గుతుంది.

ఆర్బిటాల్లలోని ఎలక్ట్రాన్ల యవనికా దక్షత అవరోహణ క్రమము.
s>p>d> f
3) వేలన్సీ ఎలక్ట్రాన్ల ఆర్బిటాల్లు లోపలికి చొచ్చుకొనిపోయే విస్తృతి :
“ఒక నిర్దిష్ట ప్రధాన క్వాంటం సంఖ్యకు, తమ ఆకృతిపై ఆధారపడి ఆర్బిటాళ్ళు కేంద్రం వైపు ఆకర్షింపబడటాన్ని ఆర్బిటాల్లు చొచ్చుకుపోవడం అంటారు”.
- వివిధ ఆర్బిటాల్లు చొచ్చుకొనిపోయే విస్తృతుల క్రమము s > p > d > f
- అనగా సౌష్ఠవాకృతిగల s – ఆర్బిటాల్ కేంద్రకం వైపుకు అధికంగా చొచ్చుకొనిపోతుంది. కాబట్టి 5 – ఆర్బిటాలు చెందిన ఎలక్ట్రాన్ విడివడటానికి అధిక ప్రమాణంలో శక్తి అవసరమవుతుంది.
- ఒకే కక్ష్యలోని వివిధ ఆర్బిటాళ్ళలో గల ఎలక్ట్రాన్లకు అయనీకరణ శక్తి విలువల క్రమం 5 > p > d > f.
4) కేంద్రకం ఆవేశం :
కేంద్రకం ఆవేశం పెరిగే కొలదీ బాహ్య కర్పరంలోని ఎలక్ట్రాన్లపై కేంద్రక ఆకర్షణ పెరుగును. అందువల్ల అయనీకరణ శక్తి పెరుగును.
అయనీకరణ శక్తి ∝ కేంద్రక ఆవేశం.
ప్రశ్న 11.
గ్రూప్ 1, మూడో పీరియడ్లో కింది ధర్మాలు ఏ విధంగా మారతాయి ? ఉదాహరణతో విశదీకరించండి.
(a) పరమాణు వ్యాసార్థం (b) IE (c) EA (d) ఆక్సైడ్ స్వభావం
జవాబు:
పరమాణు వ్యాసార్థం :
i) గ్రూపు – 1 : పరమాణు వ్యాసార్థం Li నుండి Cs వరకు పెరుగును.
ii) 3వ పీరియడ్ : మూడవ పీరియడ్లో Na నుండి Cl వరకు పరమాణు వ్యాసార్థం తగ్గును.
b) IE :
i) మొదటి గ్రూపు :
అయొనైజేషన్ పొటెన్షియల్ : ఒకటవ గ్రూపులో పై నుండి క్రిందకు పోయే కొలది I.P. విలువలు క్రమంగా తగ్గుతాయి. ఉదా : Li నుండి Cs కు పోయే కొలది I.P. విలువలు 5.39 eV పరమాణువు నుండి 3.89 eV పరమాణువుకు తగ్గుతుంది.
ii) మూడవ పీరియడ్ :
అయొనైజేషన్ పొటెన్షియల్ : ఈ పీరియడ్లో ఎడమ నుండి కుడికి పోయేకొలది I.P. విలువలు క్రమంగా పెరుగుతాయి. ఉదా : Na నుండి Ar వరకు I.P. విలువలు 5.14 eV/పరమాణువు నుండి 15.76 eV పరమాణువుకు పెరుగుతుంది.
c) EA :
i) మొదటి గ్రూపు :
Li నుండి CS వరకు ఎలక్ట్రాన్ ఎఫినిటీ విలువలు తగ్గును దీనికి కారణం పరమాణు పరిమాణం పెరగడమే.
ii) మూడవ పీరియడ్ :
3వ పీరియడ్లో Si నుండి ‘P’ కు తగ్గును మరియు P నుండి C కు పెరుగును.
Mg, Ar కు ధనాత్మక విలువలు కలిగియుండును.
d) i) మొదటి గ్రూపు :
a) మూలకాల ఆక్సైడ్ ధర్మాలు :
ఒకటవ గ్రూపులో పై నుండి క్రిందకు పోయే కొలది లోహ ధర్మం క్రమంగా పెరుగుతుంది. అందువలన మూలకాల ఆక్సైడ్ క్షారధర్మం కూడా పెరుగుతుంది.
ఉదా : Li2O యొక్క క్షారత్వం కన్నా Cs2O క్షారత్వం ఎక్కువ.
ii) మూడవ పీరియడ్ :
a) మూలకాల ఆక్సైడ్ ధర్మాలు : ఈ పీరియడ్లో ఎడమ నుండి కుడి వైపుకు పోయే కొలది ఆక్సైడ్ క్షార ధర్మం క్రమంగా తగ్గి ఆమ్ల ధర్మం క్రమంగా పెరుగుతుంది.
ఉదా : Na2O క్షార ఆక్సైడ్ కాగా క్లోరిన్ ఆక్సైడ్లు ఆమ్లంగా ఉంటాయి.
![]()
ప్రశ్న 12.
ఎలక్ట్రాన్ గ్రాహ్య ఎంథాల్పీని నిర్వచించండి. గ్రూప్లో, పీరియడ్లో అది ఎట్లా మారుతుంది ? గ్రూప్లో తరువాత మూలకం కంటే O, F ల ఎలక్ట్రాన్ గ్రాహ్య ఎంథాల్పీ ఎందుకు తక్కువ రుణాత్మకంగా ఉంది?
జవాబు:
ఎలక్ట్రాన్ గ్రాహ్య ఎంథాల్పీ (ఎలక్ట్రాన్ ఎఫినిటి) :
“వాయు స్థితిలోని మూలకం తటస్థ పరమాణువుకు ఎలక్ట్రాన్ను చేర్చి దాన్ని అయాన్ మార్చినప్పుడు విడుదలైన శక్తిని ఆ మూలకం ఎలక్ట్రాన్ ఎఫినిటి అంటారు”.
ఆవర్తన క్రమము :
i) గ్రూపులో :
గ్రూపులో పై నుంచి కిందికి పోయే కొద్దీ పరిమాణం పెరగడం వల్ల ఎలక్ట్రాన్ ఎఫినిటి విలువలు తగ్గుతాయి.
ii) పీరియడ్లో :
పీరియడ్లో ఎడమ నుంచి కుడికి పోయే కొద్దీ పరిమాణం తగ్గుతుంది. దీని ఫలితంగా ఎలక్ట్రాన్లపై ఆపేక్ష పెరుగుతుంది. అంటే ఎలక్ట్రాన్ ఎఫినిటి విలువలు పెరుగుతాయి.
- అధిక ఎలక్ట్రాన్ గ్రాహ్య ఎంథాల్పి కలిగిన మూలకం క్లోరిన్ (- 349 kJ/mole)
- జడవాయువులకు ఎలక్ట్రాన్ ఎఫినిటీ విలువ సున్నా
- గ్రూపులో తరువాత మూలకం కంటే O, F ల ఎలక్ట్రాన్ గ్రాహ్య ఎంథాల్పీ తక్కువ ఋణాత్మకంగా ఉంటుంది. దీనికి కారణం ఈ మూలకాలు O, F తక్కువ పరమాణు పరిమాణం కలిగి అధిక ఎలక్ట్రాన్ వికర్షణలు కలిగి ఉంటాయి.
O → – 141 KJ / mole, S → – 200 kJ/Mole
F → – 328 KJ / mole, CI – 349 kJ/Mole
ప్రశ్న 13.
(a) రుణ విద్యుదాత్మకత అంటే ఏమిటి?
(b) గ్రూప్లో, పీరియడ్లో అది ఎట్లా మారుతుంది?
జవాబు:
(a) ఋణ విద్యుదాత్మకత – నిర్వచనము :
“విజాతీయ పరమాణువులున్న ఒక ద్విపరమాణుక అణువులో లేదా ధృవ సంయోజనీయ బంధంలో సమిష్టిగా పంచుకున్న ఎలక్ట్రాన్ జంట (లు)ను మూలక పరమాణువు తనవైపుకు ఆకర్షించుకునే ప్రవృత్తిని ఆ మూలకం ఋణవిద్యుదాత్మకత” అంటారు.
ఋణ విద్యుదాత్మకత – పౌలింగ్ స్కేలు :
పౌలింగ్ స్కేలు అణువు యొక్క బంధశక్తుల ఆధారంగా రూపొందించబడినది. A – B అను అణువులో A మరియు B ల ఋణవిద్యుదాత్మకతలు వరుసగా XA మరియు XB అయిన పౌలింగ్ స్కేలు ప్రకారము.
XA – XB = 0.208√∆
ఇచ్చట ∆ = EA – B – \(\frac{1}{2}\) (EA – A + EB – B)
EA – B అనగా A – B అణువు యొక్క బంధశక్తి
EA – A అనగా A – A అణువు యొక్క బంధశక్తి
EB – B అనగా B – B అణువు యొక్క బంధశక్తి
(b) ఆవర్తన క్రమము :
i) గ్రూపులో :
గ్రూపులో పై నుంచి కిందికి పోయే కొద్దీ పరమాణు పరిమాణం పెరగడం వల్ల ఋణ విద్యుదాత్మకత తగ్గుతుంది.
ii) పీరియడ్లో :
పీరియడ్లో ఎడమ నుంచి కుడివైపుకు పరమాణు పరిమాణం తగ్గడం వల్ల ఋణ విద్యుదాత్మకత
పెరుగుతుంది.
- అధిక ఋణ విద్యుదాత్మక మూలకం ఫ్లోరిన్, పౌలింగ్ స్కేలు ద్వారా దాని విలువ 4.0.
- రెండు మూలకాలు ఋణవిద్యుదాత్మక విలువల భేదం బట్టి బంధ స్వభావం తెలుసుకొనవచ్చు.
- ఋణవిద్యుదాత్మక విలువల భేదం > 1.7 అయితే అయానిక బంధం
- ఋణవిద్యుదాత్మక విలువల భేదం < 1.7 అయితే సంయోజనీయ బంధం
- ఋణవిద్యుదాత్మక విలువల భేదం = 1.7 అయితే 50% అయానిక, 50% సంయోజనీయ బంధం
![]()
ప్రశ్న 14.
కింది వాటిని విశదీకరించండి. (a) సంయోజకత (b) కర్ణ సంబంధం (c) గ్రూప్ 1 లో ఆక్సైడ్ స్వభావంలో మార్పు
జవాబు:
(a) సంయోజకత :
“ఒక మూలకము యొక్క సంయోగ సామర్థ్యమును ‘సంయోజకత’ అంటారు.” (లేదా)
‘ఏదైనా మూలక పరమాణువుతో సంయోగం చెందే హైడ్రోజన్ పరమాణువుల సంఖ్యను (లేదా) క్లోరిన్ పరమాణువుల సంఖ్యను (లేదా) ఆక్సిజన్ పరమాణువుల సంఖ్యకు రెట్టింపు సంఖ్యను ఆ మూలకపు సంయోజకత అంటారు.
సంయోజకత = హైడ్రోజన్ పరమాణువుల సంఖ్య
= క్లోరిన్ పరమాణువుల సంఖ్య
= 2 × ఆక్సిజన్ పరమాణువుల సంఖ్య
ఆవర్తన క్రమము :
i) పీరియడ్లో :
పీరియడ్లో సంయోజకత పెరుగును. ‘H’ పరంగా 1 నుంచి 4 వరకు పెరిగి తర్వాత ‘1’ కి తగ్గును.

ii) గ్రూపులో :
గ్రూపులో సంయోజకత గ్రూపు సంఖ్యకు సమానమవుతుంది. (IV వ గ్రూపు వరకు) (లేదా) (8 – గ్రూపు సంఖ్యకు) సమానమవుతుంది. (V గ్రూపు తరువాత).
(b) కర్ణ సంబంధం :
“ఆధునిక ఆవర్తన పట్టికలో రెండవ పీరియడ్కు చెందిన మూలకం యొక్క ధర్మాలు, మూడవ పీరియడ్లోని తర్వాత గ్రూపుకి చెందిన మూలక ధర్మాలను పోలి ఉంటాయి. ఈ సంబంధాన్ని కర్ణ సంబంధం అంటారు”.
ఉదా : (Li, Mg); (Be, Al); (B, Si)
c) మొదటి గ్రూపు :
మూలకాల ఆక్సైడ్ ధర్మాలు :
ఒకటవ గ్రూపులో పై నుండి కిందకు పోయే కొలది లోహ ధర్మం క్రమంగా పెరుగుతుంది. అందువలన మూలకాల ఆక్సైడ్ క్షారధర్మం కూడా పెరుగుతుంది.
ఉదా : Li2O యొక్క క్షారత్వం కన్నా Cs2O క్షారత్వం ఎక్కువ.
సాధించిన సమస్యలు (Solved Problems)
ప్రశ్న 1.
120 పరమాణు సంఖ్య ఉన్న మూలకం IUPAC పేరు, సంకేతం ఏది?
సాధన:
1, 2, 0ల వర్గాలు వరుసగా ఉన్, బై, నిల్లు కాబట్టి సంకేతం, పేరు వరుసగా ఉన్, ఉబ్బినిలియమ్.
![]()
ప్రశ్న 2.
ఆవర్తన పట్టికలో ఐదో పీరియడ్లో 18 మూలకాలు ఉండటాన్ని ఏ విధంగా సమర్ధిస్తారు?
సాధన:
ఐదో పీరియడ్ ప్రాథమిక క్వాంటమ్ సంఖ్య n = 5 ఐన, l = 0, 1, 2, 3. లభ్యమయ్యే 4d, 5s, 5p ఆర్బిటాళ్ళ శక్తి క్రమం 5s < 4d < 5p. మొత్తం లభ్యమయ్యే ఆర్బిటాళ్ళ సంఖ్య 9 సమకూర్చగలిగే మొత్తం ఎలక్ట్రాన్ల సంఖ్య 18, కాబట్టి ఐదో పీరియడ్లో 18 మూలకాలుంటాయి.
ప్రశ్న 3.
Z = 117, 120 ఉన్న మూలకాలను ఇంకా కనుక్కోలేదు. ఏ గ్రూప్ / కుటుంబంలో వీటిని ఉంచుతారు? వాటి ఎలక్ట్రాన్ విన్యాసాలను తెలపండి.
సాధన:
Z = 117 గల మూలకం హాలోజన్ కుటుంబం (గ్రూప్ 17) కి చెందుతుందని తెలుస్తుంది, దాని ఎలక్ట్రాన్ విన్యాసం [Rn] 5f146d107s²7p5 అయి ఉండవచ్చు. Z = 120 గల మూలకాన్ని గ్రూప్ 2 (క్షారమృత్తికా లోహాలు)లో ఉంచవచ్చు, దాని ఎలక్ట్రాన్ విన్యాసం[Uuo]8s’ అయి ఉండవచ్చు.
ప్రశ్న 4.
కింద ఉన్న మూలకాలను పరమాణు సంఖ్య, ఆవర్తన పట్టికలోని స్థానం ప్రకారం, వాటి లోహ స్వభావం పెరిగే క్రమంలో అమర్చండి Si, Be, Mg, Na, P.
సాధన:
లోహ స్వభావం గ్రూప్ లో పై నుంచి కిందకు పెరుగుతుంది, పీరియడ్లో ఎడమ నుంచి కుడికి తగ్గుతుంది. కాబట్టి లోహ స్వభావం పెరిగే క్రమం : P < Si < Be < Mg < Na.
ప్రశ్న 5.
క్రింది వాటిలో వేటికి అత్యధిక పరిమాణం, అత్యల్ప పరిమాణం ఉంటాయి? Mg. Mg2+, Al, Al3+.
సాధన:
పరమాణు వ్యాసార్థం పీరియడ్లో తగ్గుతుంది. మూల పరమాణువుల కంటే కాటయాన్లు చిన్నవిగా ఉంటాయి. సమ ఎలక్ట్రానిక్ కణాలలో అత్యధిక ధన కేంద్రక ఆవేశం ఉన్న దానికి అత్యల్ప వ్యాసార్థం ఉంటుంది. కాబట్టి Mg కు అత్యధిక పరిమాణం, Al3+ కు అత్యల్ప పరిమాణం ఉంటాయి.
ప్రశ్న 6.
మూడవ పీరియడ్ మూలకాలైన Na, Mg, Si ల ప్రథమ అయొనైజేషన్ ఎంథాల్పీలు ∆iH వరసగా 496, 737, 786 kJ mol-1. Al ప్రథమ ∆iH విలువ 575, 760 kJ mol-1 లలో దేనికి దగ్గరగా ఉంటుందో ఊహించండి? సమాధానాన్ని సమర్థించండి.
సాధన:
575 kJ mol-1 కు దగ్గరగా ఉంటుంది. 3p – ఎలక్ట్రాన్లపై 35- ఎలక్ట్రాన్లకు ఉన్న ప్రభావిత యవనికా ప్రభావం వల్ల AI, Mg కంటె తక్కువ అయొనైజేషన్ ఎంథాల్పీ ఉంటుంది.
![]()
ప్రశ్న 7.
కింది వాటిలో రుణాత్మక ఎలక్ట్రాన్ గ్రాహ్య ఎంథాల్పీ దేనికి ఎక్కువ, దేనికి తక్కువ? P, S, CI, F. సమాధానాన్ని విశదీకరించండి.
సాధన:
పీరియడ్లో సాధారణంగా ఎడమ నుంచి కుడికి, ఎలక్ట్రాన్ గ్రాహ్య ఎంథాల్పీ అధిక రుణాత్మకమవుతుంది. గ్రూప్ కిందకు, ఎలక్ట్రాన్ గ్రాహ్య ఎంథాల్పీ తక్కువ రుణాత్మకమవుతుంది. పెద్దదైన 3p – ఆర్బిటాల్లో ఎలక్ట్రాన్ చేరిక కంటే 2p- ఆర్బిటాల్లో ఎలక్ట్రాన్ చేరిక అధిక ఎలక్ట్రాన్ వికర్షణలకు దారితీస్తుంది. కాబట్టి, అధిక రుణాత్మక ఎలక్ట్రాన్ గ్రాహ్య ఎంథాల్పీ ఉన్న మూలకం క్లోరిన్, తక్కువ రుణాత్మక ఎలక్ట్రాన్ గ్రాహ్య ఎంథాల్పీ ఉన్న మూలకం ఫాస్ఫరస్.
ప్రశ్న 8.
కింద ఉన్న జంట మూలకాల నుంచి ఏర్పడు పదార్థాల ఫార్ములాలను, ఆవర్తన పట్టికను ఉపయోగించి కనుక్కోండి; (a) సిలికాన్, బ్రోమిన్, (b) అల్యూమినియం, సల్ఫర్.
సాధన:
a) 4 సంయోజకతగా ఉన్న సిలికాన్ 14వ గ్రూప్ మూలకం; 1 సంయోజకత కలిగిన బ్రోమిన్ హాలోజన్ గ్రూప్కు చెందింది. కాబట్టి, ఏర్పడే పదార్థం ఫార్ములా, SiBr4.
b) 3 సంయోజకతగా ఉన్న అల్యూమినియం 13వ గ్రూప్కు చెందింది. సంయోజకత 2 గల సల్ఫర్ 16వ గ్రూప్ మూలకం. కాబట్టి, ఏర్పడు పదార్థం ఫార్ములా Al2S3.
ప్రశ్న 9.
[AlCl(H2O)5]2+ లో Al ఆక్సీకరణ స్థితి, సంయోజనీయత ఒకే విధంగా ఉంటుందా?
సాధన:
ఉండదు: Al ఆక్సీకరణ స్థితి +3 సమయోజనీయత 6.
![]()
ప్రశ్న 10.
Na2O క్షార ఆక్సైడ్ అనీ, Cl2O7 ఆమ్ల ఆక్సైడ్ అనీ, నీటితో రసాయన చర్య ద్వారా చూపండి.
సాధన:
Na2O నీటితో బలమైన క్షారాన్ని Cl2O7 బలమైన ఆమ్లాన్ని ఏర్పరుస్తాయి.
Na2O + H2O → 2NaOH
Cl2O7 + H2O → 2HClO4
వాటి క్షార, ఆమ్ల ప్రవృత్తిని లిట్మస్ కాగితంతో గుణాత్మకంగా పరీక్షించవచ్చు.