Andhra Pradesh BIEAP AP Inter 1st Year Chemistry Study Material 8th Lesson హైడ్రోజన్ – దాని సమ్మేళనాలు Textbook Questions and Answers.
AP Inter 1st Year Chemistry Study Material 8th Lesson హైడ్రోజన్ – దాని సమ్మేళనాలు
అతిస్వల్ప సమాధాన ప్రశ్నలు
ప్రశ్న 1.
హైడ్రోజన్ ఐసోటోపులు మూడు వాటి చర్యావేగాల్లో భేదపడతాయి. కారణాలు తెలపండి.
జవాబు:
హైడ్రోజన్ మూడు రకాల సమస్థానీయాలను కలిగి ఉంది. అవి వరుసగా 1) ప్రోటియం 2) డ్యుటీరియం 3) ట్రిటియం. ఈ మూడు సమస్థానీయాలలో వరుసగా 0, 1, 2 న్యూట్రాన్లు ఉంటాయి. వీటిలో ట్రిటియం రేడియోధార్మికత కలిగి ఉంటుంది.
భేదాలు :
- ప్రోటియంలో న్యూట్రాన్లు ఉండవు. డ్యుటీరియంలో 1 న్యూట్రాన్ ఉంటుంది. ట్రిటియంలో రెండు న్యూట్రాన్లు ఉంటాయి.
- ఈ సమస్థానీయాలు వాటి ద్రవ్యరాశిలో భేదిస్తాయి.
- డ్యుటీరియం కన్నా హైడ్రోజన్ చర్యాశీలత ఎక్కువ.
ప్రశ్న 2.
అధిక ద్రవీభవన స్థానాలున్న లోహాలను వెల్డింగ్ చేయటానికి డైహైడ్రోజనన్ను ఎందుకు వాడతారు?
జవాబు:
హైడ్రోజన్ యొక్క ముఖ్యమయిన అనుకరణం ఆక్సీ-హైడ్రోజన్ టార్చ్, ఆక్సీ-హైడ్రోజన్ బ్లో టార్చ్ శుద్ద ఆక్సిజన్తో హైడ్రోజను మండించినప్పుడు అధిక జ్వాల ఉష్ణోగ్రత (2800°C) వస్తుంది. దీన్ని వెల్డింగ్ చేయడానికి, ప్లాటినం లోహం, క్వార్ట్లలను ద్రవీకరించడానికి వాడతారు. హైడ్రోజన్ వెల్డింగ్ టార్ను కూడా వెల్డింగ్ పనులకే వాడతారు కాని హైడ్రోజన్ పరమాణువుల పునఃసంకలనోష్టాన్ని అధిక ఉష్ణోగ్రతలను పొందటానికి (>3000°C) ఉపయోగిస్తారు.
ప్రశ్న 3.
అత్యంత శుద్ధమైన డైహైడ్రోజన్ ను తయారుచేయడానికి ఒక పద్ధతిని వివరించండి.
జవాబు:
అత్యంత శుద్ధమైన డై హైడ్రోజను వేడి Ba(OH)2 ద్రావణాన్ని నికెల్ విద్యుద్ఘాటాల మధ్య విద్యుద్విశ్లేషణ చేసి పొందవచ్చు. ఇచ్చట 99.95% శుద్ధమైన H2 ఏర్పడును.
ప్రశ్న 4.
“సిన్ గ్యాస్” పదాన్ని వివరించండి.
జవాబు:
CO మరియు H2 ల మిశ్రమం మిథనోల్ మరియు అనేక హైడ్రోకార్బన్ల సంశ్లేషణకు ఉపయోగపడును. ఈ మిశ్రమాన్ని సిస్ గ్యాస్ అంటారు.
తయారీ :
![]()
ప్రశ్న 5.
“కోల్ గాసిఫికేషన్” అంటే ఏమిటి? దానిని సరైన, తుల్య సమీకరణంతో వివరించండి.
జవాబు:
కోలన్ను ఉపయోగించి 1270K ఉష్ణోగ్రత వద్ద సిన్ గ్యాస్ ను తయారుచేయుటను కోల్ గ్యాసిఫికేషన్ అంటారు.

ప్రశ్న 6.
హైడ్రైడ్ అంటే నిర్వచనం చెప్పండి. ఎన్ని రకాల హైడ్రైడ్లున్నాయి? వాటి పేర్లను చెప్పండి.
జవాబు:
జడవాయువులు తప్ప ఇతర మూలకాలతో హైడ్రోజన్ ఏర్పరచే ద్విగుణ సమ్మేళనాలను హైడ్రైడ్లు అంటారు.
హైడ్రైడ్లు మూడు రకాలు :
- అయానిక హైడ్రైడ్లు
- సంయోజనీయ హైడ్రైడ్లు
- లోహ హైడ్రైడ్లు.
![]()
ప్రశ్న 7.
ద్రవీకృత ప్రావస్థలో నీటికి అసాధారణ లక్షణం ఉంటుంది. అది నీటి అధిక బాష్పీభవనోష్టానికి దారితీస్తుంది. ఆ ధర్మం ఏమిటి?
జవాబు:
నీటిలో అంతర అణుక హైడ్రోజన్ బంధాలు కలవు. ఈ అసాధారణ ధర్మం వలన నీటికి అధిక ఘనీభవన స్థానం, బాష్పీభవన స్థానం మరియు అధిక బాష్పీభవనోష్టానికి దారితీస్తుంది.
ప్రశ్న 8.
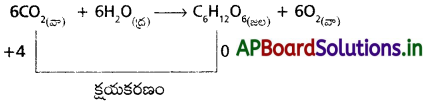
శ్రీ కిరణజన్య సంయోగక్రియ జరుగుతున్నప్పుడు నీరు 0్మగా ఆక్సీకరణం చెందుతుంది. అయితే ఏ మూలకం క్షయకరణం చెందుతుంది?
జవాబు:
కిరణజన్య సంయోగక్రియ జరిగినపుడు కార్బన్ క్షయకరణం చెందును.
ప్రశ్న 9.
“స్వయం ప్రోటోలసిస్” అంటే మీకేమి తెలుస్తుంది? నీటి స్వయం ప్రోటోలసిసికి సమీకరణాన్ని రాయండి.
జవాబు:
నీటి యొక్క ఆటోప్రోటాలిసిస్ ఈ క్రింది విధంగా జరుగుతుంది.
![]()
సార్థకత :
దీనిని బట్టి నీటి ద్విస్వభావ లక్షణం తెలుస్తుంది. అంటే క్షారాలను తనలో కరిగించుకునేటప్పుడు నీరు బ్రౌన్ స్టెడ్ ఆమ్లంగాను, ఆమ్లాన్ని కరిగించుకునేటప్పుడు బ్రౌన్టెడ్ క్షారంగాను పనిచేస్తుంది.
ప్రశ్న 10.
బ్రానెడ్ సిద్ధాంతపరంగా నీరు ద్విస్వభావం గల పదార్థం. దానిని మీరు ఎట్లా వివరిస్తారు ?
జవాబు:
ద్విస్వభావ లక్షణం :
క్షారాలను తనలో కరిగించుకునేటప్పుడు నీరు బ్రౌన్టెడ్ ఆమ్లంగానూ, ఆమ్లాన్ని కరిగించుకునేటప్పుడు బ్రౌన్ స్టెడ్ క్షారంగాను పనిచేస్తుంది. దీనిని బట్టి నీటి ద్విస్వభావ లక్షణం తెలుస్తుంది. ఇది స్వయం అయనీకరణం జరగడం వల్ల అవుతుంది.
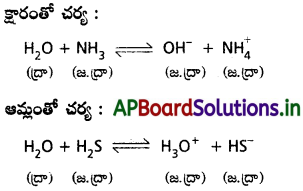
స్వల్ప సమాధాన ప్రశ్నలు
ప్రశ్న 1.
NH3 H2O, HF ల బాష్పీభవన స్థానాలు, ఆయా గ్రూపుల్లో వాటి తరువాత మూలకాల హైడ్రైడ్ల బాష్పీభవన స్థానాలకంటే ఎక్కువగా ఉంటాయి. మీ కారణాలు చెప్పండి.
జవాబు:
NH3, H2O, HF ల బాష్పీభవన స్థానాలు, ఆమ్ల గ్రూపుల్లో వాటి తరువాత మూలకాల హైడ్రైడ్ల బాష్పీభవన స్థానాల కంటే ఎక్కువగా ఉంటాయి.
వివరణ :
- NH3, H2O మరియు HF లు ఎలక్ట్రాన్లు అధికంగా గల హైడ్రైడ్లు వీటిలో N, O, Fలపై 1, 2, 3 ఒంటరి ఎలక్ట్రాన్ జంటలు గలవు.
- అధిక ఋణవిద్యుదాత్మకత మూలకాలపై ఒంటరి ఎలక్ట్రాన్ జంటలుండుట వలన హైడ్రోజన్ బంధాలు ఏర్పడతాయి.
- ఈ హైడ్రోజన్ బంధాలు ఏర్పడుట వలన ఈ హైడ్రైడ్లకు అధిక బాష్పీభవన స్థానాలుంటాయి.
ప్రశ్న 2.
ఆవర్తన పట్టికలో హైడ్రోజన్ స్థానాన్ని దాని ఎలక్ట్రాన్ విన్యాసరపరంగా చర్చించండి.
జవాబు:
హైడ్రోజన్ ఒక ఎలక్ట్రాన్ను పోగొట్టుకుని ఏకమాత్రధనావేశిత అయానన్ను ఇస్తుంది. క్షారలోహాలు కూడా ఎలక్ట్రాన్ను పోగొట్టుకుని ఏకమాత్ర ధనావేశిత అయాన న్ను ఇస్తాయి. కాబట్టి హైడ్రోజనన్ను IA గ్రూప్ మూలకాలతో కలపవచ్చు.
హైడ్రోజన్ ఒక ఎలక్ట్రానన్ను కలుపుకుని ఏకమాత్ర ఋణావేశిత అయానన్ను ఇస్తుంది. అందువలన దానిని ఏకమాత్ర ఋణావేశిత అయాన్ను ఇచ్చే హాలోజన్ (VIIA) గ్రూప్తో కూడా కలపవచ్చు.
హైడ్రోజన్ ఎలక్ట్రాన్లో 1s ఆర్బిటాల్లో ప్రవేశించటం వలన దానిని IA గ్రూప్ మూలకాలతోనే కలపటం జరిగింది. . అయినప్పటికి దాని స్థానం సరిగా లేదు.
ప్రశ్న 3.
హైడ్రోజన్ ఎలక్ట్రాన్ విన్యాసం దాని రసాయన ధర్మాలకు ఎట్లా అనువుగా ఉంటుంది?
జవాబు:
- ‘H’ యొక్క ఎలక్ట్రాన్ విన్యాసం 1s¹.
- డైహైడ్రోజన్ న్ను UV కిరణాలతో చర్య జరుపుట ద్వారా ఏర్పడిన పరమాణుక హైడ్రోజన్ దాదాపుగా అన్ని మూలకాలతో చర్య జరుపును.
- ఈ పరమాణు హైడ్రోజన్ అన్ని చర్యలను పూర్తి చేయును.
a) ఒక ఎలక్ట్రాన్ కోల్పోయి H+ ను
b) ఒక ఎలక్ట్రాన్ గ్రహించి H– ను
c) ఎలక్ట్రాన్ల పంచుకొని సంయోజనీయ బంధాలను ఏర్పరచును.
ఉదా : 1) H2(వా) + F2(వా) → 2HF(వా)
2) 2Li(ఘ)+ H2(వా) → 2LiH
![]()
ప్రశ్న 4.
a) క్లోరిన్, b) సోడియం లోహంలతో డైహైడ్రోజన్ చర్య జరిపితే ఏమవుతుంది? వివరించండి.
జవాబు:
a) డైహైడ్రోజన్లో క్లోరిన్ చర్య :
డై హైడ్రోజన్ క్లోరిన్తో చర్య జరిపి హైడ్రోజన్ క్లోరైడ్ను ఏర్పరచును. ఈ చర్య సూర్యకాంతి సమక్షంలో జరుగును.
![]()
b) సోడియం లోహంతో చర్య :
డై హైడ్రోజన్ అధిక చర్యశీలత గల సోడియంతో చర్య జరిపి సోడియం హైడ్రైడ్ను ఏర్పరచును.
![]()
ప్రశ్న 5.
భారజలం పై ఒక వ్యాఖ్యను రాయండి.
జవాబు:
డ్యుటీరియం ఆక్సైడ్ను భారజలం అంటారు.
తయారీ :
భారజలాన్ని సాధారణ జలంను విద్యుద్విశ్లేషణ చేసి పొందవచ్చు.
- మోలార్ ద్రవ్యరాశి, ద్రవీభవన స్థానం, బాష్పీభవన స్థానం లాంటి భౌతిక ధర్మాలు భారజలంకు నీటికంటే ఎక్కువగా ఉంటాయి.
- కానీ డై ఎలక్ట్రిక్ స్థిరాంకం, ద్రావణీయత భారజలంకు నీటి కంటే తక్కువ.
రసాయన ధర్మాలు :
1. వినిమయ చర్యలు :
భారజలం వివిధ సమ్మేళనాలలోని ‘H’ పరమాణువులను పూర్తిగా గాని లేక పాక్షికంగా గాని భార హైడ్రోజన్తో ప్రతిక్షేపిస్తుంది. ఇట్టి చర్యలనే వినిమయ చర్యలు అంటారు.
ఉదా : HCl + D2O → DCl + HDO
2. డ్యుటిరాలిసిస్ :
సాధారణ జలం వలె భారజలం కూడా కొన్ని లవణాలను జలవిశ్లేషణ చెందిస్తుంది. దీనిని డ్యుటిరాలిసిస్
అంటారు.
ఉదా : AlCl3 + 3D2O → Al(OD)3 + 3DCl
3. డ్యుటిరేట్లను ఇచ్చుట :
సాధారణ జలం వలె, భారజలం కూడా కొన్ని లవణాలలో స్ఫటిక జలంగా ఉంటుంది. వీటినే డ్యుటిరో హైడ్రేటులు అంటారు.
ఉదా : CuSO4. 5D2O, MgSO4.D2O
ఉపయోగాలు :
- న్యూక్లియర్ రియాక్టర్లలో మితకారిగా ఉపయోగిస్తారు.
- మొక్కలు, జంతువులలో జరిగే చర్యల అధ్యయనానికి ట్రేసర్ విధానంలో ట్రేసర్గా ఉపయోగిస్తారు.
- క్రిమిసంహారిణిగాను, సూక్ష్మసంహారిణిగాను ఉపయోగిస్తారు.
ప్రశ్న 6.
హైడ్రోజన్ ఐసోటోపుల పేర్లను తెలపండి. ఈ ఐసోటోపుల ద్రవ్యరాశుల నిష్పత్తి ఏమిటి ?
జవాబు:
హైడ్రోజన్ ఐసోటోపులు :
ప్రోటియం (1H¹ లేక P), డ్యుటీరియం (1H² లేక D) మరియు ట్రిటియం (1H³ లేక T).
- ట్రిటియం రేడియోధార్మిక ఐసోటోప్.
- ఈ ఐసోటోప్ల ద్రవ్యరాశుల నిష్పత్తి : 1 : 2 : 3 (P : D : T)
- ప్రోటియంలో న్యూట్రాన్లు లేవు. డ్యుటీరియంలో ఒకటి, ట్రిటియంలో రెండు న్యూట్రాన్లు కలవు.
ప్రశ్న 7.
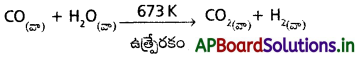
“వాటర్ గ్యాస్ షిప్” చర్య అంటే ఏమిటి? ఈ చర్యతో హైడ్రోజన్ తయారీని ఎట్లా పెంచగలరు?
జవాబు:
CO మరియు H2 ల మిశ్రమాన్ని జలవాయువు (వాటర్ గ్యాస్) అంటారు. దీనినే సిస్ గ్యాస్ అంటారు.
“వాటర్ గ్యాస్ షిఫ్ట్ చర్య” :
సిగ్గ్యాస్ మిశ్రమంలోని CO, ఐరన్ క్రోమేట్ ఉత్ప్రేరక సమక్షంలో చర్య జరుపుటను వాటర్ గ్యాస్ షిఫ్ట్ చర్య అంటారు.
ఈ చర్య ద్వారా డైహైడ్రోజన్ ఉత్పత్తి పెంచవచ్చు.
ప్రశ్న 8.
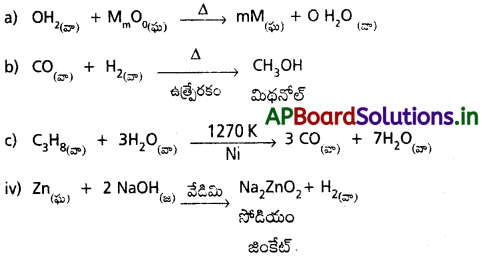
కింది చర్యలను పూర్తిచేసి, తుల్యం చేయండి.
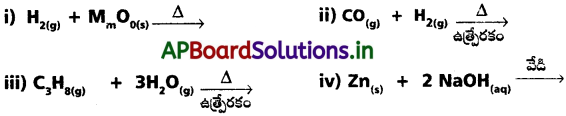
జవాబు:
ప్రశ్న 9.
13వ గ్రూపు మూలకాలు ఏర్పరచే హైడ్రేడ్ల స్వభావం ఏమిటి ?
జవాబు:
- 13వ గ్రూపు మూలకాలు p-బ్లాకుకు చెందుతాయి.
- ఇవి సంయోజనీయ (లేదా) అణు హైడ్రైడ్లను ఏర్పరుస్తాయి.
- ఈ అణు హైడ్రైడ్లు మూడు రకాలుగా కలవు.
1) ఎలక్ట్రాన్ న్యూనత హైడ్రైడ్లు
2) ఎలక్ట్రాన్ ఖచ్చిత హైడ్రైడ్లు
3) ఎలక్ట్రాన్ అధిక హైడ్రైడ్లు - 13వ గ్రూపు మూలకాలు ఎలక్ట్రాన్ న్యూనత హైడ్రేడ్లను ఏర్పరుస్తాయి. వీటిలో లూయీ నిర్మాణం వ్రాయుటకు అవసరమగు ఎలక్ట్రాన్లు ఉండవు.
- ఇవి లూయీ ఆమ్లాలుగా పనిచేస్తాయి. ఇవి ఎలక్ట్రాన్ జంటను స్వీకరించి సమన్వయ సంయోజనీయ బంధాలు ఏర్పరుస్తాయి.
![]()
ప్రశ్న 10.
సంశ్లేషిత రెజిన్ పద్ధతి, అయాన్ వినిమయ రెజిన్ పద్ధతుల్లో జలకాఠిన్యతను తొలగించడానికి ఉపయోగించే సూత్రాన్ని, పద్ధతిని వివరించండి.
జవాబు:
సంశ్లేషిత అయాన్ – వినిమయ రెజిన్ పద్ధతి :
- ప్రస్తుత రోజులలో ఈ పద్ధతిని కఠిన జలాన్ని సాధుజలంగా మార్చుటకు ఎక్కువగా ఉపయోగిస్తున్నారు.
- ఈ పద్ధతిలో సంశ్లేషక రెజిన్లు వాడుతారు. ఇది పర్మిట్ పద్ధతి కంటే ఉపయోగకరమైనది.
సూత్రం :
కఠిన జలాన్ని కాటయాన్, ఆనయాన్ గొట్టాల ద్వారా పంపుతూ అయాన్రహిత నీటిని ఏర్పరుచుట.
అయాన్రహిత నీరు అనగా ఎటువంటి ఖనిజ లవణాలు లేని నీరు.
విధానం : ఈ పద్ధతి రెండు దశలలో జరుగును.
Step – I : కాటయాన్ మార్పిడి పద్ధతి.
Step – II : ఆనయాన్ మార్పిడి పద్ధతి.
Step – I : కాటయాన్ మార్పిడి పద్ధతి:
- ఈ పద్ధతిలో – SO3Hసమూహం కలిగిన పెద్ద కర్బన అణువులు సంశ్లేషక రెజిన్లు (R – SO3H)
R = ఆల్కైల్ సమూహం. - మొట్టమొదట సంశ్లేషక రెజిన్ NaCI తో చర్య జరిపి RNaగా మారును.
- ఈ RNa, కఠినజలంలోకి Ca+2 మరియు Mg+2 అయాన్లను మార్పిడి చేసి సాధుజలంగా మారును.
2 Na(ఘ) + M+2(జ) → R2M(ఘ) + 2 Na+(జ) - NaCl జల ద్రావణం ఉపయోగించి రెజిన్ ను పునరుత్పత్తి చేయవచ్చు.
- ఈ దశలో H+ అయాన్లు ఏర్పడును.
2 RH(ఘ) + M+2(జ) → MR2M(ఘ) + 2 H+(జ)
Step – II : ఆనయాన్ మార్పిడి పద్ధతి:
ఈ పద్ధతిలో RNH3OH ను సంశ్లేషక రెజిన్ గా వాడతారు.
రెజిన్కు సంబంధించిన Cl–, SO-24, HCO–3 లు OH అయాన్లను మార్పిడి చేయును.
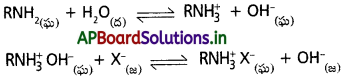
పైన ఏర్పడిన H+ మరియు OH– అయాన్లు చర్య జరిపి అయాన్ రహిత జలం ఏర్పడును.
![]()
ప్రశ్న 11.
ఇంధనంగా హైడ్రోజన్ ఉపయోగాన్ని గురించి కొన్ని వాక్యాలు రాయండి. [Mar. ’13]
జవాబు:
- కోల్గ్యాస్, వాటర్ గ్యాస్ల రూపంలో హైడ్రోజను పారిశ్రామిక ఇంధనంగా వాడతారు.
- ఆక్సీహైడ్రోజన్ బ్లోటార్చ్ సహాయంతో ప్లాటినం, క్వార్ట్జ్ మొదలగువానిని కరిగించటం, వెల్డింగ్ చేయటం చేస్తారు.
- కార్బొరేటెడ్ వాటర్ గ్యాస్, సెమీవాటర్ గ్యాస్లను కూడా ఇంధనంగా ఉపయోగిస్తారు.
- హైడ్రోజన్ను విద్యుత్ శక్తిని ఉత్పత్తి చేయుటకు ఇంధన ఘటాలతో ఉపయోగిస్తారు.
- చతుర్చక్ర వాహనాలలో 5% హైడ్రోజన్ ఉన్న CNG ని ఉపయోగిస్తారు.
ప్రశ్న 12.
1% H2O2 ద్రావణాన్ని మీకు ఇచ్చాం. దాని నుంచి శుద్ద H2O2ని తయారుచేయడానికి మీరు ఏమి చర్యలను తీసుకుంటారు?
జవాబు:
ఇవ్వబడిన 1% H2O2 నుండి శుద్ధ H2O2 ను క్రింది విధంగా పొందవచ్చు.
Step – I :
తగ్గించిన పీడనం వద్ద ఇవ్వబడిన 1% H2O2 ద్రావణాన్ని జాగ్రత్తగా నీరు ఉన్న పాత్రలో వేడిచేయవలెను. ఇచ్చట 30% H2O2 ఏర్పడును.,
Step – II :
పై దశలోని ద్రావణాన్ని స్వేదన కుప్పెలో తక్కువ పీడనం వద్ద అనగా 15మి.మీ. పీడనం వద్ద వేడిచేయవలెను. ఇచ్చట 85% H2O2 ఏ ద్రావణం ఏర్పడును.
Step – III :
పై దశలోని నమూనాను ఘనీభవనం చేసి H2O2 స్ఫటికాలను పొందవచ్చు. ( శుద్ధత ≅ 100%).
![]()
ప్రశ్న 13.
ఆధునిక కాలంలో H2O2 కి ఏవైనా మూడు ఉపయోగాలను చెప్పండి.
జవాబు:
- గాయాలను శుభ్రపరచడానికి ఉపయోగిస్తారు.
- సిల్కు, దంతాలు, ఉన్ని మొదలైన వానిని విరంజనం చేయడానికి ఉపయోగిస్తారు.
- ప్రయోగశాలలో ఆక్సీకరణిగా ఉపయోగిస్తారు.
- ఎక్కువ గాఢత గల H2O2 ద్రావణాన్ని రాకెట్లలో ఇంధనంగా వాడతారు.
- H2O2 ను హరిత రసాయనశాస్త్రంలో కాలుష్యాన్ని తగ్గించుటకు ఉపయోగిస్తారు.
- అధిక నాణ్యత గల డిటర్జెంట్ల తయారీలో వాడుతారు.
- ఆహార ఉత్పత్తులు, ఔషధ పరిశ్రమలలో ఉపయోగిస్తారు.
దీర్ఘ సమాధాన ప్రశ్నలు
ప్రశ్న 1.
వ్యాపార సరళిలో డైహైడ్రోజన్ని తయారుచేయడంపై ఒక వ్యాసం రాయండి. తుల్య సమీకరణాలను ఇవ్వండి.
జవాబు:
వ్యాపార సరళిలో డై హైడ్రోజన్ తయారీ
i) హైడ్రోకార్బన్ల నుండి :
హైడ్రో కార్బన్ల ఉత్ప్రేరక సమక్షంలో నీటి ఆవిరితో చర్య జరిపి హైడ్రోజన్ ను ఏర్పరచును.

ii) నీటిని విద్యుత్ విశ్లేషణ చేయుట :
ఆమ్లీకృత(లేదా) క్షారీకృత నీటిని విద్యుద్విశ్లేషణ చేసి హైడ్రోజన్ వాయువును ఏర్పరచును .

iii) నెల్సన్ పద్ధతి :
బ్రైన్ ద్రావణాన్ని విద్యుద్విశ్లేషణ చేయుట ద్వారా H2 ను పొందవచ్చు.
2NaCl → 2Na+ + 2Cl–
2Cl– → Cl2 + 2e–(ఆనోడ్)
2H2O + 2e– → H2 + 2OH–(కాథోడ్)
2Na+ + 20H– → 2 NaoH
iv) అత్యంత శుద్ధ డై హైడ్రోజన్ న్ను వేడి Ba(OH)2 జలద్రావణాన్ని విద్యుద్విశ్లేషణ చేయగా ఏర్పడును.
v) సిన్ గ్యాస్ నుండి : సిన్ గ్యాస్ నుండి డై హైడ్రోజను ఉత్పత్తి చేయవచ్చు.
![]()
ప్రశ్న 2.
i) N2
ii) లోహ అయాన్లు, లోహ ఆక్సైడ్లు
iii) కర్బన సమ్మేళనాలు.
వీటితో చర్యలను బట్టి డైహైడ్రోజన్ రసాయనశాస్త్రాన్ని వివరించండి.
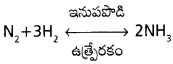
జవాబు:
i) నైట్రోజన్, హైడ్రోజన్ వాయువులను 450°C, 500°C వద్ద 250 అట్మా పీడనంలో చర్య జరిపిస్తే అమ్మోనియా ఏర్పడుతుంది.
ii) a) లోహ అయాన్లతో చర్య :
లోహ అయాన్లను జలద్రావణంలో లోహాలుగా హైడ్రోజన్ క్షయకరణం చెందించును.
H2 + Pd+2 → Pd + 2H+
b) లోహ ఆక్సైడ్లతో చర్య : లోహ ఆక్సైడ్లను లోహాలుగా క్షయకరణం చెందించును.
WO3 + 3H2 → W + 3H2O
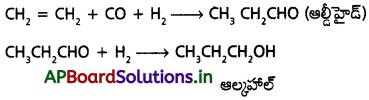
iii) కర్బన సమ్మేళనాలతో చర్య :
ఆల్కీన్లు హైడ్రోఫార్మాయిలేషన్ జరిపి ఆల్డిహైడ్లను ఏర్పరచును. ఈ ఆల్డీహైడ్లు క్షయకరణ జరిపి ఆల్కహాల్లుగా మార్చును.
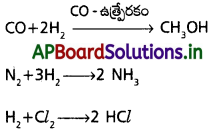
పారిశ్రామిక రసాయనాల తయారీ :
డై హైడ్రోజన్ పారిశ్రామిక రసాయనాలైన CH3OH, NH3, HCl ల తయారీలో ఉపయోగపడును.
ప్రశ్న 3.
కింది వాటిని సరైన ఉదాహరణలతో వివరించండి. [Mar. ’14]
i) ఎలక్ట్రాన్ కొరత గల హైడ్రైడ్లు
ii) ఎలక్ట్రాన్లు కచ్చితంగా ఉన్న హైడ్రైడ్లు
iii) ఎలక్ట్రాన్లు అధికంగాగల హైడ్రైడ్లు
జవాబు:
i) ఎలక్ట్రాన్ కొరత హైడ్రైడ్లు :
ఏ అణు హైడ్రైడ్లలో అయితే లూయీ నిర్మాణాన్ని వ్రాయుటకు అవసరమైన వేలన్సీ ఎలక్ట్రాన్లు ఉండవో అటువంటి అణు హైడ్రైడ్లను ఎలక్ట్రాన్ కొరత హైడ్రైడ్లు అంటారు.
ఉదా : (AlH3)n, B2H6 మొదలగునవి.
ii) ఎలక్ట్రాన్ ఖచ్చిత హైడ్రైడ్లు :
ఏ అణు హైడ్రేడ్లలో అయితే లూయి నిర్మాణాన్ని వ్రాయుటకు సరిగా అవసరమగు వేలన్సీ ఎలక్ట్రాన్లు ఉంటాయో ఆ అణు హైడ్రైడ్లను ఎలక్ట్రాన్ ఖచ్చిత హైడ్రైడ్లు అంటారు.
ఉదా : CH4 C2H6 మొదలగునవి.
iii) ఎలక్ట్రాన్ అధిక హైడ్రేడ్లు :
ఏ అణు హైడ్రైడ్లలో అయితే లూయీ నిర్మాణాన్ని వ్రాయుటకు అవసరమగు వేలన్సీ ఎలక్ట్రాన్ల కంటే అధికంగా ఉంటాయో ఆ అణుహైడ్రైడ్లను ఎలక్ట్రాన్ అధిక హైడ్రైడ్లు అంటారు.
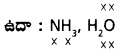
ప్రశ్న 4.
i) అయానిక హైడ్రైడ్లు ii) అల్పాంతరాళ హైడ్రైడ్ల గూర్చి క్లుప్తంగా రాయండి.
జవాబు:
i) అయానిక హైడ్రేడ్లు :
- వీటినే లవణాల వంటి హైడ్రైడ్లు అంటారు. (సాలైన్ హైడ్రైడ్లు)
- s – బ్లాకు మూలకాలు ఈ హైడ్రేడ్లను ఏర్పరుస్తాయి.
- ఇవి స్టాయిక్యామెట్రిక్ సమ్మేళనాలు. ఉదా : LiH, NaH మొదలగునవి.
- తయారీ : లోహాన్ని నేరుగా H2 తో సంయోగం ద్వారా పొందవచ్చు.
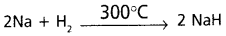
భౌతిక ధర్మాలు :
- ఇవి స్ఫటికా సమ్మేళనాలు అధిక ద్రవీభవనస్థానం కలిగి ఉంటాయి.
- ఇవి ఘన స్థితిలో విద్యుద్వాహకత ప్రదర్శించవు. గలనస్థితిలో ప్రదర్శిస్తాయి.
రసాయన ధర్మాలు :
- ఈ హైడ్రైడ్లను విద్యుద్విశ్లేషణ చేయగా డైహైడ్రోజన్ వాయువును ఏర్పరచును.
2H– → H2 + 2e– (ఆనోడ్) - లిథియం హైడ్రైడ్ నుండి 4A/HA ను తయారు చేయవచ్చు
8LiH + Al2C6 → 2LiAlH6 + 6LiCl - ఈ హైడ్రైడ్లు నీటితో చర్య జరిపి H2 వాయువును ఏర్పరచును.
LiH + H2O → LiOH + H2↑
ii) అల్పాంతరాళ హైడ్రైడ్లు :
d – బ్లాకు లేదా f – బ్లాకు మూలకాలు హైడ్రోజన్తో సంయోగం చెంది అల్పాంతరాళ హైడ్రేడ్లను ఏర్పరచును.
ఉదా : CrH, CrH2, ZnH2
- వీటినే లోహ హైడ్రైడ్లు అంటారు. ఈ హైడ్రైడ్లలో లోహజాలకంలోని అల్పాంతరాళాలలో హైడ్రోజన్ ఆక్రమణ జరుగును.
- లోహము కంటే లోహ హైడ్రైడ్క విద్యుద్వాహకత తక్కువ.
- 7, 8 మరియు 9 గ్రూపు మూలకాలు ఈ హైడ్రైడ్లను ఏర్పరచవు. 6వ గ్రూపులో క్రోమియం మాత్రమే ఏర్పరచును.
![]()
ప్రశ్న 5.
నీటి రసాయన ధర్మాలను ఏ నాలుగింటినైనా విశదీకరించండి.
జవాబు:
i) జలవిశ్లేషణ :
ఏదేని సమ్మేళనంలో నీరు రసాయన చర్య జరుపుటను జలవిశ్లేషణ అంటారు.
అధిక డై ఎలక్ట్రిక్ స్థిరాంకం వలన హైడ్రేటింగ్ సామర్థ్యం నీటికి ఎక్కువ.
ii) హైడ్రోజన్ ఏర్పడుట :
ధనవిద్యుదాత్మక మూలకాలతో నీరు చర్య జరిపి డైహైడ్రోజన్ ను ఏర్పరచును.
2Na + 2H2O. → 2NaOH + H2
iii) కిరణజన్య సంయోగ క్రియ :
కిరణజన్య సంయోగక్రియలో నీరు ఆక్సిజన్ గా మారును.
6CO2 + 6H2O → C6H12O6 + 6O2
iv) హైడ్రేట్లను ఏర్పరచుట :
లవణాలు స్పటికీకరణంలో నీటి అణువుల ద్వారా హైడ్రేట్ లవణాలను ఏర్పరచవచ్చు.
ఉదా : BaCl2.2H2O, CuSO4. 5H2O
ప్రశ్న 6.
కఠినజలం, మృదుజలం అంటే వివరించండి. [T.S. Mar. ’15]
i) అయాన్-వినిమయ పద్ధతి
ii) కాల్గన్ పద్ధతులను నీటి కఠినత్వాన్ని తొలగించడానికి వాడకంపై వ్యాఖ్యను రాయండి. [A.P. Mar. ’15]
జవాబు:
కఠినజలం :
సబ్బుతో త్వరగా నురగను ఏర్పరచని నీటిని కఠినజలం అంటారు. కఠినజలంలో కఠినత్వం ఉంటుంది.
- నీటిలో Ca, Mg లవణాల వలన కఠినత్వం వస్తుంది.
- Ca, Mg బై కార్బొనేట్ల వల్ల అశాశ్వత కాఠిన్యత వస్తుంది.
- Ca, Mg క్లోరైడ్లు, సల్ఫేట్ల వల్ల కఠినత్వం వస్తుంది.
మృదుజలం :
సబ్బుతో త్వరగా నురగను ఏర్పరచే నీటిని మృదుజలం అంటారు.
i) అయాన్ వినిమయ పద్ధతి:
ఈ పద్ధతిని జియొలైట్/ పెరుటిట్ ప్రక్రియ అనికూడా అంటారు. ఆర్ధ సోడియమ్ అల్యూమినియమ్ సిలికేట్ అంటే జియొలైట్/పెరుటిట్, సోడియమ్ అల్యూమినియమ్ సిలికేట్ (NaAlSiO4) ని క్లుప్తంగా చెప్పడం కోసం NaZ అని రాస్తారు. దీనిని కఠిన జలానికి కలిపినప్పుడు వినిమయ చర్యలు జరుగుతాయి.
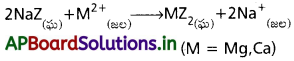
జియొలైట్లో ఉన్న సోడియమ్ అంతా ఖర్చు అయిపోయినప్పుడు అది వ్యయమైపోయింది అని అంటారు. దాన్ని సజల సోడియమ్ క్లోరైడ్ ద్రావణంతో అభిచర్యని జరిపి పునరుత్పత్తి చేస్తారు.
MZ2(ఘ) +2NaCl(జల) → 2NaZ(ఘ) +MCl2(జల)
ii) కాల్గన్ పద్ధతి :
సోడియమ్ హెక్సా మెటాఫాస్ఫేట్ (Na6P6O18) ని వ్యాపార సరళిలో “కాల్గన్” అంటారు. దీనిని కఠినజలానికి కలిపినప్పుడు కింది చర్యలు జరుగుతాయి.
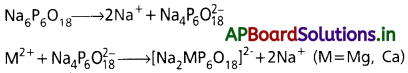
సంక్లిష్ట ఆనయాన్ Mg2+, Ca2+ అయాన్లను ద్రావణంలో ఉంచుతుంది.
ప్రశ్న 7.
హైడ్రోజన్ పెరాక్సైడ్ ఆక్సీకరణిగాను, క్షయకరణిగాను పనిచేయగలదు అనడానికి రసాయన చర్యలను రాసి సమర్థించండి.
జవాబు:
ఆక్సీకరణ ధర్మాలు :
1) నల్లని లెడ్ సల్ఫైడు తెల్లని లెడ్ సల్ఫేటుగా ఆక్సీకరణం చెందిస్తుంది.
PbS + 4H2O2 → PbSO4 + 4H2O
2) ఫెర్రస్ లవణాలను ఆమ్ల ద్రావణంలో ఫెర్రిక్ లవణాలుగా ఆక్సీకరణం చెందిస్తుంది.
2FeSO4 + H2SO4 + H2O2 → Fe2(SO4)3 + 2H2O
3) అయొడైడ్ లవణాల నుండి అయొడిన్ ను విడుదల చేస్తుంది.
2KI + H2SO4 + H2O2 → K2SO4 + 2H2O + I2
క్షయకరణ ధర్మాలు :
1) క్లోరిన్, బ్రోమిన్లను హైడ్రోజన్ క్లోరైడ్, హైడ్రోజన్ బ్రోమైడ్లుగా క్షయకరణం చెందిస్తుంది.
Cl2 + H2O2 → 2HCl + O2; Br2 + H2O2 → 2HBr + O2
2) సిల్వర్ ఆక్సైడ్ను సిల్వర్గా క్షయకరణం చెందిస్తుంది.
Ag2O + H2O2 → 2Ag + H2O + O2
3) ఓజోన్ ను, ఆక్సిజన్గా క్షయకరణం చెందిస్తుంది.
O3 + H2O2 → 2O2 + H2O
ప్రశ్న 8.
కింది రసాయన చర్యలను పూర్తి చేసి తుల్యం చేయండి.
i) PbS(ఘ) + H2O2 (జల)
ii) Mv O–4 (జల) + H2O2(జల) →
iii) CaO(ఘ) + H2O(వా) →
iv) Ca,N,(ఘ) + H2O(ద్ర) →
పై చర్యలను (a) జలవిశ్లేషణ, (b) ఆక్సీకరణ-క్షయకరణ (c) హైడ్రేషన్ చర్యలుగా వర్గీకరించండి.
జవాబు:

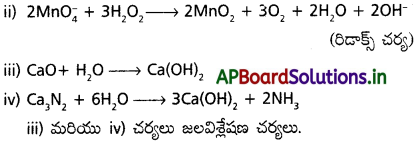
![]()
ప్రశ్న 9.
హైడ్రోజన్ పెరాక్సైడ్ని తయారుచేయడానికి వివిధ పద్ధతులను వాటికి అనువైన రసాయన సమీకరణాలతో చర్చించండి. వీటిలో ఏ పద్దతి H2O2 ని తయారుచేయడానికి ఉపయోగపడుతుంది ?
జవాబు:
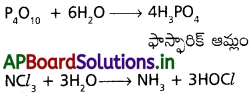
H2O2 తయారీ పద్ధతులు
i) ఆమ్లీకృత BaO2 నుండి అధిక నీటిని తొలగించి H2O2 ను తయారు చేయవచ్చు.
BaO2. 8H2O + H2SO → BaSO4 + H2O2 + 8H2O
ii) స్వయం ఆక్సీకరణ పద్ధతి:
2-ఇథైల్ ఆంత్రా క్వినోల్ను స్వయం ఆక్సీకరణం చేయగా H2O2 ఏర్పడును.
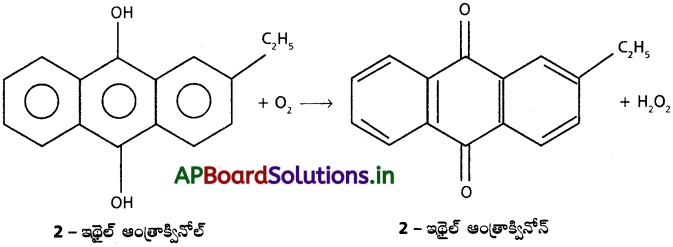
iii) పెరాక్సోడైసల్ఫ్యూరిక్ ఆమ్లం నుండి : 50% H2SO4 ను విద్యుద్విశ్లేషణ చేయగా పెరాక్సోడైసల్ఫ్యూరిక్ ఆమ్లం ఏర్పడును. దీనిని జలవిశ్లేషణ చేయగా H2O2 ఏర్పడును.
2HSO–4 → H2S2O8 → 2HSO–4 + 2H+ + H2O2
D2O2 తయారీ :
K2S2O8 ను భారజలంతో చర్య జరుపగా D2O2 ఏర్పడును.
K2S2O8 + 2D2O → 2KDSO4 + D2O2
ప్రశ్న 10.
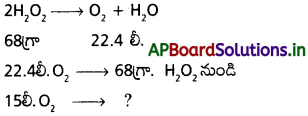
H2O2 గాఢతని ఎన్ని రకాలుగా మీరు చెప్పగలరు? 15 ఘనపరిమాణ H2O2 గాఢతని gL-1 లలో లెక్కగట్టండి. ఈ గాఢతను నార్మాలిటీ, మొలారిటీలలో తెలియజేయండి.
జవాబు:
H2O2 గాఢతను రెండు విధాలుగా చెప్పవచ్చును. 1) మొలారిటీ 2) నార్మాలిటీ
సమస్యసాధన :
→ 15ఘనపరిమాణ H2O2 ద్రావణం అనగా 1లీ. H2O2 15 లీ. O2STP వద్ద ఏర్పరుచును.

సాధించిన సమస్యలు (Solved Problems)
ప్రశ్న 1.
(i) క్లోరిన్, (ii) సోడియమ్, (iii) కాపర్ (ii) ఆక్సైడ్లతో హైడ్రోజన్ చర్యలపై వ్యాఖ్యానించండి.
సాధన:
(i) హైడ్రోజన్తో క్లోరిన్ చర్యలో హైడ్రోజన్ క్లోరైడ్ ఏర్పడుతుంది. H, Cl ల మధ్య ఒక ఎలక్ట్రాన్ జంటను పంచుకోవడంతో సమయోజనీయ అణువు ఏర్పడటానికి దారితీస్తుంది.
(ii) సోడియమ్ హైడ్రోజన్ను సోడియమ్ హైడ్రైడ్గా క్షయీకరిస్తుంది. Na నుంచి H కు ఒక ఎలక్ట్రాన్ బదిలీ అవుతుంది. Na+H– అయానిక సమ్మేళనం ఏర్పడుతుంది.
(iii) హైడ్రోజన్ కాపర్ (II) ఆక్సైడ్ను కాపర్గా క్షయీకరిస్తుంది. కాపర్ సున్నా ఆక్సిడేషన్ స్థితిలో ఉంటుంది. హైడ్రోజన్ H2O గా ఆక్సీకరణం చెందుతుంది. H2O ఒక సమయోజనీయ అణువు.
ప్రశ్న 2.
H2O బాష్పీభవనస్థానం H2S కంటే ఎక్కువ. కారణాలు చెప్పండి.
సాధన:
అణుభారం ప్రకారం H2O బాష్పీభవనస్థానం H2S కంటే తక్కువ ఉండాలి అనుకొంటాం. కానీ రుణ విద్యుదాత్మకత ఎక్కువ కాబట్టి దాని హైడ్రైడ్ H2O లో హైడ్రోజన్ బంధ పరిమాణం చాలా చెప్పుకోదగినంత ఉంటుంది. కాబట్టి H2O బాష్పీభవనస్థానం H2S బాష్పీభవన స్థానం కంటే ఎక్కువ ఉంటుంది.
ప్రశ్న 3.
CuSO4, 5H2O లో హైడ్రోజన్ బంధిత జలాణువులు ఎన్ని ఉంటాయి?
సాధన:
కోఆర్డినేషన్ క్షేత్రం బయట ఉన్న ఒక్క జలాణువు మాత్రమే హైడ్రోజన్ బంధితజలం. మిగిలిన నాలుగు జలాణువులు సమన్వయ సమయోజనీయ జలాణువులు.
![]()
ప్రశ్న 4.
10 ఘనపరిమాణ హైడ్రోజన్ పెరాక్సైడ్ ద్రావణం గాఢతను లెక్క కట్టండి.
సాధన:
10 ఘనపరిమాణ H2O2 ద్రావణం అంటే IL H2O2 ద్రావణం STP వద్ద 10l ల ఆక్సిజన్ని ఇస్తుందని అర్థం.
2H2O2(ద్ర) → O2(వా) + H2O(ద్ర)
2 × 34g 22.4 L. STP వద్ద = 68 g
పై సమీకరణాన్ని బట్టి 22.4 l ల O2 ని 68g. H2O2 STP వద్ద ఏర్పరుస్తుంది.
10 ≈ ల O2 వద్ద STP రావాలంటే \(\frac{68 \times 10}{22.4}\) g. ల H2O2 కావాలి.
= 30.36 g ≈ 30 g. H2O2
కాబట్టి 10 volume H2O2 ద్రావణం గాఢత = 30.36 gl-1 = 3% H2O2 ద్రావణం.