Andhra Pradesh BIEAP AP Inter 2nd Year Chemistry Study Material 7th Lesson d,f – బ్లాక్ మూలకాలు & సమన్వయ సమ్మేళనాలు Textbook Questions and Answers.
AP Inter 2nd Year Chemistry Study Material 7th Lesson d,f – బ్లాక్ మూలకాలు & సమన్వయ సమ్మేళనాలు
అతిస్వల్ప సమాధాన ప్రశ్నలు
ప్రశ్న 1.
పరివర్తన మూలకాలు అంటే ఏమిటి? ఉదాహరణలు ఇవ్వండి.
జవాబు:
ఏ మూలకాలలో అయితే మూలక స్థితిలో కానీ, అయానిక స్థితిలో కానీ పాక్షికంగా నిండిన d-ఆర్బిటాళ్ళు కలిగి ఉంటాయో వాటిని పరివర్తన మూలకాలు అంటారు. ఉదా : Mn, Co, Ag మొదలైనవి.
ప్రశ్న 2.
3d, 4d, 5d శ్రేణులలో ఏయే మూలకాలను పరివర్తన మూలకాలుగా పరిగణించరు? ఎందువల్ల?
జవాబు:
Zn (3d-శ్రేణి), Cd (4d-శ్రేణి), Hg (5d-శ్రేణి) మూలకాలను పరివర్తన మూలకాలుగా పరిగణించరు. దీనికి కారణం వీటిలో పూర్తిగా నిండిన d-ఆర్బిటాళ్ళు కలిగి ఉండటమే.
ప్రశ్న 3.
d-బ్లాక్ మూలకాలను పరివర్తన మూలకాలు అని ఎందుకు పిలుస్తారు?
జవాబు:
d-బ్లాకు మూలకాలను పరివర్తన మూలకాలు అంటారు. దీనికి కారణం వాటి ధర్మాలు ధనవిద్యుదాత్మకత గల S-బ్లాక్ మూలకాలకు మరియు ఋణ విద్యుదాత్మకత గల p-బ్లాక్ మూలకాలకు మధ్య పరివర్తనం చెందటం.
ప్రశ్న 4.
పరివర్తన మూలకాల సాధారణ ఎలక్ట్రాన్ విన్యాసాన్ని రాయండి.
జవాబు:
పరివర్తన మూలకాల సాధారణ ఎలక్ట్రాన్ విన్యాసం (n – 1)d1-10 ns1-2
ప్రశ్న 5.
పరివర్తన మూలకాల ఎలక్ట్రాన్ విన్యాసానికి, పరివర్తన మూలకాలు కాని వాటి విన్యాసంతో ఏవిధమైన భేదం ఉంటుంది?
జవాబు:
- పరివర్తన మూలకాల సాధారణ ఎలక్ట్రాన్ విన్యాసం (n – 1) d1-10 ns1-2
- పరివర్తన మూలకాలు కాని వాటి సాధారణ ఎలక్ట్రాన్ విన్యాసం (n – 1)d1-10 ns².
ప్రశ్న 6.
క్రోమియమ్ (Cr), కాపర్ (Cu) ల ఎలక్ట్రాన్ విన్యాసాలను రాయండి.
జవాబు:
- క్రోమియం (Cr) యొక్క ఎలక్ట్రాన్ విన్యాసం – [Ar]4s¹3d5.
- కాపర్ (Cu) యొక్క ఎలక్ట్రాన్ విన్యాసం – [Ar] 4s¹3d10.
![]()
ప్రశ్న 7.
పరివర్తన మూలకాలు విలక్షణ ధర్మాలు ప్రదర్శించడానికి కారణం ఏమిటి?
జవాబు:
పాక్షికంగా నిండిన d-ఆర్బిటాళ్లు కలిగి ఉండుట వలన పరివర్తన మూలకాలు బహుళ ఆక్సీకరణ స్థితి, రంగు ధర్మం, అయస్కాంత ధర్మం, సంక్లిష్ట సమ్మేళనాలను ఏర్పరచే సామర్థ్యం వంటి అభిలాక్షణిక (లేదా) విలక్షణ ధర్మాలను ప్రదర్శిస్తాయి.
ప్రశ్న 8.
స్కాండియమ్ పరివర్తన మూలకం. కానీ జింక్ కాదు. ఎందువల్ల?
జవాబు:
స్కాండియమ్ ఎలక్ట్రాన్ విన్యాసం – [Ar] 4s²3d¹.
జింక్ ఎలక్ట్రాన్ విన్యాసం – [Ar] 4s²3d10.
స్కాండియంలో ఒక ఒంటరి ఎలక్ట్రాన్ కలదు. కానీ జింక్లో ఒంటరి ఎలక్ట్రాన్లు లేవు. కావున స్కాండియం పరివర్తన మూలకం కానీ జింక్ కాదు.
ప్రశ్న 9.
సిల్వర్లో d10 విన్యాసం ఉన్నప్పటికీ, దానిని పరివర్తన మూలకంగా పరిగణిస్తారు. ఎందువల్ల?
జవాబు:
సిల్వర్లో d10విన్యాసం ఉన్నప్పటికి దానిని పరివర్తన మూలకంగా పరిగణిస్తారు. ఎందువలన అనగా ఇది పరివర్తన మూలకాల సాధారణ ఎలక్ట్రాన్ విన్యాసాన్ని సూచిస్తుంది. (n – 1) d1-10 ns1-2 [Ag-4d105s¹]
ప్రశ్న 10.
Co2+, Mn2+ ల ఎలక్ట్రాన్ విన్యాసాన్ని రాయండి.
జవాబు:
- Co2+ యొక్క ఎలక్ట్రాన్ విన్యాసం – [Ar] 4s0 3d7
- Mn2+ యొక్క ఎలక్ట్రాన్ విన్యాసం – [Ar] 4s0 3d5.
ప్రశ్న 11.
+3స్థితికి ఆక్సీకరణం చెందడానికి Mn2+ సమ్మేళనాలకు, Fe2+ సమ్మేళనాల కంటే ఎక్కువ స్థిరత్వం ఉంటుంది. ఎందుకు?
జవాబు:
Mn2+ ఎలక్ట్రాన్ విన్యాసం – [Ar] 4s0 3d5.
Fe2+ ఎలక్ట్రాన్ విన్యాసం – [Ar] 4s0 3d6.
Mn2+ నందు సగం నిండిన d-ఆర్బిటాళ్లు కలవు. కావున + 3 స్థితికి ఆక్సీకరణం చెందడానికి Mn 2 సమ్మేళనాలకు, Fe2+ సమ్మేళనాల కంటే ఎక్కువ స్థిరత్వం ఉంటుంది.
ప్రశ్న 12.
మొదటి పరివర్తన శ్రేణిలో ఏ లోహం తరచుగా +1 ఆక్సీకరణ స్థితిని ప్రదర్శిస్తుంది? ఎందువల్ల?
జవాబు:
మొదటి పరివర్తన శ్రేణిలో కాపర్ లోహం తరచుగా +1 ఆక్సీకరణ స్థితి ప్రదర్శిస్తుంది. దీనికి కారణం Cu+ యొక్క ఎలక్ట్రాన్ విన్యాసం ([Ar] 4s03d10) లో పూర్తిస్థాయిలో నిండిన 3d-ఆర్బిటాళ్ళు కలిగి ఉండటం. ఇది స్థిరమైనది.
![]()
ప్రశ్న 13.
పరివర్తన మూలకాలు ఒకటి కంటే ఎక్కువ ఆక్సీకరణ స్థితులు (బహుళ ఆక్సీకరణ స్థితులు ప్రదర్శిస్తాయి. ఎందుకు?
జవాబు:
పరివర్తన మూలకాలు ఒకటి కంటే ఎక్కువ ఆక్సీకరణ స్థితులు ప్రదర్శిస్తాయి.
కారణం :
(n – 1) d ఆర్బిటాల్క ns ఆర్బిటాల్క మధ్య శక్తి భేదం చాలా తక్కువగా ఉంటుంది. దీని వలన రెండు ఆర్బిటాళ్ళ నుండి ఎలక్ట్రాన్లు కోల్పోతాయి.
ప్రశ్న 14.
స్కాండియమ్ (Sc) పరివర్తన మూలకం అయినప్పటికీ, అది బహుళ ఆక్సీకరణ స్థితులు ప్రదర్శించదు. ఎందువల్ల?
జవాబు:
స్కాండియం ఎలక్ట్రాన్ విన్యాసం [Ar] 4s²3d¹. దీనిలో కేవలం ఒక ఒంటరి ఎలక్ట్రాన్ మాత్రమే కలదు. కావున అది బహుళ ఆక్సీకరణ స్థితులు ప్రదర్శించదు.
ప్రశ్న 15.
ఎందువల్ల Ni, Cu, Zn లలో M3+ ఆక్సీకరణ స్థితిని పొందడం కష్టం?
జవాబు:
Ni ఎలక్ట్రాన్ విన్యాసం [Ar] 4s²3d8
Ni2+ ఎలక్ట్రాన్ విన్యాసం [Ar] 4s03d8
Ni2+ నుండి ఎలక్ట్రాన్ తొలగించుటకు కష్టతరం. ఎందువల్ల అనగా Ni కు అధిక ఋణాత్మక ఆర్ద్రీకరణ ఎంథాల్పీ కలిగి ఉంటుంది. కావున Ni3+ ఏర్పడుట కష్టం
Cu ఎలక్ట్రాన్ విన్యాసం [Ar] 4s¹ 3d10
Cu+ ఎలక్ట్రాన్ విన్యాసం [Ar] 4s03d10
3d10 నుండి ఎలక్ట్రాన్ తొలగించుట కష్టతరం. 3d10 స్థిరమైనది. కావున Cu+3 ఏర్పడుట కష్టం.
Zn ఎలక్ట్రాన్ విన్యాసం [Ar] 4s²3d10
Zn2+ ఎలక్ట్రాన్ విన్యాసం [Ar] 4s03d10
3d10 (స్థిరమైనది) నుండి ఎలక్ట్రాన్ తొలగించుట కష్టతరం. కావున Zn+2 ఏర్పడుట కష్టం.
ప్రశ్న 16.
రెండింటికీ ఒకే విధమైన విన్యాసం ఉన్నప్పటికీ, Cr+2 క్షయకరణి అయితే, Mn3+ ఆక్సీకరణి. ఎందువల్ల?
జవాబు:
Cr+2 అనగా ఎలక్ట్రాన్ విన్యాసం d4 నుండి d³కి మార్పు చెందును. d³ అనేది సగం నిండిన t2gస్థితి. Mn+3 ఆక్సీకరణం చెంది Mn+2 గా మారుతుంది. దీనికి కారణం స్థిరమైన సగం నిండిన ఆర్బిటాళ్లు కలిగి ఉండటం అందువలన Cr+2 క్షయకరణి, Mn+3 ఆక్సీకరణి.
ప్రశ్న 17.
Cr, Mo, W లు ఒకే గ్రూప్కు (గ్రూప్ 6) చెందిన మూలకాలైనప్పటికీ, Cr (VI) బలమైన ఆక్సీకరణి అయితే, Mo (VI), W (VI) లు కావు. ఎందువల్ల?
జవాబు:
6 వ గ్రూపులో Mo (VI), W (VI) లు Cr (VI) కంటే స్థిరమైనవి. కావున ఆమ్ల యానకంలో డైక్రోమేట్ రూపంలో Cr (VI). బలమైన ఆక్సీకరణి కానీ MoO3 మరియు WO3 లు కావు.
![]()
ప్రశ్న 18.
M3+/M+2 ప్రమాణ ఎలక్ట్రోడ్ పొటెన్షియల్ Mn కు సాపేక్షంగా ఎక్కువగా, Fe కు సాపేక్షంగా తక్కువ ఉంటుంది అనే వాస్తవిక విషయం నుంచి మీరు ఏమి గ్రహిస్తారు?
జవాబు:
M3+/M+2 ప్రమాణ ఎలక్ట్రోడ్ పొటెన్షియల్ Mn కు సాపేక్షంగా ఎక్కువగా, Fe కు సాపేక్షంగా తక్కువ ఉంటుంది. దీనికి కారణం Mn యొక్క తృతీయ అయనీకరణ శక్తి చాలా అధికంగా ఉండటం (d5 నుండి d4).
ప్రశ్న 19.
పరివర్తన మూలకాలకు అధిక ద్రవీభవన స్థానాలు ఉంటాయి. ఎండవల్ల?
జవాబు:
పరివర్తన మూలకాల అంతర పరమాణుక లోహ బంధాలలో ns ఎలక్ట్రాన్లతో పాటు (n – 1)d ఎలక్ట్రాన్లు కూడా ఎక్కువ సంఖ్యలో పాల్గొనటం వలన పరివర్తన మూలకాలకు అధిక ద్రవీభవన స్థానాలు కలిగి ఉంటాయి.
ప్రశ్న 20.
మొదటి పరివర్తన శ్రేణి (3d శ్రేణి) లో క్రోమియమ్కు అత్యధిక ద్రవీభవన స్థానం ఉంటుంది. ఎందువల్ల?
జవాబు:
మొదటి పరివర్తన శ్రేణి (3d-శ్రేణి) లో క్రోమియమ్కు అత్యధిక ద్రవీభవన స్థానం ఉంటుంది.
కారణం :
క్రోమియంలోని 3d-ఆర్బిటాల్లోని ఒంటరి ఎలక్ట్రాన్లు ప్రత్యేకించి అంతర పరమాణుక అనుసంధానాలకు అనుకూలిస్తాయి.
ప్రశ్న 21.
S-బ్లాక్ మూలకాలతో పోలిస్తే, పరివర్తన మూలకాలు అధిక పరమాణీకరణ ఎంథాల్పీలను ప్రదర్శిస్తాయి. ఎందువల్ల?
జవాబు:
పరివర్తన మూలకాలలో ఎక్కువ సంఖ్యలో ఒంటరి ఎలక్ట్రాన్లు కలిగి ఉండుట వలన బలమైన అంతర పరమాణుక అనుసంధానాలు ఏర్పడతాయి. వీటి వలన బలమైన బంధాలు ఏర్పడతాయి. దీని ఫలితంగా అధిక పరమాణీకరణ ఎంథాల్పీలను ప్రదర్శిస్తాయి.
ప్రశ్న 22.
మొదటి పరివర్తన శ్రేణిలో (3d శ్రేణి) జింక్కు అత్యల్ప పరమాణీకరణ ఎంథాల్పీ ఉంటుంది. ఎందువల్ల?
జవాబు:
జింక్ అయానిక స్థితిలోకానీ, మూలక స్థితిలో కానీ ఒంటరి ఎలక్ట్రాన్లను కలిగి ఉండదు. అందువలన మొదటి పరివర్తన శ్రేణిలో (3d శ్రేణి) జింక్ అత్యల్ప పరమాణీకరణ ఎంథాల్పీ కలిగి ఉంటుంది.
ప్రశ్న 23.
ఒక శ్రేణిలో పరివర్తన మూలకాల సాంద్రతలు ఏ విధంగా మారతాయని మీరు ఊహిస్తారు? ఎందుకు?
జవాబు:
ఒక శ్రేణిలో పరివర్తన మూలకాల సాంద్రతలు పెరుగుతాయి.
ఉదా : 3d శ్రేణిలో Ti నుండి Cu కు సాంద్రత గణనీయంగా పెరుగుతుంది.
పరమాణు భారం పెరుగుట వలన లోహ వ్యాసార్థం తగ్గి సాంద్రతలు పెరుగుతాయి.
![]()
ప్రశ్న 24.
ఒక శ్రేణిలో పరివర్తన లోహాల పరమాణు, అయానిక పరిమాణాలు ఎలా మారతాయి?
జవాబు:
క్రొత్తగా వచ్చే ఎలక్ట్రాన్ ప్రతీసారి d-ఆర్బిటాల్లోనికి ప్రవేశించుట వలన పరివర్తన మూలక శ్రేణిలో లోహాల పరమాణు, అయానిక పరిమాణాలు తగ్గుతాయి.
ప్రశ్న 25.
Mn, Ni, Zn లు ఉండవలసిన దానికంటే ఎక్కువ రుణ EΘ విలువలు ఎందుకు ప్రదర్శిస్తాయి?
జవాబు:
Mn, Ni, Zn లు ఉండవలసిన దానికంటే ఎక్కువ రుణ EΘ విలువలు ప్రదర్శిస్తాయి.
వివరణ :
Mn+2 లో స్థిరమైన సగం నిండిన -ఆర్బిటాళ్లు ఉండటం వలన, జింక్ లో స్థిరమైన పూర్తిగా నిండిన d- ఆర్బిటాళ్ళు ఉండుట వలన, నికెల్లో అధిక పరమాణీకరణ ఎంథాల్పీ కలిగి ఉండుట వలన ఉండవలసిన దానికంటే ఎక్కువ రుణ E0 విలువలు ప్రదర్శిస్తాయి.
ప్రశ్న 26.
మొదటి పరివర్తన శ్రేణిలో (3d శ్రేణి) కాపరికి మాత్రమే ధన EΘM2+/M విలువ ఉంటుంది. ఎందుకు?
జవాబు:
మొదటి పరివర్తన శ్రేణిలో కాపరికి మాత్రమే ధన EΘM2+/M విలువ ఉంటుంది. దీనికి కారణం అధిక ∆aH0 మరియు తక్కువ ∆hydH0 విలువలు కలిగి ఉండటం.
ప్రశ్న 27.
CuII, CuF2, CuCl2, CuBr2 లాంటి హాలైడ్లను ఏర్పరుస్తుంది. కానీ CuI2 ను ఏర్పరచలేదు. ఎందుకు?
జవాబు:
CuII, CuF2, CuCl2, CuBr2 లాంటి హాలైడ్లను ఏర్పరుస్తుంది. కానీ CuI2 ను ఏర్పరచదు. దీనికి కారణం Cu+2, IT ను I ఆక్సీకరణం చెందించును.
2Cu+2 + 4I– → Cu2I2 + I2
ప్రశ్న 28.
Mn అధికస్థాయి ఫ్లోరైడ్ MnF4 అయితే, అధికస్థాయి ఆక్సైడ్ Mn2O7. ఎందుకు?
జవాబు:
ఫ్లోరిన్ కంటే ఆక్సిజన్కు అధిక ఆక్సీకరణ స్థితులు, స్థిరపరచే స్వభావం అధికంగా ఉంటుంది. అందువలన Mn అధికస్థాయి ఫ్లోరైడ్ MnF4 అయితే అధికస్థాయి ఆక్సైడ్ Mn2O7
ప్రశ్న 29.
ఒక పరివర్తన మూలకం, దాని ఫ్లోరైడ్ లేదా ఆక్సైడ్లలో దేనిలో అత్యధిక ఆక్సీకరణ స్థితిని ప్రదర్శిస్తుంది. ఎందుకు?
జవాబు:
- ఫ్లోరైడ్లలో TiF4, VF5, CrF6 అధిక ఆక్సీకరణ స్థితులు ప్రదర్శిస్తాయి.
- MnO3F లో Mn ఆక్సీకరణ స్థితి + 7 కలిగి ఉంటుంది.
- Sc2O3, Mn2O7 ఆక్సైడ్ అధిక ఆక్సీకరణ స్థితి ప్రదర్శిస్తాయి.
- Mn2O7 లో (Mn) ఆక్సీకరణ స్థితి +7.
![]()
ప్రశ్న 30.
Zn2+ డయా అయస్కాంత పదార్థం అయితే, Mn2+ పారా అయస్కాంత పదార్థం. ఎందుకు? [TS. Mar’15]
జవాబు:
- Zn2+ ఎలక్ట్రాన్ విన్యాసం [Ar] 4s03d10. దీనిలో ఒంటరి ఎలక్ట్రాన్లు లేవు. కావున ఇది డయా అయస్కాంత స్వభావం కలిగి ఉంటుంది.
- Mn2+ ఎలక్ట్రాన్ విన్యాసం [Ar] 4s03d5. దీనిలో ఐదు ఒంటరి ఎలక్ట్రాన్లు కలిగి ఉండును. కావున ఇది పారా అయస్కాంత స్వభావం కలిగి ఉంటుంది.
ప్రశ్న 31.
పరివర్తన లోహ అయాన్ల అయస్కాంత భ్రామకాలు లెక్కగట్టే భ్రమణ-ఆధారిత భ్రామకం (spin only) రాయండి.
జవాబు:
పరివర్తన లోహ అయాన్ల అయస్కాంత భ్రామకాలు లెక్కగట్టే భ్రమణ-ఆధారిత భ్రామకం
µ = \(\sqrt{n(n+2}\)BM.
ప్రశ్న 32.
Fe2+(జల) అయాన్ ‘భ్రమణ-ఆధారిత భ్రామకం’ అయస్కాంత భ్రామకాన్ని లెక్కకట్టండి.
జవాబు:
Fe2+ అయాన్ ఎలక్ట్రాన్ విన్యాసం [Ar] 4s03d6
దీనిలో నాలుగు ఒంటరి ఎలక్ట్రాన్లు గలవు n = 4
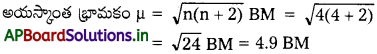
ప్రశ్న 33.
‘అననుపాతం’ అంటే అర్థం ఏమిటి? జలద్రావణంలో అననుపాత చర్యకు ఒక ఉదాహరణ ఇవ్వండి. [AP. Mar. 17]
జవాబు:
ఒక చర్యలో ఒకే మూలకం ఆక్సీకరణం మరియు క్షయకరణం రెండు జరిగితే వాటిని అననుపాత చర్యలు అంటారు.
ఉదా : Cu+ అయాన్ జల ద్రావణంలో తక్కువ స్థిరత్వాన్ని కలిగి ఉంటుంది. ఇది అననుపాత చర్య జరుగుతుంది.
2Cu+(జల) → Cu+2(జల) + Cu(ఘ)
ప్రశ్న 34.
జల Cu2+ అయాన్లు నీలి రంగులో ఉంటాయి. కానీ జల Zn2+ అయాన్లు రంగు లేనివి. ఎందుకు? [AP & TS. Mar. 16]
జవాబు:
- Cu2+ అయాన్ ఎలక్ట్రాన్ విన్యాసం [Ar] 4s03d9 దీనిలో ఒక ఒంటరి ఎలక్ట్రాన్ కలదు. దీనివలన Cu+2 అయాన్ నీలి రంగులో ఉంటుంది.
- Zn+2 అయాన్ ఎలక్ట్రాన్ విన్యాసం [Ar] 4s03d10. దీనిలో ఒంటరి ఎలక్ట్రాన్లు ఉండవు. దీని వలన Zn2+ అయాన్కు రంగులేదు.
ప్రశ్న 35.
సంక్లిష్ట సమ్మేళనాలు అంటే ఏమిటి? ఉదాహరణలు ఇవ్వండి.
జవాబు:
సంక్లిష్ట సమ్మేళనాలు :
పరివర్తన లోహ పరమాణువులు లేదా అయాన్లు అత్యధిక సంఖ్యలో సమ్మేళనాలను ఏర్పరుస్తాయి. వీటిలో ఆనయాన్లు లేదా తటస్థ గ్రూపులు సమన్వయ సంయోజనీయ బంధాల ద్వారా లోహ పరమాణువుకు అయాన్కు బంధితమై ఉంటాయి. వీటిని సమన్వయ సమ్మేళనాలు అంటారు.
ఉదా : [Co(NH3)6]3+, [Fe(CN)6]4-
![]()
ప్రశ్న 36.
పరివర్తన లోహాలు అధిక సంఖ్యలో సంక్లిష్ట సమ్మేళనాలు ఏర్పరుస్తాయి. ఎందువల్ల?
జవాబు:
పరివర్తన లోహాలు అధిక సంఖ్యలో సంక్లిష్ట సమ్మేళనాలు ఏర్పరుస్తాయి. దీనికి కారణం
- వీటి అయాన్లకు తక్కువ పరిమాణం ఉండుట వలన.
- అధిక ప్రభావిక కేంద్రకావేశం కలిగి ఉండుట వలన.
- అసంపూర్ణ d-ఆర్బిటాళ్లు కలిగి ఉండుట వలన.
ప్రశ్న 37.
పరివర్తన లోహాలు ఉత్ప్రేరక ధర్మాలను ఎలా ప్రదర్శిస్తాయి?
జవాబు:
ఉత్ప్రేరక ధర్మాలు :
- పరివర్తన మూలకాలు మరియు వాటి సమ్మేళనాలు పరిశ్రమలలో, జీవ వ్యవస్థలలో ముఖ్యమైన ఉత్ప్రేరకాలుగా పనిచేస్తాయి.
- పరివర్తన మూలకాల ఉత్ప్రేరణ సామర్థ్యం అవి ఏర్పరచే ఆక్సీకరణ స్థితులపైన మరియు సమన్వయ సమ్మేళనాలను ఏర్పరచే స్వభావంపైన ఆధారపడుతుంది.
ఉదా :
1) SO2 నుండి SO3 ని తయారుచేయునపుడు V2O5 ఉత్ప్రేరకంగా పనిచేయును.
![]()
2) NH3 తయారీలో Fe ఉత్ప్రేరకంగా పనిచేయును.
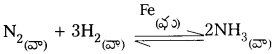
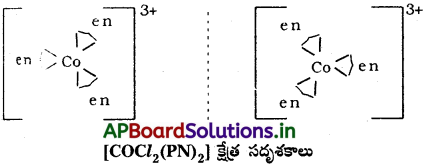
ప్రశ్న 38.
పరివర్తన లోహాలు లేదా వాటి సమ్మేళనాలు ఉత్ప్రేరకాలుగా పనిచేసే రెండు చర్యలను ఇవ్వండి.
జవాబు:
1) SO2 నుండి SO3ని తయారుచేయునపుడు V2O5 ఉత్ప్రేరకంగా పనిచేయును.
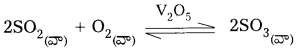
2) NH3 తయారీలో Fe ఉత్ప్రేరకంగా పనిచేయును.
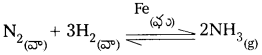
ప్రశ్న 39.
మిశ్రలోహం అంటే ఏమిటి? ఉదాహరణ ఇవ్వండి.
జవాబు:
“ఒక లోహాన్ని ఇతర లోహాలతో గాని, అర్ధ లోహాలతో గాని లేదా ఒక్కొక్కప్పుడు అ-లోహాలతో బాగా సన్నిహితంగా, కలిపితే ఏర్పడిగాని లోహాల భౌతిక ధర్మాలున్న మిశ్రమ పదార్థాన్ని మిశ్రలోహం అంటారు”.
ఉదా : ‘కంచు”, దీని సంఘటనం 75 – 90% Cu; 10 – 25% Sn.
ప్రశ్న 40.
పరివర్తన లోహాలు సులభంగా మిశ్రలోహాలను ఏర్పరుస్తాయి. ఎందువల్ల?
జవాబు:
పరివర్తన మూలకాలు ఒకే రకమైన పరమాణు లేదా అయానిక వ్యాసార్థాలు కలిగి ఉండటం వలన మరియు ఒకేరకమైన విలక్షణ ధర్మాలు కలిగి ఉండుట వలన పరివర్తన మూలకాలు మిశ్రమ లోహాలను త్వరగా ఏర్పరుస్తాయి.
ప్రశ్న 41.
మొదటి పరివర్తన శ్రేణి ఆక్సైడ్ లో అయానిక లక్షణం, ఆమ్ల స్వభావం ఎలా మారతాయి?
జవాబు:
- పరివర్తన మూలకాలలో లోహ ఆక్సీకరణ స్థితి పెరిగే కొలది అయానిక స్వభావం తగ్గును.
ఉదా : Mn2O7 అనునది ఆకుపచ్చని సంయోజనీయ తైలం. - CrO3 మరియు V2O5 లలో అధిక ఆమ్ల స్వభావం కలదు.
- V2O5కు ద్విస్వభావం (అధికంగా ఆమ్లం) కలిగి ఉండి క్షారాలు మరియు ఆమ్లాలతో చర్చ జరిపి VO-34 మరియు VO+4 ఏర్పరచును.
- Mn2O7 సమ్మేళనం HMnO4 ను. CrO3 సమ్మేళనం, H2CrO4 మరియు H2Cr2O7 లను ఏర్పరచును.
ప్రశ్న 42.
పొటాషియమ్ డైక్రోమేట్ ద్రావణంపై pH పెరుగుదల ప్రభావం ఏమిటి?
జవాబు:
K2Cr2O7 (నారింజరంగు) పై pH పెరుగుదల వలన అది K2CrO4 (పసుపురంగు) గా మారును.

ప్రశ్న 43.
మొదటి శ్రేణి పరివర్తన లోహాలలో, లోహం ప్రదర్శించే ఆక్సీకరణ స్థితి దాని గ్రూప్ సంఖ్యకు సమానమయ్యే ఆక్సో లోహ ఆనయాన్ల పేర్లను తెలపండి.
జవాబు:
VO-34 అయాన్ ‘+5’ ఆక్సీకరణ స్థితిని ప్రదర్శిస్తుంది. ఈ ఆక్సీకరణ సంఖ్య దాని గ్రూపు సంఖ్య (V) కు సమానం.
VO-34 – x + 4(−2) = -3, x = + 5.
![]()
ప్రశ్న 44.
పర్మాంగనేట్ అంశమాపనాలను సాధారణంగా సల్ఫ్యూరిక్ ఆమ్లం సమక్షంలో జరుపుతారు. కానీ హైడ్రోక్లోరిక్ ఆమ్లం సమక్షంలో జరపరు. ఎందువల్ల ?
జవాబు:
హైడ్రోక్లోరిక్ ఆమ్లం, క్లోరిన్గా ఆక్సీకరణం చెందును. అందువలన పర్మాంగనేట్ అంశమాపనాలను సాధారణంగా సల్ఫ్యూరిక్ ఆమ్ల సమక్షంలో జరుపుతారు. కానీ హైడ్రోక్లోరిక్ ఆమ్ల సమక్షంలో జరుపరు.
ప్రశ్న 45.
లాంథనైడ్ సంకోచం అంటే ఏమిటి?
జవాబు:
లాంథనైడ్లలో పరమాణు వ్యాసార్థం లేదా పరమాణు పరిమాణం లేదా అయానిక వ్యాసార్థం పరమాణు సంఖ్య పెరిగే కొలది నెమ్మదిగా తగ్గును. దీనినే లాంథనైడ్ సంకోచం అంటారు.
ప్రశ్న 46.
లాంథనైడ్లు ప్రదర్శించే వివిధ ఆక్సీకరణ స్థితులు ఏవి?
జవాబు:
- లాంథనైడ్లు +2, +3 ఆక్సీకరణ స్థితులు ప్రధానంగా ప్రదర్శిస్తాయి. కొన్ని సందర్భాలలో + 2 మరియు + 4 స్థితులను ఘనపదార్థాలలో ప్రదర్శిస్తాయి.
- ఈ మూలకాల సాధారణ ఆక్సీకరణ స్థితి +3.
ప్రశ్న 47.
‘మిష్ లోహం’ (Mischmetal) అంటే ఏమిటి? దాని సంఘటనాన్ని, ఉపయోగాలను ఇవ్వండి. [AP. Mar.’16]
జవాబు:
మిష్ లోహం అనేది ఒక మిశ్రమ లోహం. దీనిలో లాంథనైడ్ (~95%) లోహం, ఐరన్ (~ 5%) మరియు S, C, Ca, Alలు తక్కువ పరిమాణంలో ఉంటాయి.
మిష్లోహాన్ని బుల్లెట్లు, తొడుగులు, తేలిక చకుముకిల తయారీకి ఉపయోగించే Mg- ఆధారిత మిశ్రమ లోహ ఉత్పత్తికి వాడుతారు.
ప్రశ్న 48.
ఆక్టినైడ్ సంకోచం అంటే ఏమిటి?
జవాబు:
ఆక్టినైడ్ శ్రేణిలో పరమాణువుల, M+3 అయాన్ల పరిమాణం క్రమంగా తగ్గుతుంది. దీనినే ఆక్టినైడ్ సంకోచం అని అంటారు.
ప్రశ్న 49.
సమన్వయ సమ్మేళనాలు అంటే ఏమిటి? రెండు ఉదాహరణలు ఇవ్వండి.
జవాబు:
సమన్వయ సమ్మేళనాలు :
పరివర్తన లోహ పరమాణువులు లేదా అయాన్లు అత్యధిక సంఖ్యలో సమ్మేళనాలను ఏర్పరుస్తాయి. వీటిలో ఆనయాన్లు లేదా తటస్థ గ్రూపులు సమన్వయ సంయోజనీయ బంధాల ద్వారా లోహ పరమాణువుకు అయాన్కు బంధితమై ఉంటాయి. వీటిని సమన్వయ సమ్మేళనాలు అంటారు.
ఉదా : [Co(NH3)6]3+, [Fe(CN)6]4-
![]()
ప్రశ్న 50.
“కో ఆర్డినేషన్ పాలిహెడ్రన్’ అంటే ఏమిటి?
జవాబు:
కేంద్ర లోహ పరమాణువు లేదా అయాన్ చుట్టూ ఉన్న లైగాండ్ల త్రిజ్యామితీయ అమరికను బట్టి ఆ సంక్లిష్టానికి గల జ్యామితిని నిర్ణయిస్తారు. దీనినే సమన్వయ బహుభుజి లేదా కో ఆర్డినేషన్ పాలిహెడ్రన్ అంటారు.
ఉదా : ఆక్టాహెడ్రల్ (అష్టముఖీయం), టెట్రా హెడ్రల్ (చతుర్ముఖీయం)
ప్రశ్న 51.
ద్వంద్వ లవణం (double salt) అంటే ఏమిటి? ఉదాహరణ ఇవ్వండి.
జవాబు:
ద్వంద్వ లవణం :
ఏ లవణాలలో అయితే రెండు కాటయాన్లు, ఒక ఆనయాన్ ఉంటుందో ఆ లక్షణాలను ద్వంద్వ లవణాలు అంటారు.
నీటిలో కరిగించినపుడు ఇది సామాన్య అయాన్ల విఘటనం చెందుతాయి.
ఉదా : కార్నలైట్ KCl.MgCl2.6H2O
ప్రశ్న 52.
సంక్లిష్ట సమ్మేళనానికి, ద్వంద్వ లవణానికి మధ్య భేదం ఏమిటి?
జవాబు:
ద్వంద్వ లవణాన్ని నీటిలో కరిగించినపుడు పూర్తిగా సామాన్య అయాన్లుగా విఘటనం చెందును. కానీ సంక్లిష్ట సమ్మేళనం విఘటనం చెందీ సంక్లిష్ట అయాన్ మరియు ప్రతి అయాన్లు ఏర్పడును.
ప్రశ్న 53.
లైగాండ్ అంటే ఏమిటి?
జవాబు:
లైగాండ్ :
సంక్లిష్టంలో కేంద్ర లోహ పరమాణువుకు లేదా అయాన్కు ఎలక్ట్రాన్ జంటలను దానం చేయడం ద్వారా సమన్వయ బంధాలను ఏర్పరచే అయాన్ లేదా అణువును లైగాండ్ అంటారు.
ఉదా : Cl–, Br–, SCN– మొదలైనవి.
ప్రశ్న 54.
అయానిక, తటస్థ లైగాండ్లు ఒక్కొక్క దానికి ఒక్కొక్క ఉదాహరణ ఇవ్వండి.
జవాబు:
- అయానిక లైగాండ్లకు ఉదాహరణ – CN–, I–, Cl–
- తటస్థ లైగాండ్లకు ఉదాహరణ – NH3, H2O
ప్రశ్న 55.
ఒక మోల్ CoCl3 ని AgNO3 ద్రావణంతో చర్య జరిపినప్పుడు ఎన్ని మోల్ల AgC! అవక్షేపితమవుతుంది?
జవాబు:
ఒక మోల్ CoCl3 ని AgNO3 ద్రావణంతో చర్య జరిపినపుడు మూడు మోల్ల AgCl అవక్షేపితమవుతుంది.
3 AgNO3 + CoCl3 → Co(NO3)3 + 3 AgCl↓
![]()
ప్రశ్న 57.
‘ఉభయదంత’ లైగాండ్ (ambidentate ligand) అంటే ఏమిటి? ఉదాహరణ ఇవ్వండి. (లేదా) ‘కీలేట్ లైగాండ్’ అంటే ఏమిటి? ఉదాహరణ ఇవ్వండి. [AP. Mar.’16]
జవాబు:
రెండు దాత పరమాణువుల గల ఏకదంత లైగాండ్ తనలోని రెండు పరమాణువులలో దేని ద్వారానైనా సమన్వయం చేయగలుగుతుంది. ఇటువంటి లైగాండ్లను ఉభయదంత (ఏంబిడెంటేడ్) లైగాండ్లు లేదా కీలేట్ లైగాండ్లు అంటారు.
ఉదా : C2O-24, CO-23 etc.
ప్రశ్న 58.
CuSO4.5H2O నీలి రంగులో ఉంటుంది. కానీ అనార్థ CuSO4 రంగులేనిది. ఎందుకు?
జవాబు:
CuSO4.5H2O నీలి రంగులో ఉంటుంది. కానీ అనార్థ CuSO4 రంగులేనిది. దీనికి కారణం లైగాండ్లు లేకపోవడం వలన స్ఫటిక క్షేత్ర విభజన జరగదు.
ప్రశ్న 59.
1 : 1 మోలార్ నిష్పత్తిలో FeSO4 ద్రావణాన్ని (NH4)2SO4 ద్రావణంతో కలిపితే, ఆ ద్రావణం Fe2+ అయాను పరీక్షనిస్తుంది. కానీ 1 : 4 మోలార్ నిష్పత్తిలో CuSO4 ద్రావణాన్ని అమోనియా జలద్రావణంతో కలిపితే, ఆ ద్రావణం Cu2+ అయాన్కు పరీక్షను ఇవ్వదు. ఎందువల్ల?
జవాబు:
- 1 : 1 మోలార్ నిష్పత్తిలో FeSO4 ద్రావణాన్ని (NH4)2SO4 ద్రావణంతో కలిపితే, ఆ ద్రావణం Fe2- అయాన్కు పరీక్షనిస్తుంది. దీనికి కారణం ఈ మిశ్రమం ద్వంద్వ లవణం FeSO4(NH4)2 SO4. 6H2O (మోర్ లవణం)ను ఏర్పరుస్తుంది.
- 1 : 4 మోలార్ నిష్పత్తిలో CuSO4 ద్రావణాన్ని అమ్మోనియా జల ద్రావణంతో కలిపితే ఆ ద్రావణం Cu2+ కు పరీక్షని ఇవ్వదు. దీనికి కారణం సంక్లిష్ట సమ్మేళనం [Cu(NH3)4]SO4 ఏర్పడటం.
ప్రశ్న 60.
క్రింది సమన్వయ జాతులలో ఎన్ని జ్యామితీయ ఐసోమర్లు సాధ్యమవుతాయి?
ఎ) [Cr(C2O4)3]3-
బి) [Co(NH3)3Cl3]
జవాబు:
ఎ) [Cr(C204)3]3- : రెండు జ్యామితీయ ఐసోమర్లు సాధ్యపడతాయి.
బి) [Co(NH3)3Cl3] : రెండు జ్యామితీయ ఐసోమర్లు సాధ్యపడతాయి.
ప్రశ్న 61.
కాపర్ సల్ఫేట్ జలద్రావణానికి అధికంగా KCN జలద్రావణం కలిపినప్పుడు ఏర్పడే సమన్వయ జాతి ఏమిటి?
జవాబు:
కాపర్ సల్ఫేట్ ద్రావణానికి అధికంగా KCN జలద్రావణం కలిపినప్పుడు పొటాషియం టెట్రా సయనో కాపర్ (II) సంక్లిష్టం ఏర్పడును.
బలమైన లైగాండ్ CN ఉండుట వలన ఈ సంక్లిష్టం ఏర్పడినది.
4KCN(జల) + CuSO4(జల) → K2[Cu(CN)4](జల) + K2SO4(జల)
![]()
ప్రశ్న 62.
[Cr(NH3)6]3+ పారా అయస్కాంత పదార్థం. కాగా [Ni(CN)4]2- డయా అయస్కాంత పదార్థం. ఎందువల్ల?
జవాబు:
- [Cr(NH3)6]3+ లో మూడు ఒంటరి ఎలక్ట్రాన్లు ఉండుట వలన పారా అయస్కాంత స్వభావం కలిగి ఉండును.
- [Ni(CN4)]2+ లో ఒంటరి ఎలక్ట్రాన్లు లేనందు వల్ల డయా అయస్కాంత స్వభావం కలిగి ఉండును.
ప్రశ్న 63.
[Ni(H2O)6]2+ ద్రావణం ఆకుపచ్చని రంగులో ఉంటుంది. కానీ [Ni(CN)4]2- ద్రావణం రంగు లేనిది. ఎందువల్ల?
జవాబు:
- [Ni(H2O)6]2+ సంక్లిష్టంలో H2O బలహీన లైగాండ్. ఈ లైగాండ్ ఎలక్ట్రాన్లను జతపరచదు. కావున రెండు ఒంటరి ఎలక్ట్రాన్లు ఉంటాయి. ఇవి d-d-పరివర్తనలు జరిపి ఎరుపురంగు కాంతి వికిరణాన్ని శోషించుకొని ఆకుపచ్చని రంగు కాంతిని విడుదల చేస్తాయి.
- [Ni(CN)4]2+ సంక్లిష్టంలో CN– అయాన్ బలమైన లైగాండ్. ఈ లైగాండ్ ఎలక్ట్రాన్లను జతపరుస్తుంది. కావున ఒంటరి ఎలక్ట్రాన్లు ఉండవు. మరియు పరివర్తనలు జరగవు. అందువలన [Ni (CN)4]2- ద్రావణం రంగు లేనిది.
ప్రశ్న 64.
[Fe(CN)4]2-, [Fe(H2O)6]2+ లకు జలద్రావణాలలో వేరువేరు రంగులు ఉంటాయి. ఎందువల్ల?
జవాబు:
ఇవ్వబడిన సంక్లిష్ట సమ్మేళనాలలో Fe యొక్క ఆక్సీకరణ స్థితి +2 మరియు బాహ్య ఎలక్ట్రాన్ విన్యాసం 3d6 బలహీన లైగాండ్ H2O సమక్షంలో నాలుగు ఒంటరి ఎలక్ట్రాన్లు కలిగి ఉంటుంది. బలమైన లైగాండ్ CN– సమక్షంలో ఎలక్ట్రాన్లు జత కలుస్తాయి. ఒంటరి ఎలక్ట్రాన్ల సంఖ్యలో భిన్నంగా ఉండుట వలన ఇవ్వబడిన సంక్లిష్టాలు రెండు వేరు వేరు రంగులు కలిగి ఉంటాయి.
ప్రశ్న 65.
క్రింది వాటిలో కోబాల్ట్ ఆక్సీకరణ స్థితి ఎంత?
(ఎ) K[Co(CO)4],
(బి) [Co(NH3)6]3+ ?
జవాబు:
i) K[Co(CO)4] : 1 + x + 4(0) = 0, x = −1
ii) [Co(NH3)6]3+ : x + 6(0) = + 3, x = + 3.
స్వల్ప సమాధాన ప్రశ్నలు
ప్రశ్న 1.
3d శ్రేణితో పోలిస్తే 4d, 5d శ్రేణులలో అనురూప పరివర్తన లోహాలు అధిక పరమాణీకరణ ఎంథాల్పీ చూపిస్తాయి. వివరించండి.
జవాబు:
3d-శ్రేణితో పోలిస్తే 4d, 5d శ్రేణులలో అనురూప పరివర్తన లోహాలు అధిక పరమాణీకరణ ఎంథాల్పీ చూపిస్తాయి.
కారణం :
భారయుత పరివర్తన లోహాల సమ్మేళనాలలో తరచుగా కనిపించే లోహ లోహ బంధాలు ఈ అధిక పరమాణీకరణ ఎంథాల్పీకి కారణం.
ప్రశ్న 2.
3d, 4d శ్రేణులలోని మూలకాల పరమాణు, అయానిక సైజులతో పోలిస్తే 4d, 5d శ్రేణులలో మూలకాల పరమాణు వ్యాసార్థాలు మారకుండా దాదాపు ఒకే విధంగా ఉంటాయి. వ్యాఖ్యానించండి.
జవాబు:
3d, 4d శ్రేణులలోని మూలకాల పరమాణు, అయానిక సైజులతో పోలిస్తే 4d, 5d శ్రేణులలో మూలకాల పరమాణు వ్యాసార్థాలు మారకుండా దాదాపుగా ఒకే విధంగా ఉంటాయి.
వివరణ :
5d శ్రేణిలో ఎలక్ట్రాన్లు ప్రవేశించడానికి ముందే 4f ఆర్బిటాల్లు ఎలక్ట్రాన్లతో నిండి ఉంటాయి. ఈ విధంగా 5d కంటే ముందుగా 4f ఆర్బిటాల్లు నిండటం పరమాణు వ్యాసార్థాలలో క్రమమైన తగ్గుదలకు దారి తీస్తుంది. ఈ పరమాణు వ్యాసార్థాలలో తగ్గుదలనే లాంథనైడ్ సంకోచం అంటారు.
![]()
ప్రశ్న 3.
[Ni(CO)4], [Fe(CO)5] లలో వరుసగా Ni, Fe ల సున్నా ఆక్సీకరణ స్థితి గురించి విశదీకరించండి.
జవాబు:
[Ni(CO)4], [Fe(CO)5] లలో వరుసగా Ni, Fe లకు సున్నా ఆక్సీకరణ స్థితి కలిగి ఉంటాయి.
కారణం :
ఈ సంక్లిష్ట సమ్మేళనాలలోని లైగాండ్లకు 6-బంధాలతో పాటు బంధాలను ఏర్పరచే సామర్థ్యం ఉండటం వలన లోహాలకు అల్ప ఆక్సీకరణ స్థితి కలిగి ఉంటాయి.
ప్రశ్న 4.
జలద్రావణాలలో పరివర్తన లోహ అయాన్లు అభిలాక్షణిక రంగులను ఎందువల్ల ప్రదర్శిస్తాయి? ఉదాహరణలతో వివరించండి.
జవాబు:
ఒక సంక్లిష్టంలో లోహ అయాన్ లోని ఒకే (n) విలువ గల తక్కువశక్తి గల d-ఆర్బిటాల్ నుండి ఒక ఎక్కువ శక్తిగల d- ఆర్బిటాల్లోనికి ఉత్తేజితం చెందినపుడు ఉత్తేజితశక్తి, శోషిత కాంతి పౌనఃపున్యంనకు సంబంధించినదై ఉంటుంది. లోహ అయాన్ ప్రదర్శించే రంగు శోషిత కాంతి ప్రదర్శించే రంగుకు సంపూరక రంగుగా ఉంటుంది. శోషిత కాంతి పౌనఃపున్యం లైగాండ్ స్వభావం పై ఆధారపడి ఉంటుంది. జలద్రావణాలలో వివిధ లోహ అయాన్లు ప్రదర్శించే రంగులు ఈ క్రింది పట్టికలో ఇవ్వబడ్డాయి.
కొన్ని మొదటి శ్రేణి పరివర్తన లోహాల అయాన్ల (జల) రంగులు
| విన్యాసం | ఉదాహరణ | రంగు |
| 3d0 | Sc3+ | రంగులేదు |
| 3d0 | Ti4+ | రంగులేదు |
| 3d1 | Ti3+ | ఉదా |
| 3d1 | V4+ | నీలిరంగు |
| 3d2 | V3+ | ఆకుపచ్చ |
| 3d3 | V2+ | ఊదా |
| 3d3 | Cr3+ | ఊదా |
| 3d4 | Mn2+ | ఊదా |
| 3d4 | Cr2+ | నీలిరంగు |
| 3d5 | Mn2+ | పింక్ |
| 3d5 | Fe3+ | పసుపుపచ్చ |
| 3d6 | Fe2+ | ఆకుపచ్చ |
| 3d6 | Co3+ | నీలిరంగు |
| 3d7 | Co2+ | పింక్ |
| 3d8 | Ni2+ | ఆకుపచ్చ |
| 3d9 | Cu2+ | నీలిరంగు |
| 3d10 | Zn2+ | రంగులేదు |
ప్రశ్న 5.
I–, S4O2-8 ల మధ్య జరిగే చర్యలో ఐరన్ (III) ఉత్ప్రేరకం క్రియాశీలతను వివరించండి.
జవాబు:
పరివర్తన లోహ అయాన్లు, వాటి ఆక్సీకరణ స్థితులు మార్పుకోగలిగి ప్రభావాత్మక ఉత్ప్రేరకాలుగా పనిచేస్తాయి.
I–, S4O-28 ల మధ్య జరిగే చర్యలో ఐరన్ (III) ఉత్ప్రేరక క్రియాశీలత ఈ క్రింద చర్యల ద్వారా వివరించబడినది.

ప్రశ్న 6.
అల్పాంతరాళ సమ్మేళనాలు అంటే ఏమిటి? అవి ఎలా ఏర్పడతాయి? రెండు ఉదాహరణలు ఇవ్వండి.
జవాబు:
అల్పాంతంరాళ సమ్మేళనాలు ఏర్పడటం:
H,C లేదా N లాంటి చిన్న పరమాణువులు లోహాల స్ఫటిక జాలకంలోని అల్పాంతరాళాలలో చిక్కుకుపోయినప్పుడు ఏర్పడే సమ్మేళనాలను అల్పాంతరాళ సమ్మేళనాలు అంటారు. ఈ సమ్మేళనాలు సాధారణంగా నాన్-స్టాయికియోమెట్రిక్ సమ్మేళనాలు. ఇవి అయానిక సమ్మేళనాలు కావు అలా అని సమయోజనీయ సమ్మేళనాలు కావు. ఈ సమ్మేళనాలకు ఉదాహరణలు TiC, Mn4N, Fe3H, VH0.56, TiH1.7 మొదలైనవి. వీటి ఫార్ములాలలో పరివర్తన లోహం, దాని సాధారణ ఆక్సీకరణ స్థితికి సంబంధించినదై ఉండదు. ఈ సమ్మేళనాల సంఘటన స్వభావాన్ని బట్టి, వీటిని అల్పాంతరాళ సమ్మేళనాలు అని అంటారు. వీటి ముఖ్యమైన భౌతిక, రసాయన లక్షణాలు క్రింది విధంగా ఉంటాయి.
- ఈ సమ్మేళనాలకు అధిక ద్రవీభవన స్థానాలు ఉంటాయి. ఈ ద్రవీభవన స్థానాలు ఆ సమ్మేళనంలోని లోహం ద్రవీభవన స్థానం కంటే ఎక్కువగా ఉంటాయి.
- ఈ సమ్మేళనాలకు గట్టితనం ఉంటుంది. కొన్ని బోరైడ్లకు డైమండ్ అంత గట్టిదనం ఉంటుంది.
- ఈ సమ్మేళనాలు లోహ వాహకత్వాన్ని పదిలపరచుకుంటాయి.
- ఈ సమ్మేళనాలకు రసాయనికంగా జడత్వం ఉంటుంది.
ప్రశ్న 7.
అల్పాంతరాళ సమ్మేళనాల లక్షణాలను రాయండి.
జవాబు:
అల్పాంతర సమ్మేళనాల లక్షణాలు :
- ఈ సమ్మేళనాలకు అధిక ద్రవీభవన స్థానాలు ఉంటాయి. ఈ ద్రవీభవన స్థానాలు ఆ సమ్మేళనంలోని లోహం ద్రవీభవన స్థానం కంటే ఎక్కువగా ఉంటాయి.
- ఈ సమ్మేళనాలకు గట్టితనం ఉంటుంది. కొన్ని బోరైడ్లకు డైమండ్ అంత గట్టిదనం ఉంటుంది.
- ఈ సమ్మేళనాలు లోహ వాహకత్వాన్ని పదిలపరచుకుంటాయి.
- ఈ సమ్మేళనాలకు రసాయనికంగా జడత్వం ఉంటుంది.
![]()
ప్రశ్న 8.
పరివర్తన మూలకాల విలక్షణ ధర్మాలను రాయండి. [AP. Mar.’15]
జవాబు:
పరివర్తన లోహాలు లేదా మూలకాలు విలక్షణ ధర్మాలను చూపుతాయి. వాట్తో కొన్నింటిని కింది జాబితాగా పొందుపరచడమైనది..
a) ఎలక్ట్రానిక్ విన్యాసాలు
b) బహుళ ఆక్సీకరణ స్థితులు
c) పారా, ఫెర్రో అయస్కాంత ధర్మాలు
d) రంగు హైడ్రేటెడ్ అయాన్లు, లవణాలు ఏర్పడటం
e) మిశ్రమ లోహాలు ఏర్పడే సామర్థ్యం
f) ఉత్ప్రేరక ధర్మాలు
g) సంక్లిష్టాలు ఏర్పడే సామర్థ్యం
h) లోహ స్వభావం
i) అయొనైజేషన్ శక్తి
j) పరమాణు, అయానిక వ్యాసార్థాలు
k) అల్పాంతరాళ సమ్మేళనాలు
ప్రశ్న 9.
క్రింది వాటి ఎలక్ట్రాన్ విన్యాసాలను రాయండి.
(ఎ) Cr3+ (బి) Cu+ (సి) Co2+ (డి) Mn2+
జవాబు:
ఎ) Cr3+ ఎలక్ట్రాన్ విన్యాసం [Ar] 4s03d³
బి) Cu+ ఎలక్ట్రాన్ విన్యాసం [Ar] 4s03d10
సి) Co2+ ఎలక్ట్రాన్ విన్యాసం [Ar] 4s03d7
డి) Mn2+ ఎలక్ట్రాన్ విన్యాసం [Ar] 4s03d5
![]()
ప్రశ్న 10.
ఒక పరివర్తన మూలక పరమాణువులలో భూస్థితిలో d-ఎలక్ట్రాన్ విన్యాసాలు క్రింది విధంగా ఉన్నాయి. 3d³, 3d5, 3d8, 3d4 వీటిలో ఏ విన్యాసం స్థిర ఆక్సీకరణ స్థితిని తెలుపుతుంది?
జవాబు:
- 3d³ యొక్క స్థిరమైన ఆక్సీకరణ స్థితులు +2, +3, +4 మరియు +5 (V)
- 3d5 యొక్క స్థిరమైన ఆక్సీకరణ స్థితులు +3, + 4 మరియు +6 (Cr)
- 3d5 యొక్క స్థిరమైన ఆక్సీకరణ స్థితులు +2, +4, +6 మరియు +7 (Mn)
- 3d8 యొక్క స్థిరమైన ఆక్సీకరణ స్థితులు +2, +3 (Co)
- 3d4 ఈ విన్యాసంకు ఉనికి లేదు.
ప్రశ్న 11.
లాంథనైడ్ సంకోచం అంటే ఏమిటి? లాంథనైడ్ సంకోచం ఫలితాలు ఏమిటి?
జవాబు:
లాంథనైడ్ సంకోచము :
లాంథనైడ్లలో పరమాణు పరిమాణం (లేదా) అయాన్ పరిమాణంలో తరుగుదలను లాంథనైడ్ సంకోచమంటారు.
కారణము :
లాంథనైడ్లను, వాటి త్రిక సంయోజక అయాన్లలోను పరమాణు సంఖ్యతోబాటు కేంద్రక ఆవేశం పెరుగుతుంది. ఒక మూలకం నుంచి తరువాత మూలకానికి వెళుతుంటే భేదాత్మక ఎలక్ట్రాన్, బాహ్య కక్ష్యలోకి కాకుండా అంతర్గతమయిన 4f – ఆర్బిటాల్లోకి చేరతాయి. f-ఆర్బిటాల్ యవనికా ప్రభావం చాలా తక్కువ. అందువల్ల ప్రభావక కేంద్రక ఆవేశం, ఆయా పరమాణు సైజులను (లేదా) అయానిక సైజులను కుచింపచేస్తుంది.
ఫలితాలు :
- ఈ సంకోచం వల్ల లాంథనైడ్ల రసాయన ధర్మాలు ఒక మూలకం నుంచి ఇంకొక దానికి చాలా స్వల్పంగా మారతాయి. దాని ఫలితంగా లాంథనైడ్లను వేరుపరచడం చాలా కష్ట సాధ్యం.
- లాంథనైడ్ల అనంతరం వచ్చే 6వ పీరియడ్ మూలకాల అనూహ్య లక్షణాలను లాంథనైడ్ సంకోచం పరంగా వివరించవచ్చు.
- 4d – శ్రేణిలోని మూలకాల వ్యాసార్థాలు, వాటి అనురూప 3d – మూలకాల వ్యాసార్థాల క్రింద ఎక్కువగా ఉంటాయి. కాని 4d శ్రేణి నుంచి 5d శ్రేణికి పోయేటప్పుడు అదే ప్రవృత్తి కనిపించదు. దానికి కారణము లాంథనైడ్ సంకోచము.
ఉదా : Hf (Z = 72), Zr (Z – 40) లు సారూప్యంగా AR, IRలను కలిగిఉంటాయి. 0.144 nm, 0.145 nm. అదేవిధంగా Nb & Ta (AR విలువలు ఒక్కొక్క దానికి 0.134 nm); Mo & W (AR విలువలు ఒక్కొక్క దానికి 0.130 nm). ఈ మూలకాల జంటలకు సన్నిహిత రసాయన ధర్మాలుంటాయి. - దీని ఫలితంగా ముందుగా వచ్చే హైడ్రాక్సైడ్లు అయానిక స్వభావాన్ని, తరువాత మూలకాల హైడ్రాక్సైడ్లు సమయోజనీయ స్వభావాన్ని కలిగివున్నాయి. అందువల్ల లాంథనైడ్ హైడ్రాక్సైడ్ క్షారత్వం La నుంచి Luకి తగ్గుతుంది.
ప్రశ్న 12.
పరివర్తన లోహాల ఆక్సీకరణ స్థితులలో మార్పు, పరివర్తన మూలకాలు కాని వాటిలో ఈ మార్పుకు గల భేదం ఏమిటి?
ఉదాహరణలతో విశదీకరించండి.
జవాబు:
పరివర్తన మూలకాలలో అసంపూర్ణ (-ఆర్బిటాళ్లు కలిగి ఉండుట వలన ఆక్సీకరణ స్థితులు ఒక్కొక్కటిగా మారుతాయి.
ఉదా : Mn− +2, +3, +4, +5, + 6 మరియు +7 స్థితులు ప్రదర్శిస్తుంది (అన్నింటికి బేధం ఒకటి)
పరివర్తన మూలకాలు కాని వాటిలో ఈ మార్పు ఎన్నికైనదిగా ఉండును. మధ్య బేధం 2గా ఉండును.
ఉదా : S − +2, +4, +6 స్థితులు ప్రదర్శించును.
N – +3, +5 స్థితులు ప్రదర్శించును.
ప్రశ్న 13.
ఐరన్ క్రోమైట్ ధాతువు నుంచి పొటాషియమ్ డైక్రోమేట్ తయారీని వర్ణించండి.
జవాబు:
ఐరన్ క్రోమైట్ ధాతువు నుంచి పొటాషియమ్ డైక్రోమేట్ తయారీ :
పొటాషియమ్ డైక్రోమేట్ తోళ్ళ పరిశ్రమలో ఉపయోగించే ముఖ్య రసాయన పదార్థం. దీనిని అనేక ఎజో సమ్మేళనాల తయారీలో ఆక్సీకరణిగా ఉపయోగిస్తారు. డైక్రోమేట్లను సాధారణంగా క్రోమేట్ నుంచి తయారుచేస్తారు. దీనిని క్రోమైట్ ధాతువును బాగా గాలి తగిలేటట్లు సోడియమ్ లేదా పొటాషియమ్ కార్బొనేట్తో గలనం చేసి పొందుతారు. సోడియమ్ కార్బొనేట్తో చర్య క్రింది విధంగా జరుగుతుంది.
4 FeCr2O4 + 8Na2CO3 + 7O2 → 8Na2CrO4 + 2Fe2O3 + 8CO2
పై చర్యలో ఏర్పడ్డ పసుపురంగు సోడియమ్ క్రోమేట్ ద్రావణాన్ని వడపోసి, సల్ఫ్యూరికామ్లంతో ఆమ్లీకృతం చేస్తే ఆరెంజ్ రంగు గల సోడియమ్ డైక్రోమేట్ Na, CrzO, .2H* స్ఫటికాలు ఏర్పడతాయి.
2Na2CrO4 + 2H+ → Na2Cr2O7 + 2Na+ + H2O
సోడియమ్ డైక్రోమేట్, పొటాషియమ్ డైక్రోమేట్ కంటే నీటిలో ఎక్కువగా కరుగుతుంది. కాబట్టి సోడియమ్ డైక్రోమేట్ను పొటాషియమ్ క్లోరైడ్తో చర్య జరిపించి. పొటాషియమ్ డైక్రోమేట్ను తయారుచేస్తారు.
Na2Cr2O7 + 2KCl → K2Cr2O7 + 2NaCl
![]()
ప్రశ్న 14.
పొటాషియమ్ డైక్రోమేట్ ఆక్సీకరణ చర్యా విధానాన్ని వివరించండి. క్రింది వాటితో దాని చర్యలకు అయానిక సమీకరణాలు రాయండి.
(ఎ) అయొడైడ్ (బి) ఐరన్ (II) ద్రావణం (సి) H2S (డి) Sn(II)
జవాబు:
ఆమ్ల యానకం (మాధ్యమం) లో పొటాషియం డైక్రోమేట్ బలమైన ఆక్సీకరణి. ఈ ఆక్సీకరణ స్వభావాన్ని క్రింది విధంగా సూచించవచ్చు.
Cr2O-27 + 14H+ + 6e ̄ → 2Cr+3 (E° = 1.33 V)
అయానిక సమీకరణాలు :
i) K2Cr2O7 మరియు I–
Cr2O-27 + 14H+ + 6I– → 2Cr-3 + 3I2 + 7H2O
ii) K2Cr2O7 మరియు Fe2+ (జల)
Cr2O-27 + 14H+ + 6Fe+2 → 2Cr+3 + 3Fe+3 + 7H2O
iii) K2Cr2O7 మరియు H2S
Cr2O-27 + 8H+ + 3H2S → 3Cr+3 + 3S + 7H2O
ప్రశ్న 15.
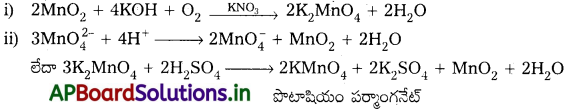
పొటాషియం పర్మాంగనేట్ తయారీని వర్ణించండి.
జవాబు:
పొటాషియం పర్మాంగనేట్ (KMnO4) తయారీ :
MnO2 ను క్షార లోహ హైడ్రాక్సైడ్, KNO3 లాంటి ఆక్సీకరణితో గల్తనం చెందించి, KMnO4 ను తయారుచేస్తారు. ఈ చర్యలో ముదురు ఆకుపచ్చ పొటాషియం మాంగనేట్ K2MnO4 ఏర్పడి అది తటస్థ లేదా ఆమ్ల ద్రావణంతో అననుపాతం చెంది పొటాషియం పర్మాంగనేట్ను ఇస్తుంది.
ప్రశ్న 16.
ఆమ్లీకృత పొటాషియమ్ పర్మాంగనేట్ ద్రావణం క్రింది వాటితో ఎలా చర్య జరుపుతుంది?
(ఎ) ఐరన్ (II) అయాన్లు (బి) SO2 (సి) ఆగ్జాలిక్ ఆమ్లం.
ఈ చర్యలకు అయానిక సమీకరణాలు రాయండి.
జవాబు:
KMnO4 ఆమ్ల యానకంలో చర్య
MnO–4 + 8H+ + 5e– → Mn+2 + 4H2O ———- (i)
ఎ) ఫెర్రస్ అయాన్ను ఫెర్రిక్ అయాన్గా ఆక్సీకరణం చేయును.
Fe2+ →Fe+3 + e– ———- (ii)
పై రెండు సమీకరణాల నుండి
5Fe+2 + MnO–4 + 8H+ → Mn+2 + 4H2O + 5Fe+3
బి) SO2 ను SO-24 గా ఆక్సీకరణం చేయును.
SO2 + 2H2O → SO2-4 + 4H+ + 2e– ———- (iii)
సమీకరణం (i), (iii) నుండి
5SO2 + 2MnO–4 + 2H2O →2Mn+2 + 4H+ + 5SO-24
సి) ఆగ్జాలిక్ ఆమ్లం CO గా ఆక్సీకరణం చెందును.
C2O2-4 → 2CO2 + 2e– ———- (iv)
(i), (iv) సమీకరణాల నుండి
5C2O2-4 + 2MnO–4 + 16H+ → 2Mn+2 + 8H2O + 10CO2
ప్రశ్న 17.
జలద్రావణంలో Cu+, Sc3+, Mn2+, Fe2+లలో ఏ అయాన్లకు రంగు ఉంటుందని భావిస్తున్నారు? కారణాలు ఇవ్వండి.
జవాబు:
ఏ అయాన్లలో అయితే అసంపూర్ణ d- ఆర్బిటాళ్ళను కలిగి ఉంటాయో అని రంగు ధర్మాన్ని ప్రదర్శిస్తాయి. పూర్థి స్థాయిలో నిండిన d-ఆర్బిటాళ్లు (లేదా) ఖాళీ d-ఆర్బిటాళ్ళు కలిగిన అయాన్లు రంగు ధర్మం ప్రదర్శించవు.
Cu+ = [Ar] 3d10 రంగు లేదు.
Sc+3 = [Ar] రంగు లేదు.
Mn+2 = [Ar] 3d5 పింక్ రంగు (గులాబి)
Fe+2 = [Ar] 3d5 లేత ఆకుపచ్చ
Sc3+ మరియు Cu+ అయాన్లు 3d0 మరియు 3d10 విన్యాసాలు కలిగి ఉన్నాయి. (బాహ్యకక్ష్యలో) కావున వీటికి రంగులేదు. మిగతా అయాన్లు అనగా Mn+2 Fe+2 లు జలద్రావణాలలో రంగు ధర్మాన్ని ప్రదర్శిస్తాయి. దీనికి కారణం అసంపూర్ణ d-ఆర్బిటాళ్ళు కలిగి ఉండటం.
ప్రశ్న 18.
మొదటి పరివర్తన శ్రేణి మూలకాల +2 ఆక్సీకరణ స్థితుల స్థిరత్వాలను పోల్చండి.
జవాబు:
| మూలకం (+2 స్థితి) | ఎలక్ట్రాన్ విన్యాసం (బాహ్య) |
| 21Sc+2 | 3d1 |
| 22Ti+2 | 3d2 |
| 23V+2 | 3d3 |
| 24Cr+2 | 3d4 |
| 25Mn+2 | 3d5 |
పైన మూలకాలతో రెండు 4s ఎలక్ట్రాన్లు తొలగింపబడ్డాయి. (Cr+2లో ఒక 4s ఎలక్ట్రాన్, ఒక 3d-ఎలక్ట్రాన్) పరమాణు సంఖ్య పెరుగుదలతో ఒంటరి ఎలక్ట్రాన్ల సంఖ్య కూడా పెరుగును. కావున M+2 కాటమాన్ల స్థిరత్వం Sc+2 నుండి Mn+2 కు పెరుగును.
![]()
ప్రశ్న 19.
హుండ్ నియమాన్ని ఉపయోగించి Ce3+ అయాన్ ఎలక్ట్రాన్ విన్యాసాన్ని ఉత్పాదించి, ‘భ్రమణ-ఆధారిత భ్రామకం’ (‘spin-only) ఆధారంగా దాని అయస్కాంత భ్రామకాన్ని లెక్కకట్టండి.
జవాబు:
Ce(Z = 58) = [Xe] 4f¹5d¹6s²
Ce+3 = [Xe]4f¹ (ఒక ఒంటరి ఎలక్ట్రాన్)

ప్రశ్న 20.
Ti2+, V2+ Cr3+, n2+ అయాన్లు ప్రతిదానిలోను ఎన్ని 3d ఎలక్ట్రాన్లు ఉంటాయో రాయండి. ఈ హైడ్రేట్ అయాన్లలో (ఆక్టాహెడ్రల్). అయిదు 3d ఆర్బిటాల్లు ఏవిధంగా నిండి ఉంటాయని ఊహిస్తున్నారో సూచించండి.
జవాబు:
ప్రశ్న 21.
వెర్నర్ సమన్వయ సమ్మేళనాల సిద్ధాంతాన్ని తగిన ఉదాహరణలతో వివరించండి. [TS. Mar.’15; Mar. ’14]
జవాబు:
వెర్నర్ సిద్ధాంతము – ప్రతిపాదనలు :
- ప్రతి సంక్లిష్ట సమ్మేళనంలోనూ మధ్యస్థ లోహ పరమాణువు లేదా అయాన్ ఉంటుంది.
- మధ్యస్థ లోహం రెండు రకాల సంయోజకతలను చూపిస్తుంది. అవి :
(a) ప్రైమరీ వేలన్సీ
(b) సెకండరీ వేలన్సీ
a) ప్రైమరీ వేలన్సీ :
సాధారణంగా ప్రైమరీ వేలన్సీ, సంఖ్యాత్మకంగా లోహపు ఆక్సిడేషన్ స్థితికి సమానంగా ఉంటుంది. ఈ వేలన్సీలకు దిశ ఉండదు. వీటిని చుక్కల గీతతో సూచిస్తారు. (………). కణాలు లేదా గ్రూపులు ప్రైమరీ వేలన్సీతో బంధించబడితే అవి పూర్తిగా అయనీకరణం చెందుతాయి. ప్రైమరీ వేలన్సీ సాధారణ లవణాల్లోని లోహాలకు, సంక్లిష్ట పదార్థాల్లోని లోహాలకు కూడా సమంగా వర్తిస్తుంది. ఈ వేలన్సీలు అయానిక బంధాల సంఖ్యతో సమానంగా ఉంటాయి. ఉదా : CoCl, (Co+3; 3CL లు ఉంటాయి). ఇందులో Coకి మూడు ప్రైమరీ వేలన్సీలుంటాయి. అంటే మూడు అయానిక బంధాలుంటాయన్న మాట.
అదే విధంగా [Co(NH3)6] Cl3 సంక్లిష్టంలో Co ప్రైమరీ వేలన్సీ మూడు.
b) సెకండరీ వేలన్సీ :
ఒక లోహపు సెకండరీ వేలన్సీలు దాని చుట్టూ సౌష్ఠవంగా, నిర్దిష్ట దిశలలో వ్యాపించి ఉంటాయి. ప్రతి లోహానికీ నిర్దిష్ట ఆక్సిడేషన్ స్థితిలో దాని స్వాభావికమయిన సెకండరీ వేలన్సీల సంఖ్య ఉంటుంది.
ఉదా 1: CoCl3. 6NH3 సంక్లిష్టంలో 3 క్లోరైడ్లు ప్రైమరీ వేలన్సీలతో బంధించబడి ఉంటాయి. ఆరు అమోనియాలు సెకండరీ వేలన్సీలతో బంధిచబడి ఉంటాయి.
ఉదా 2 : CuSO4. 4NH3 సంక్లిష్టంలో Cuతో SO42- రెండు ప్రైమరీ వేలన్సీలతో బంధించబడి ఉంటుంది. నాలుగు NH3 అణువులు సెకండరీ వేలన్సీలతో బంధింతమయి ఉంటాయి.
సెకండరీ వేలన్సీలకు దిశాలక్షణం ఉంది కాబట్టి, సంక్లిష్టాన్ని. (అణువు లేదా అయాన్)కి నిర్దిష్టమయిన ఆకృతి ఉంటుంది. సెకండరీ వేలన్సీలను అఖండిత గీత (-) తో సూచిస్తారు. సంక్లిష్టంలో లోహం కో ఆర్డినేషన్ సంఖ్య దాని సెకండరీ వేలన్సీల సంఖ్యకు సమానం అవుతుంది. క్రింది ఉదాహరణలు వెర్నర్ సిద్ధాంతాన్ని విశదీకరిస్తాయి.
ఉదా : 1) COCl3. 6NH3
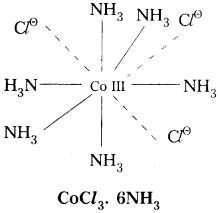
ఈ సంక్లిష్టంలో Co(III) కేంద్రక లోహ అయాన్. దీని ఆక్సిడేషన్ స్థితి III. దీనిలో ప్రాథమిక వేలన్సీ విలువ 3. ఈ వేలన్సీ ‘C’ తో సంతృప్తం చేయబడ్డాయి. ద్వితీయ వేలన్సీ విలువ 6. ఈ వేలన్సీ NH3 అణువులతో సంతృప్తం చేయబడింది.
2) CoCl3. 5NH3 :
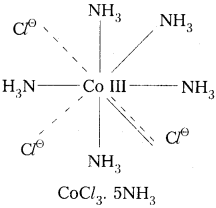
ఈ సంక్లిష్టంలో Co(III) కేంద్రక లోహ అయాన్. దీని ఆక్సిడేషన్ స్థితి III. దీనిలో ప్రాథమిక వేలన్సీ విలువ 3. ఈ వేలన్సీ. ‘C’ తో సంతృప్తం, చేయబడ్డాయి. ద్వితీయ వేలన్సీ విలువ 5. ఈ వేలన్సీ NH3 అణువులతో సంతృప్తం చేయబడింది.
3) CoCl3. 4NH4 :
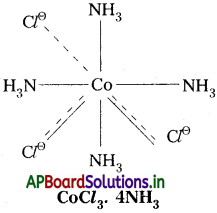
ఈ సంక్లిష్టంలో Co(III) కేంద్రక లోహ అయాన్. దీని ఆక్సిడేషన్ స్థితి III. దీనిలో ప్రాథమిక వేలన్సీ విలువ 3. ఈ వేలన్సీ ‘C’ తో సంతృప్తం చేయబడ్డాయి. ద్వితీయ వేలన్సీ విలువ 4. ఈ వేలన్సీ NH3 అణువులతో సంతృప్తం చేయబడింది.
4) CoCl3. 3 NH3 :
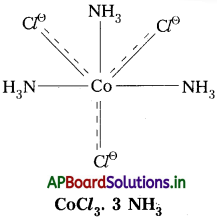
ఈ సంక్లిష్టంలో Co(III) కేంద్రక లోహ అయాన్. దీని ఆక్సిడేషన్ స్థితి III. దీనిలో ప్రాథమిక వేలన్సీ విలువ 3. ఈ వేలన్సీ ‘Cl’ తో సంతృప్తం చేయబడ్డాయి. ద్వితీయ వేలన్సీ విలువ 3. ఈ వేలన్సీ NH3 అణువులతో సంతృప్తం చేయబడింది.
ప్రశ్న 22.
క్రింది సంక్లిష్ట జాతుల జ్యామితీయ ఆకృతులను ఇవ్వండి.
ఎ) [Co(NH3)6]3+ బి) [Ni(CO)4] సి) [Pt Cl4]2- డి) [Fe(CN)6]4-.
జవాబు:
ఎ) [Co(NH3)6]3+ యొక్క జ్యామితీయ ఆకృతి ఆక్టాహెడ్రల్ (అష్టముఖీయం)
బి) [Ni(CO)4] యొక్క జ్యామితీయ ఆకృతి టెట్రాహెడ్రల్ (చతుర్ముఖీయం)
సి) [PtCl4]2- యొక్క జ్యామితీయ ఆకృతి సమతల చతురస్రం
డి) [Fe(CN)6]-4 యొక్క జ్యామితీయ ఆకృతి ఆక్టాహెడ్రల్ (అష్టముఖీయం).
ప్రశ్న 23.
క్రింది పదాలను వివరించండి.
(ఎ) లైగాండ్ (బి) సమన్వయ సంఖ్య (సి) సమన్వయ సమూహం (డి) కేంద్ర లోహ పరమాణువు/ అయాన్
జవాబు:
ఎ) లైగాండ్ :
సంక్లిష్టంలో కేంద్ర లోహ పరమాణువుకు లేదా అయాన్కు ఎలక్ట్రాన్ జంటలను దానం చేయడం ద్వారా సమన్వయ బంధాలను ఏర్పరచే అయాన్ లేదా అణువును లైగాండ్ అంటారు.
ఉదా : Cl–, CN–, Br–, SCN–
లైగాండ్లో ఒంటరి ఎలక్ట్రాన్ జంటను దానం చేసే పరమాణువును దాత పరమాణువు లేదా లిగేటింగ్ పరమాణువు అంటారు. లైగాండ్లు భిన్న రకాలు.
ఏకదంతం లైగాండ్లు :
సంక్లిష్టంలో కేంద్ర లోహపరమాణువు లేదా అయాన్కు లైగాండ్లోని ఒకే ఒక దాత పరమాణువుతో సమన్వయ సంయోజనీయబంధం ఏర్పడితే ఆ లైగాండ్ను ఏకదంత లైగాండ్ అంటారు.
ఉదా : Cl– Br– etc.
ii) బహుదంత లైగాండ్లు :
లైగాండ్లో ఒకటి కంటే అధిక సంఖ్యలో దాత పరమాణువులు ఉండి అవి కేంద్ర లోహ పరమాణువు లేదా అయాన్తో రెండు లేదా అంతకంటే ఎక్కువ సమన్వయ సంయోజనీయ బంధాలను ఏకకాలంలో ఏర్పరిస్తే ఆలైగాండ్లను బహుదంత లైగాండ్లు అంటారు.
ఉదా : C2O-24etc.
iii) ఉభయదంత లైగాండ్లు :
రెండు దాత పరమాణువుల గల ఏకదంత లైగాండ్ తనలోని రెండు పరమాణువులలో దేని ద్వారానైనా సమన్వయం చేయగలుగుతుంది. ఇటువంటి లైగాండ్లను ఉభయదంత (ఏంబిడెంటేడ్) లైగాండ్లు లేదా కీలేట్ లైగాండ్లు అంటారు.
ఉదా : C2O-24, CO-23 etc.
బి) సమన్వయ సంఖ్య :
సమన్వయ సమ్మేళనం/అయాన్లో కేంద్ర లోహ పరమాణువు లేదా అయాన్తో లైగాండ్లు ఏర్పరచే సమన్వయ బంధాల సంఖ్యను సమన్వయ సంఖ్య అంటారు.
ఉదా : (NH3)6]Cl3లో సమన్వయ సంఖ్య ఆరు
సి) సమన్వయ సమూహం :
కేంద్ర లోహ పరమాణువు లేదా అయాన్ తో స్థిరసంఖ్యలో అణువుల, లేదా అయాన్ల సమన్వయ బంధి-ల ద్వారా ఏర్పడిన దానిని సమన్వయ సమూహం అంటారు.
డి) కేంద్ర లోహ పరమాణువు (లేదా) అయాన్ :
సమన్వయ సమూహంలో దేనితోనైతే స్థిరసంఖ్యలో అయాన్లు లేదా గ్రూపులు నిర్దిష్టమైన త్రిజ్యామితీ విన్యాసంలో బంధం ఏర్పరుస్తాయో ఆలోహ పరమాణువు లేదా అయానన్ను కేంద్ర లోహ పరమాణువు లేదా అయాన్ అంటారు.
ఉదా : (Ni (CO)4) లో Ni కేంద్ర లోహపరమాణువు
![]()
ప్రశ్న 24.
క్రింది పదాలను వివరించండి. (ఎ) ఏకదంత లైగాండ్ (బి) ద్విదంత లైగాండ్ (సి) బహుదంత లైగాండ్ (డి) ఏంబిడెంటేట్ (ఉభయదంత) లైగాండ్ ఒక్కొక్కదనాకి ఒక్కొక్క ఉదాహరణ ఇవ్వండి.
జవాబు:
ఎ) ఏకదంతం లైగాండ్లు :
సంక్లిష్టంలో కేంద్ర లోహపరమాణువు లేదా అయాన్కు లైగాండ్లోని ఒకే ఒక దాత పరమాణువుతో సమన్వయ సంయోజనీయబంధం ఏర్పడితే ఆ లైగాండ్ను ఏకదంత లైగాండ్ అంటారు.
![]()
బి) ద్విదంత లైగాండ్లు :
రెండు దాత పరమాణువుల ద్వారా సమన్వయ సంయోజనీయ బంధాలను ఏర్పరచే లైగాండ్లను ద్విదంత లైగాండ్లు అంటారు.
ఉదా : C2O-24
సి) బహుదంత లైగాండ్లు :
లైగాండ్లో ఒకటి కంటే అధిక సంఖ్యలో దాత పరమాణువులు ఉండి అవి కేంద్ర లోహ పరమాణువు లేదా అయాన్ రెండు లేదా అంతకంటే ఎక్కువ సమన్వయ సంయోజనీయ బంధాలను ఏకకాలంలో ఏర్పరిస్తే ఆలైగాండ్లను బహుదంత లైగాండ్లు అంటారు.
ఉదా : C2O-24
డి) ఉభయదంత లైగాండ్లు:
రెండు దాత పరమాణువుల గల ఏకదంత లైగాండ్ తనలోని రెండు పరమాణువులలో దేని ద్వారానైనా సమన్వయం చేయగలుగుతుంది. ఇటువంటి లైగాండ్లను ఉభయదంత (ఏంబిడెంటేడ్) లైగాండ్లు లేదా కీలేట్ లైగాండ్లు అంటారు.
ఉదా : C2O2-4, C2O-23 etc
ప్రశ్న 25.
‘కీలేట్ ప్రభావం’ అంటే ఏమిటి? ఉదాహరణ ఇవ్వండి.
జవాబు:
ద్విదంత (లేదా) బహుదంత లైగాండ్లలోని దాత పరమాణువులు కేంద్ర లోహ అయాన్ లేదా పరమాణువుతో సమన్వయ సంయోజనీయ బంధాలను ఏర్పరచి 5 లేదా 6 పరమాణువుల సంఖ్య గల వలయములను ఏర్పరచుటను కీలేట్ ప్రభావం అంటారు.
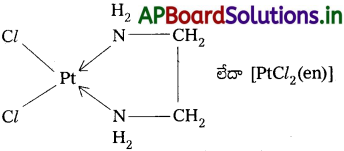
ప్రశ్న 26.
క్రింది సంక్లిష్ట జాతులలో కేంద్ర లోహ పరమాణువుల ఆక్సీకరణ సంఖ్యలను ఇవ్వండి.
(ఎ) [Ni(CO)4] (బి) [Co(NH3)6]3+ (సి) [Fe(CN)6]4- (డి) [Fe(C2O4)3]3-
జవాబు:
ఎ) [Ni(CO)4] :
x + 4(0) = 0
x = 0
‘Ni’ యొక్క ఆక్సీకరణ స్థితి = 0
బి) [Co(NH3)6]3+ :
x + 6(0) = +3
x = + 3
‘Co’ యొక్క ఆక్సీకరణ స్థితి + 3.
సి) [Fe(CN)6]4- :
x + 6(-1) = -4
x = + 2
‘Fe’ యొక్క ఆక్సీకరణ స్థితి + 2.
డి) [Fe(C2O4)3]3-
x + 3(-2) = -3
X = + 3
‘Fe’ యొక్క ఆక్సీకరణ స్థితి + 3.
ప్రశ్న 27.
IUPAC నియమాలు ఉపయోగించి క్రింది వాటి సాంకేతికాలు రాయండి.
(ఎ) టెట్రాహైడ్రాక్సోజింకేట్ (II) (బి) హెక్సమీన్ కోబాల్ట్ (సి) పొటాషియమ్ టెట్రాక్లోరోపల్లాడేట్ (II) పొటాషియమ్ ట్రై
(ఆగ్జలేటో) క్రోమేట్ (III)
జవాబు:
ఎ) టెట్రా హైడ్రాక్సో జింకెట్ (II) – [Zn(OH)4]-2
బి) హెక్సమీన్ కోబాల్ట్ (III) సల్ఫేట్ – [Co(NH3)6]2 (SO4)3
సి) పొటాషియం టెట్రాక్లోరో పల్లాడేట్ (II) – K2[PdCl42]
డి) పొటాషియం ట్రై (ఆగ్జలేటో) క్రోమేట్ (III) – K3[Cr(C2O4)3]
ప్రశ్న 28.
IUPAC నియమాలు ఉపయోగించి క్రింది వాటి శాస్త్రీయ నామాలను రాయండి.
(ఎ) [Co(NH3)6]Cl3 (బి) [Pt(NH3)2Cl(NH2CH3)]Cl (సి) [Ti(H2O)6]3+ (డి) [NiCl4]2-
జవాబు:
ఎ) హెక్సావిమీన్ కోబాల్ట్ (III) క్లోరైడ్
బి) డై ఎమీన్ క్లోరో (మిథైల్ ఏమీన్) ప్లాటినమ్ (II) క్లోరైడ్
సి) హెక్సా ఆక్వా టైటానియం (III) అయాన్
డి) టెట్రాక్లోరో నికెలేట్ (III) అయాన్
![]()
ప్రశ్న 29.
సమన్వయ సమ్మేళనాలలో జ్యామితీయ సాదృశ్యాన్ని తగిన ఉదాహరణలు ఇచ్చి వివరించండి.
జవాబు:
క్షేత్ర సాదృశ్యం :
- సమన్వయ సంక్లిష్టాలలో లైగాండ్లకు విభిన్న జ్యామితీయ అమరికలు సాధ్యమవడం వల్ల ఈ సాదృశ్యం సంభవిస్తుంది.
- సమన్వయ సంఖ్యలు 4, 6 గల సంక్లిష్టాలు ఈ రకం సాదృశ్యానికి ముఖ్య ఉదాహరణలు.
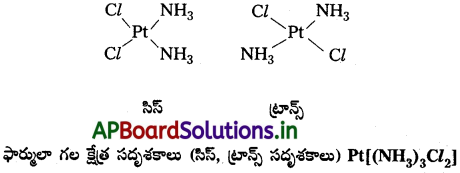
- [MX2L2] [X, L లు ఏకదంత లైగాండ్లు] ఫార్ములాతో సూచించబడిన సమతల చతురస్ర సంక్లిష్టంలో X లైగాండ్లు రెండూ ఒకదానికొకటి పక్కపక్కన ఉన్నట్లైతే దానిని సిస్ సాదృశ్యం అంటారు. వ్యతిరేక దిశలలో ఉన్నట్లైతే ట్రాన్స్ సాదృశ్యం అంటారు.
- [MAB XL] (A, B, X, L లు నాలుగు ఏకదంత లైగాండ్లే) అనే ఇతర సమతల చతురస్ర సంక్లిష్టం మూడు సదృశకాలను రెండు సిస్, ఒక ట్రాన్స్ ఏర్పరుస్తుంది. ఈ రకం ప్రవర్తన టెట్రా హెడ్రల్ జ్యామితి గల సంక్లిష్టాలలో తటస్థపడదు.
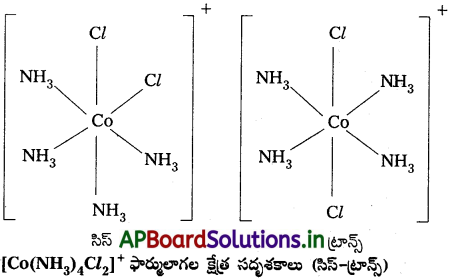
- [MX2L4] ఫార్ములా గల ఆక్టాహెడ్రల్ సంక్లిష్టాలలో సాధ్యపడుతుంది. రెండు X లు సిస్ విన్యాసంలో లేదా ట్రాన్స్ విన్యాసంలో ఉంటాయి.
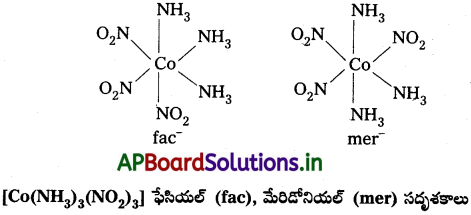
- [Co(NH3)4NO2)3] లాంటి [Ma3b3] రకం ఆక్టాహెడ్రల్ సమన్వయ సమూహాలలో వేరొక రకం క్షేత్ర సాదృశ్యం తటస్థపడుతుంది. దీనిలో అదే లైగాండ్లకు చెందిన మూడు దాత పరమాణువులు సంక్లిష్ట నిర్మాణంలో ఆక్టాహెడ్రల్ ఫలకంలో పక్కపక్క స్థానాలను ఆక్రమిస్తాయి. వీటిని ఫేషియల్ (fac) సదృశకాలు అని అంటారు. లైగాండ్లు ఆక్టా హెడ్రల్ మెరిడియన్ చుట్టూ వ్యాప్తి చెంది ఉంటే ఆ సదృశకాన్ని మెరిడోనియల్ (mer) సదృశకం అంటారు.
ప్రశ్న 30.
హోమోలిప్టిక్, హెటిరోలోప్టిక్ సంక్లిష్టాలు అంటే ఏమిటి? ఒక్కొక్కదానికి ఒక్కొక్క ఉదాహరణ ఇవ్వండి.
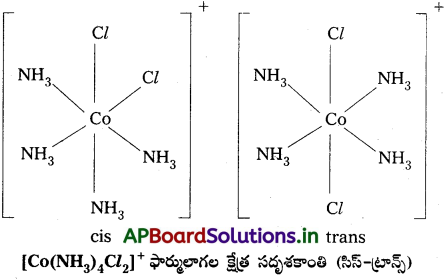
జవాబు:
హోమోలిప్టిక్, హెటిరోలోప్టిక్ సంక్లిష్టాలు :
ఒక సంక్లిష్టంలోని లోహంతో బంధితమైన లైగాండ్లు అన్నీ ఒకే రకం (సమానమైనవి) అయితే ఆ సంక్లిష్టాన్ని హోమోలెప్టిక్ సంక్లిష్టాలు అంటారు. ఉదాహరణకు [Co(NH3)6]3+. సంక్లిష్టంలో లోహంతో ఒకటి కంటే ఎక్కువ రకాల (భిన్న) లైగాండ్లు బంధితమై ఉంటే ఆ సంక్లిష్టాన్ని హెటిరోలెప్టిక్ సంక్లిష్టం అంటారు. ఉదాహరణకు [Co(NH3)4 Cl2]+.
దీర్ఘ సమాధాన ప్రశ్నలు
ప్రశ్న 1.
క్రింది వాటిని తగిన కారణాలతో వివరించండి.
(ఎ) పరివర్తన లోహాలు, వాటి అనేక సమ్మేళనాలు పరాఅయస్కాంత స్వభావాన్ని చూపిస్తాయి.
(బి) పరివర్తన లోహాల పరమాణీకరణ ఎంథాల్పీలు అధికంగా ఉంటాయి.
(సి) పరివర్తన లోహాలు సాధారణంగా రంగు ఉన్న సమ్మేళనాలను ఏర్పరుస్తాయి.
(డి) పరివర్తన లోహాలు, వాటి అనేక సమ్మేళనాలు మంచి ఉత్ప్రేరకాలుగా పనిచేస్తాయి.
జవాబు:
ఎ) పరివర్తనమూలకాలలో ఒంటరి ఎలక్ట్రాన్లు ఉంటాయి. ఈ ఒంటరి ఎలక్ట్రాన్లు సూక్ష్మ అయస్కాంతాల వలె పనిచేస్తాయి. అందువలన పరివర్తన మూలక లోహాలు పారా అయస్కాంత స్వభావం కలిగి ఉంటాయి.
బి) పరివర్తన మూలకాలలో అధిక సంఖ్యలో ఒంటరి ఎలక్ట్రాన్లు కలిగి ఉండుటవలన వీటి పరమాణువుల మధ్య బలమైన అంతర పరమాణుక ఆకర్షణలు కలిగి ఉండి బలమైన బంధాలను ఏర్పరుస్తాయి. ఈ కారణం చేత ఈ లోహాలు అధిక పరమాణీకరణ ఎంథాల్పీలు కలిగి ఉంటాయి.
సి) పరివర్తన లోహాలలో ఒంటరి ఎలక్ట్రాన్లు కలిగి ఉంటాయి. ఈ ఒంటరి ఎలక్ట్రాన్లు దృగ్గోచర ప్రాంతంలోని కాంతిని శోషించుకొని d-d పరివర్తనాలు జరుపుతాయి. ఈ d-d పరివర్తనలు వల్ల ఇవి రంగు ధర్మాన్ని ప్రదర్శిస్తాయి.
డి) పరివర్తన మూలకాలు, వాటి సమ్మేళనాలు ఉత్ప్రేరక ధర్మాలు ప్రదర్శిస్తాయి. ఈ ఉత్ప్రేరక ధర్మాలకు కారణం, పరివర్తన మూలకాలకు ఒకటి కంటే ఎక్కువ ఆక్సీకరణ స్థితులు కలిగి ఉండటం, సంక్లిష్టాలు ఏర్పరచటం.
ఉదా : Fe (హేబర్ పద్ధతిలో)
V2O5 (స్పర్శ పద్ధతి)
Ni (నూనెల హైడ్రోజనీకరణం)
పరివర్తన లోహ అయాన్లు, వాటి ఆక్సీకరణ స్థితులు మార్చుకోగలిగి ప్రభావాత్మక ఉత్ప్రేరకాలుగా పనిచేస్తాయి. I– + S2O-28 ల మధ్య జరిగే చర్యలో ఐరన్ (III) ఉత్ప్రేరక క్రియాశీలత ఈ క్రింద చర్యల ద్వారా వివరించబడినది.
ప్రశ్న 2.
పొటాషియమ్ పర్మాంగనేట్ తయారీని వర్ణించండి. ఆమ్లీకృత పొటాషియమ్ పర్మాంగనేట్ ద్రావణం క్రింది వాటితో ఎలా చర్య జరుపుతుంది?
(ఎ) ఐరన్ (బి) అయాన్లు SO2 (సి) ఆగ్జాలిక్ ఆమ్లం అయానిక సమీకరణాలు రాయండి.
జవాబు:
MnO2 ను క్షార లోహ హైడ్రాక్సైడ్, KNO2 లాంటి ఆక్సీకరణితో గలనం చెందించి, KMnO4 ను తయారుచేస్తారు. ఈ చర్యలో ముదురు ఆకుపచ్చ పొటాషియం మాంగనేట్ K2MnO4 ఏర్పడి అది తటస్థ లేదా ఆమ్ల ద్రావణంతో అననుపాతం చెంది పొటాషియం పర్మాంగనేట్ను ఇస్తుంది.

ప్రశ్న 3.
క్రింది ధర్మాలకు సంబంధించి, ఆక్టినైడ్ల రసాయనశాస్త్రాన్ని, లాంథనైడ్లతో సోల్చండి.
(ఎ) ఎలక్ట్రాన్ విన్యాసం (బి) ఆక్సీకరణ స్థితి (సి) పరమాణు, అయానిక పరిమాణాలు (డి) రసాయన చర్యాశీలత
జవాబు:
| లాంథనైడ్లు | ఆక్టినైడ్లు |
| ఎ) ఎలక్ట్రాన్ విన్యాసం [Xe]54 4f1-145d0-16s² |
ఎలక్ట్రాన్ విన్యాసం [Rn]86 5f1-146d0-17s2 |
| బి) ఆక్సీకరణ స్థితులు సాధారణ ఆక్సీకరణ స్థితి = +3 మిగిలిన ఆక్సీకరణ స్థితులు = +2, +4 |
ఆక్సీకరణ స్థితులు సాధారణ ఆక్సీకరణ స్థితి = +3 మిగిలిన ఆక్సీకరణ స్థితులు = +4, +5, +6 |
| సి) పరమాణు, అయానిక పరిమాణాలు పరమాణు పరిమాణం లేదా అయాన్ పరిమాణం లాంథనైడ్ల శ్రేణిలో పరమాణు సంఖ్య పెరిగే కొలది నెమ్మదిగా తగ్గును. |
పరమాణు, అయానిక పరిమాణాలు పరమాణు పరిమాణం లేదా అయాన్ పరిమాణం ఆక్టినైడ్ల శ్రేణిలో పరమాణు సంఖ్య పెరిగే కొలది నెమ్మదిగా తగ్గును. |
| డి) రసాయన చర్యాశీలత a) సంక్లిష్టాలను ఏర్పరచే సామర్థ్యం తక్కువ. b) ప్రోమిథియం తప్ప మిగతా మూలకాలు రేడియోధార్మికమైనది కావు. c) ఆక్సోకాటయాన్ లు ఏర్పరచవు. d) ఆక్సైడ్లు, హైడ్రాక్సైడ్లు తక్కువ క్షారత్వం కలదు. |
రసాయన చర్యాశీలత a) సంక్లిష్టాలను ఏర్పరచే సామర్థ్యం ఎక్కువ. b) అని ఆక్టినైడ్లు రేడియో ధార్మిక మూలకాలు. c) UO2+2, Pu02+2, UO+, లాంటి కాటయాన్లు ఏర్పరుస్తాయి. d) ఆక్సైడ్లు, హైడ్రాక్సైడ్లు తక్కువ క్షారత్వం కలదు. |
ప్రశ్న 4.
క్రింది వాటిని ఎలా వివరిస్తారు?
ఎ) d4 జాతులలో, Cr2+ బలమైన క్షయకరణి అయితే, మాంగనీస్ (III) బలమైన ఆక్సీకరణి
బి) జలద్రావణంలో కోబాల్ట్ (II) కు స్థిరత్వం ఉంటుంది. కానీ సంక్లిష్టాలను ఏర్పరచే కారకాల సమక్షంలో సులభంగా ఆక్సీకరణం చెందుతుంది.
సి) అయాన్లలో d¹ విన్యాసం చాలా అస్థిరమైనది.
జవాబు:
ఎ) Cr+3/Cr+2 యొక్క E° విలువ ఋణాత్మకమైనది (-0.41 V) Mn+3/Mn+2 యొక్క Eo విలువ ధనాత్మకమైనది (+1.57 V) Cr+2 అయాన్లు ఎలక్ట్రాన్లు కోల్పోయి Cr+3 గా మారి క్షయకరణిగా పనిచేయును. Mn+3 అయాన్ ఎలక్ట్రాన్ గ్రహించి Mn+2 గా మారి ఆక్సీకరణిగా పనిచేయును.
బి) Co (III) అయాన్క Co (II) అయాన్ కంటే సంక్లిష్టాలను ఏర్పరచే సామర్థ్యం ఎక్కువ. సంక్లిష్టాలను ఏర్పరచే కారకాల సమక్షంలో Co (III) అయాన్గా జలద్రావణం స్థిరంగా ఉండి Co (III) అయాన్గా ఆక్సీకరణం చెందును.
సి) d¹ ఎలక్ట్రాన్ విన్యాసం కలిగిన పరివర్తనములకు లోహాలు ఒక ఎలక్ట్రాన్ కోల్పోయి d0– ఎలక్ట్రాన్ విన్యాసం ఏర్పరచును. ఇది స్థిరమైనది. కావున ఈ అయాన్లు (d¹-విన్యాసం) ఆక్సీకరణం లేదా అననుపాత చర్య జరిపి స్థిరమైన d0 విన్యాసం పొందుతాయి.
![]()
ప్రశ్న 5.
పరివర్తన లోహాల క్రింది లక్షణాలకు కారణాలను తెలిపి, ఉదాహరణలు ఇవ్వండి.
ఎ) పరివర్తన లోహం అల్పస్థాయి ఆక్సైడు క్షార స్వభావం ఉంటే, అధికస్థాయి ఆక్సైడ్కు ద్విస్వభావం/ఆమ్ల స్వభావం ఉంటుంది.
బి) పరివర్తన లోహం, దాని ఆక్సైడ్లలోను, ఫ్లోరైడ్లలోను అత్యధిక ఆక్సీకరణ స్థితిని ప్రదర్శిస్తుంది.
సి) లోహ ఆక్సీ ఆనయాన్లలో అత్యధిక ఆక్సీకరణ స్థితి ప్రదర్శితమవుతుంది.
జవాబు:
ఎ) మూలకం యొక్క ఆక్సీకరణ స్థితి పెరిగే కొలది ఆక్సైడ్ల ఆమ్ల స్వభావం పెరుగును.
ఉదా : MnO(Mn+2) క్షార ఆక్సైడ్, Mn2O, (Mn+7) ఆమ్ల ఆక్సైడ్
బి) ఆక్సిజన్ మరియు ఫ్లోరిన్ లు రెండు అధిక ఋణ విద్యుదయస్కాంత మూలకాలు. ఇవి పరివర్తన మూలకం యొక్క ఆక్సీకరణ స్థితిని పెంచుతాయి. ఆక్సిజన్ మూలకం పరివర్తన మూలకంతో బహు బంధాలను ఏర్పరచి ఆక్సీకరణ స్థితి
పెరుగుటకు కారణం అగును.
సి) లోహ ఆక్సీ ఆనయాన్లలో అత్యధిక ఆక్సీకరణ స్థితికి కారణం ఆక్సిజన్ యొక్క అధిక ఋణ విద్యుదాత్మకత.
ఉదా : [CrO4]-2 లో Cr ఆక్సీకరణ స్థితి + 6, [MnO4]– లో Mn ఆక్సీకరణ స్థితి + 7
ప్రశ్న 6.
క్రింది ధర్మాలకు సంబంధించి, ఆక్టినైడ్ల రసాయనశాస్త్రాన్ని, లాంథనైడ్లతో పోల్చండి.
ఎ) ఎలక్ట్రాన్ విన్యాసం
బి) ఆక్సీకరణ స్థితి
సి) పరమాణు, అయానిక సైజులు
డి) రసాయన చర్యాశీలత
ఇ) అయస్కాంత ధర్మాలు
ఎఫ్) అయనీకరణ ఎంథాల్పీ
జవాబు:
| లాంథనైడ్లు | ఆక్టినైడ్లు |
| ఎ) ఎలక్ట్రాన్ విన్యాసం [Xe]54 4f1-145d0-1652 |
ఎలక్ట్రాన్ విన్యాసం [Rn]86 5f1-146d0-17s2 |
| బి) ఆక్సీకరణ స్థితులు సాధారణ ఆక్సీకరణ స్థితి = +3 మిగిలిన ఆక్సీకరణ స్థితులు +2, +4 |
ఆక్సీకరణ స్థితులు సాధారణ ఆక్సీకరణ స్థితి = +3 మిగిలిన ఆక్సీకరణ స్థితులు = +4, +5, +6 |
| సి) పరమాణు, అయానిక పరిమాణాలు పరమాణు పరిమాణం లేదా అయాన్ పరిమాణం లాంథనైడ్ల శ్రేణిలో పరమాణు సంఖ్య పెరిగే కొలది నెమ్మదిగా తగ్గును. actinoid of its own group. |
పరమాణు, అయానిక పరిమాణాలు పరమాణు పరిమాణం లేదా అయాన్ పరిమాణం ఆక్టినైడ్ల శ్రేణిలో పరమాణు సంఖ్య పెరిగే కొలది నెమ్మదిగా తగ్గును. |
| డి) రసాయన చర్యాశీలత a) సంక్లిష్టాలను ఏర్పరచే సామర్థ్యం తక్కువ. b) ప్రోమిథియం తప్ప మిగతా మూలకాలు రేడియోథార్మికమైనది కావు. c) ఆక్సోకాటయాన్లు ఏర్పరచవు. | రసాయన చర్యాశీలత a) సంక్లిష్టాలను ఏర్పరచే సామర్థ్యం ఎక్కువ.’ b) అని ఆక్టినైడ్లు రేడియో ధార్మిక మూలకాలు. c) UO2+2, PuO2+2, UO+, లాంటి కాటయాన్లు ఏర్పరుస్తాయి. |
ప్రశ్న 7.
సమన్వయ సమ్మేళనాల IUPAC నామకరణ విధానాన్ని తగిన ఉదాహరణలతో వివరించండి.
జవాబు:
IUPAC నామకరణం :
ఒక సంయోగ పదార్థం ఫార్ములాను ఆ పదార్థం సంఘటనను తెలిపే లఘు వర్ణనగా భావిస్తారు. . సమన్వయ సమ్మేళనాలకు నామకరణం చేయడానికి క్రింది నియమాలను IUPAC వారు ప్రతిపాదించారు.
i) సంక్లిష్ట ధనావేశ అయాన్ పేరును ముందు రాసి తరువాత రుణావేశ అయాన్ పేరు రాయాలి.
ఉదా : పొటాషియమ్ హెక్సాసయనోఫెర్రేట్ (II), ఫార్ములా-K4[Fe(CN)6]
ii) సంక్లిష్ట మండలంలో లైగాండ్ పేర్లను లోహం పేరుకు ముందు రాయాలి. అయితే ఫార్ములా రాసేటప్పుడు లోహ పరమాణువు సంకేతాన్ని ముందుగా రాయాలి.
ఉదా : టెట్రా ఎమన్కాపర్ (II) సల్ఫేట్. ఫార్ములా-[Cu(NH3)4]SO4
iii) సమన్వయ సంక్లిష్ట ఫార్ములాలో సజాతి లైగాండ్లు ఒకటి కంటే ఎక్కువ ఉంటే వాటి సంఖ్యను పూర్వపదం (Prefix) ద్వారా తెలపాలి. సంక్లిష్ట లైగాండ్ను బ్రాకెట్లలో ( ) రాసి, దీని ముందు పూర్వపదాలు బిస్, టిన్లను రాయాలి.
ఉదాహరణలు :
| సమన్వయ (సంక్లిష్ట) మండలంలోని లైగాండ్ల సంఖ్య | వాడవలసిన పూర్వపదాలు | |
| సాధారణ లైగాండ్ | సంక్లిష్ట లైగాండ్ | |
| 2 | డై | బిస్ |
| 3 | ట్రై | ట్రిస్ |
| 4 | టెట్రా | టెట్రాకిస్ |
| 5 | పెంటా | పెంటాకిస్ |
| 6 | హెక్సా | హెక్సాకిస్ |
ఉదా : [Co(NH2CH2CH2NH2) Cl2] Cl ను డైక్లోరోబిస్ (ఇథిలీన్ ఎమీన్) కోబాల్ట్ (III) క్లోరైడ్గా రాయాలి.
iv) లైగాండ్ల పేర్లను, ఆంగ్ల భాషలోని పేర్ల ఆధారంగా, అక్షర క్రమంలో రాయాలి.
ఉదా : [PtCl2(NH3)2] డైఎమీన్ డైక్లోరోప్లాటినమ్ (II)
v) రుణవిద్యుదావేశ లైగాండ్ల పేర్లను, పేర్ల చివర ‘ఓ’ను కలిపి రాయాలి. తటస్థ లైగాండ్లను వాటి సహజ పేర్లతోనే రాయాలి.
ఉదా : Cl– – క్లోరో, CN– – సయనో
పై వాటి మినహాయింపులను క్రింద చూడండి.
| లైగాండ్ | తెలిపే పద్దతి |
| H2O | ఆక్వా |
| NH3 | అమోనియా |
| CO | కార్బొనైల్ |
| NO | నైట్రోసైల్ |
vi) లోహ పరమాణువు ఆక్సీకరణ స్థితిని బ్రాకెట్లో రోమన్ అంకెతో రాస్తారు.
ఉదా : [Ag(NH3)2] [Ag(CN)2] ను డైఎమీన్ సిల్వర్ (I) డైసయనో అర్జెంటేట్ (I)గా రాయాలి.
vii)సంక్లిష్ట భాగం విద్యుదావేశం రుణవిద్యుదావేశం అయితే లోహం పేరు చివరన ఏట్ (ate) గా రాయాలి.
ఉదా : [Co(SCN)4]2- – టెట్రాథయోసయనేటోకోబాల్టేట్ (II)
కొన్ని లోహాలకు వాటి గ్రీకు, లాటిన్ పేర్లను వాడుతున్నా కదా! కాబట్టి వాటి ఆధారంగా పేర్లను రాయాలి.
ఉదా : Fe – ఫెర్రేట్ Pb – ప్లంబేట్ Sn – స్టానేట్, Ag – అర్జంటేట్, Au – ఆరేట్
viii) సంక్లిష్టాలలో రెండు లైగాండ్ల స్థానాలను, అవి పక్కపక్కన ఉన్నాయా లేదా ఒక దానిని మరొకటి వ్యతిరేకించి దిశలో ఉన్నాయా అనే దానిని అనుసరించి వాటి పేర్లకు ముందు సిస్ (పక్కపక్కన) లేదా ట్రాన్స్ (వ్యతిరేక దిశలో) అనే పూర్వపదం (Prefix) రాయాలి.
ix) సంక్లిష్టంలో రెండు లోహ అయాన్లను కలుపుతూ ఉండే బ్రిడ్జ్ లైగాండ్లు ఉంటే ఆ సమన్వయ లైగాండ్ను µ అనే గ్రీకు అక్షర పూర్వపదం ఉంచి రాయాలి.
ఉదా : [(NH3)4 Co(OH)(NH2)Co(NH3)4]+ ను µ-ఎమిడో-µ హైడ్రాక్సోబిస్ (టెట్రాఎమీన్) కోబాల్ట్ (IV) గా రాయాలి.
సమన్వయ సమ్మేళనాల IUPAC నామకరణాన్ని క్రింది ఉదాహరణలు వివరిస్తాయి.
ఎ) టెట్రా హైడ్రాక్సో జింకెట్ (II) – [Zn(OH)4]-2
బి) హెక్సమీన్ కోబాల్ట్ (III) సల్ఫేట్ – [Co(NH3)6]2 (SO4)3
సి) పోటాషియం టెట్రాక్లోరో పల్లాడేట్ (II) – K2[PdCl4]
డి) పొటాషియం ట్రై (ఆగ్జలేటో) క్రోమేట్ (III) – K2[Cr(C2O4)3]
![]()
ప్రశ్న 8.
సమన్వయ సమ్మేళనాలు ప్రదర్శించే వివిధ రకాల అణుసాదృశ్యాలను తగిన ఉదాహరణలతో వివరించండి.
జవాబు:
ఒకే అణుఫార్ములా ఉండి, విభిన్న పరమాణు అమరికలు గల సమ్మేళనాలను ఐసోమర్లు లేదా సాదృశ్యకాలను ప్రదర్శిస్తాయి.
a) ప్రాదేశిక సాదృశ్యం
b) నిర్మాణాత్మక సాదృశ్యం
ఎ) ప్రాదేశిక సాదృశ్యం :
ఒకే అణు ఫార్ములా కలిగి ఉండి, లైగాండ్ల ప్రాదేశిక అమరికలో భేదం కనపరచే రెండు సమన్వయ సమ్మేళనాలు ప్రదర్శించే సాదృశ్యాన్ని ప్రాదేశిక సాదృశ్యం అంటారు.
దీనిని రెండు వర్గాలుగా విభజించారు.
(i) క్షేత్ర సాదృశ్యం (ii) దృక్ సాదృశ్యం
బి) నిర్మాణాత్మక సాదృశ్యం :
నిర్మాణాత్మక సాదృశ్యంను ఈ క్రింది వర్గాలుగా విభజించారు.
- బంధ సాదృశ్యం
- సమన్వయ సాదృశ్యం
- అయనీకరణ సాదృశ్యం
- హైడ్రేట్ సాదృశ్యం
a. i) క్షేత్ర సాదృశ్యం :
- సమన్వయ సంక్లిష్టాలలో లైగాండ్లకు విభిన్న జ్యామితీయ అమరికలు సాధ్యమవడం వల్ల ఈ సాదృశ్యం సంభవిస్తుంది.
- సమన్వయ సంఖ్యలు 4, 6 గల సంక్లిష్టాలు ఈ రకం సాదృశ్యానికి ముఖ్య ఉదాహరణలు.
- [MX2L2] [X, Lలు ఏకదంత లైగాండ్లు] ఫార్ములాతో సూచించబడిన సమతల చతురస్ర సంక్లిష్టంలో x లైగాండ్లు రెండూ ఒకదానికొకటి పక్కపక్కన ఉన్నట్లైతే దానిని సిస్ సాదృశ్యం అంటారు. వ్యతిరేక దిశలలో ఉన్నట్లైతే ట్రాన్స్ సాదృశ్యం అంటారు.
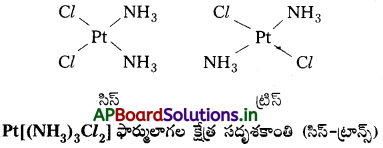
- [MAB XL] (A, B, X, L లు నాలుగు ఏకదంత లైగాండ్లే) అనే ఇతర సమతల చతురస్ర సంక్లిష్టం మూడు సదృశకాలను రెండు సిస్, ఒక ట్రాన్స్ ఏర్పరుస్తుంది. ఈ రకం ప్రవర్తన టెట్రా హెడ్రల్ జ్యామితి గల సంక్లిష్టాలలో తటస్థపడదు:
- [MX2L4] ఫార్ములా గల ఆక్టాహెడ్రల్ సంక్లిష్టాలలో సాధ్యపడుతుంది. రెండు X లు సిస్ విన్యాసంలో లేదా ట్రాన్స్. విన్యాసంలో ఉంటాయి.
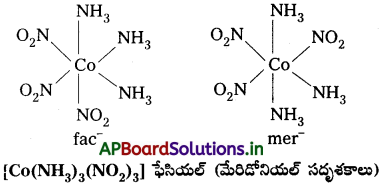
- Co(NH3)4 NO2)3) – లాంటి [Ma3b3] రకం ఆక్టాహెడ్రల్ సమన్వయ సమూహాలలో వేరొక రకం క్షేత్ర సాదృశ్యం తటస్థపడుతుంది. దీనిలో అదే లైగాండ్లకు చెందిన మూడు దాత పరమాణువులు సంక్లిష్ట నిర్మాణంలో ఆక్టాహెడ్రల్ ఫలకంలో పక్కపక్క స్థానాలను ఆక్రమిస్తాయి. వీటిని ఫేషియల్ (fac) సదృశకాలు అని అంటారు. లైగాండ్లు ఆక్టాహెడ్రల్ మెరిడియన్ చుట్టూ వ్యాప్తి చెంది ఉంటే ఆ సదృశకాన్ని మెరిడోనియల్ (mer) సదృశకం అంటారు.
(ii) దృక్ సాదృశ్యం :
రెండు సదృశకాలు ఒకదానికొకటి అధ్యారోపితం కాని బింబ, ప్రతిబింబాలుగా ఉంటే దృక్ సాదృశ్యం ప్రాప్తిస్తుంది. ఈ రకం సదృశకాలను దృక్ సదృశకాలు లేదా ఎనాన్షియోమర్లు అంటారు. అధ్యారోపితం కాని అణువులు లేదా అయాన్లను కైరల్ (chiral) అణువులు లేదా అయాన్లు అంటారు. పొలారిమీటర్లో సమతల ధ్రువిత కాంతి సమతలాన్ని భ్రమణం చేసే దిశ ఆధారంగా (కుడివైపుకు అయితే d, ఎడమవైపుకు అయితే I) ఈ రెండు రూపాలను (సదృశకాలను) డెక్ (d), లీవో (1) అంటారు. ద్విదంత (బైడెండేట్) లైగాండ్లు గల ఆక్టాహెడ్రల్ సంక్లిష్టాలలో దృక్ సాదృశ్యం సామాన్యంగా ప్రాప్తిస్తుంది.
[PtCl2 (en)2]2+ సంక్లిష్టంలో సిస్ సదృశకం మాత్రమే ధ్రువణ భ్రమణతను ప్రదర్శిస్తుంది.
బి) (i) నిర్మాణాత్మక సాదృశ్యం :
(బంధసాదృశ్యం) : బంధ సాదృశ్యం చూపించే సమన్వయ అణువు లేదా అయాన్లో కనీసం ఒక ఏంబిడెంటేట్ లైగాండ్ ఉండాలి. NCS– లైగాండ్ గల సంక్లిష్టం ఒక ఉదాహరణ. ఒక బంధ సంక్లిష్టంలో M- SCN బంధం ఏర్పడుతుంది.
ఉదా : [Mn(CO)5SCN] మరియు [Mn(CO)5NCS]
(ii) సమన్వయ సాదృశ్యం :
సంక్లిష్టంలో ఉండే విభిన్న లోహాలలోని కాటయానిక, ఆనయానిక సమూహాల మధ్య లైగాండ్లు వినిమయం చెందడం వలన ఈ సాదృశ్యం ఏర్పడుతుంది.
ఉదా : [Co(NH3)6] [Cr(CN)6] and [Co(CN)6] [Cr(NH3)6]
(iii) అయనీకరణ సాదృశ్యం :
సంక్లిష్టం సమ్మేళనంలోని ప్రతి అయాన్ కూడా లైగాండ్గా పని చేయగలిగితే ఈ రకం సాదృశ్యం ఏర్పడుతుంది.
ఉదా : [Co(NH3)5SO4] Br మరియు [Co(NH3)5Br]SO4
(iv) హైడ్రేట్ సాదృశ్యం :
నీరు ద్రావణిగా పనిచేయడం కారణంగా ఈ సాదృశ్యాన్ని హైడ్రేట్ సాదృశం అంటారు. ఇది అయనీకరణ సాదృశ్యం లాంటిదే. హైడ్రేట్ సదృశకాలలో నీటి అణువులు లోహ అయాన్లతో నేరుగా సమన్వయ బంధం ఏర్పరచగలవి గాను లేదా స్వేచ్ఛా నీటి అణువులుగా స్ఫటిక జాలకంలో ఉండేవి గాను రెండు విధాలుగా ఉండవచ్చు. ఉదాహరణకి [Cr(H2O)6]Cl3 జల సంక్లిష్టం ఊదారంగు] సంక్లిష్టం. అదే దీని హైడ్రేట్ సదృశకం [Cr(H2O)5Cl]Cl3 H2O బూడిద-ఆకుపచ్చ రంగు] సంక్లిష్టం.
ప్రశ్న 9.
వేలెన్స్ బంధ సిద్ధాంతం ఆధారంగా క్రింది సమన్వయ సమూహాలలో బంధ స్వభావాన్ని అయస్కాంత స్వభావాన్ని చర్చించండి.
ఎ) [Fe(CN)6]4- బి) [FeF6]3- సి) [Co(C2O4)3]3- డి) [CoF6]3-
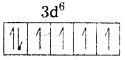
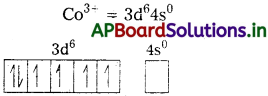
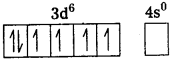
జవాబు:
i) [Fe(CN)6]4- : ఈ సంక్లిష్టంలో Fe, Fe2+ గా ఉంటుంది.
Fe [Ar] 4s²3d6
Fe+2 = [Ar] 4s03d6
CN– బలమైన క్షేత్ర లైగాండ్ ఇది ఒంటరి ఎలక్ట్రాన్లను జతపరుస్తుంది. కావున CN– లకు రెండు 3d-ఆర్బిటాళ్లు అందుబాటులో ఉంటాయి.
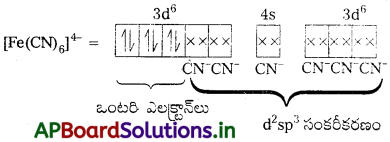
ఒంటరి ఎలక్ట్రాన్లు లేనందున ఈ సంక్లిష్టం డయా అయస్కాంత స్వభావం కలిగి ఉండును. (n – 1) d-ఆర్బిటాళ్లు బంధంలో పాల్గొన్నాయి. కావున ఇది తక్కువ స్పిన్ సంక్లిష్టం.
బి) [FeF6]3- : ఈ సంక్లిష్టంలో Fe యొక్క ఆక్సీకరణ స్థితి + 3.

F – అనునది బలహీన క్షేత్ర లైగాండ్. కావున ఇక్కడ ఎలక్ట్రాన్లు జతకలవవు. కావున బంధాలను ఏర్పరచుటకు 3d – ఆర్బిటాళ్లు అందుబాటులో ఉండవు.
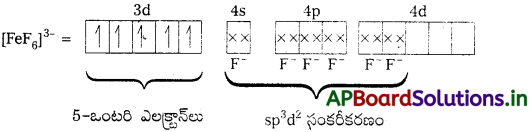
ఐదు ఒంటరి ఎలక్ట్రాన్లు కలిగి ఉండుట వలన ఈ సంక్లిష్టం పారా అయస్కాంతత్వం కలిగి ఉండును. ఇచ్చట nd- ఆర్బిటాళ్లు బంధాలలో పాల్గొన్నాయి. కావున ఇది అధిక స్టిన్ సంక్లిష్టం.
సి) [Co(C2O4)3]3- : ఈ సంక్లిష్టంలో Co యొక్క ఆక్సీకరణ స్థితి + 3.
Co+3 = [Ar] 4s0 3d6
ఆక్సలేట్ అయాన్ బలమైన క్షేత్ర లైగాండ్ అగుట వలన 3d-ఎలక్ట్రాన్లు జతపరచబడతాయి. రెండు 3d-ఆర్బిటాళ్లతో ఆక్సలేట్ అయాన్లు బంధాలను ఏర్పరుస్తాయి.
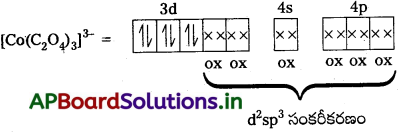
అన్ని ఎలక్ట్రాన్లు జతపరచడం వలన సంక్లిష్ట డయా అయస్కాంతత్వం స్వభావాన్ని కలిగి ఉండును. (n – 1) d- ఆర్బిటాళ్లు బంధంలో పాల్గొనుట వలన ఇది తక్కువ స్పిన్ సంక్లిష్టం.
డి) [CoF6]3- ; ఈ సంక్లిష్టంలో Co+3 అయాన్ ఉంటుంది.
Co+3 = [Ar] 4s03d6
F– బలహీనక్షేత్ర లైగాండ్. కావున ఎలక్ట్రాన్ జతపరచబడవు. F– ఆర్బిటాళ్లను ఆక్రమిస్తుంది.
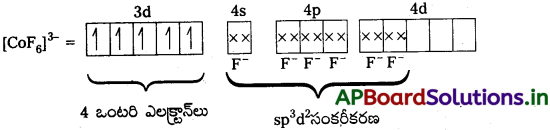
నాలుగు ఒంటరి ఎలక్ట్రాన్లు కలిగి ఉండుట వలన సంక్లిష్టం పారా అయస్కాంత స్వభావం కలిగి ఉండును. nd ఆర్బీటాళ్లు బంధలంలో పాల్గొనుట వలన ఇది అధిక స్పిన్ సంక్లిష్టం.
ప్రశ్న 10.
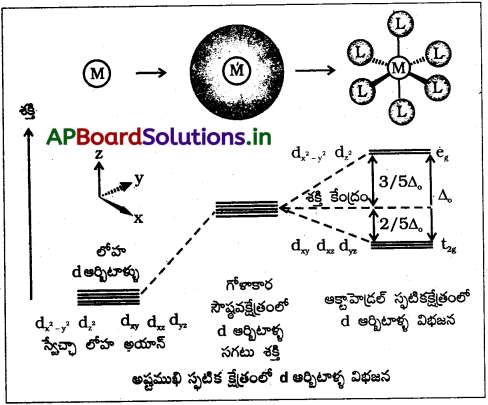
అష్టముఖీయ స్ఫటిక క్షేత్రంలో d-ఆర్బిటాల్ల విభజనకు రేఖాపటం గీయండి.
జవాబు:
ప్రశ్న 11.
వర్ణపట రసాయన శ్రేణి spectrochemical (serice) అంటే ఏమిటి? దుర్బల క్షేత్ర లైగాండు, ప్రబల క్షేత్ర లైగాండ్కు మధ్య గల భేదాన్ని వివరించండి.
జవాబు:
వర్ణపట రసాయన శ్రేణి :
భిన్న లైగాండ్లు ఏర్పరచిన సంక్లిష్టాలు శోషించుకొన్న కాంతి ఆధారంగా ప్రయోగాత్మకంగా రూపొందించబడిన శ్రేణిని వర్ణ పట రసాయన శ్రేణి అంటారు.
(లేదా)
లైగాండ్లు వాటి క్షేత్ర బలాలను పెరగే క్రమంలో వ్రాయబడ్డ శ్రేణిని వర్ణపట రసాయన శ్రేణి అంటారు.
I– < Br– < S-2 < SCN– < Cl– < N-3 < F– < OH- < C2O-24 < H2O < NCS– < NH3 < en < CN- < CO
d-ఆర్బిటాల్లో ఒకే ఎలక్ట్రాన్ ఉన్నట్లయితే అది అల్పశక్తి t2g ఆర్బిటాల్లోనే ఉంటుంది. d², d³ సంక్లిష్టాలలో హుండ్ నియమం ఆధారంగా మూడు t2g ఆర్బిటాళ్లు ఒంటరి ఎలక్ట్రాన్లతో నిండుతాయి. అయితే d4 విషయంలో రెండు భిన్న రకాల ఎలక్ట్రాన్ పంపిణీ విధానాలు సాధ్యం అవుతాయి.
- నాల్గవ ఎలక్ట్రాన్ t2g ఆర్బిటాల్లోకి చేరి దానిలోని ఒంటరి ఎలక్ట్రాన్తో జతకూడవచ్చు.
- ఎలక్ట్రానున్లు జతకూడటానికి అవసరమైన శక్తి (p) ని అధిగమించి eg ఆర్బిటాల్లోకి నాల్గవ ఎలక్ట్రాన్ ఒంటరిగా చేరవచ్చు.
ఈ రెండు అవకాశాలలో ఏది జరుగుతుంది అనేది స్పటిక క్షేత్ర విభజన శక్తి (∆0) మరియు ఎలక్ట్రాన్లు జతకూడటానికి అవసరమైనశక్తి (p) పై ఆధారపడి ఉంటుంది.
a) ∆0 < P → t2g³, etg,¹ విన్యాసం ప్రాప్తిస్తుంది. ∆0 < P అయినప్పుడు లైగాండ్లను బలహీన క్షేత్ర లైగాండ్లు అంటారు. అవి అధిక స్పిచ్ సంక్లిష్టాలను ఏర్పరుస్తాయి.
b) ∆0 > P → t2g4 eg0 విన్యాసం ప్రాప్తిస్తుంది. ∆0 > P అయినపుడు లైగాండ్లను బలమైన క్షేత్ర లైగాండ్లు అంటారు. అవి తక్కువ స్పిస్ సంక్లిష్టాలను ఏర్పరుస్తాయి.
![]()
ప్రశ్న 12.
లోహ కార్బొనైల్లలో బంధ స్వభావాన్ని చర్చించండి.
జవాబు:
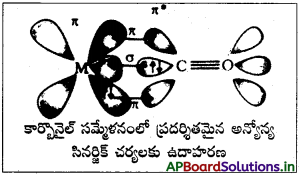
లోహ కార్బొనైల్ లోని లోహ కర్బాన్ బంధానికి (σ) బంధ, (π) బంధ లక్షణాలు రెండూ ఉంటాయి. కార్బొనైల్ కార్బన్ మీది ఒంటరి ఎలక్ట్రాన్ జంట ఆర్బిటాల్ లోహ పరమాణువు ఖాళీ ఆర్బిటాల్లోకి ఎలక్ట్రాన్ జంటను పంపుతుంది. దీనివల్ల σ-బంధం ఏర్పడుతుంది. π- బంధం మాత్రం జంట ఎలక్ట్రాన్లతో నిండి ఉన్న లోహ పరమాణువు d-ఆర్బిటాల్ (CO) అణువులో ఉన్న ఖాళీ π* అపబంధక· ఆర్భిటాల్లోకి ఎలక్ట్రాన్ జంటను పంపటం వల్ల ఏర్పడుతుంది. సినర్జిక్ ప్రభావంతో లోహ లైగాండ్ (CO) బంధం మరింత బలపడుతుంది.
ప్రశ్న 13.
వివిధ రంగాలలో సమన్వయ సమ్మేళనాల అనువర్తనాలను వివరించండి.
జవాబు:
సమన్వయ సమ్మేళనాలు చాలా ముఖ్యమైనవి. ఇవి ఖనిజాలు, మొక్కలు, జంతువులకు చెందిన అనేక పదార్థాల్లో ఉంటాయి. విశ్లేషణ రసాయనశాస్త్రంలో, లోహ శాస్త్రంలో, జీవ వ్యవస్థలో, పరిశ్రమల్లో, మందుల తయారీలో వీటికి అత్యంత ప్రాధాన్యత ఉంది. కొన్ని ప్రాధాన్యతలను చూద్దాం.
గుణాత్మక, పరిమాణాత్మక రసాయన విశ్లేషణల్లో సమన్వయ సంక్లిష్టాలు ఉపయోగపడతాయి. లోహ అయాన్లతో లైగాండ్లు ముఖ్యంగా కీలేటింగ్ లైగాండ్లు రంగురంగుల సంక్లిష్టాలను ఇస్తాయి. వీటి ఆధారంగా సాధారణ రసాయన చర్యా పద్ధతుల ద్వారా లేదా తగిన సాధనాలు (instruments) వాడి తెలియని పదార్థాలను లేదా అయాన్లను గుర్తించవచ్చు. పరిమాణాత్మక విశ్లేషణ చేయవచ్చు. దీనికి ఉపయోగపడే కొన్ని కారకాలు (reagents) ఇథిలిన్ డై ఎమీన్ టెట్రా ఎసిటిక్ ఆమ్లం (EDTA), దాని ఉత్పన్నాలు, డైమిథైల్ ఆక్సైమ్ (DMG), α – నైట్రసో – β – నాఫ్తాల్, క్యూప్రాన్ మొదలైనవి.
Na2EDTAతో ట్రైట్రేషన్ చేసి జల కాఠిన్యతను పరిమాణాత్మకంగా తెలుసుకొంటారు. కఠిన జలంలోని Mg2+, Ca2+ లు EDTA తో సంక్లిష్టాలను ఇస్తాయి. కాల్షియమ్, మెగ్నీషియమ్ సంక్లిష్టాల స్థిరత్వ స్థిరాంకాలు వేరువేరుగా ఉండటం వల్ల వాటిని విడిగా గుర్తించడానికి వీలవుతుంది.
సిల్వర్, గోల్డ్ లాంటి లోహాలను నిష్కర్షించే (extract) విధానాల్లో సంక్లిష్టాల ఏర్పాటు సూత్రం ఉపయోగిస్తారు. ఉదాహరణకు గోల్డ్ ఆక్సిజన్ సమక్షంలో సయనైడ్ జలద్రావణంలో [Au(CN)2]– సంక్లిష్టాన్ని ఇస్తుంది. దీనికి Zn లోహం కలిపితే గోల్డ్, లోహరూపంలో వస్తుంది.
లోహాన్ని శుద్ధిచేయడానికి వాటితో సమన్వయ సంక్లిష్టాలు ఏర్పరచి వాటిని వియోగం చెందిస్తే శుద్ధ లోహాలు వస్తాయి. మలిన నికెల్ లోహాన్ని CO తో సంక్లిష్టం [Ni(CO)4] ఏర్పరచి [Ni(CO)4] ను వేడిచేసి వియోగం చెందించాలి.
జీవ వ్యవస్థలో సమన్వయ సమ్మేళనాల పాత్ర ముఖ్యమైనది. కిరణజన్య సంయోగక్రియలో ఉపయోగపడే ఆకుపచ్చ పదార్థం క్లోరోఫిల్ (chlorophyll), రక్తంలో ఆక్సిజన్ను మోసుకొనిపోయే ఎర్రటి పదార్థం హిమోగ్లోబిన్, మరణాన్ని కూడా కలుగజేసే బలహీనతకు దేని లోపమైతే కారణమో ఆ విటమిన్ B12, సయనో కోబాల్ ఎమీన్లు వరసగా మెగ్నీషియమ్, ఐరన్, కోబాల్ట్ లోహాల సంక్లిష్టాలు. వీటితోపాటు కార్బాక్సీపెప్టిడేస్ A అనే లోహాలతో సంక్లిష్టాలను ఏర్పరచే ఎంజైమ్లు, కార్బొనిక్ ఎన్హెడ్రేజ్ లాంటి జీవ రసాయన ఉత్ప్రేరకాల లాంటివి చాలా ముఖ్యమయినవి.
సంక్లిష్టాలు అనేక పారిశ్రామిక చర్యల్లో ఉత్ప్రేరకాలు. ఉదాహరణకి రోడియమ్ సంక్లిష్టం [(Ph3P)3 RhCl], ఆల్కీన్లను హైడ్రోజనీకరణం చేసే చర్యలో వాడే విల్కిన్సన్ ఉత్ప్రేరకం లాంటివి ముఖ్యమైనవి.
సంక్లిష్ట ద్రావణాలు [Ag(CN)2]–, [Au(CN)2]– ల నుంచి Ag, Auలను ఇతర పదార్థాలపై ఎలక్ట్రోప్లేటింగ్ చేయడం శుద్ధ లవణ ద్రావణాలు వాడటం కంటే ఉపయోగకరమైనది.
నలుపు – తెలుపు ఫోటోగ్రఫీలో డెవలప్ చేసిన ఫిల్మ్ ను హైపో ద్రావణంలో ఉంచి వియోగం చెందని AgBrను సంక్లిష్టం [Ag(S2O3)2]3- గా తొలగిస్తారు.
కీలేట్ వైద్య విధానానికి వైద్య రసాయనశాస్త్రంలో రోజురోజుకు ఆదరణ పెరుగుతోంది. జంతువులు / మొక్కల్లో లోహాలు విషపూరిత (toxic) పరిమాణాల్లో ఉంటే వాటిని సంక్లిష్టాలుగా మార్చి తొలగిస్తారు. కాపర్, ఐరన్ అధికంగా ఉంటే వాటిని వరసగా D-పెనిసిలమీన్ (D-pensillamine), డిస్ఫెర్రి ఆక్సైమ్ (desfferioxime) లాంటి కీలెటింగ్ కారకాలను ఉపయోగించి సమన్వయ సమ్మేళనాలు ఏర్పరచి తొలగిస్తారు. EDTAను లెడ్ విషాన్ని తొలగించడానికి వాడతారు. ట్యూమర్లు (గడ్డలు) తొలగించడానికి ప్లాటినమ్ సమన్వయ సమ్మేళనాలను వాడతారు. ఇవి ట్యూమర్ల పెరుగుదల వేగాన్ని తగ్గిస్తాయి. సిస్-ప్లాటిన్, దానికి సంబంధించిన సమ్మేళనాలు ఇందుకు ఉదాహరణలు.
సాధించిన సమస్యలు Textual Examples
ప్రశ్న 1.
ఏ ప్రాతిపదికపై, స్కాండియమ్ (Z = 21) పరివర్తన మూలకమని, జింక్ (Z = 30) కాదని చెప్పగలరు?
సాధన:
స్కాండియమ్లో పరమాణు స్థితిలో అసంపూర్తిగా నిండివున్న 3d ఆర్బిటాల్ (3d’) ఉండటం వల్ల. దానిని పరివర్తన మూలకంగా పరిగణిస్తారు. కానీ, జింక్ పరమాణువుకు భూస్థితిలోను, దాని సాధారణ ఆక్సీకరణ స్థితిలోను (Zn2+) పూర్తిగా నిండిన d ఆర్బిటాల్లు (3d10) ఉంటాయి. కాబట్టి దాన్ని పరివర్తన మూలకంగా పరిగణించరు.
![]()
ప్రశ్న 2.
పరివర్తన మూలకాలు ఎందువల్ల అధిక పరమాణీకరణ ఎంథాల్పీలు ప్రదర్శిస్తాయి?
సాధన:
పరివర్తన మూలకాల పరమాణువులలో అధిక సంఖ్యలో ఉన్న ఒంటరి ఎలక్ట్రాన్ల మధ్య జరిగే బలమైన అంతర పరమాణుక అన్యోన్య చర్యలు, పరమాణువుల మధ్య బలమైన బంధాల్ని ఏర్పరుస్తాయి. దీని ఫలితంగా అధిక పరమాణీకరణ ఎంథాల్పీలు ఉంటాయి.
ప్రశ్న 3.
బహుళ ఆక్సీకరణ స్థితులు ప్రదర్శించని పరివర్తన మూలకం పేరును తెలపండి.
సాధన:
స్కాండియమ్ (Z = 21), బహుళ ఆక్సీకరణ స్థితులు ప్రదర్శించదు.
ప్రశ్న 4.
రెండింటికీ d4 విన్యాసం ఉన్నప్పటికీ Cr2+ క్షయకరణ ధర్మాన్ని, Mn3+ ఆక్సీకరణ ధర్మాన్ని ప్రదర్శిస్తాయి. ఎందువల్ల?
సాధన:
Cr2+ క్షయకరణి. దీనికి కారణం దాని విన్యాసం d4 నుంచి d³ కి మారుతుంది. d³ విన్యాసంలో సగం నిండిన t2g స్థాయి ఉంటుంది. అదేవిధంగా Mn2+ నుంచి Mn3+ కు విన్యాసంలో మార్పు సగం నిండిన (d5) విన్యాసానికి వీలు కల్పిస్తుంది. ఈ విన్యాసానికి అధిక స్థిరత్వం ఉంటుంది.
ప్రశ్న 5.
VO+2 < Cr2O2-7 < MnO–4 శ్రేణిలో ఆక్సీకరణ సామర్థ్యం పెరిగే క్రమాన్ని ఎలా వివరిస్తారు?
సాధన:
దీనికి కారణం ఈ అయాన్లు క్షయకరణం చెందగా ఏర్పడ్డ అల్పస్థాయి జాతుల స్థిరత్వం పెరగడం.
ప్రశ్న 6.
మొదటి శ్రేణి పరివర్తన లోహాల EΘ విలువలు కింది విధంగా ఉంటాయి.

పై విలువలు ఒక క్రమంలో లేకపోవడానికి కారణాలు వివరించండి.
సాధన:
మూలకాల EΘ (M+2/M) విలువలు ఒక క్రమంలో లేకపోవడానికి కారణం. వీటి అయనీకరణ ఎంథాల్పీలలో మార్పు (∆iH1 + ∆iH2) ఒక క్రమ పద్ధతిలో ఉండకపోవడం అంతేకాకుండా మాంగనీస్, వెనేడియమ్ల విషయంలో, వాటి ఉత్పతన ఎంథాల్పీలు సాపేక్షంగా చాలా తక్కువగా ఉండటం.
ప్రశ్న 7.
Mn3+/Mn2+ యుగ్మం EΘ విలువ, Cr3+/Cr2+, EΘ లేదా Fe3+/Fe2+, EΘ యుగ్మాల కంటే ఎక్కువ ధనాత్మకంగా ఎందుకు ఉంటుంది? వివరించండి.
సాధన:
దీనికి Mn యొక్క అత్యధిక తృతీయ అయనీకరణ ఎంథాల్పీ (అవసరమైన ఎలక్ట్రాన్ పరివర్తన (d’ నుంచి d) ముఖ్య కారణం. ఈ విషయం, Mn యొక్క + 3 ఆక్సీకరణ స్థితికి ఎందువల్ల ప్రాముఖ్యత లేదో వివరిస్తుంది.
![]()
ప్రశ్న 8.
జలద్రావణంలో ద్విసంయోజక అయాన్ అయస్కాంత భ్రామకాన్ని లెక్కకట్టండి. దాని పరమాణు సంఖ్య 25. [AP. Mar.’16]
సాధన:
పరమాణు సంఖ్య. 25 గల మూలక ద్విసంయోజక అయాన్కు జలద్రావణంలో విన్యాసం (అయిదు ఒంటరి ఎలక్ట్రాన్లు) ఉంటుంది.’ అయస్కాంత భ్రామకం, µ విలువ
µ = \(\sqrt{5(5+2}\) = 5.92 BM
ప్రశ్న 9.
ఒక ఆక్సీకరణస్థితి ‘అననుపాతం’ అంటే అర్థం ఏమిటి? ఒక ఉదాహరణ ఇవ్వండి.
సాధన:
ఒక నిర్దిష్ట ఆక్సీకరణస్థితి, దాని అల్ప, అధిక ఆక్సీకరణ స్థితుల కంటే సాపేక్షంగా తక్కువ స్థిరత్వం ఉంటే, అది ఆ ఆక్సీకరణ స్థితి నుంచి అల్ప, అధిక ఆక్సీకరణ స్థితులలోకి మారడాన్ని ‘అననుపాతం’ చెందినదని అంటారు. ఉదాహరణకు ఆమ్ల ద్రావణంలో Mn(VI), Mn(VII) లకు Mn(IV) తో పోలిస్తే సాపేక్షంగా అస్థిరత్వం ఉంటుంది.
3MnVIO2-4 + 4H+ → 2MnVIIO–4 + MnIVO2 + 2H2O
ప్రశ్న 10.
+4 ఆక్సీకరణ స్థితి ప్రదర్శించడంలో బాగా ప్రసిద్ధమైన లాంథనైడ్ మూలకం పేరు చెప్పండి.
సాధన:
సీరియమ్ (2 = 58)
ప్రశ్న 11.
క్రింది సమ్మేళనాలలోని లోహాలకు, వాటి జలద్రావణలకు క్రింది పరిశీలనల ఆధారంగా సెకండరీ వేలన్స్లను తెలపండి.
| ఫార్ములా | అధిక AgNO3 ద్రావణంతో చర్యలో ఒక మోల్ సమ్మేళనం ఏర్పరచిన అవక్షేపిత AgCl మోల్ల సంఖ్య |
| (i) PdCl2. 4NH3 | 2 |
| (ii) NiCl2. 6H2O | 2 |
| (iii) PtCl4. 2HCl | 0 |
| (iv) CoCl3. 4NH3 | 1 |
| (v) PtCl2. 2NH3 | 0 |
సాధన:
i) సెకండరీ 4 ii) సెకండరీ 6 iii) సెకండరీ 6 iv) సెకండరీ 6 v) సెకండరీ 4
ప్రశ్న 12.
క్రింది సమన్వయ సమ్మేళనాల ఫార్ములాలు రాయండి. [TS. Mar.’17]
ఎ) టెట్రాఎమీన్ఆక్వాక్లోరోకోబాల్ట్ (III) క్లోరైడ్
బి) పొటాషియమ్ టెట్రాహైడ్రాక్సోజింకేట్ (II)
సి) పొటాషియమ్ ట్రైఆగ్జలేటోఅల్యూమినేట్ (III)
డి) డైక్లోరోబిస్ (ఈథేన్-1, 2 – డైఎమీన్) కోబాల్ట్ (III) క్లోరైడ్ ఇ) టెట్రాకార్బొనైల్నికెల్ (0)
సాధన:
ఎ) [Co(NH3)4(H2O)Cl]Cl2
బి) K2[Zn(OH)4]
సి) K3[Al(C2O4)3]
డి) [CoCl2(en)2]+
ఇ) [Ni(CO)4]
ప్రశ్న 13.
క్రింది సమన్వయ సమ్మేళనాల IUPAC పేర్లు రాయండి.
ఎ) [Pt(NH3)2Cl(NO2)]
బి) K3[Cr(C2O4)3]
సి) [CoCl2(en)2]Cl
డి) [Co(NH3)5(CO3)]Cl
ఇ) Hg[Co(SCN)4]
సాధన:
ఎ) డైఎమీన్ క్లోరోనైట్రిటో-N-ప్లాటినమ్ (II)
బి) పొటాషియమ్ ట్రెఆగ్జలేటోక్రోమేట్ (III)
సి) డైక్లోరోబిస్ (ఈథేన్-1, 2-డైఎమీన్) కోబాల్ట్ (III) క్లోరైడ్
డి) పెంటా ఎమీన్ కార్బొనేటోకోబాల్ట్ (III) క్లోరైడ్
ఇ) మెర్క్యురీ టెట్రాథయోసయనేటోకోబాల్టేట్ (III)
![]()
ప్రశ్న 14.
టెట్రాహెడ్రల్ సంక్లిష్టాలలో రెండు రకాల ఏకదంత లైగాండ్లు కేంద్ర లోహ పరమాణువు/అయాన్ తో సమన్వయ బంధాలు ఏర్పరచినా క్షేత్ర సాదృశ్యం వీలుకాదు. ఎందువల్ల ఝ
సాధన:
టెట్రాహెడ్రల్ సంక్లిష్టాలు క్షేత్ర సాదృశ్యాన్ని ప్రదర్శించవు. ఎందుకంటే, ఏకదంత లైగాండ్లు కేంద్ర లోహ పరమాణువు/ అయాన్తో బంధాలు ఏర్పరచినా ప్రాదేశికంగా నాలుగు బంధాల్లో వాటి సాపేక్ష స్థానాల మధ్య బేధం లేకుండా సమానంగా ఉండటమే.
ప్రశ్న 15.
(Fe(NH3)2(CN)4]– క్షేత్ర సదృశకాలను రాయండి.
సాధన:
ప్రశ్న 16.
క్రింది సమన్వయ సంక్లిష్టాలు రెండింటిలో ధ్రువణ భ్రమణం చూపించేదానిని వాటి నిర్మాణాల ద్వారా చెప్పండి.
ఎ) సిస్-(CrCl2(ox)2]3- బి) ట్రాన్స్ [CrCl2(ox)2]3-
సాధన:
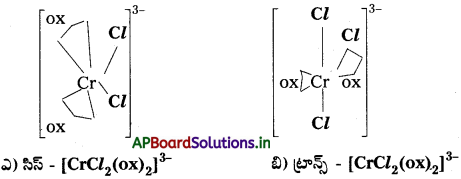
రెండింటిలో (a) సిస్ – [CrCl2(ox)2]3- కు మాత్రమే కైరల్, ధ్రువణ భ్రమణత ఉంటుంది.
ప్రశ్న 17.
[MnBr4]2- కేవలం స్పిస్ అయస్కాంత భ్రామకం (spin only magnetic moment) విలువ 5.9 BM ఈ సంక్లిష్ట అయాన్ జ్యామితిని ఊహించండి.
సాధన:
[MnBr4]2- లో Mn2+ అయాన్ సమన్వయ సంఖ్య నాలుగు. అంటే Mn2+ టెట్రాహెడ్రల్(sp³) లేదా సమతల చతురస్రం (dsp²) సంకరీకరణం చెంది ఉండాలి. అయితే దీని అయస్కాంత భ్రామకం 5.9 అంటే దీనికి ఐదు ఒంటరి ఎలక్ట్రాన్లున్నాయి. కాబట్టి sp³ సంకరీకరణం జరిగి ఆకృతి టెట్రాహెడ్రల్గా ఉండాలి. సమతల చతురస్రం కాదు. అప్పుడే ఐదు ఆర్బిటాళ్ళ ఒంటరి ఎలక్ట్రాన్ల విన్యాసం వివరించడానికి వీలవుతుంది.
పాఠ్యాంశ ప్రశ్నలు Intext Questions
ప్రశ్న 1.
సిల్వర్ పరమాణువుకు భూస్థితిలో పూర్తిగా నిండిన d-ఆర్బిటాల్లు (4d10) ఉంటాయి. అయినా, దానిని పరివర్తన మూలకం అని ఎలా చెప్పగలరు?
సాధన:
సిల్వర్ (Z = 47)+2 ఆక్సీకరణ స్థితి ప్రదర్శిస్తుంది. ఈ స్థితిలో దీనిలో అసంపూర్తిగా నిండినd ఆర్బిటాల్లు (4d) ఉంటాయి. కాబట్టి అది ఒక పరివర్తన మూలకం.
ప్రశ్న 2.
Sc (Z = 21) నుంచి Zn (Z = 30) వరకు గల శ్రేణిలో జింకు అత్యల్ప పరమాణీకరణ ఎంథాల్పీ, 126 kJ mol-1, ఉంటుంది. ఎందువల్ల?
సాధన:
లోహ బంధాలను ఏర్పరచేటప్పుడు, జింక్ లోని 3d-ఆర్బిటాల్ల ఎలక్ట్రాన్లు లోహబంధాలను ఏర్పడటంలో పాల్గొనవు. కానీ 3d శ్రేణిలోని మిగతా మూలకాలన్నింటిలోను, d-ఆర్బిటాల్ల ఎలక్ట్రాన్లు లోహ బంధాలు ఏర్పడటంలో పాల్గొంటాయి.
ప్రశ్న 3.
3d శ్రేణి పరివర్తన లోహాలలో ఏది అత్యధిక సంఖ్యలో ఆక్సీకరణ స్థితులు ప్రదర్శిస్తుంది? ఎందువల్ల?
సాధన:
మాంగనీస్ (Z = 25), దాని పరమాణువులో గరిష్ట సంఖ్యలో జతగూడని ఎలక్ట్రాన్లు ఉంటాయి.
![]()
ప్రశ్న 4.
కాపర్ E°(M+2/M) విలువ ధనాత్మకం (+0.34 V). దీనికి తగిన కాణం ఏమిటి?
(సూచన : వాటి అధిక ∆aH–, అల్ప, ∆ హైడ్రేషన్ H– లను తీసుకోండి)
సాధన:
కాపరు అధిక పరమాణీకరణ ఎంథాల్పీ మరియు తక్కువ హైడ్రేషన్ ఎంథాల్పీ కలిగి ఉంటుంది. కావున కాపర్ E° (M2+/M) విలువ (+0.34v) ధనాత్మకంగా ఉంటుంది.
ప్రశ్న 5.
మొదటి శ్రేణి పరివర్తన మూలకాల అయనీకరణ ఎంథాల్పీల’ (ప్రథమ, ద్వితీయ) అపక్రమ మార్పును ఎలా వివరిస్తారు?
సాధన:
అయనీకరణ ఎంథాల్పీలలో మార్పు క్రమ పద్ధతిలో లేకపోవడానికి కారణం వివిధ 3d విన్యాసాల స్థిరత్వాలలో గల వ్యత్యాసాలు, (ఉదా : d0, d5, d10విన్యాసాలకు అత్యధిక స్థిరత్వం ఉంటుంది):
ప్రశ్న 6.
ఒక లోహం దాన ఆక్సైడ్లోగాని లేదా ఫ్లోరైడ్లోగాని మాత్రమే గరిష్ట ఆక్సీకరణ స్థితిని ఎందుకు ప్రదర్శిస్తుంది?
సాధన:
అల్ప పరమాణు పరిమాణం, అధిక రుణవిద్యుదాత్మకత ఉండటం వల్ల ఆక్సిజన్ లేదా ఫ్లోరిన్, లోహాన్ని దాని గరిష్ట ఆక్సీకరణ స్థితికి ఆక్సీకరణం చేయగలవు.
ప్రశ్న 7.
Cr2+, Fe2+ లలో ఏది బలమైన క్షయకరణి? ఎందువల్ల?
సాధన:
Cr2+ Fe2+. కంటే బలమైన క్షయకరణి.
కారణం :
Cr2+ నుంచి Cr3+ కు d4 → d5 పరివర్తనం జరుగుతుంది. కానీ, Fe2+ నుంచి Fe3+ కు d6 → d5 పరివర్తనం. జరుగుతుంది. ఒక యానకం (జలద్రావణం) లో d3 విన్యాసం d5 కంటే ఎక్కువ స్థిరత్వాన్ని కలుగజేస్తుంది. (CFSCచూడండి).
ప్రశ్న 8.
M2+(జల) అయాన్ భ్రమణ-ఆధారిత భ్రామకం ద్వారా లెక్కించిన ‘spin only అయస్కాంత భ్రామకాన్ని లెక్కకట్టండి. (Z = 27).
సాధన:
Z = 27, M2+ ఎలక్ట్రాన్ విన్యాసం [Ar] 3d7
n = 2
అయస్కాంత భ్రామకం µ = \(\sqrt{\mathrm{n}(\mathrm{n}+2)}=\sqrt{3(3+2)}=\sqrt{15}\) = 3.87 BM
![]()
ప్రశ్న 9.
జలద్రావణాలలో, Cu+ అయాను ఎందుకు స్థిరత్వం ఉండదో వివరించండి.
సాధన:
Cu+ జలద్రావణంలో అననుపాతం చెందుతుంది.
2Cu+ (జల) → Cu2+ (జల) + Cu (ఘ)
దీనికి E° విలువ అనుకూలమైనది.
ప్రశ్న 10.
ఒక మూలకంతో పోల్చినప్పుడు మరొక మూలకానికి లాంథనైడ్ సంకోచం కంటే ఆక్టినైడ్ సంకోచం ఎక్కువ. ఎందుకు?
సాధన:
5f-ఎలక్ట్రాన్లు కేంద్రక ఆవేశం నుంచి ఎక్కువ ప్రభావాత్మకంగా పరిరక్షించబడతాయి. వేరే విధంగా చెప్పాలంటే, 5f-ఎలక్ట్రాన్లు ఆ శ్రేణిలోని మూలకానికి, మూలకానికి మధ్య బలహీన పరిరక్షణను కలుగజేస్తాయి.
ప్రశ్న 11.
క్రింది సమన్వయ సమ్మేళనాల ఫార్ములాలు రాయండి.
i) టెట్రాఎమీన్ ఆక్వాక్లోర్లోకోబాల్ట్ (III) క్లోరైడ్
ii) పొటాషియమ్ టెట్రాసయనోనికెలేట్ (II)
iii) ట్రిస్ (ఈథేన్-1, 2-డైఎమీన్) క్రోమియమ్ (III) క్లోరైడ్
iv) ఎమీన్బ్రోమోక్లోరోనైట్రిటో-N-ప్లాటినమ్ (II) నైట్రేట్
v) డైక్లోరోటిస్ (ఈథేన్-1, 2-డై ఎమీన్) ప్లాటినమ్ (IV) నైట్రేట్
vi) ఐరన్ (III) హెక్సాసయనైడో ఫెర్రేట్ (III)
సాధన:
i) [Co(NH3)4 (H2O)2]Cl3
ii) K2[Ni(CN)3]
iii) [Cr(en)3]Cl3
iv) [Pt(NH2) BrCl(NO2)]–
v) [PtCl (en)3] (NO3)2
vi) Fe4[Fe(CN)6]3
ప్రశ్న 12.
క్రింది సమన్వయ సమ్మేళనాల IUPAC పేర్లు రాయండి.
(i) [Co(NH3)6]Cl3
(ii) [Co(NH3)5Cl]Cl2
(iii) K3[Fe(CN)6]
(iv) K3[Fe(C2O4)3]
(v) K2[PdCl4]
(vi) [Pt(NH3)2Cl(NH2CH3)Cl.
సాధన:
i) హెక్సాఎమీన్ కోబాల్ట్ (III) క్లోరైడ్
ii) పెంటా ఎమీన్ క్లోరోకోబాల్ట్ (II) క్లోరైడ్
iii) పొటాషియం హెక్సాసయనో ఫెర్రేట్ (III)
iv) పొటాషియంట్రెఆక్జలేటో ఫెర్రేట్ (III)
v) పొటాషియం టెట్రాక్లోరోపల్లాడేట్ (II)
vi) డైఎమీన్ క్లోరో(మిథనమైన్) ప్లాటినమ్ (II) క్లోరైడ్
ప్రశ్న 13.
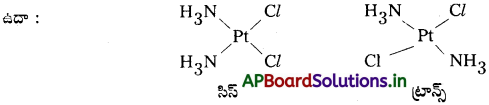
క్రింది సంక్లిష్టాలు ప్రదర్శించగల సాదృశ్యాల రకాలను తెలిపి ఆ సదృశకాల నిర్మాణాలు రాయండి.
(i) K[Cr(H2O)2(C2O4)2]
(ii) [Co(en)3]Cl3
(iii) [Co(NH3)5(NO2)](NO3)2
(iv) [Pt(NH3)(H2O)Cl2]
సాధన:
i) జ్యామితీయ (సిస్-, ట్రాన్స్-) సాదృశ్యం, దృక్ సాదృశ్యాలు సిస్కు ఉంటాయి.
ii) రెండు దృక్ సాదృశ్యాలు ఉంటాయి.
iii) పది సాదృశ్యాలు సాధ్యమవుతాయి. (సూచన : జ్యామితీయ, అయనీకరణ, బంధ (లింకేజ్) సాదృశ్యాలు ఉంటాయి.)
iv) జ్యామితీయ (సిస్-, ట్రాన్స్-) సాదృశ్యాలు ఉంటాయి.
![]()
ప్రశ్న 14.
[Co(NH3)5Cl]SO4, [Co(NH3)5SO4]Cl లు అయనీకరణ సదృశకాలని ఎలా చెప్పగలవు?
సాధన:
అయనీకరణ ఐసోమర్లు నీటిలో కరిగి, వేరువేరు అయాన్లను ఇస్తాయి. ఇవి వివిధ కారకాలతో వేరువేరుగా చర్య
జరుపుతాయి.
[Co(NH3)5Br]SO4 + Ba2+(aq) → BaSO4(ఘ)
[Co(NH3)5SO4]Br + Ba² → చర్యలేదు
[Co(NH3)5Br ]SO4 + Ag+ → చర్యలేదు
[Co(NH3)5SO4]Br + Ag+ → AgBr (ఘ)
ప్రశ్న 15.
[Ni(CN)4]2- అయాను సమతల చతురస్రం (square planar) డయా అయస్కాంత ధర్మం ఉన్నాయి. అదే [NiCl4]2- అయాను చతుర్ముఖి జ్యామితి నిర్మాణం పరా అయస్కాంత ధర్మం, వీటిని వేలెన్స్ బంధ సిద్ధాంతంతో ఎలా వివరిస్తారు?
సాధన:
ఈ సంక్లిష్టంలో ఒంటరి ఎలక్ట్రాన్లు లేనందున డయా అయస్కాంత స్వభావం కలిగి ఉంటుంది.
ఈ సంక్లిష్టంలో రెండు ఒంటరి ఎలక్ట్రాన్లు ఉండుట వలన పారా అయస్కాంత స్వభావం కలిగి ఉండును.
ప్రశ్న 16.
[Ni(CO)4]2- పరా అయస్కాంత అయాన్, కాని [Ni(CO)4] డయా అయస్కాంత అణువు. కాని రెండూ కూడా టెట్రాహెడ్రల్ జ్యామితిలో ఉంటాయి. ఎందువల్ల?
సాధన:
[Ni(CO)4]2- లో Ni ఆక్సీకరణ స్థితి సున్నా, కానీ NiCl42- లో Ni ఆక్సీకరణ స్థితి + 2 CO లైగాండ్ సమక్షంలో Ni లోని ఒంటరి d-ఎలక్ట్రాన్లు జతగూడతాయి. కానీ Cl– బలహీనమైన లైగాండ్ కావడం వల్ల ఒంటరి ఎలక్ట్రాన్లు జతగూడటం జరగదు.
ప్రశ్న 17.
[Fe(H2O)6]3+ కు బలమైన పరా అయస్కాంత ధర్మం ఉంటుంది. [Fe(CN)6]3- కు బలహీనమైన పరా అయస్కాంత ధర్మం ఉంటుంది. వివరించండి.
సాధన:
CN- (బలమైన లైగాండ్) సమక్షంలో 3d-ఎలక్ట్రాన్లు జతగూడి, ఒకే ఒక ఒంటరి ఎలక్ట్రాన్ ఉంటుంది. కేంద్ర లోహ అయాన్ d² sp³ సంకరీకరణంలో పాల్గొని అంతర ఆర్బిటాల్ సంక్లిష్టాన్ని ఏర్పరుస్తుంది. H2O (బలహీనమైన లైగాండ్) సమక్షంలో 3d ఎలక్ట్రాన్లు జతగూడవు. కేంద్ర లోహ అయాన్ sp³ d² సంకరీకరణంలో పాల్గొని బాహ్య ఆర్బిటాల్ సంక్లిష్టాన్ని ఏర్పరుస్తుంది. దీనిలో అయిదు జతగూడని ఎలక్ట్రాన్లు ఉంటాయి. కాబట్టి బలమైన పరాయస్కాంత ధర్మం ఉంటుంది.
ప్రశ్న 18.
[Co(NH3)6]3+ ఒక అంతర్ ఆర్బిటాల్ సంక్లిష్టమయితే [Ni(NH3)6]2+ ఒక బాహ్య ఆర్బిటాల్ సంక్లిష్టం వివరించండి.
సాధన:
[Co(NH3)6]3+ లో NH3 సమక్షంలో 3d-ఎలక్ట్రాన్లు జతగూడి, రెండు ఖాళీ d ఆర్బిటాబికాలు ఉండి, అవి d² sp³ సంకరీకరణంలో పాల్గొని, అంతర ఆర్బిటాల్ సంక్లిష్టాన్ని ఏర్పరుస్తుంది.
కానీ [Ni(NH3)6]2+ లో Ni +2 ఆక్సీకరణ స్థితిలో ఉండి, d8 విన్యాసం ఉండి, sp³d² సంకరీకరణంలో పాల్గొని, బాహ్య ఆర్బిటాల్ సంక్లిష్టాన్ని ఏర్పరుస్తంది.
ప్రశ్న 19.
సమతల చతురస్ర జ్యామితి గల [Pt(CN)4]2+ అయాన్లో ఎన్న జతకూడని (ఒంటరి) ఎలక్ట్రాన్లు ఉంటాయి?
సాధన:
సమతల చతురస్రం ఆకృతిని dsp² సంకరీకరణంలో పాల్గొనాలి. కాబట్టి 5d-ఆర్బిటాల్లలోని ఒంటరి ఎలక్ట్రాన్లు జతగూడి, ఒక ఖాళీ d ఆర్బిటాలు పొందుపరచి, dsp² సంకరీకరణంలో పాల్గొంటుంది.
![]()
ప్రశ్న 20.
హెక్సా ఆక్వో మాంగనీస్ (II) అయాన్లో ఐదు జతకూడని ఎలక్ట్రాన్లున్నాయి. అదే హెక్సా సయనో మాంగనీస్ (II) అయాన్లో ఒకటి మాత్రమే జతకూడని ఎలక్ట్రాన్ ఉంది. స్ఫటిక క్షేత్ర సిద్ధాంతం ఉపయోగించి వీటిని వివరించండి.
సాధన:
హెక్సా ఆక్వా మాంగనీస్ (II) అయాన్లోని లైగాండ్ H2O బలహీనక్షేత్ర లైగాండ్ (t2g³ eg²) కావున ఐదు ఒంటరి ఎలక్ట్రాన్లు కలిగి ఉంటాయి. ఇది అధిక స్పిస్ సంక్లిష్టం.
హెక్సా సయనో మాంగనీస్ (II) అయాన్లోని లైగాండ్ N– బలమైన క్షేత్ర లైగాండ్ (t2g5 eg0) కావున ఒక ఒంటరి ఎలక్ట్రాన్ కలదు. ఇది తక్కువ స్పిస్ సంక్లిష్టం.
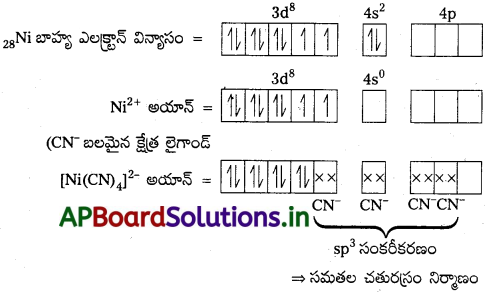
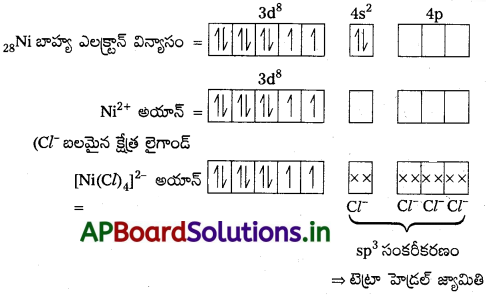
ప్రశ్న 21.
Cu(NH3)42+ సంక్లిష్టానికి మొత్తం చర్య సాహచర్య స్థిరత్వ స్థిరాంకం (Overall association) లేదా ఫార్మేషన్ స్థిరాంకం విలువ β4 = 2.1 × 1013 మొత్తం సంక్లిష్టం విఘటన (వియోజన, dissociation) సమతాస్థితి స్థిరాంకం ఎంత?
సాధన:
మొత్తం విఘటన స్థిరాంకం, మొత్తం స్థిరత్వ స్థిరాంకానికి విలోమం అంటే
= \(\frac{1}{\beta_4}\) = 4.7 × 10-14.