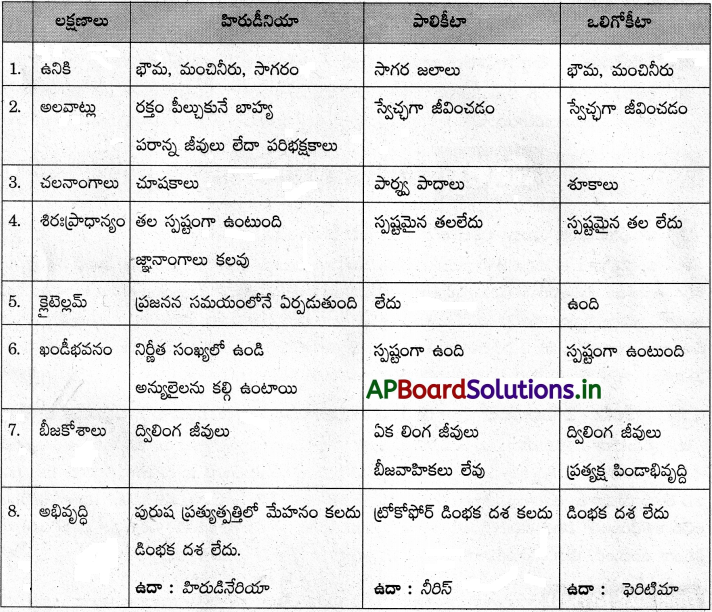
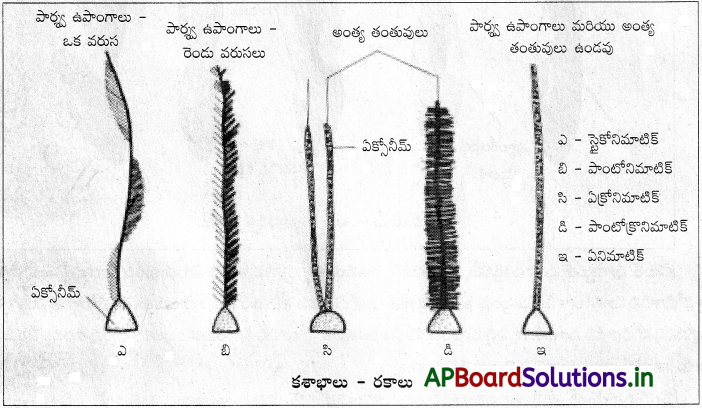
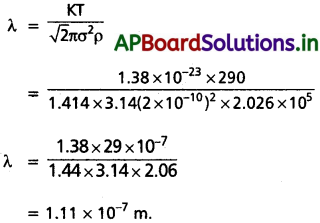
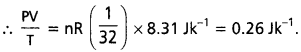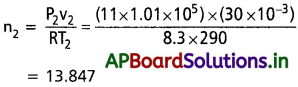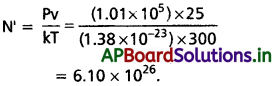Andhra Pradesh BIEAP AP Inter 1st Year Zoology Study Material 2nd Lesson జంతుదేహ నిర్మాణం Textbook Questions and Answers.
AP Inter 1st Year Zoology Study Material 2nd Lesson జంతుదేహ నిర్మాణం
అతిస్వల్ప సమాధాన ప్రశ్నలు
ప్రశ్న 1.
స్పంజికలలో అనేక వేల కణాలున్నప్పటికీ కణజాల స్థాయి వ్యవస్థీకరణ లేదు. వ్యాఖ్యానించండి.
జవాబు:
కణస్థాయి వ్యవస్థీకరణ అతి నిమ్న స్థాయి వ్యవస్థీకరణ. ఈ వ్యవస్థలో వివిధ రకాల కణాలు క్రియాత్మకంగా వివిక్తత చెంది ఉంటాయి. ఎందుకంటే వీటిలో నాడీ కణాలు, జ్ఞానకణాలు ఉండవు. వీటిలో కణాలు వదులైన కణ సమూహాలుగా ఉండును.
ప్రశ్న 2.
జంతువులలో కణజాల స్థాయి వ్యవస్థీకరణ అంటే ఏమిటి ? ఏ మెటాజోవన్లలలో ఈ వ్యవస్థీకరణ కనిపిస్తుంది ?
జవాబు:
ఇది యూమెటాజోవన్లలో అతి తక్కువ స్థాయి వ్యవస్థ. నిడేరియా వర్గానికి చెందిన జీవులు కణజాల స్థాయిని ప్రదర్శిస్తాయి. ఈ జీవులలో ఒకే రకమైన విధి నిర్వహించే కణాలు ఒకే కణజాలముగా ఏర్పడును.
ప్రశ్న 3.
సమర్థమైన జీవన విధానానికి జీవులలో ఏ స్థాయి వ్యవస్థీకరణ (ఇతర వ్యవస్థీకరణతో పోల్చినప్పుడు) తోడ్పడుతుంది?
జవాబు:
అవయవ వ్యవస్థ స్థాయి వ్యవస్థీకరణ త్రిస్తరిత జీవులలో కనిపించును. ఇది అతి సమర్థవంతమైన అవయవ వ్యవస్థ స్థాయి. జ్ఞాన, నాడీ కణాలు వీటి చర్యలను సమన్వయం చేస్తాయి.
ప్రశ్న 4.
ఏకాక్ష విషమధృవ (monaxial heteropolar) సౌష్ఠవము అంటే ఏమిటి ? ఇది ఏ జంతువులలో ప్రధాన సౌష్ఠవంగా ఉంటుందో తెలపండి?
జవాబు:
జంతువు మధ్య అక్షము ద్వారా పోయే ఏ తలమునుంచైనా ఛేదించినపుడు రెండు సమాన అర్థ భాగాలేర్పడితే దానిని ఏకాక్ష విషమ ధృవ సౌష్ఠవము అందురు. నిడేరియా మరియు టీనోఫోరా జీవులలో ఇది ప్రధాన సౌష్ఠవముగా ఉండును.
ప్రశ్న 5.
నెమ్మదిగా చలించే జీవులకు లేదా వృంతరహిత జీవులకు వ్యాసార్థ సౌష్ఠవం అనుకూలనం నిరూపించండి.
జవాబు:
వ్యాసార్థ సౌష్ఠవ జంతువులు నీటిలో నివసిస్తూ అన్ని దిశల నుండి వచ్చే ప్రేరణలకు ప్రతిస్పందిస్తాయి. కాబట్టి వ్యాసార్థం సౌష్ఠవము నేలకు అంటుకొని లేదా నెమ్మదిగా కదిలే జంతువులకు చాలా అనుకూలము.

ప్రశ్న 6.
శీర్షత అంటే ఏమిటి? అది జీవులకు ఎట్లా ఉపయోగపడుతుంది?
జవాబు:
కొన్ని జీవులలో పూర్వాంతంలో నాడీ, జ్ఞాన కణాలు కేంద్రీకృతం చెందటంవల్ల ఆ జీవులలో శీర్షిత ఏర్పడును. ఈ జంతువులు ఆహార సముపార్జనలో, సంగమ జీవిని వెతుక్కోవటంలో, భక్షక జీవులనుండి తప్పించుకోవటంలో ఎక్కువ సమర్థవంతముగా ఉంటాయి.
ప్రశ్న 7.
నాళంలో నాళం వ్యవస్థీకరణ మొట్టమొదట ఏ జంతువులలో కనిపించింది? వాటి శరీరకుహరం పేరు తెలపండి.
జవాబు:
సూడోసీలోమేట్ జీవులలో అనగా నిమటోడా వర్గ జీవులలో నాళములో నాళము వ్యవస్థీకరణ కనిపిస్తుంది. ఈ శరీర కుహరంను మిథ్యా శరీర కుహరం అందురు.
ప్రశ్న 8.
నిజశరీరకుహరాన్ని ఎందుకు ద్వితీయశరీర కుహరంగా భావిస్తారు?
జవాబు:
యూసీలోమేట్ల పిండాభివృద్ధిలో మధ్యత్వచం నుండి ఏర్పడిన నిజశరీరకుహరం సంయుక్త బీజ కుహర స్థానాన్ని ఆక్రమిస్తుంది. కాబట్టి నిజ శరీర కుహరాన్ని ద్వితీయ శరీర కుహరం అందురు.
ప్రశ్న 9.
తిరోగమన ఆంత్రవేష్టన అవయవాలను తెలపండి.
జవాబు:
సకశేరుకాలలో మూత్రపిండములాంటి కొన్ని అవయవాలు ఉదరభాగంలో మాత్రమే, దైహిక వేష్ఠనంతో కప్పబడి ఉంటాయి. అలాంటి ఆంత్ర వేష్ఠనాన్ని తిరోవేష్ఠనము అని, ఆ అవయవాలను తిరోవేష్ఠన అవయవములు అందురు.
ప్రశ్న 10.
ప్రోటోస్టోమ్ల తొలి పిండాభివృద్ధిలో మీ సెంటోబ్లాస్ట్ కణాలను తొలగించినపుడు, ఆ జంతువుల భవిష్యత్తు ఎట్లా ఉంటుంది?
జవాబు:
ప్రోటోస్టోమ్ జీవులలో మీసెంటోబ్లాస్ట్ కణాలు విభజన చెంది మధ్యత్వచ దిమ్మెలను ఏర్పరచి వాటితో చీలికా కుహరం అనగా షైజోసీలోమ్ ఏర్పడును. ఈ కణాలను తొలగించుటవల్ల ప్రోటోస్టోమ్ జీవులు సీలోమ్ను ఏర్పరచలేవు.
ప్రశ్న 11.
ఎంటిరోసీలోమ్/ఆంత్రశరీర కుహరం అంటే ఏమిటి ? జంతురాజ్యంలో ఎంటిరోసీలోమ్ వర్గాలను పేర్కొనండి. [Mar. ’14]
జవాబు:
ఆదిఆంత్ర మధ్యత్వచ కోశాలనుండి ఏర్పడిన శరీర కుహరాన్ని ఆంత్ర శరీర కుహరం అందురు. వర్గము ఇకైనోడర్మేటా, హెమికార్డేటా, కార్డేటాలు ఎంటిరోసీలోమేటా వర్గములు.
ప్రశ్న 12.
స్తరీకరణ చెందిన ఉపకళా కణాలు స్రవించే క్రియలో తక్కువ పాత్ర వహిస్తాయి. మన చర్మంపై వీటి పాత్రను నిరూపించండి.
జవాబు:
స్తరిత ఉపకళా కణాల ముఖ్య విధి రసాయనిక మరియు యాంత్రిక ఒత్తిడి నుండి రక్షిస్తుంది. ఇది పొడిగా ఉండే చర్మం ఉపరితలాన్ని కప్పి ఉంచి స్రవించే ప్రక్రియలో తక్కువ పాత్ర వహిస్తుంది.
ప్రశ్న 13.
అంతస్రావక, బహిస్రావక గ్రంథుల తేడాలను ఉదాహరణలతో తెలపండి. [Mar. ’14]
జవాబు:
నాళసహితమైన గ్రంథులను బహిస్రావిక గ్రంథులు అందురు. ఉదా : లాలాజల గ్రంథులు.
నాళరహితమైన గ్రంథులను అంతస్రావక గ్రంథులు అందురు. ఉదా : పిట్యూటరీ గ్రంథి.

ప్రశ్న 14.
హోలోక్రైన్, ఎపోక్రైన్ గ్రంథుల మధ్య తేడాలను గుర్తించండి.
జవాబు:
| హోలోక్రైన్ గ్రంథులు | ఎపోక్రైన్ గ్రంథులు |
కణ మొత్తము విచ్ఛిన్నం చెంది దానిలోని స్రావకాలను వెలుపలికి విడుదల చేస్తాయి.
ఉదా : చర్మస్రావ గ్రంథులు | కణ అగ్రభాగము స్రావక పదార్థముతో సహా కణం నుండి తెగి విడిపోతుంది.
ఉదా : క్షీర గ్రంథులు |
ప్రశ్న 15.
మాస్ట్ కణాలు స్రవించే రెండు పదార్థాలను, వాటి విధులను తెలపండి.
జవాబు:
- హెపారిన్ : ఇది రక్త స్కంధన నిరోధకముగా పనిచేయును.
- హిస్టమీన్ : ఇది రక్తనాళ విస్ఫారముగా పనిచేయును.
ప్రశ్న 16.
స్నాయువు, స్నాయు బంధనం మధ్య తేడాలను తెలపండి. [Mar. ’14]
జవాబు:
కండరాలను ఎముకతో అతికించే సంయోజక కణజాలమును స్నాయు బంధనము అందురు. ఎముకను ఇతర ఎముకలతో అతికించే సంయోజక కణజాలమును బంధకం లేదా స్నాయువు అని అందురు.
ప్రశ్న 17.
గోధుమకొవ్వు, తెలుపుకొవ్వుల మధ్య తేడాలను తెలపండి.
జవాబు:
గోధుమ కొవ్వు గర్భస్థ పిండాలలోను, శిశువులలోను ఎక్కువగా ఉంటుంది. దీని ఎడిపోసైట్ కణాలలో అనేక చిన్న కొవ్వు బిందువులు ఉంటాయి. ఇది శిశువులలో ఉష్ణాన్ని ఉత్పత్తిచేసి దేహ ఉష్ణోగ్రతను కాపాడుతుంది.
తెలుపు కొవ్వు పౌఢ జీవులలో అధికముగా ఉండి ఎడిపోసైట్ కణములో ఒక పెద్ద కొవ్వు బిందువు ఉంటుంది.
ప్రశ్న 18.
అత్యంత బలమైన మృదులాస్థి ఏది ? మానవుని శరీరంలో ఏ భాగాలలో ఇది కనిపిస్తుంది?
జవాబు:
తంతుయుత మృదులాస్థి అతి బలమైన మృదులాస్థి. కారణము వీటిలో కట్టలుగా కొల్లాజన్ తంతువులు ఉంటాయి. ఇది మానవునిలో అంతర్కశేరుక చక్రికలలోను, శ్రోణిమేఖల జఘన సంధాయకంలోను ఉంటుంది.
ప్రశ్న 19.
ఆస్టియోబ్లాస్ట్లు, ఆస్టియోక్లాస్ట్ల మధ్య తేడాలను తెలపండి.
జవాబు:
| ఆస్టియోబ్లాస్ట్ | ఆస్టియోక్లాస్ట్లు |
| ఆస్టియోబ్లాస్ట్లు మాత్రికలోని సేంద్రియ పదార్థములను స్రవిస్తాయి. అంతేకాకుండా ఎముకను ఖనిజీకృతం చేయటానికి ముఖ్యపాత్ర వహించును. | భక్షక కణాలుగా ఎముకను పునఃశోషణము చేసే విధిని కలిగి ఉంటాయి. |
ప్రశ్న 20.
ఆస్టియాన్ ను నిర్వచించండి.
జవాబు:
హెవర్షియన్ కుల్య, దానిచుట్టూ ఉన్న పటలికలు, లిక్విణులు అన్నింటినీ కలిపి ఆస్టియాన్ అందురు.
ప్రశ్న 21.
వోక్మన్ కుల్యలు అంటే ఏమిటి? వాటి పాత్రను తెలపండి.
జవాబు:
హేవర్షియన్ కుల్యలు అడ్డుగా లేదా ఏటవాలుగా ఉండే వోక్మాన్ కుల్యలు ద్వారా ఇతర హేవర్షియన్ కుల్యలతో, పర్యస్తికతో, మజ్జాకుహరంతో కలుపబడి ఉంటాయి. హేవర్షియన్ కుల్యల రక్తనాళములనుంచి పోషకాలు, వాయువులు సూక్ష్మ కుల్యల ద్వారా అస్థికణజాలమంతా వ్యాపనం చెందుతాయి.
ప్రశ్న 22.
సెసమాయిడ్ ఎముక అంటే ఏమిటి? ఉదాహరణ తెలపండి.
జవాబు:
ఈ ఎముక స్నాయుబంధకాలు అర్థభవనము చెందటంవల్ల ఏర్పడుతుంది. ఉదా : పటెల (మోకాలి చిప్ప), క్షీరదాల మణికట్టులో పిసిఫామ్ ఎముక.
ప్రశ్న 23.
మైక్రోగ్లియాలు అంటే ఏమిటి? వాటి పుట్టుక గురించి తెలిపి, విధులను పేర్కొనండి.
జవాబు:
మైక్రోగ్లియల్ కణాలు భక్షక కణాలు. ఇవి న్యూరోగ్లియా కణముల నుంచి ఏర్పడి మధ్యత్వచమునుంచి ఉద్భవిస్తాయి.
ప్రశ్న 24.
మిథ్యా ఏక ధృవ న్యూరాన్లు అంటే ఏమిటి? ఇవి ఎక్కడ కనిపిస్తాయి?
జవాబు:
ఇది ఏక ధృవ నాడీ కణము యొక్క నాడీ దేహము నాడీ సంధి యొక్క పృష్ఠ శాఖలో కనిపిస్తుంది. అటువంటి ఏకధృవ నాడీ కణాలను మిథ్యా ఏక ధృవ నాడీ కణాలు అందురు.
స్వల్ప సమాధాన ప్రశ్నలు
ప్రశ్న 1.
మెటాజోవాలో నాలుగు వివిధ అంతస్థుల వ్యవస్థీకరణను వివరించండి.
జవాబు:
1. కణస్థాయి వ్యవస్థీకరణ :
ఇది మెటాజోవన్లలోని అతి నిమ్న స్థాయి వ్యవస్థీకరణ. దీన్ని స్పంజికలు (పారాజోవన్లు) ప్రదర్శిస్తాయి. వీటిలో వివిధ రకాల కణాలు క్రియాత్మకంగా వివిక్తత చెంది ఉంటాయి. ఎందుకంటే వీటిలో నాడీకణాలు, జ్ఞానకణాలు ఉండవు. కణాలు వదులైన కణసమూహాలుగా అమరి ఉంటాయి.. కానీ కణజాలాన్ని ఏర్పరచవు. కణాలు శ్రమ విభజనను ప్రదర్శిస్తాయి. శరీరకుడ్యం వెలుపలి స్తరంలో పినాకోసైట్లు, పోరోసైట్లు (ఇవి నీటిని వెలుపలి నుంచి స్పంజికా కుహరంలోకి పంపుతాయి) లోపలి స్తరంలో (స్పంజికా కుహరాన్ని ఆవరించిన కొయానోసైట్లు ఉంటాయి. ఈ రెండు పొరల మధ్య కణరహిత మీసోగ్లియా లేదా మీసోహైల్ ఉంటుంది.
2. కణజాల స్థాయి వ్యవస్థీకరణ :
ఇది యూమెటాజోవన్లలో అతి తక్కువస్థాయి వ్యవస్థ. నిడేరియా వర్గానికి చెందిన జంతువులు కణజాలస్థాయిని ప్రదర్శిస్తాయి. ఈ జీవులలో ఒకే రకమైన విధి నిర్వహించే కణాలు ఒకే కణజాలంగా ఏర్పడ్డాయి. ఈ విధంగా ఏర్పడిన కణజాలాల మధ్య నాడీకణాలు, జ్ఞాన కణాలు సమన్వయం చేకూరుస్తాయి. జంతువుల శరీర నిర్మాణంలో కణజాలాలు ఏర్పడటం మొదటి ముఖ్యమైన పరిణామ దశ.
3. అవయవ స్థాయి వ్యవస్థీకరణ :
వివిధ రకాల కణజాలాలు సంఘటితమై ఒక ప్రత్యేక విధిని నిర్వహించడానికి ఏర్పడే నిర్మాణాన్ని అవయవం అంటారు. కణజాల స్థాయి కంటే అవయవ వ్యవస్థ స్థాయి ఉన్నత పరిణామ దశను సూచిస్తుంది. అవయవ వ్యవస్థ మొట్టమొదటిగా ప్లాటి హెల్మింథిస్ వర్గంలో ఏర్పడింది.
4. అవయవ-వ్యవస్థ స్థాయి వ్యవస్థీకరణ :
జంతువుల దేహనిర్మాణంలో ఇది అత్యున్నతస్థాయి వ్యవస్థీకరణ. ఇది బల్లపరుపు పురుగులు, విమటోడ్లు, అనెలిడన్లు, ఆర్థ్రోపొడా, మలస్క, ఇకైనోడర్మేటా, కార్డేట్ త్రిస్తరిత జీవులలో కనిపిస్తుంది. మధ్యత్వం ఏర్పడటం వల్ల త్రి స్తరిత జీవులలో కణజాలాలు సంఘటితమై అవయవాలు, అవయవ వ్యవస్థలు ఏర్పడ్డాయి. జ్ఞాన, నాడీకణాలు వీటి చర్యలను సమన్వయం చేస్తాయి. త్రిస్తరిత జీవుల పరిణామక్రమంలో ఈ స్థాయి క్లిష్టత పెరుగుతూ వచ్చింది. ఉదాహరణకు కొన్ని ప్లాటి హెల్మెంథిస్ జీవుల జీర్ణనాళంలో ఒకే రంధ్రం ఉంటుంది. ఈ విధమైన అసంపూర్ణ ఆహారనాళం ఏర్పడటంవల్ల క్రమంగా నోరు, పాయువులుగా మారింది. ఈ రకం ఆహారనాళం నిమటోడా నుంచి కార్డేటా వరకు గల జంతువులలో కనిపిస్తుంది. ఇదే విధంగా ప్రసరణ వ్యవస్థ కూడా వివృత రకం నుంచి ఆవృత రకంగా మారింది.

ప్రశ్న 2.
ఏ సమూహ బైలెటేరియన్లలో ఘన బాప్లాన్ కనిపిస్తుంది. దాన్ని ఎందుకలా పేర్కొన్నారు?
జవాబు:
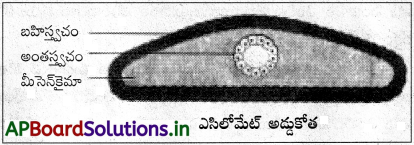
ఈ సమూహ జంతువులలో శరీరకుహరం ఉండదు కాబట్టి వీటిని శరీరకుహర రహిత జీవులు లేదా ఎసీలోమేట్లు అంటారు. ఉదా : ప్లాటి హెల్మింథిస్ (నిమ్నస్థాయి బైలెటేరియన్లు). వీటి దేహంలో సంయుక్త బీజకుహరిక మధ్యత్వచం నుంచి ఏర్పడిన మధ్యభ్రూణ కణజాలంతో నిండి ఉంటుంది. ఈ విధంగా ఇది ఘనశరీరరచనను చూపుతాయి. ఎసీలోమేట్లలో శరీరకుహరం లోపించడం వల్ల అనేక సమస్యలున్నాయి. శరీర అవయవాలు మీసెన్్కమాలో అంతస్థగితమై స్వేచ్ఛగా కదలలేవు. అంతేకాకుండా ఆహారనాళం నుంచి శరీర కుడ్యానికి పదార్థాల వ్యాపనం చాలా నెమ్మదిగా, తక్కువ సామర్థ్యంతో కొనసాగుతాయి.
ప్రశ్న 3.
మిథ్యాశరీరకుహరంపై శరీరకుహరానికిగల అనుకూలనాలను తెలపండి.
జవాబు:
మిథ్యాశరీరకుహరం కంటే నిజశరీరకుహరంవల్ల కలిగే లాభాలు :
- యూసీలోమేట్ల అంతరాంగాలు కండరసహితంగా ఉంటాయి. (ఎందుకంటే అవి మధ్యత్వచంలో కలిసి ఉంటాయి). దీనివల్ల అంతరాంగాలు శరీరకుహరంలో శరీరకుడ్యంతో సంబంధం లేకుండా స్వేచ్ఛగా సంకోచ సడలికలు జరుపుతాయి. ఉదా : ఆహారనాళపు పెరిస్టాల్టిక్ కదలికలు.
- బీజవాహికలు లేని అకశేరుకాలలోనూ, స్త్రీ సకశేరుకాలలోనూ బీజకణాలు శరీరకుహరంలోకి విడుదలవుతాయి.
- శరీరకుహరద్రవం విసర్జక పదార్థాలను గ్రహించి తాత్కాలికంగా నిల్వచేసి బయటికి పంపుతుంది.
- యూసీలోమేట్లలో మధ్యత్వచం ఆహారనాళ అంతస్త్వచంతో సంబంధం ఏర్పరచుకొని లోనికి నొక్కడం వల్ల ఆహారనాళంలో అంతర జఠరం, జీర్ణాశయం మొదలైన భాగాలు అభివృద్ధి చెందుతాయి. దీన్ని ప్రాథమిక ప్రేరేపణ అంటారు. సూడోసీలోమేట్లలో మధ్యత్వచం, ఆహారనాళం మధ్య ఇటువంటి సంబంధం ఉండదు. అందువల్ల వీటిలో ఆహారనాళం సరళంగా, సన్నటి పొడవైన నాళం రూపంలో ఉంటుంది.
ప్రశ్న 4.
షైజోసీలోమ్, ఎంటిరోసీలోమ్ ఏర్పడే విధానాన్ని వివరించండి.
జవాబు:
1. విభక్త శరీర కుహర జీవులు :
మధ్యత్వచం చీలి శరీరకుహరం ఏర్పడిన జంతువులను షైజోసీలోమేట్లు అంటారు. అనెలిడ్లు, ఆర్థ్రోపోడ్లు, మలస్కా జీవులు షైజోసీలోమేట్లు, అన్ని షైజోసీలోమేట్లు ప్రాథమిక ముఖదారులు. ఈ జీవులు ‘పూర్ణభంజిత’ సర్పిల, నిర్ధారిత విదళనాలను ప్రదర్శిస్తాయి. తొలి పిండంలోని 4d బ్లాస్టోమియర్ లేదా మీసెంటోబ్లాస్ట్ కణం విభజన చెంది బహిస్త్వచం, అంతస్త్వచం మధ్య మధ్యత్వచ దిమ్మెలు ఏర్పరచి సంయుక్తబీజకుహరికను భర్తీ చేస్తుంది. ప్రతీ మధ్యత్వచ దిమ్మెలో ఏర్పడిన చీలిక షైజోసీలోమ్ (చీలికకుహరం) ఏర్పడటానికి దారితీస్తుంది. అనెలిడాలో షైజెసీలోమ్ క్రియాత్మక శరీరకుహరం

(పర్యాంతరాంగ కుహరం). అనెలిడా జీవులలో శరీరకుహరం వరసగా గదులు కలిగి ఉండగా, ఆర్థ్రోపొడా, మలస్కా జీవులలో క్రియాత్మక శరీరకుహరం) అంతరాంగ అవయవాల చుట్టూ ఉండి రక్తం (హీమోలింఫ్) తో నిండి రక్తకుహరంగా పిలవబడుతుంది. ఇది పిండానికి చెందిన సంయుక్తబీజకుహరం శరీరకుహర గదులతో కలియడం వల్ల ఏర్పడింది. దీనివల్ల కణజాలాలు నేరుగా రక్తంలో (హీమోలింఫ్) తడిసి ఉంటాయి.
2. ఆంత్రశరీర కుహర జీవులు :
ఆదిఆంత్ర మధ్యత్వచ కోశాల నుంచి ఏర్పడిన శరీరకుహరాన్ని ఆంత్రశరీర కుహరం అంటారు. ఇకైనోడర్మ్లు, హెమికార్డట్లు, కార్డట్లు ఎంటిరోసీలోమేట్లు. ఈ జంతువులలో మధ్యత్వచ ఎంటిరోసీలోమ్ ఏర్పడుతుంది. అన్ని ఎంటిరోసీలోమేట్లు ద్వితీయ ముఖదారులు. ఇవి వ్యాసార్థ లేదా చక్రాభ, అనిర్ధారిత విదళనాన్ని ప్రదర్శిస్తాయి.

ప్రశ్న 5.
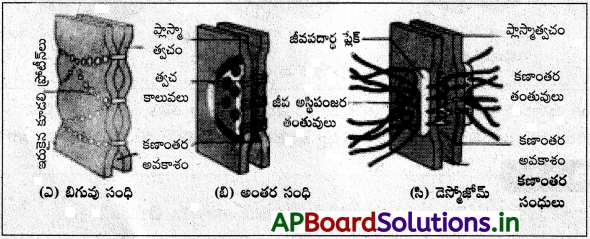
ఉపకళా కణజాలాల్లో మూడు రకాల కణ మధ్యాంతర కూడళ్ల గురించి వివరించండి.
జవాబు:
కణమధ్యాంతర కూడళ్ళు :
ఇవి మూడు రకాలు – బిగువు సంధులు, డెస్మోజోమ్లు, అంతర సంధులు. ఇది ఆ కణజాలాల ప్రత్యేక అవసరాలను తీర్చడానికి ఏర్పడ్డాయి.
ఎ) బిగువు సంధులు :
ఈ రకమైన సంధులు ఉపకళాకణాల్లో శరీర ద్రవాలు కారకుండా నిరోధిస్తాయి. ఉదాహరణకు ఇవి స్వేద గ్రంథుల (మన చర్మాన్ని నీరు పట్టిఉండేలా తయారుచేస్తుంది) లో కణాల నుంచి నీరు చుట్టూ గల కణాలకు చేరనివ్వవు. పక్కపక్కన గల కణాల ప్లాస్మాత్వచం ఒకదానికొకటి గట్టిగా ఒత్తుకొని ప్రత్యేక ప్రోటీన్లతో బంధించబడి ఉంటాయి.
బి) డెస్మోజోమ్లు :
ఇవి గుండీ వంటి ప్రోటీన్ నిర్మాణాలు కణాల మధ్య బంధన సంధులుగా పనిచేస్తాయి. దృఢమైన పలకలను బంధించే రివిట్లలాగా ఇవి కణత్వచాలను బంధిస్తాయి. వీటి కణాంతరావకాశంలో కెడరిన్లు అనే సంసజక త్వచ ప్రోటీన్లు ఉంటాయి. ఇవి జీవపదార్థంలో ఫలకాలు కలిగి ఉండి మాధ్యమిక తంతువులతో అతికి ఉంటాయి. ఈ తంతువులు కెరటిన్ (ఉపకళా కణాలు) లేదా డెస్మిన్ (హృదయకండరం) లాంటి ప్రోటీన్లతో ఏర్పడతాయి.
సి) అంతర సంధులు (సమాచార సంధులు)
ఇవి నిరంతరంగా పక్కన గల కణాల మధ్య జీవపదార్థ కాల్వలను ఏర్పరుస్తాయి. ఈ లక్షణం మొక్కలలో ప్లాస్మోడెస్మాటాలతో పోల్చదగినవి. ఈ సంధుల గుండా వివిధ రకాల అయాన్లు, చక్కెర అణువులు, అమైనో ఆమ్లాలు నిరంతరంగా ఒక కణం నుంచి ఇంకొకదానికి ప్రయాణిస్తాయి. ఇవి హృదయ కండరాలతో సహా చాలా రకాల కణజాలాల్లో ఉంటాయి. కొన్ని నాడీ కణాల మద్య ఇవి విద్యుత్ నాడీ సంధులుగా పనిచేస్తూ నాడీ ప్రచోదనాలను వేగంగా పంపిస్తాయి.
ప్రశ్న 6.
గ్రంథి ఉపకళ గురించి రాయండి.
జవాబు:
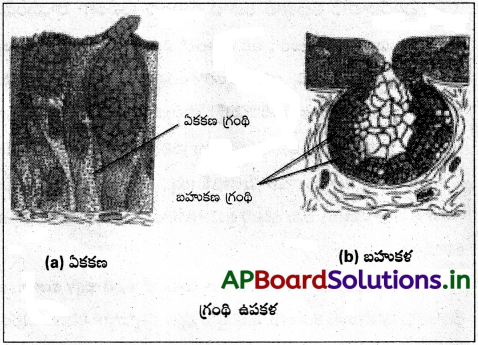
గ్రంథి ఉపకళ :
కొన్ని స్తంభాకార లేదా ఘనాకార కణాలు ప్రత్యేకతను సంతరించుకొని స్రావకాలను ఉత్పత్తి చేస్తాయి. ఇలాంటి ఉపకళను గ్రంథి ఉపకళ అంటారు. దీనిలోని గ్రంథికణాలు | రెండు రకాలు. అవి
(i) ఏకకణ గ్రంథులు :
ఇవి ఉపకళాత్వచంలో విడివిడిగా ఉంటాయి. ఉదాహరణ : ఆహారనాళంలోని గాబ్లెట్ కణాలు.
(ii) బహుకణ గ్రంథులు :
ఇవి ఉపకళాత్వచంలో గుంపులు గుంపులుగా ఏర్పడతాయి. ఉదాహరణ : లాలాజల గ్రంథులలో గుచ్ఛాలుగా ఉన్న గ్రంథి కణాలు. స్రావాలు విడుదల చేసే పద్ధతిని అనుసరించి గ్రంథులు రెండు రకాలు. అవి బహిస్రావక, అంతస్రావక గ్రంథులు. బహిస్రావ గ్రంథులు నాళ సహితమై శ్లేష్మం, లాలాజలం, చెవి గులిమీ (సిరుమిన్), నూనె, పాలు, జీర్ణరసాలు, ఇతర కణ ఉత్పత్తులను స్రవిస్తాయి.
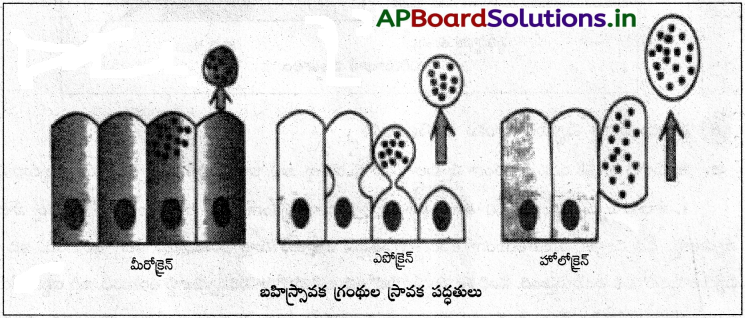
స్రావక పద్ధతి ఆధారంగా బహిస్సావ గ్రంథులు మూడు రకాలు :
(i) మీరోక్రైన్ గ్రంథులు (ఉదా : క్లోమం) స్రావక కణికలను ఇతర కణపదార్థాలు నష్టపోకుండా వెలుపలికి విడుదలచేస్తాయి.
(ii) ఎపోక్రైన్ గ్రంథులు (ఉదా : క్షీరగ్రంథులు) కణ అగ్రభాగం స్రావక పదార్థంతో సహా కణం నుంచి తెగి విడిపోతుంది.
(iii) హోలోక్రైన్ గ్రంథులు (ఉదా : చర్మస్రావ గ్రంథులు) కణం మొత్తం విచ్ఛిన్నం చెంది దానిలోని స్రావకాలను వెలుపలికి విడుదల చేస్తాయి. అంతస్రావ గ్రంథులు నాళరహితమైనవి. వీటి స్రావాలను హార్మోన్లు అంటారు. హార్మోన్లు నాళాల ద్వారా కాకుండా నిర్దేశిత భాగాలకు రక్తం ద్వారా రవాణా చేయబడతాయి.
ప్రశ్న 7.
ఏరియోలార్ కణజాల కణాల గురించి క్లుప్తంగా రాయండి.
జవాబు:
ఎరియోలార్ కణజాలం : ఇది దేహంలో ఎక్కువగా విస్తరించి ఉండే సంయోజక కణజాలాల్లో ఒకటి. అన్ని అవయవాలలో ఇది దట్టించబడి ఉంటుంది. ఇది చర్మంలో అధశ్చర్మ స్తరాన్ని ఏర్పరుస్తుంది. ఎరియోలార్ కణజాలంలో ఫైబ్రోబ్లాస్ట్లు, మాస్ట్ కణాలు, స్థూలభక్షక కణాలు, ఎడిపోసైట్స్, ఫ్లాస్మాకణాలు, తంతువులు ఉంటాయి.
1. ఫైబ్రోబ్లాస్ట్లు :
ఇవి తంతువులను స్రవించే అత్యంత సాధారణ కణాలు. అచేతన కణాలను ఫైబ్రోసైట్లు అంటారు.
2. మాస్ట్ కణాలు :
ఇవి హెపారిన్ (రక్తస్కందన నిరోధకం), హిస్టమిన్, బ్రాడికైనిన్-రక్తనాళ విస్ఫారకాలు), సెరటోనిన్ (రక్తనాళ సంకోచకాలు) లను స్రవిస్తాయి. గాయాలు, సంక్రమణకు అనుక్రియగా వాసోడయలేటర్లు వాపు లేదా ఉజ్వలనాన్ని కలిగిస్తాయి.
3. స్థూలభక్షకకణాలు :
ఇవి అమీబా రూపంలో ఉండే భక్షక కణాలు. ఇవి రక్తంలోని మోనోసైట్ల నుంచి ఉద్భవిస్తాయి. ఇవి దేహంలోని చనిపోయిన కణాలను, కణచెత్తను భక్షణ చర్య ద్వారా తీసివేసి శుభ్రం చేస్తాయి. అందువల్ల వీటిని అంతర సఫాయికారులు అంటారు. కణజాలానికి అతికి ఉండే స్థూల భక్షకకణాలను హిస్టియోసైట్స్ అనీ, స్వేచ్ఛగా తిరుగాడే స్థూలభక్షకకణాలనీ అంటారు.
4. ప్లాస్మాకణాలు :
ఇవి B-లింఫోసైట్ల నుంచి ఉద్భవిస్తాయి. ప్రతిరక్షకాలను ఉత్పత్తి చేస్తాయి.
5. ఎడిపోసైట్స్ :
కొవ్వును నిల్వజేసే ప్రత్యేక కణాలు.

ప్రశ్న 8.
మూడు రకాల మృదులాస్థులను వివరించండి.
జవాబు:
మృదులాస్థి మాత్రిక రచన ఆధారంగా మృదులాస్థి మూడు రకాలు. అవి, కాచాభ, స్థితిస్థాపక, తంతుయుత మృదులాస్థులు.
1. కాచాభ మృదులాస్థి :
ఇది నీలి-తెలుపు వర్ణంలో పాక్షిక పారదర్శకంగా, గాజు లాగా ఉంటుంది. ఇది సర్వ సాధారణ మృదులాస్థి. దీని మాత్రిక సమజాతీయంగా ఉండి, సున్నితమైన కొల్లాజన్ సూక్ష్మతంతువులను కలిగి ఉంటుంది. ఇది అన్ని మృదులాస్థులలో అతి బలహీనమైంది. సంధితల మృదులాస్థిలో తప్ప అన్నిటిలోనూ పరిమృదులాస్థి ఉంటుంది. ఇది అస్థిసకశేరుకాల పిండాలలోనూ సైక్లోస్టోమ్లలోనూ, మృదులాస్థి చేపలలోనూ అంతరాస్థిపంజరాన్ని ఏర్పరుస్తుంది. దీని నుంచి సంధితల మృదులాస్థి (సంధిని ఏర్పరచే పొడవు ఎముకల స్వేచ్ఛాతలం), పర్శుక మృదులాస్థి పర్శుకల ఉరోస్థి భాగాలు, ఎపిఫైసియల్ ఫలకాలు, నాసికాపుట మృదులాస్థి, శ్వాసనాళ మృదులాస్థి వలయాలు, స్వరపేటిక మృదులాస్థి మొదలైనవి ఏర్పడతాయి.

2. స్థితిస్థాపక మృదులాస్థి :
స్థితిస్థాపక తంతువులు ఉండటంవల్ల ఇది పసుపురంగులో ఉంటుంది. దీని మాత్రికలో కొల్లాజన్ తంతువులతో బాటు అధిక సంఖ్యలో పసుపు స్థితిస్థాపక తంతువులు ఉంటాయి. ఇది బలాన్ని, స్థితిస్థాపకతను ఇస్తుంది. పరిమృదులాస్థి ఉంటుంది. ఈ మృదులాస్థి వెలుపలి చెవి గొప్ప శ్రోతఃనాళాలు, ఉపజిహ్వికలో ఉంటుంది.
3. తంతుయుత మృదులాస్థి :
మాత్రికలో కట్టలుగా కొల్లాజన్ తంతువులు ఉంటాయి. పరిమృదులాస్థి ఉండదు. అన్ని మృదులాస్థులలో కెల్లా ఈ మృదులాస్థి చాలా ధృడమైంది. ఇది అంతర్ కశేరుక చక్రికలలోనూ, శ్రోణిమేఖల జఘన సంధాయకంలోను ఉంటుంది.

ప్రశ్న 9.
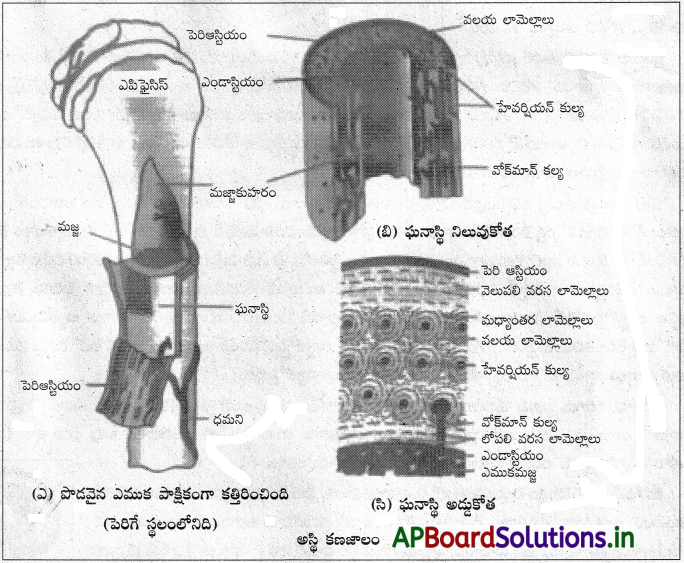
హేవర్షియన్ వ్యవస్థను విపులీకరించండి. [Mar. 14]
జవాబు:

పొడవాటి ఎముకలో రెండు విస్తరించిన అంత్యాల (ఎపిఫైసిస్) మధ్య కాడ లేదా డయాఫైసిస్ ఉంటుంది. పెరిగే ఎముకలో డయాఫైసిస్ ఎపిఫైసిస్ మధ్య మెటాఫైసిస్ ఉంటుంది. మెటాఫైసిస్లో మృదులాస్థితో ఏర్పడిన ఎపిఫైసియల్ ఫలకం (ఇది కాచాభ మృదులాస్థితో ఏర్పడుతుంది) ఉంటుంది. ఇది ఎముక పొడవుగా పెరగడానికి తోడ్పడుతుంది. ప్రౌఢజీవులలో దీన్ని సూచిస్తూ ఒక ఎపిఫైసియల్ రేఖ ఏర్పడుతుంది. డయాఫైసిస్ను ఆవరించి సాంద్ర సంయోజక తంతుకణజాలం, పర్యార్థిక ఉంటుంది. పొడవాటి ఎముకల డయాఫైసిస్లో మజ్జాకుహరం అనే బోలైన కుహరంతో ఉంటుంది. దీన్ని ఆవరించి అంతరాస్థిక ఉంటుంది.
పెరి ఆస్టియం, అంతరాస్థిక మధ్య ఎముక మాత్రికలో అనేక వరసలలో పటలికలు ఉంటాయి. పర్యార్థిక కింద ఉండే పటలికలను వెలుపలి పరిధీయ పటలికలు అనీ, అంతరాస్థిక చుట్టూ ఉండే వాటిని అంతర ఆవర్తిత పటలికలు అంటారు. ఈ రెండు పటలికల మధ్య అనేక హేవర్షియన్ వ్యవస్థలు (ఆస్టియాన్-ఎముక ప్రమాణాలు) ఉంటాయి. ప్రతి హేవర్షియన్ వ్యవస్థ ఏక కేంద్రక వలయం లాగా ఏర్పడుతుంది. దీని మధ్యలో హేవర్షియన్ కుల్య, దానిలో రక్త, శోషనాళాలు ఉంటాయి. హేవర్షియన్ నాళం చుట్టూ అనేక లిక్విణులు వలయాకార పటలికలుగా అమరి ఉంటాయి. వీటిలో ఆస్టియోసైట్లు ఉంటాయి. మాత్రికలోని లిక్విణులు ద్రవంతో నిండి, ఇతర లిక్విణులతో సూక్ష్మకుల్య ద్వారా కలిసి ఉంటాయి. హేవర్షియన్ నాళం చుట్టూ ఉండే లిక్విణులు వాటి సూక్ష్మకుల్యల ద్వారా హేవర్షియన్ నాళంతో కలుస్తాయి.
ప్రతీ లిక్విణిలో ఒక ఆస్టియోసైట్ ఉంటుంది. ఇది ఆస్టియోబ్లాస్ట్ క్రియారహిత రూపం. ఆస్టియోసైట్ల జీవపదార్థ కీలితాలు సూక్ష్మకుల్యల ద్వారా విస్తరిస్తాయి. హేవర్షియన్ కుల్య, దాని చుట్టూ ఉన్న పటలికలు, లిక్విణులు అన్నింటిని కలిపి హేవర్షియన్ వ్యవస్థ లేదా ఆస్టియాన్ అంటారు. ఇది అస్థికణజాలంలో నిర్మాణాత్మక క్రియాత్మక ప్రమాణం. హేవర్షియన్ కుల్యలు అడ్డుగా లేదా ఏటవాలుగా ఉండే వోల్క్ మన్ కుల్యల ద్వారా ఇతర హేవర్షియన్ కుల్యలతో, పర్యస్థికతో, మజ్జాకుహరంతో కలపబడి ఉంటాయి. హేవర్షియన్ కుల్యల రక్తనాళాలనుంచి పోషకాలు, వాయువులు సూక్ష్మకుల్యల ద్వారా అస్థికణజాలం అంతటా వ్యాపనం చెందుతాయి.
ప్రశ్న 10.
లింఫ్/శోషరసంపై స్వల్ప సమాధానం రాయండి.
జవాబు:
శోషరసం :
ఇది రంగులేని ద్రవం. ఇందులో RBC, రక్త ఫలకికలు, పెద్ద ప్లాస్మాప్రోటీన్లు ఉండవు. అయితే ఎక్కువగా ల్యూకోసైట్లు ఉంటాయి. ఇది ప్లాస్మా, లింఫోసైట్స్లో ఏర్పడింది. ఇతర కణజాల ద్రవాలతో పోల్చినప్పుడు వీటిలో అతి కొద్దిపాళ్లలో పోషకాలు, ఆక్సిజన్, ఎక్కువ పరిమాణంలో CO2,ఇతర జీవపోషకాలు ఉంటాయి. శోషరసం కణ మధ్యాంతరస్థలంలో రక్తం నుంచి ఏర్పడుతుంది. రక్తం రక్త కేశనాళికల ద్వారా ప్రవహించేటప్పుడు, ధమనికలలో అధిక జలస్థితిక పీడనంవల్ల రక్తం నుంచి నీరు, ద్రావితాలు, తక్కువ అణుభారంగల ప్రోటీన్లు రక్తకేశనాళికల కుడ్యం నుంచి మధ్యాంతర స్థలంలోకి విడుదలవుతాయి. దీన్ని మధ్యాంతర ద్రవం లేదా కణజాల ద్రవం అంటారు. సిరికల చివరలలో తక్కువ ద్రవాభిసరణ పీడనంవల్ల చాలావరకు మధ్యాంతర ద్రవం నేరుగా రక్తకేశనాళికలను చేరుతుంది. కొద్ది కణజాలద్రవం మాత్రం శోషరస నాళాల ద్వారా ప్రయాణించి అధోజత్రుకాసిర ద్వారా తుదకు రక్తాన్ని చేరుతుంది. శోషరసనాళాలలో ప్రవహించే మధ్యాంతర ద్రవాన్ని శోషరసం అంటారు.
ప్రశ్న 11.
అస్థిపంజర కండరనిర్మాణాన్ని వివరించండి.
జవాబు:
అస్థిపంజర (రేఖిత, నియంత్రిత – కండరం :
ఇవి సాధారణంగా ఎముకలకు స్నాయుబంధనంతో అతుక్కొని ఉంటాయి. ద్విశిరస్థ కండరం లాంటి నమూనా అకండరంలో కండరతంతువులు పలచని ఎండోమైసియం అనే సంయోజక కణజాల తొడుగుతో ఉంటాయి. కండర తంతువులు కట్టను ఫాసికిల్ అంటారు. దీన్ని ఆవరించిన సంయోజక కణజాలపు పొరను పెరిమైసియం అంటారు. ఒక ఫాసికిల్స్ సమూహం ఒక కండరాన్ని ఏర్పరుస్తుంది. ఇలాంటి కండరాన్ని కప్పి ఉండే సంయోజక కణజాలపు పొరను ఎపిమైసియం (వెలుపలి సంయోజక కణజాలం తొడుగు) అంటారు. కండరాన్ని దాటి పొడిగించబడిన ఈ సంయోజక కణజాలస్తరాలు రజ్జువులాంటి స్నాయుబంధనాన్ని లేదా పలకలాంటి ఎపోన్యూరోసిస్ ఏర్పరుస్తాయి.

అస్థిపంజర కండరతంతువు పొడవైన, స్తూపాకార, శాఖారహిత కణం. కణ జీవపదార్థంలో పరిధీయంగా (కణాలు కలిసిపోయిన సినీ షియం స్థితి ఏర్పడుతుంది) అండాకార బహుకేంద్రకాలు ఉంటాయి. సార్కోప్లాజంలో ఉన్న అనేక సూక్ష్మకండర తంతువులు ఏకాంతరంగా నిష్కాంతి, కాంతి పట్టీలను ప్రదర్శిస్తాయి. అందువల్ల దీన్ని రేఖిత లేదా చారల కండరం అంటారు. అస్థిపంజర కండరం జీవి నియంత్రణలో (నియంత్రిత కండరం) పనిచేస్తుంది. అస్థిపంజర కండరం త్వరగా సంకోచం జరుపుతుంది. త్వరగా గ్లానికి గురవుతుంది. దీన్ని దైహిక నాడీవ్యవస్థ క్రమబద్దీకరిస్తుంది. శాటిలైట్ కణాలు చలనంలేని (చర్యారహిత), ఏకకేంద్రక, మయోజెనిక్ కణాలు. ఈ కణాలు నియమితంగా కండర పునరుత్పత్తిలో సహాయపడతాయి.
ప్రశ్న 12.
హృదయ కండర నిర్మాణాన్ని వివరించండి.
జవాబు:

హృదయ కండర (రేఖిత, అనియంత్రిత) :
ఇది అస్థిపంజర కండరంలాగా రేఖిత కండరం (సార్కోమియర్లు ఉంటాయి) హృదయ కండరాలు సకశేరుకాల హృదయంలోని మయోకార్డియంలో ఉంటాయి. హృదయ కండరకణాలు లేదా మయోకార్డియల్ కణాలు పొట్టిగా, స్తూపాకారంగా ఒకటి లేదా రెండు కేంద్రకాలతో ఉంటాయి. ఇవి ఒకదానితో ఒకటి కలిసి ఉంటాయి. వీటి మధ్య రిక్తసంధులు ఏర్పడి ఉంటాయి. వీటి ద్వారా విద్యుత్ ప్రచోదనాలు హృదయకండరం అంతా వ్యాప్తి చెందుతాయి. హృదయకండరంలో అంతర సంధాయక చక్రికలు ఉంటాయి. ఈ చక్రికలు హృదయ కండరాల ప్రత్యేకత. వీటిలోని రక్తసంధులు ఏర్పడతాయి.
సకశేరుకాల హృదయ కండరాల సంకోచానికి ఎలాంటి నాడీ ఉద్దీపన అవసరం లేదు. వీటిలో ప్రత్యేకమయిన స్వయంలయ బద్ధక నిర్మాణమయిన లయారంభకం వల్ల ప్రేరణ ఉత్పత్తి అవుతుంది. హృదయ కండరం అనియంత్రితమైంది. అయితే హృదయ స్పందన రేటును స్వయంచోదిత నాడులు ఎపినెఫ్రిన్/ఎడ్రినాలిన్ అనే హార్మోన్ల ద్వారా క్రమపరుస్తాయి. ఉత్తేజవంతమైన హృదయ కణం వేగంగా ఇతర అన్ని హృదయకణాలను ఉత్తేజపరిచి మొత్తం హృదయ సంకోచాన్ని కలిగిస్తుంది. దీనివల్ల ఒకే రీతిగా మొత్తం కండరసంకోచం జరుగుతుంది. కాబట్టి హృదయ కండరాన్ని క్రియాత్మక సినీ షియం అంటారు. హృదయ కండరంగా గ్లానికి లోను కాదు. ఎందుకంటే దీనిలో లెక్కలేనన్ని సార్కోసోమ్స్, మయోగ్లోబిన్ అణువులు (ఆక్సిజన్ను నిల్వచేసే వర్ణకం), అధిక రక్త సరఫరా ఉండటం వల్ల ఇది నిరంతర వాయు శ్వాసక్రియ జరుపుతూ ఉంటుంది.

ప్రశ్న 13.
నాడీకణజాలంలో ఊతకణాల గురించి రాయండి.
జవాబు:
న్యూరోగ్లియా (ఊత కణాలు) :
నాడీచర్యలకు కావలసిన అనుకూల సూక్ష్మ వాతావరణాన్ని, ఊతను ప్రసారరహిత కణాలైన న్యూరోగ్లియా కణాలు కల్పిస్తాయి. న్యూరాన్స్ లాగా కాకుండా, ఇవి జీవిత పర్యంతం విభజన చెందుతాయి. కేంద్రనాడీవ్యవస్థ లోని న్యూరోగ్లియా కణాలలో ఆలిగోడెండ్రోసైట్స్ (మయలిన్ ఆచ్ఛాదం ఏర్పరచేది), ఆస్ట్రోసైట్స్-నక్షత్రఆకార కణాలు) అంతర సంధాయకమైన జాలకాన్ని ఏర్పరచి నాడీకణాలను రక్తకేశనాళికలతో బంధిస్తాయి. (రక్తం-మెదడు అవరోధాన్ని ఏర్పరచడంలో తోడ్పడతాయి, ఎపెండిమల్ కణాలు శైలికలతో ఉంటాయి. ఇవి మెదడు, నాడీదండం కుహరాన్ని ఆవరించి మస్తిష్కమేరుద్రవం కదలికలకు తోడ్పడతాయి. మైక్రోగ్లియల్ కణాలు భక్షక కణాలుగా కూడా పిలవబడతాయి. ఇవి మధ్యత్వచం నుంచి ఉద్భవిస్తాయి. పరిధీయ నాడీవ్యవస్థలోని న్యూరోగ్లియల్ కణాలలో ఉపగ్రహకణాలు ష్వాన్ కణాలు ఉంటాయి. నాడీసంధిలో కణదేహాలను ఆవరించి ఉపగ్రహకణాలు ఉంటాయి. ష్వాన్ కణాలు తంత్రికాక్షం చుట్టూ న్యూరిలెమ్మాను ఏర్పరుస్తాయి.
ప్రశ్న 14.
బహుధ్రువ న్యూరాన్ నిర్మాణం వివరించండి.
జవాబు:
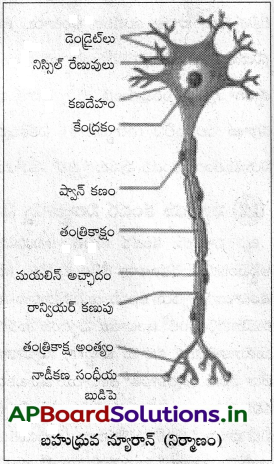
బహుధ్రువ నాడీకణ నిర్మాణము :
నాడీ కణజాలంలో ఈ కణాలు క్రియాత్మక ప్రమాణాలు. ఈ కణాలు విద్యుత్ ఉత్తేజితమై ప్రేరణలను గ్రహించడం, ప్రారంభించడం, ప్రసారం/నిర్వహణ మొదలైనవి చేస్తాయి. న్యూరాన్ ఉద్దీపన చెందినప్పుడు విద్యుత్ అలజడి (క్రియాశక్మం) జనించి తంత్రికాక్షం పొడవునా వేగంగా ప్రయాణిస్తుంది. న్యూరాన్లో కణదేహం, ఒకటి లేదా ఎక్కువ డెండ్రైట్లు, ఒక తంత్రికాక్షం ఉంటాయి.
కణదేహం :
దీన్ని పెరికేరియాన్, సైటాన్ లేదా దేహం అంటారు. జీవ పదార్థంలో అధికరేణువులు, పెద్ద గుండ్రని కేంద్రకం ఉంటాయి. జీవపదార్థంలో నిస్సిల్ నిర్మాణాలు లేదా నిస్సిల్ రేణువులు (ఇవి ప్రోటీన్ సంశ్లేషణస్థలమైన గరుకు ఎండోప్లాస్మిక్ రెటిక్యులమ్ను సూచిస్తాయి), నాడీ సూక్ష్మతంతువులు, లైపోఫ్యూసిన్ రేణువులు (వయస్సుతో పాటు లైసోజోమ్లలో పేరుకొన్న కణవ్యర్థాలు) ఉంటాయి. కేంద్రనాడీవ్యవస్థలో ఉన్న కణదేహ సమూహాలను కేంద్రకం అనీ, పరిధీయ నాడీవ్యవస్థలో ఉన్న సమూహాని నాడీ సంధి అంటారు.
డెండైట్స్ :
కణదేహం నుంచి ఏర్పడిన అనేక పొట్టి శాఖలు గల నిర్మాణాలను డెండ్రైట్స్ అంటారు. వీటిలో నిస్సిల్ నిర్మాణాలు నాడీ తంతువులు ఉంటాయి. ఇవి కణదేహం దిశగా నాడీ ప్రచోదనాలు (అభివాహిచర్య) అందిస్తాయి.
తంత్రికాక్షం :
తంత్రికాక్షం ఒకే ఒక, పొడవైన, స్తూపాకార నిర్మాణం. ఇది కణదేహంలోని ఒక ప్రాంతమైన తంత్రికాక్షపు మిట్ట నుంచి ఉద్భవిస్తుంది. తంత్రికాక్షం యొక్క ప్లాస్మాలెమ్మాను ఆగ్జోలెమ్మా అనీ జీవపదార్థాన్ని ఆర్థోప్లాసం అనీ అంటారు. వీటిలో నాడీతంతువులు ఉంటాయి. నిస్సిల్ నిర్మాణాలు ఉండవు. తంత్రికాక్షం సహపార్శ్వశాఖలను ఏర్పరుస్తాయి. తంత్రికాక్ష పరాంతంలో అనేక చిన్నచిన్న తంతువులు టెలోడెండ్రియా (తంత్రికాక్ష అంత్యాలు) నాడీకణ సంధీయ బుడిపెలు లేదా అంత్య బొత్తాలు లేదాగా అంతమవుతాయి. అంత్య బొత్తాలలో నాడీకణసంధీయతిత్తులు ఉంటాయి. వీటిలో నాడీ అభివాహకాలు అనే రసాయనాలు ఉంటాయి. తంత్రికాక్షం నాడీ ప్రచోదనాలను ఇతర నాడీకణాలకు కండర కణాలకు ప్రసరింపచేస్తుంది. కేంద్రనాడీవ్యవస్థలోని తంత్రికాక్షాల సమూహాలను నాడీ మార్గాలు అనీ, పరిధీయ నాడీవస్థలో వాటిని నాడులు అనీ అంటారు.
ప్రశ్న 15.
రక్త ఫలకికలు, నాడీకణసంధి గురించి లఘుటీక రాయండి.
జవాబు:

1. రక్త ఫలకికలు :
ఇవి కేంద్రక రహితంగా, గుండ్రంగా, అండాకారంగా, ద్వికుంభాకార చక్రిక లాంటి నిర్మాణాలు ప్రతి ఘన మిల్లీమీటర్ రక్తంలో సుమారుగా 2,50,000-4,50,000 రక్త ఫలికికలు ఉంటాయి. అస్థి మజ్జలోని బృహత్కేంద్రక కణాలు శకలీకరణం చెందడం వల్ల రక్త ఫలకికలు ఏర్పడతాయి. రక్త ఫలకికల జీవితకాలం దాదాపు 5-9 రోజులు. ఇవి థ్రాంబోప్లాస్టిన్ు స్రవించి రక్త స్కందనంలో ముఖ్యపాత్ర వహిస్తాయి. ఇవి గాయమైన రక్తకేశనాళికల ఎండోథీలియల్ తలాలకు అతుక్కొని వాటిలోని చిన్న ప్రసరణ రంధ్రాలను మూసివేస్తాయి.
2. నాడీకణసంధి :
తంత్రికాక్ష పరాంతంలో అనేక చిన్న చిన్న తంతువులు టెలోడెండ్రియా నాడీకణ సంధీయ బుడిపెలు లేదా అంత్య బొత్తాలుగా అంతమవుతాయి. అంత్యబొత్తాలలో నాడీకణసంధీయతిత్తులు ఉంటాయి. వాటిలో నాడీ అభివాహకాలు అనే రసాయనాలు ఉంటాయి. తంత్రికాక్షం నాడీ ప్రచోదనాలను ఇ ఇతర నాడీకణాలను కండర కణాలను ప్రసరింపజేస్తుంది.
దీర్ఘ సమాధాన ప్రశ్నలు
ప్రశ్న 1.
శరీరకుహరం అంటే ఏమిటి? వివిధ రకాల శరీరకుహరాలను ఉదాహరణలు, పటాలతో వివరించండి.
జవాబు:

1) శరీరకుహర రహిత ద్విపార్శ్వ సౌష్ఠవ జీవులు :
ఈ సమూహ జంతువులలో శరీరకుహరం ఉండదు కాబట్టి వీటిని శరీరకుహర రహిత జీవులు లేదా ఎసీలోమేట్లు అంటారు. ఉదా : ప్లాటి హెల్మింథిస్ (నిమ్మస్థాయి బైలెటేరియన్లు). వీటి దేహంలో సంయుక్త బీజకుహరిక మధ్యత్వచం నుంచి ఏర్పడిన మధ్యభ్రూణ కణజాలంతో నిండి ఉంటుంది. ఈ విధంగా ఇవి ఘనశరీరరచనను చూపుతాయి. ఎసీలోమేట్లలో శరీరకుహరం లోపించడం వల్ల అనేక సమస్యలున్నాయి. శరీర అవయవాలు మీసెన్సైమాలో అంతస్థగితమై స్వేచ్ఛగా కదలలేవు. అంతేకాకుండా ఆహారనాళం నుంచి శరీరకుడ్యానికి పదార్థాల వ్యాపనం చాలా నెమ్మదిగా, తక్కువ సామర్థ్యంతో కొనసాగుతాయి.
2) మిథ్యా శరీరకుహర ద్విపార్శ్వ సౌష్ఠవ జీవులు :
కొన్ని జంతువులలో శరీరకుహరాన్ని మధ్యత్వచ ఉపకళ ఆవరించి ఉండదు. వీటిని సూడోసీలోమేట్లు అంటారు ఇందులో ఆస్క్ హెల్మింథిస్ వర్గజీవులు (నిమటోడా, రోటిఫెరా, కొన్ని మైనర్ వర్గాలు) ఉన్నాయి. వీటి పిండాభివృద్ధిలో మధ్య భ్రూణ కణజాలం బహిస్త్వచానికి దగ్గరగా ఉండే సంయుక్త బీజకుహరికలోని ఒక భాగంలో మాత్రమే ఉంటుంది. సంయుక్త బీజకుహరికలో మిగిలిని భాగం మిథ్యశరీరకుహరంగా మిగిలిపోతుంది. ఇది మిథ్యాశరీరకుహరద్రవంతో నిండి ఉంటుంది. నాళంలో మరొక నాళం అమరిక మొదటిసారిగా సూడోసీలోమేట్లలో కనిపిస్తుంది.

ఆహారనాళకుడ్యం కేవలం అంతస్త్వచ ఉపకళతో మాత్రమే ఏర్పడుతుంది. కాబట్టి ఆహారనాళకుడ్యంతో శోషించబడే పోషకాలు వెలుపల గల మిథ్యా శరీరకుహరద్రవం లోకి సులభంగా వ్యాపనం చెందుతాయి. ఈ క్రియ ప్రసరణవ్యవస్థ లేని లోటును పూరిస్తుంది. మిథ్యాశరీరకుహరం దాదాపుగా నిజశరీరకుహరం నిర్వహించే పనులన్నీ సమర్థవంతంగా నిర్వహిస్తుంది. మిథ్యాశరీరకుహరం, మిథ్యాశరీరకుహర జంతువులలో జలస్థితిక అస్థిపంజరం లాగా పనిచేసి కుదుపు నియంత్రణకు తోడ్పడుతుంది. అంతేకాకుండా అంతరాంగ అవయవాల స్వేచ్ఛా కదలికలకు, పోషకాల ప్రసరణకు, నత్రజని వ్యర్థ పదార్థాల నిల్వకు తోడ్పడుతుంది.
3) విభక్త శరీర కుహర జీవులు :
మధ్యత్వచం చీలి శరీరకుహరం ఏర్పడిన జంతువులను షైజోసీలోమేట్లు అంటారు. అనెలిడ్లు, ఆర్థ్రోపోడ్లు, మలస్కా జీవులు షైజోసీలోమేట్లు. అన్ని షైజోసీలోమేట్లు ప్రాథమిక ముఖధారులు. ఈ జీవులు ‘పూర్ణభంజిత’, సర్పిల, నిర్ధారిత విదళనాలను ప్రదర్శిస్తాయి. తొలి పిండంలోని 4d బ్లాస్టోమియర్ లేదా మీసెంటోబ్లాస్ట్ కణం విభజన చెంది బహిస్త్వచం, అంతస్త్వచం మధ్య మధ్యత్వచ దిమ్మెలు ఏర్పరచి సంయుక్తబీజకుహరికను భర్తీ చేస్తుంది. ప్రతీ మధ్యత్వచ దిమ్మెలో ఏర్పడిన చీలిక షైజోసీలోమ్ (చీలికకుహరం) ఏర్పడటానికి దారితీస్తుంది. అనెలిడాలో షైజెసీలోమ్ క్రియాత్మక శరీరకుహరం (పర్యాంతరాంగ కుహరం). అనెలిడా జీవులలో శరీరకుహరం వరసగా గదులు కలిగి ఉండగా, ఆర్థ్రోపొడా, మలస్కా జీవులలో క్రియాత్మక శరీరకుహరం అంతరాంగ అవయవాల చుట్టూ ఉండి రక్తం (హీమోలింఫ్)తో నిండి రక్తకుహరంగా పిలవబడుతుంది. ఇది పిండానికి చెందిన సంయుక్తబీజకుహరం శరీరకుహర గదులతో కలియడం వల్ల ఏర్పడింది. దీనివల్ల కణజాలాలు నేరుగా రక్తంలో (హీమోలింఫ్) తడిసి ఉంటాయి.

4) ఆంత్రశరీర కుహర జీవులు :
ఆదిఆంత్ర మధ్యత్వచ కోశాల నుంచి ఏర్పడిన శరీరకుహరాన్ని ఆంత్రశరీర కుహరం అంటారు. ఇకైనోడర్మ్లు, హెమికార్డట్లు, కార్డట్లు ఎంటిరోసీలోమేట్లు. ఈ జంతువులలో మధ్యత్వచ కోశాలు ఆది ఆంత్రకుడ్యం నుంచి సంయుక్త బీజకుహరికలోకి బహిర్వర్తనం చెందుతాయి. ఇవి ఒకదానితో ఒకటి కలిసి ఎంటిరోసీలోమ్ ఏర్పడుతుంది. అన్ని ఎంటిరోసీలోమేట్లు ద్వితీయ ముఖధారులు. ఇవి వ్యాసార్ధ లేదా చక్రాభ, అనిర్ధారిత విదళనాన్ని ప్రదర్శిస్తాయి.

ప్రశ్న 2.
సౌష్ఠవం అంటే ఏమిటి? జంతు సామ్రాజ్యంలో గల వివిధ రకాల సౌష్ఠవాలను ఉదాహరణలతో వివరించండి.
జవాబు:
సౌష్ఠవం :
దేహభాగాలు దేహ అక్షానికి సాపేక్షంగా జ్యామితీయ స్థితిలో అమరి ఉండటాన్ని సౌష్ఠవం అంటారు. ఒక జంతువు ప్రధాన అక్షం ద్వారా పోయే ఒకటి లేదా ఎక్కువ తలాలనుంచి ఛేదించినప్పుడు రెండు సమాన అర్ధభాగాలు లేదా యాంటీమియర్లు ఏర్పడతాయి. ఇలాంటి జంతువులను, సౌష్ఠవయుత జంతువులంటారు. వీటిలో ప్రధాన అక్షం ద్వారా పోయే తలానికి ఇరువైపులా జంట దేహభాగాలు సమదూరంలో ఉంటాయి. జతలుగా లేని అవయవాలు చాలావరకు ప్రధాన అక్షతలం పైనే ఉంటాయి. సాధారణంగా జంతువుల సౌష్ఠవం రెండు రకాలుగా ఉంటుంది.
(i) వ్యాసార్ధ సౌష్ఠవం
(ii) ద్విపార్శ్వ సౌష్ఠవం
(i) వ్యాసార్ధ/వలయ సౌష్ఠవం లేదా ఏకాక్ష విషమధ్రువ సౌష్ఠవం (ఏక అక్షం భిన్నధ్రువాలు) :
జంతువు మధ్య అక్షం (ముఖ ప్రతిముఖ అక్షం/ప్రధాన అక్షం) ద్వారా పోయే ఏ తలం నుంచి అయినా ఛేదించినప్పుడు రెండు సమాన అర్ధభాగాలేర్పడితే దాన్ని వ్యాసార్ధ సౌష్ఠవం అంటారు. ఈ సమూహ జంతువులు వృంత రహితంగా (sessile) నేలకు అంటుకొని లేదా ప్లవకాల లాగా లేదా సోమరిగా ఉంటాయి. నిడేరియన్లు, టీనోఫోరా జీవులలో (కొందరు రచయితలు వీటిని ద్వివ్యాసార్ధ జంతువులుగా తెలిపారు) వ్యాసార్థ సౌష్ఠవం ఉంటుంది. వ్యాసార్ధ సౌష్ఠవ జంతువులు నీటిలో నివసిస్తూ అన్ని దిశల నుంచి వచ్చే ప్రేరణలకు ప్రతిస్పందిస్తాయి. కాబట్టి వ్యాసార్ధ సౌష్ఠవం నేలకు అంటుకొని లేదా నెమ్మదిగా కదిలే జంతువులకు చాలా అనుకూలం. ఇకైనోడర్మ్ లాంటి త్రిస్తరిత జీవులలో వ్యాసార్ధ సౌష్ఠవం రూపాంతరం చెంది పంచ వికిరణ సౌష్ఠవంగా మారింది. వ్యాసార్ధ సౌష్ఠవం జంతువులలో సౌష్ఠవం అన్ని తలాల్లోనూ సమానంగా ఉండగా పంచ వికిరణ సౌష్ఠవం జంతువులలో మాత్రం ఇది దేహంలోని ఐదు తలాలకు పరిమితంగా ఉంటుంది.
(ii) ద్విపార్శ్వ సౌష్ఠవం :
జంతువు దేహ మధ్య అక్షం నుంచి పోయే (పూర్వ పర అక్షం) ఒకే ఒక తలం (మధ్య సమాయత తలం నుంచి ఛేదించినప్పుడు మాత్రమే రెండు సమాన అర్ధభాగాలు ఏర్పడితే, దీన్ని ద్విపార్శ్వ సౌష్ఠవం అంటారు. ఇది ప్రధానంగా త్రిస్తరిత జంతువులలో ఉంటుంది. అయితే మొలస్కా వర్గానికి చెందిన కొన్ని గాస్ట్రోపాడ్ జీవితచరిత్రలో ద్విపార్శ్వ సౌష్ఠవం డింభకాలు ఏర్పడి చివరికి అవి అసౌష్ఠవంగా మారతాయి.
ద్విపార్శ్వ సౌష్ఠవ జంతువులు ఆహార సముపార్జనలో, సంగమజీవిని వెతుక్కోవడంలో, భక్షక జీవులనుంచి తప్పించుకోవడంలో ఎక్కువ సమర్థవంతంగా ఉంటాయి. ఈ సమర్థత ఆ జీవులలో శీర్షత (పూర్వాంతంలో నాడీ, జ్ఞానకణాలు కేంద్రీకృతం) వృద్ధి చెందడం వల్ల ఏర్పడింది.

ప్రశ్న 3.
కణాల్లో నిర్మాణాత్మక మార్పుల ఆధారంగా ఉపకళా కణజాలాలను ఉదాహరణలతో వివరించి, వర్గీకరించండి.
జవాబు:
ఉపకళాకణాలు రెండు రకాలు. అవి సరళ ఉపకళ, సంయుక్త ఉపకళ. ఈ వర్గీకరణను స్తరాల సంఖ్య ఆధారంగా చేశారు. శరీరంలో ఉన్న గ్రంథులు ఉపకళా కణజాలంతో (గ్రంథి ఉపకళ) ఏర్పడ్డాయి.
(A) సరళ ఉపకళ
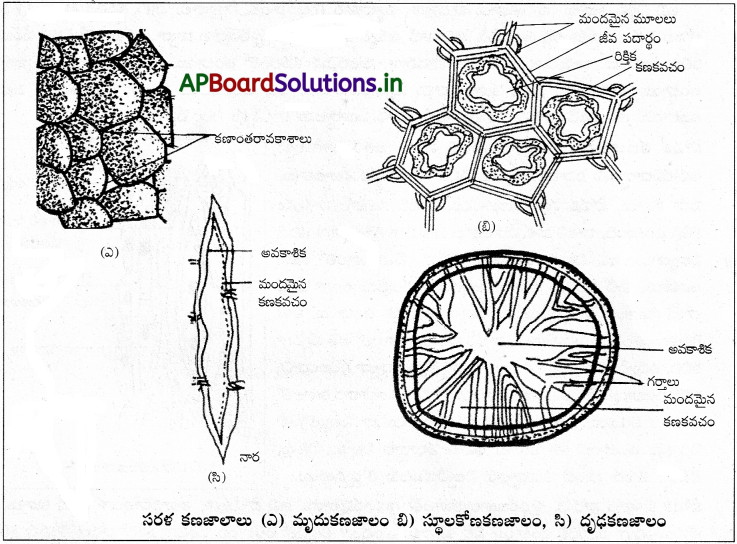
ఇది ఒకే కణస్తరంతో ఏర్పడి శరీరకుహరం, నాళాలు, నాళికలను ఆవరించి ఉంటుంది. ఇది పదార్థాల వ్యాపనం, శోషణ, గాలనం, స్రావకానికి తోడ్పడుతుంది. వీటి ఆకారం ఆధారంగా మూడు రకాలున్నాయి.
(i) సరల శల్కల ఉపకళ (పేవ్మెంట్ ఉపకళ) :

దీనిలో ఒకే కణస్తరం ఉంటుంది. దీనిలో బల్లపరుపుగా ఉన్న టైల్ లేదా గూన పెంకు లాంటి కణాలుంటాయి. కణం మధ్యలో అండాకార కేంద్రకం ఉంటుంది. ఈ కణాలు రక్తనాళాల అంతరస్తరంలో, శరీరకుహరంలోని మీసోథీలియమ్ (ప్లూరా, ఆంత్రవేష్టనం, హృదయావరణ త్వచం), నెఫ్రాన్లోని బౌమన్ గుళిక కుడ్యం, ఊపిరితిత్తులలోని వాయుకోశాలలోనూ ఆవరించి ఉంటాయి.
(ii) సరళ ఘనాకార ఉపకళ :

ఇది ఒకే కణస్తరంతో ఏర్పడి ఉంటుంది. దీనిలోని కణాలు ఘనాకారంలో ఉండి, వాటిమధ్యలో గోళాకార కేంద్రకం కలిగి ఉంటాయి. ఇవి జనన ఉపకళ, నెఫ్రాస్ లోని సమీపస్థ, దూరస్థ సంవళితనాళికలలో ఉంటాయి. నెఫ్రాన్లోని సమీపస్థ సంవళితనాళంలోని ఘనాకార ఉపకళ సూక్ష్మచూషకాలను కలిగి ఉంటుంది.
(iii) సరళ స్తంభాకార ఉపకళ :
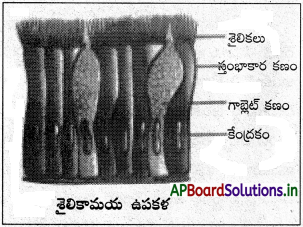
దీనిలో కణాలు పొడవుగా, సన్నగా ఒకే వరసలో అమరి ఉంటాయి. కేంద్రకం అండాకారంగా ఉండి కణ ఆధారానికి దగ్గరగా ఉంటుంది. ఈ కణాల మధ్యలో అక్కడక్కడ శ్లేష్మాన్ని స్రవించే గాబ్లెట్ కణాలు ఉంటాయి. ఈ ఉపకళ రెండు రకాలు.
(ఎ) శైలికామయ స్తంభాకార ఉపకళ :

ఇందులో స్వేచ్ఛాగ్ర తలంలో శైలికలను కలిగి ఉండే స్తంభాకార కణాలుంటాయి. ఇవి ఫాలోపియన్ నాళాలు, మెదడు కోష్ఠకాలు, నాడీదండ కేంద్రకుల్య, బ్రాంకియోల్స్ మొదలైన వాటి కుహర లోపలి తలాల్లో ఉంటాయి.
(బి) శైలికారహిత స్తంభాకార ఉపకళ :
ఈ కణాలపై శైలికలుండవు. ఇవి జీర్ణాశయం, పేగు కుహర లోపలి తలంలో ఉంటాయి. పేగులో ఉండే ఉపకళా కణాల ఉపరితలంపై సూక్ష్మ చూషకాలు ఉంటాయి. ఇవి శోషణ ఉపరితల వైశాల్యాన్ని పెంచుతాయి.
(B) సంయుక్త ఉపకళ/స్తరిత ఉపకళ :

దీనిలో ఒకటికంటే ఎక్కువ స్తరాలుంటాయి. ఈ ఉపకళ రసాయనిక, యాంత్రిక ఒత్తిడి నుంచి రక్షిస్తుంది. ఇది పొడిగా ఉండే చర్మం ఉపరితలాన్ని కప్పి ఉంటుంది. దీన్ని స్తరిత, కెరటిన్ సహిత శల్కల ఉపకళ అంటారు. అంతేకాకుండా ఇది తేమ గల ఆస్యకుహరం, గ్రసని, ఆహారవాహిక, యోని లోపలి తలాలను ఆవరిస్తుంది. దీన్ని కెరటిన్ రహిత శల్కల ఉపకళ అంటారు. ఈ ఉపకళ లాలాజలగ్రంథులు, స్వేదగ్రంథులు, క్లోమగ్రంథుల ముఖ్య నాళాల లోపలి తలాలలో కూడా ఉంటుంది. అయితే కణాలు ఘనాకారంలో ఉండటం వల్ల బహుస్తరాల కణాలు మధ్యాంతర కణాలు దీన్ని స్తరిత ఘనాకార ఉపకళ అంటారు. మూత్రాశయ కుడ్యం కూడా సంయుక్త ఉపకళతో ఏర్పడుతుంది. మూత్రాశయంలో మూత్రం పరిమాణాన్ని బట్టి ఇది పలుచగా గానీ, మందంగా గానీ మారుతూ ఉంటుంది. అందువల్ల దీన్ని పరివర్తన ఉపకళ లేదా మధ్యాంతర ఉపకళ అంటారు.
(C) గ్రంథి ఉపకళ :
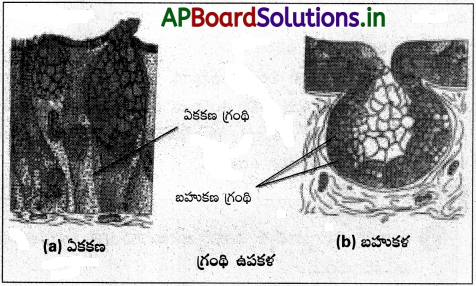
కొన్ని స్తంభాకార లేదా ఘనాకార కణాలు ప్రత్యేకతను సంతరించుకొని స్రావకాలను ఉత్పత్తి చేస్తాయి. ఇలాంటి ఉపకళను గ్రంథి ఉపకళ అంటారు. దీనిలోని గ్రంథికణాలు రెండు రకాలు. అవి (i) ఏకకణ గ్రంథులు : ఇవి ఉపకళాత్వచంలో విడివిడిగా ఉంటాయి. ఉదాహరణ : ఆహారనాళంలోని గాబ్లెట్ కణాలు (ii) బహుకణ గ్రంథులు : ఇవి ఉపకళా త్వచంలో గుంపులు గుంపులుగా ఏర్పడతాయి. ఉదాహరణ : లాలాజల గ్రంథులలో గుచ్ఛాలుగా ఉన్న గ్రంథి కణాలు. స్రావాలు విడుదల చేసే పద్ధతిని అనుసరించి గ్రంథులు రెండు రకాలు. అవి బహిస్రావక, అంతస్రావక గ్రంథులు. బహిస్రావ గ్రంథులు నాళ సహితమై శ్లేష్మం, లాలాజలం, చెవి గులిమి (సిరుమిన్, నూనె, పాలు, జీర్ణరసాలు, ఇతర కణ ఉత్పత్తులను స్రవిస్తాయి. స్రావక పద్ధతి ఆధారంగా బహిస్రావ గ్రంథులు మూడు రకాలు : (i) మీరోక్రైన్ గ్రంథులు (ఉదా: క్లోమం) స్రావక కణికలను ఇతర కణపదార్థాలు నష్టపోకుండా వె వెలుపలికి విడుదల చేస్తాయి. (i) ఎపోక్రైన్ గ్రంథులు (ఉదా: క్షీరగ్రంథులు) కణ అగ్రభాగం స్రావక పదార్థంలో సహా కణ నుంచి తెగి విడిపోతుంది. (iii) హోలోక్రైన్ గ్రంథులు (ఉదా: చర్మస్రావ గ్రంథులు) కణం మొత్తం విచ్ఛిన్నం చెంది దానిలోని స్రావకాలను వెలుపలికి విడుదల చేస్తాయి. అంతస్రావ గ్రంథులు నాళరహితమైనవి. వీటి స్రావాలను హార్మోన్లు అంటారు. హార్మోన్లు నాళాల ద్వారా కాకుండా నిర్దేశిత భాగాలకు రక్తం ద్వారా రవాణా చేయబడతాయి.

ప్రశ్న 4.
వివిధరకాల సంయోజక కణజాలాలను ఉదాహరణలతో వివరించండి.
జవాబు:
కణబాహ్య మాత్రిక, దానిలోని కణాల స్వభావాన్ని బట్టి సంయోజక కణజాలాన్ని మూడు సమూహాలుగా విభజన చేశారు. అవాస్తవిక సంయోజక కణజాలం, అస్థిపంజర కణజాలం, ద్రవరూప సంయోజక కణజాలం.
1. వాస్తవిక సంయోజక కణజాలం :
ఇది దేహంలోని అవయవాల మధ్య విస్తరించి ఉండే ప్రధాన సంయోజక కణజాలం. ఇది రెండు రకాలు.
ఎ) వదులు సంయోజక కణజాలం :
పాక్షిక ద్రవరూప మాత్రికలో కణాలు, తంతువులు వదులుగా అమరి ఉంటే దాన్ని వదులు సంయోజక కణజాలం అంటారు. ఇది మూడు రకాలు – ఎరియోలార్ కణజాలం, ఎడిపోజ్ కణజాలం, జాలక కణజాలం.
(i) ఎరియోలార్ కణజాలం :
ఇది దేహంలో ఎక్కువగా విస్తరించి ఉండే సంయోజక కణజాలాల్లో ఒకటి. అన్ని అవయవాలలో ఇది దట్టించబడి (packed) ఉంటుంది. ఇది చర్మంలో అధశ్చర్మస్తరాన్ని ఏర్పరుస్తుంది. ఎరియోలార్ కణజాలంలో ఫైబ్రోబ్లాస్ట్లు, మాస్ట్ కణాలు, స్థూలభక్షక కణాలు, ఎడిపోసైట్స్, ప్లాస్మాకణాలు, తంతువులు ఉంటాయి.
(1) ఫైబ్రోబ్లాస్ట్లు :
ఇవి తంతువులను స్రవించే అత్యంత సాధారణ కణాలు. అచేతన కణాలను ఫైబ్రోసైట్లు అంటారు.
(2) మాస్ట్ కణాలు :
ఇవి హెపారిన్ (రక్తస్కందన నిరోధకం), హిస్టమిన్, బ్రాడికైనిన్ – రక్తనాళ విస్ఫారకాలు), సెరటోనిస్ (రక్తనాళ సంకోచకాలు) లను స్రవిస్తాయి. గాయాలు, సంక్రమణకు అనుక్రియగా వాసోడయలేటర్లు వాపు లేదా ఉజ్వలనాన్ని కలిగిస్తాయి.
(3) స్థూలభక్షకకణాలను :
ఇవి అమీబా రూపంలో ఉండే భక్షక కణాలు. ఇవి రక్తంలోని మోనోసైట్ల నుంచి ఉద్భవిస్తాయి. ఇవి దేహంలోని చనిపోయిన కణాలను, కణచెత్తను భక్షణ చర్య ద్వారా తీసివేసి శుభ్రం చేస్తాయి. అందువల్ల వీటిని అంతర సఫాయికారులు అంటారు. కణజాలానికి అతికి ఉండే స్థూల భక్షకకణాలను హిస్టియోసైట్స్ అనీ, స్వేచ్ఛగా తిరుగాడే స్థూలభక్షకకణాలనీ అంటారు.
(4) ప్లాస్మాకణాలు :
ఇవి B-లింఫోసైట్ల నుంచి ఉద్భవిస్తాయి. ప్రతిరక్షకాలను ఉత్పత్తి చేస్తాయి.
(5) ఎడిపోసైట్స్ :
కొవ్వును నిల్వజేసే ప్రత్యేక కణాలు.

(ii) ఎడిపోజ్ కణజాలం :
ఇది కొవ్వును నిల్వ ఉండే ప్రత్యేక కణజాలం. ఇందులో అధికసంఖ్యలో ఎడిపోసైట్స్, కొన్ని తంతువులుంటాయి. చర్మం కింద ఉండే ఎడిపోజ్ కణజాలం ఉష్ణనిరోధకంగా పనిచేస్తుంది. ఇది తిమింగలాలు, సముద్ర ఆవుల లాంటి సముద్ర క్షీరదాలలో బ్లబ్బరు, ఒంటెలో మూపురాన్ని ఏర్పరుస్తుంది. ఇది అరచేతులు, అరికాళ్ళలో కుదుపునివారిణిగా పనిచేస్తుంది. అదనపు పోషకాలను ఈ కణజాలం కొవ్వులుగా మార్చి నిల్వ ఉంచుతుంది. ఎడిపోజ్ కణజాలం రెండు రకాలు. అవి తెలుపు ఎడిపోజ్ కణజాలం, గోధుమ ఎడిపోజ్ కణజాలం.
తెలుపు ఎడిపోజ్ కణజాలం :
ఇది ప్రౌఢ జీవులలో అధికంగా ఉంటుంది. ఎడిపోసైట్ కణంలో ఒక పెద్ద కొవ్వు బిందువు (మెనోలాక్యులార్) ఉంటుంది. తెల్లకొవ్వు జీవనచర్యలలో క్రియాశీలంగా ఉండదు.
గోధుమ ఎడిపోజ్ కణజాలం :
ఇది గర్భస్థ పిండాలలోనూ, శిశువులలోనూ ఎక్కువగా ఉంటుంది. దీని ఎడిపోసైట్ కణంలో అనేక చిన్న కొవ్వు బిందువులు (మల్టిలాక్యులర్), అనేక మైటోకాండ్రియాలు ఉంటాయి. గోధుమకొవ్వు జీవనక్రియలో క్రియాశీలంగా ఉండి ఉష్ణాన్ని ఉత్పత్తి చేసి శిశువులో దేహ ఉష్ణోగ్రతను కాపాడుతుంది.
(iii) జాలక కణజాలం :
ఈ కణజాలంలో రెటిక్యులార్ కణాలుగా పిలువబడే ప్రత్యేకమైన ఫైబ్రోబ్లాస్ట్లుంటాయి. ఇవి జాలకతంతువులను స్రవిస్తాయి. ఇవి మాత్రికలో అంతర్సంధాన జాలకంగా ఏర్పడుతాయి. శోషాభాంగాలు (అస్థిమజ్జ, ప్లీహం)కు శోషాభకణుపులకు, ఆధారత్వచ జాలక పటలికకు ఊతాన్నిచ్చే చట్రంగా ఏర్పడుతుంది.
(B) సాంద్రీయ సంయోజక కణజాలం :
ఈ కణజాలంలో తక్కువ కణాలు, ఎక్కువ తంతువులు ఉంటాయి. వీటిలో తక్కువ అథస్థ పదార్థం ఉంటుంది.

తంతువుల అమరిక ఆధారంగా సాంద్రీయ సంయోజక కణజాలం మూడు రకాలు :
(i) సాంద్రీయ క్రమయుత సంయోజక కణజాలం :
ఈ కణజాలంలో కొల్లాజెన్ తంతువుల కట్టలు ఒకదానికొకటి సమాంతరంగా అమరి ఉంటాయి. కండరాలను ఎముకతో అతికించే స్నాయుబంధనం, ఎముకలను ఇతర ఎముకలతో అతికించే బంధకం ఈ కణజాలానికి ఉదాహరణ

(ii) సాంద్రీయ క్రమరహిత సంయోజక కణజాలం :
ఈ కణజాలంలో కొల్లాజన్ తంతువుల కట్టలు క్రమరహితంగా అమరి ఉంటాయి. ఇది పర్యస్థిక, ఎండాస్టియమ్, హృదయావరణ పొర, గుండె కవాటాలు, కీళ్ల గుళిక, చర్మంలోని అంతశ్చర్యంలో లోతైన ప్రాంతాలలో ఉంటుంది.
(iii) స్థితిస్థాపక సంయోజక కణజాలం :
దీనిలో పసుపు స్థితిస్థాపక తంతువులుంటాయి. సాగదీసి వదిలివేసిన తరవాత పూర్వ ఆకారానికి ఈ కణజాలం చేరుతుంది. ఇది ధమనులు, స్వరతంత్రులు, వాయునాళాలు, శ్వాసనాళాలు, స్థితిస్థాపక బంధనాల (కశేరుకాల మధ్యలో ఉంటాయి) కుడ్యంలో ఉంటుంది.
పైన తెలిపిన వాటికి అదనంగా భ్రూణం లేదా పిండం కణజాలాలలో శ్లేష్మ సంయోజక కణజాలం ఉంటుంది. ఇది నాభిరుజ్జువు లో వార్టన్ జెల్లిగా ఏర్పడి ఉంటుంది.

ప్రశ్న 5.
అస్థిపంజర కణజాలాలను అంటే ఏమిటి? వివిధ రకాల అస్థిపంజర కణజాలాలను వివరించండి.
జవాబు:
అస్థిపంజర కణజాలం :
సకవేరుకాలలో ఇది అంతరాస్థిపంజరాన్ని ఏర్పరుస్తుంది. ఇది శరీరానికి అండగా, అవయవాల రక్షణకు, కండరాలు అతికి ఉండటానికి, చలనానికి తోడ్పడుతుంది. ఇది రెండు రకాలు.
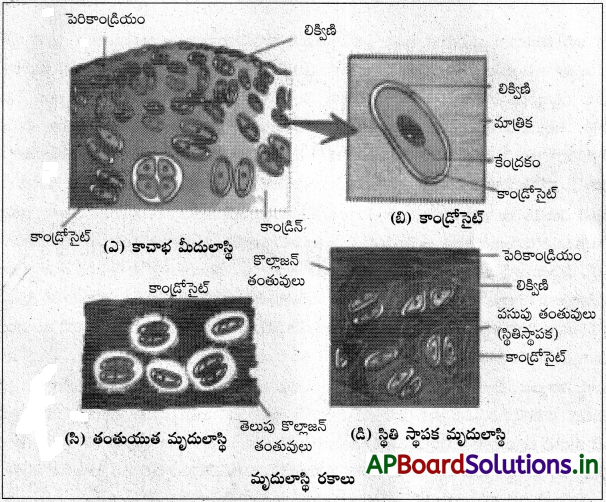
(ఎ) మృదులాస్థి లేదా గ్రిసిల్ :
ఇది మృదువైన అస్థి లాంటి సంయోజక కణజాలం. దీనిలోని మాత్రకను కాండ్రిన్ అనీ, కణాలను మృదులాస్థి కణాలు లేదా కాండ్రోసైటులు అంటారు. కాండ్రిన్ స్థితిస్థాపకతను, వంగే లక్షణాన్ని కలిగి ఉంటుంది. దీనిలో కొల్లాజన్ తంతువులు, స్థితిస్థాపక తంతువులు ఉంటాయి. మృదులాస్థి ఉపరితలాన్ని ఆవరించి పరిమృదులాస్థి ఉంటుంది. దీనిలో కాండ్రోబ్లాస్టులు అనే పూర్వమృదులాస్థి కణాలు ఉంటాయి. ఇవి మృదులాస్థి మాత్రికను స్రవిస్తాయి. కొంతకాలం తరవాత కాండ్రోబ్లాస్టులు పరిణతి చెంది కాండ్రోసైటులుగా మారి మాత్రికలో ఉండే లిక్విణులు అనే ఖాళీ ప్రదేశాలలోకి చేరి అచేతనంగా ఉండి పోతాయి.
పరిమృదులాస్థిలోకి రక్తనాళాలు విస్తరించబడి వాటి ద్వారా పోషక పదార్థాలు అందించబడతాయి. కాని మృదులాస్థి అంతర్భాగ మాత్రికలోకి రక్తప్రసరణ ఉండదు. పరిమృదులాస్థిలోని పోషక పదార్థాలు వ్యాపనం దావఆ కాండ్రిన్లోకి వ్యాప్తి చెందుతాయి. మృదులాస్థి పెరుగుదల, పునరుత్పత్తి మరమత్తులు పరిమృదులాస్థిలో జరుగుతాయి.
మృదులాస్థి మాత్రిక రచన ఆధారంగా మృదులాస్థి మూడు రకాలు . అవి, కాచాభ, స్థితిస్థాపక, తంతుయుత మృదులాస్థులు.
1. కాచాభ మృదులాస్థి :
ఇది నీలి-తెలుపు వర్ణంలో పాక్షిక పారదర్శకంగా, గాజు లాగా ఉంటుంది. ఇది సర్వసాధారణ మృదులాస్థి. దీని మాత్రక సమజాతీయంగా ఉండి, సున్నితమైన కొల్లాజన్ సూక్ష్మతంతువులను కలిగి ఉంటుంది. ఇది అన్ని మృదులాస్థులలో అతి బలహీనమైంది. సంధితల మృదులాస్థిలో తప్ప అన్నిటిలోనూ పరిమృదులాస్థి ఉంటుంది. ఇది అస్థిసకశేరుకాల పిండాలలోనూ సైక్లోస్టోమ్లలోనూ, మృదులాస్థి చేపలలోనూ అంతరాస్థిపంజరాన్ని ఏర్పరుస్తుంది. దీని నుంచి సంధితల మృదులాస్థి (సంధిని ఏర్పరచే పొడవు ఎముకల స్వేచ్ఛాతలం), పర్శుక మృదులాస్థి పర్శుకల ఉరోస్థి భాగాలు, ఎపిఫైసియల్ ఫలకాలు, నాసికాపుట మృదులాస్థి, శ్వాసనాళ మృదులాస్థి వలయాలు, స్వరపేటిక మృదులాస్థి మొదలైనవి ఏర్పడతాయి.
2. స్థితిస్థాపక మృదులాస్థి :
స్థితిస్థాపక తంతువులు ఉండటం వల్ల ఇది పసుపురంగులో ఉంటుంది. దీని మాత్రికలో కొల్లాజన్ తంతువులతో బాటు అధికసంఖ్యలో పసుపు స్థితిస్థాపక తంతువులు ఉంటాయి. ఇది బలాన్ని, స్థితిస్థాపకతను ఇస్తుంది. పరిమృదులాస్థి ఉంటుంది. ఈ మృదులాస్థి వెలుపలి చెవి దొప్ప, శ్రోతఃనాళాలు, ఉపజిహ్వికలో ఉంటుంది.
3. తంతుయుత మృదులాస్థి :
మాత్రికలో కట్టలుగా కొల్లాజన్ తంతువులు ఉంటాయి. పరిమృదులాస్థి ఉండదు. అన్ని మృదులాస్థులలో కెల్లా ఈ మృదులాస్థి చాలా ధృడమైంది. ఇది అంతర్కశేరుక చక్రికలలోనూ, శ్రోణిమేఖల జఘన సంధాయకంలోను ఉంటుంది.
(బి) అస్థి కణజాలం :
ఎముక అధిక ఖటికీకృతమైన దృఢమైన సంయోజక కణజాలం. ప్రౌఢ సకశేరుకాలలో ఇది అంతరాస్థిపంజరంగా ఉంటుంది. శరీరంలో నిర్మాణాత్మక చట్రాన్ని ఏర్పరుస్తుంది, మృదు కణజాలానికి ఆధారాన్నిస్తుంది, సున్నిత అవయవాలను రక్షిస్తుంది. ఎముకలు వాటికి అతికి ఉన్న కండరాలతో కలిసి కదలికలకు తోడ్పడతాయి. ఎముకలో దృఢమైన, వంగని మాత్రిక ఉంటుంది. ఇందులో అధికంగా కాల్షియం లవణాలు, కొల్లాజన్ తంతువులు ఉంటాయి. వయస్సు పెరుగుతున్న కొద్దీ అకర్బన పదార్థాలు పేరుకుపోవడం వల్ల ఎముకలు పెళుసుగా మారతాయి. ఎముకలు కాల్షియం, మెగ్నీషియం, భాస్వరం మొదలైన వాటికి హోమియోస్టాటిక్ రిజర్వాయర్ ఉంటుంది. ఎముక విరివిగా రక్తనాళాలను కలిగి ఉంటుంది.
ఎముక వెలుపలి తలంలో తంతుయుత పర్యార్థిక, లోపలి తలంలో అంటే ఎముక మజ్జకుహరాన్ని ఆవరించి అంతరాస్థిక అనే సంయోజక కణతొడుగులుంటాయి. ఈ రెండింటి మధ్య కణబాహ్యమాత్రిక, అస్థి కణాలు ఉంటాయి. అస్థి కణాలలో ఆస్టియోబ్లాస్ట్లు, ఆస్టియోసైట్స్, ఆస్టియోక్లాస్ట్లు అనే మూడు రకాల కణాలు ఉంటాయి. ఆస్టియోబ్లాస్టులు (అపరిపక్వ అస్థికణాలు) మాత్రికలోని సేంద్రియ పదార్థాలను (కొల్లాజన్ తంతువులు) స్రవిస్తాయి. అంతేకాకుండా ఎముకను ఖనిజీకృతం చేయడానికి ముఖ్యపాత్ర వహిస్తాయి. ఈ కణాలు పరిపక్వత చెంది ఆస్టియోసైట్గా మారతాయి. ఆస్టియోసైట్స్ ద్రవం నిండిన లిక్విణులలో ఇమిడి ఉంటాయి. ఆస్టియోక్లాస్ట్లు భక్షకకణాలుగా ఎముకను పునఃశోషణం చేసే విధిని కలిగి ఉంటాయి.
ఘనాస్థి నిర్మాణం :
పొడవాటి ఎముకలో రెండు విస్తరించిన అంత్యాల (ఎపిఫైసిన్) మధ్య కాడ లేదా డయాఫైసిన్ ఉంటుంది. పెరిగే ఎముకలో డయాఫైసిన్, ఎపిఫైసిన్ మధ్య మెటాఫైసిస్ ఉంటుంది. మెటాఫైసిస్ లో మృదులాస్థితో ఏర్పడిన ఎపిఫైసియల్ ఫలకం (ఇది కాచాభ మృదులాస్థితో ఏర్పడుతుంది) ఉంటుంది. ఇది ఎముక పొడవుగా పెరగడానికి తోడ్పడుతుంది. ప్రౌఢజీవులలో దీన్ని సూచిస్తూ ఒక ఎపిఫైసియల్ రేఖ ఏర్పడుతుంది. డయాఫైసిస్ను ఆవరించి సాంద్ర సంయోజక తంతుకణజాలం, పర్యార్థిక ఉంటుంది. పొడవాటి ఎముకల డయాఫైసిస్లో మజ్జాకుహరం అనే బోలైన కుహరంతో ఉంటుంది. దీన్ని ఆవరించి అంతరాస్థిక ఉంటుంది. పెరి ఆస్టియం, అంతరాస్థిక మధ్య ఎముక మాత్రకలో అనేక వరసలలో పటలికలు ఉంటాయి. పర్యార్థిక కింద ఉండే పటలికలను వెలుపలి పరిధీయ పటలికలు అంటారు. అంతరాస్థిక చుట్టూ ఉండే వాటిని అంతర ఆవర్తిత పటలికలు అంటారు. ఈ రెండు పటలికల మధ్య అనేక హేవర్షియన్ వ్యవస్థలు (ఆస్టియాన్ – ఎముక ప్రమాణాలు) ఉంటాయి. ప్రతి హేవర్షియన్ వ్యవస్థ ఏక కేంద్రక వలయంలాగా ఏర్పడుతుంది. దీని మధ్యలో హేవర్షియన్ కుల్య, దానిలో రక్త, శోషనాళాలు ఉంటాయి.
హేవర్షియన్ నాళం చుట్టూ అనేక లిక్విణులు వలయాకార పటలికలుగా అమరి ఉంటాయి. వీటిలో ఆస్టియోసైట్లు ఉంటాయి. మాత్రికలోని లిక్విణులు ద్రవంతో నిండి, ఇతర లిక్విణులతో సూక్ష్మకుల్య ద్వారా కలిసి ఉంటాయి. హేవర్షియన్ నాళం చుట్టూ ఉండే లిక్విణులు వాటి సూక్ష్మకుల్యల ద్వారా హేవర్షియన్ నాళంతో కలుస్తాయి. ప్రతీ లిక్విణిలో ఒక ఆస్టియోసైట్ ఉంటుంది. ఇది ఆస్టియోబ్లాస్ట్ క్రియారహిత రూపం, ఆస్టియోసైట్ల జీవపదార్థ కీలితాలు సూక్ష్మకుల్యల ద్వారా విస్తరిస్తాయి. హేవర్షియన్ కుల్య, దాని చుట్టూ ఉన్న పటలికలు, లిక్విణులు అన్నిటిని కలిపి హేవర్షియన్ వ్యవస్థ లేదా ఆస్టియాన్ అంటారు. ఇది అస్థికణజాలంలో నిర్మానాత్మక క్రియాత్మక ప్రమాణం. హేవర్షియన్ కుల్యలు అడ్డుగా లేదా ఏటవాలుగా ఉండే వోల్క్మన్ కుల్యల ద్వారా ఇతర హేవర్షియన్ కుల్యలతో, పర్యస్థికతో, మజ్జాకుహరంతో కలపబడి ఉంటాయి. హేవర్షియన్ కుల్యల రక్తనాళాల నుంచి పోషకాలు, వాయువులు సూక్ష్మకుల్యల ద్వారా అస్థికణజాలం అంతటా వ్యాపనం చెందుతాయి.
ప్రశ్న 6.
రక్తంలో రూపనిష్పాదితాల పదార్థాలను గురించి రాయండి.
జవాబు:
(i) రక్త కణాలు :
రక్త కణాలు మూడు రకాలు. అవి, ఎరిత్రోసైట్లు (ఎర్రరక్తకణాలు), ల్యూకోసైట్లు (తెల్లరక్తకణాలు), రక్త ఫలకికలు. రక్తకణాలు ఏర్పడటాన్ని హీమోపోయిసిస్ లేదా హిమాటోపోయిసిస్ అంటారు. పిండజనన తొలిదశల్లో రక్తకణాలు సొనసంచి మధ్యత్వచం నుంచి ఏర్పడతాయి. ఆ తరవాత కాలేయం, ప్లీహం తాత్కాలిక రక్త కణోత్పాదక కణజాలాలుగా పనిచేస్తాయి. పిండాభివృద్ధి తుది దశల్లో, జననాంతర ఎరుపు అస్థిమజ్జ రక్తకణోత్పాదనకు ప్రధాన స్థానంగా పనిచేస్తుంది.

(ii) ఎర్రరక్తకణాలు :
క్షీరదాల ఎర్రరక్తకణాలు వర్తులంగా (ఒంటెలు, లామాస్లో దీర్ఘవృత్తీయంగా ఉంటాయి), ద్విపుటాకారంగా, కేంద్రకరహితంగా ఉంటాయి. ద్విపుటాకార ఆకారం ఎక్కువ ఉపరితల ఘనపరిమాణ నిష్పత్తిని కలగజేస్తుంది. ఇది వాయువుల వినిమయానికి ఎక్కువ ప్రదేశాన్ని అందిస్తుంది. ఇవి 7.8µm వ్యాసంతో ఉంటాయి. ప్రతీ ఘన మిల్లీమీటర్ రక్తంలో, పురుషుడిలో 5 మిలియన్లు, స్త్రీలో 4.5 మిలియన్ల ఎర్రరక్తకణాలుంటాయి. ఎర్రరక్తకణాల సంఖ్యలో తగ్గుదలను ఎరిత్రోసైటోపీనియా అంటారు. ఇది రక్తహీనత కు దారితీస్తుంది. ఎర్రరక్తకణాల సంఖ్యలో అసాధారణ, పెరుగుదలను పాలిసైథీమియా అంటారు. రక్తంలో ఆక్సిజన్ కొరత ఎరిత్రోపాయిటిన్ హార్మోన్ విడుదలకు మూత్రపిండాలను ప్రేరేపిస్తుంది. ఎరిత్రోపాయిటిన్ RBC అధిక ఉత్పత్తికి ఎముక మజ్జను ప్రేరేపిస్తుంది. RBC పరిపక్వతకు విటమిన్ B12, ఫోలిక్ ఆమ్లాలు అవసరం.
క్షీరదాల RBC ని ఆవరించి ప్లాస్మాత్వచం ఉంటుంది. అభివృద్ధి చెందేటప్పుడు రెటిక్యులోసైట్ దశలో కేంద్రకాన్ని, ఇతర కణాంగాలను కోల్పోతాయి. RBC ల జీవపదార్థంలో ‘హీమోగ్లోబిన్’ అనే క్రోమోప్రోటీన్ ఉంటుంది. ప్రతీ హీమోగ్లోబిన్ అణువులో 4 పాలిపెప్టైడ్ గొలుసులు (2α మరియు 2β) మరియు 4 హీమ్ అణువులు ఉంటాయి. ప్రతీ హీమ్ వర్గం మధ్యలో ఒక Fe2+ ఉంటుంది. ఇది ఒక O2 అణువుతో కలవగలుగుతుంది. మానవుల్లో ఎర్రరక్తకణాల జీవితకాలం సుమారు 120 రోజులు వయసుడిగిన ఎర్రరక్తకణాలను ప్లీహం, కాలేయం నాశనం చేస్తాయి.
(iii) తెల్లరక్తకణాలు :
ఇవి కేంద్రకసహిత, రంగులేని పూర్తి కణాలు. ఇవి గోళాకార లేదా క్రమరహిత ఆకారంతో ఉంటాయి. అమీబాయిడ్ కదలికలతో రక్త కేశనాళికల ద్వారా బాహ్య ప్రాంతాలకు డయాపెడిసిస్ ద్వారా చేరతాయి. తెల్లరక్తకణాలు RBC కంటే పరిమాణంలో పెద్దగా, సంఖ్యలో తక్కువగా ఉంటాయి. సాధారణ స్థితిలో ప్రతీ ఘన మిల్లీమీటర్కు 6000-10000 వరకు తెల్లరక్తకణాలు ఉంటాయి. తెల్లరక్తకణాలు ఏర్పడే విధానాన్ని ల్యూకోపాయిసిస్ అంటారు. సంక్రమణ, అలర్జీలో కొద్దిగా పెరిగిన తెల్లరక్తకణాల సంఖ్యను ల్యూకోసైటోసిస్ (Leucocytosis) అంటారు. అసాధారణ సంఖ్యలో పెరిగిన తెల్లరక్తకణాలు ల్యుకేమియా అనే ఒక రకమైన కాన్సర్ను తెలియజేస్తుంది. WBC సంఖ్య క్షీణించడాన్ని ల్యూకోసైటోపీనియా అంటారు. WBC లలో రెండు ముఖ్యరకాలు. కణికాభ కణాలు (గ్రాన్యులోసైట్లు), కణికారహిత కణాలు (ఎగ్రాన్యులోసైట్లు).
కణికాభ కణాలు :
ఇవి జీవపదార్థంలో కణికలు లేదా రేణువులు ఉండే తెల్లరక్తకణాలు. ఈ కణాల కేంద్రకం వివిధ ఆకారాలలో ఉంటుంది. వీటిని బహురూప కేంద్రక తెల్ల రక్తకణాలు అంటారు. వీటి జీవపదార్థం ఆమ్ల లేదా క్షార లేదా తటస్థ రంజకాలను గ్రహిస్తుంది. రంజక లక్షణం ఆధారంగా ఇవి మూడు రకాలు.
బేసోఫిల్స్ :
ఇవి మొత్తం తెల్లరక్తకణాలలో 0.4% ఉంటాయి. వీటి కేంద్రకం క్రమరహిత లంబికలుగా విభజించబడి ఉంటుంది. జీవపదార్ధ రేణువులు కొద్దిసంఖ్యలో క్రమరహిత ఆకారంలో ఉంటాయి. ఇవి క్షార రంజకాలను గ్రహిస్తాయి. ఇవి హెపారిన్, హిస్టమస్ మొదలైన వాటిని ఉత్పత్తి చేస్తాయి. అవసరమైనప్పుడు మాస్ట్ కణాలకు అనుబంధంగా విధులను నిర్వహిస్తాయి.

ఇస్నోఫిల్స్/ఎసిడోఫిల్స్ :
ఇవి మొత్తం ల్యూకోసైట్లలో 2.3% ఉంటాయి. వీటి కేంద్రకం రెండు లంబికలను కలిగి ఉంటుంది. ఆమ్ల రంజకాలైన ఇయోసిస్ ను గ్రహించే పెద్ద రేణువులు కణజీవద్రవ్యంలో ఉంటాయి (పటం 2.25). ఇవి అలర్జిక్ ప్రతిచర్యలలో ముఖ్యపాత్ర వహిస్తాయి. హెల్మింథిక్ పురుగుల సాంక్రమణ, అలర్జిక్ ప్రతిచర్యలలో వీటి సంఖ్య పెరుగుతుంది. ఇవి ప్రతిజనక – ప్రతిరక్షక సంక్లిష్టాలను తొలగిస్తాయి.

న్యూట్రోఫిల్స్ (Neutrophils) :
మొత్తం ల్యూకోసైట్లలో న్యూట్రోఫిల్స్ సుమారు 62% ఉంటాయి. కేంద్రకం మూడు లేదా ఎక్కువ లంబికలతో (2.5) ఉంటుంది. ప్రత్యేకమైన జీవపదార్థ రేణువులు చిన్నగా, విరివిగా ఉంటాయి. ఇవి తటస్థ రంజకాలను పీల్చుకొంటాయి. న్యూట్రోఫిల్స్ చురుకైన భక్షకకణాలు. వీటిని సాధారణంగా సూక్ష్మరూప రక్షకభటులు అంటారు. స్త్రీ క్షీరదాలలో కొన్ని న్యూట్రోఫిల్స్లో లైంగిక క్రొమాటిన్ లేదా డ్రమ్హక్ రూపంలో (ఇది కుదించబడ్డ X – క్రోమోసోమ్) కేంద్రకానికి ఒకవైపు అతికి ఉంటుంది.
కణికారహిత కణాలు :
వీటిలో జీవపదార్థ రేణువులు ఉండవు. వీటి కేంద్రకం లంబికలుగా విభజన చెంది ఉండదు. ఇవి రెండు రకాలు.

(ఎ) లింఫోసైట్లు :
ఇవి మొత్తం ల్యూకోసైట్లలో 30% ఉంటాయి. ఇవి చిన్నగా వర్తులాకారంలో ఉంటాయి. వీటి కేంద్రకం పెద్దగా ఉండి కణంలో ఎక్కువ భాగాన్ని ఆక్రమిస్తుంది. కొద్దిగా పరిధీయ జీవపదార్థంతో కూడి ఉంటాయి. క్రియాత్మకంగా రెండు రకాల లింఫోసైట్లున్నాయి. ప్రతిదేహాలను ఉత్పత్తి చేసే B-లింఫోసైట్స్, శరీర వ్యాధినిరోధక ప్రతిచర్యలలో ముఖ్యపాత్ర వహించే T-లింఫోసైట్స్. కొన్ని లింఫోసైట్స్ కొద్దిరోజులు మాత్రమే జీవిస్తాయి. ఇంకొన్ని చాలా సంవత్సరాలు జీవిస్తాయి.

(బి) మోనోసైట్లు :
ఇవి మొత్తం తెల్లరక్తకణాలలో సుమారు 5.3% ఉంటాయి. కేంద్రకం మూత్రపిండ (రెనిఫామ్) ఆకారంలో ఉంటుంది. ఇవి అతిపెద్ద గమన భక్షక కణాలు. ఇవి బాక్టీరియా, కణశిథిలాలను మింగివేస్తాయి. ఇవి సంయోజక కణజాలంలోకి ప్రవేశించినప్పుడు స్థూలభక్షక కణాలుగా విభేదనం చెందుతాయి.
(iv) రక్తఫలకికలు :
ఇవి కేంద్రక రహితంగా, గుండ్రంగా, అండాకారంగా ద్వికుంభాకార చక్రికలాంటి నిర్మాణాలు. ప్రతి ఘన మిల్లీమీటర్ రక్తంలో సుమారు 2,50,000 – 4,50,000 రక్తఫలకికలు ఉంటాయి. అస్థిమజ్జలో బృహత్కేంద్రక కణాలు శకలీకరణం చెందడం వల్ల రక్త ఫలకికలు ఏర్పడతాయి. రక్తఫలకికల జీవితకాలం దాదాపు 5-9 రోజులు. ఇవి థ్రాంబోప్లాస్టిన్ను స్రవించి రక్త స్కంధనంలో ముఖ్యపాత్ర వహిస్తాయి. ఇవి గాయమైన రక్తకేశినాళికల ఎండోథీలియల్ తలాలకు అతుక్కొని వాటిలోని చిన్న ప్రసరణ రంధ్రాలను మూసివేస్తాయి.

ప్రశ్న 7.
మూడు రకాల కండర కణజాలాలను పోల్చి బేధాలను తెలపండి.
జవాబు:
కండరాలు మూడు రకాలు. అవి అస్థిపంజర, నునుపు, హృదయ కండరాలు. ఎముక పెరిమైసియం
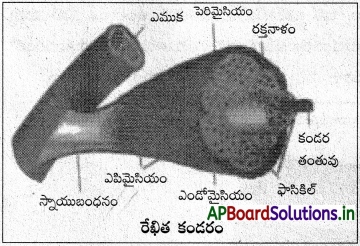
అస్థిపంజర (రేఖిత, నియంత్రిత) కండరం :
ఇవి సాధారణంగా ఎముకలకు స్నాయుబంధనంతో అతుక్కొని ఉంటాయి. ద్విశిరస్థ కండరంలాంటి నమూనా అస్థికండరంలో కండర తంతువులు పలచని ఎండోమైసియం అనే సంయోజక కణజాల తొడుగుతో ఉంటాయి. కండరతంతువుల కట్టను ఫాసికిల్ అంటారు. దీన్ని ఆవరించిన సంయోజక కణజాలపు పొరను పెరిమైసియం అంటారు. ఒక ఫాసికిల్స్ సమూహం ఒక కండరాన్ని ఏర్పరుస్తుంది. ఇలాంటి కండరాన్ని కప్పి ఉండే సంయోజక కణజాలపు పొరను ఎపిమైసియం (వెలుపలి సంయోజక కణజాలం తొడుగు) అంటారు. కండరాన్ని దాటి పొడిగించ బడిన ఈ సంయోజక కణజాలస్తరాలు రజ్జువులాంటి స్నాయు బంధనాన్ని లేదా పలకలాంటి ఎపోన్యూరోసిస్ ని ఏర్పరుస్తాయి. అస్థిపంజర కండరతంతువు పొడవైన, స్తూపాకార, శాఖారహిత కణం. కణ సార్కొలెమ్మా జీవపదార్థంలో పరిధీయంగా (కణాలు కలిసిపోయిన సిన్పీషియం స్థితి ఏర్పడుతుంది) అండాకార బహుకేంద్రకాలు ఉంటాయి.

సార్కోప్లాజంలో ఉన్న అనేక సూక్ష్మకండర తంతువులు ఏకాంతరంగా నిష్కాంతి, కాంతి పట్టీలను ప్రదర్శిస్తాయి. అందువల్ల దీన్ని రేఖిత లేదా చారల కండరం అంటారు. రేఖిత కండర తంతువు అస్థిపంజర కండరం జీవి నియంత్రణలో (నియంత్రిత కండరం) పనిచేస్తుంది. అస్థిపంజర కండరం త్వరగా సంకోచం జరుపుతుంది. త్వరగా గ్లానికి గురవుతుంది. దీన్ని దైహిక నాడీవ్యవస్థ క్రమబద్దీకరిస్తుంది. శాటిలైట్ కణాలు చలనంలేని (చర్యారహిత), ఏకకేంద్రక, మయోజెనిక్ కణాలు. ఈ కణాలు నియమితంగా కండర పునరుత్పత్తిలో సహాయపడతాయి.

నునుపు (అరేఖిత, అనియంత్రిత) కండరం :
ఈ కండరం రక్తనాళాలు, వాయునాళాలు, శ్వాసనాళాలు, జీర్ణాశయం, పేగు, విసర్జకనాళాలు, జనననాళాలు మొదలైన అంతరాంగ అవయవాలలో ఉంటుంది. అందువల్ల అంతరంగ కండరం అంటారు. వీటిలో అడ్డుపట్టీలు ఉండవు కాబట్టి నునుపు కండరం అంటారు. ఇవి కంటిలోని తారక (iris), శైలికాదేహం, చర్మంలో రోమపుటికలకు అతికి ఉండే ఎరక్టార్ పిలి కండరాలలో ఉంటాయి.
సాధారణంగా నునుపు కండరాలు స్తరాలు/పలకల (పత్రాల) మాదిరి అమరి ఉంటాయి. నునుపు కండరతంతువు, కండె ఆకారంలో (తర్కురూపం) ఉండే ఏకకేంద్రక కణం. సూక్ష్మ కండరతంతువులు నిష్కాంతి, కాంతి పట్టీలను ఏకాంతర పద్ధతిలో కలిగి ఉండవు. ఎందుకంటే ఏక్టిన్, మయోసిన్ పోగులు క్రమపద్ధతిలో అమరి ఉండవు. నునుపు కండరాలు నియంత్రణలో పనిచేయవు. కాబట్టి వీటిని అనియంత్రిత కండరాలు అంటారు. నునుపు కండరం, దీర్ఘకాల సంకోచాలను చూపించే కండరం. ఇవి ఎలాంటి అలసటకులోనుకాకుండా దీర్ఘకాలం సంకోచస్థితిలో ఉండగలుగుతాయి. నునుపు కండర సంకోచం స్వయంచోదిత నాడీవ్యవస్థ ఆధీనంలో ఉంటుంది.
హృదయ కండరం (రేఖిత, అనియంత్రిత) :
ఇది అస్థిపంజర కండరం లాగా రేఖిత కండరం (సార్కోమియర్లు ఉంటాయి)హృదయ కండరాలు సకశేరుకాల హృదయంలోని మయోకార్డియంలో ఉంటాయి. హృదయ కండరకణాలు లేదా మయోకార్డియల్ కణాలు పొట్టిగా, స్తూపాకారంగా ఒకటి లేదా రెండు కేంద్రకాలతో ఉంటాయి. ఇవి ఒకదానితో ఒకటి కలిసి ఉంటాయి. వీటి మధ్య రిక్తసంధులు ఏర్పడి ఉంటాయి. వీటి ద్వారా విద్యుత్ ప్రచోదనాలు హృదయకండరం అంతా వ్యాప్తి చెందుతాయి. హృదయకండరంలో అంతర సంధాయక చక్రికలు ఉంటాయి. ఈ చక్రికలు హృదయ కండరాల ప్రత్యేకత. వీటిలోని రక్తసంధులు ఏర్పడతాయి.

సకశేరుకాల హృదయ కండరాల సంకోచానికి ఎలాంటి నాడీ ఉద్దీపన అవసరం లేదు. వీటిలో ప్రత్యేకమయిన స్వయంలయబద్ధక నిర్మాణమయిన లయారంభకం వల్ల ప్రేరణ ఉత్పత్తి అవుతుంది. హృదయ కండరం అనియంత్రితమైంది. అయితే హృదయస్పందన రేటును స్వయంచోదిత నాడులు, ఎపినెఫ్రిన్/ఎడ్రినాలిన్ అనే హార్మోన్ల ద్వారా క్రమపరుస్తాయి. ఉత్తేజవంతమైన హృదయ కణం వేగంగా ఇతర అన్ని హృదయకణాలను ఉత్తేజపరిచి మొత్తం హృదయసంకోచాన్ని కలిగిస్తుంది. దీనివల్ల ఒకే రీతిగా మొత్తం కండరసంకోచం జరుగుతుంది. కాబట్టి హృదయ కండరాన్ని క్రియాత్మక సిన్షీషియం అంటారు. హృదయ కండరంగా గ్లానికి లోను కాదు. ఎందుకంటే దీనిలో లెక్కలేనన్ని సార్కోసోమ్స్, మయోగ్లోబిన్ అణువులు (ఆక్సిజన్ను నిల్వచేసే వర్ణకం), అధిక రక్త సరఫరా ఉండటం వల్ల ఇది నిరంతర వాయు శ్వాసక్రియ జరుపుతూ ఉంటుంది.
![]()

![]()
![]()
![]()
![]()
![]()